差示扫描量热技术在药剂学中的应用进展
2017-11-15刘婕,杨丽,方亮
刘 婕,杨 丽,方 亮
差示扫描量热技术在药剂学中的应用进展
刘 婕*,杨 丽,方 亮
(沈阳药科大学药学院, 辽宁沈阳 110016)
差示扫描量热法(differential scanning calorimetry,DSC)能够提供物质的物理性质和热能性质等信息,其具有样品用量少、分析速度快、温控范围大、制样简单等优点,作为热分析技术在药剂学领域已被使用多年。本文作者综述了近几年来DSC技术在药剂学中的新应用,并介绍了该技术在药剂研究中的最新进展。
药剂学;定性分析;定量分析;差示扫描量热法;应用;进展
差示扫描量热法(differential scanning calorimetry, DSC)是指在程序控温和一定气氛下,测量流入流出样品和参比物的热流与温度或时间关系的一种热分析技术,其结构示意图如图1所示[1]。在加热或冷却过程中,随着物质结构、相态和化学性质的改变,产生相应的热效应。这些热效应在DSC曲线上则表现为吸热(如熔化、脱水)或放热(如结晶)或热熔改变(如玻璃转化),由此对物质进行物理化学转变、定性定量分析。图2为典型的DSC曲线示意图[2],其对各种热效应做出了说明,在DSC曲线上,热流对时间的积分为峰面积,即物质产生热效应时吸收或释放的热量。
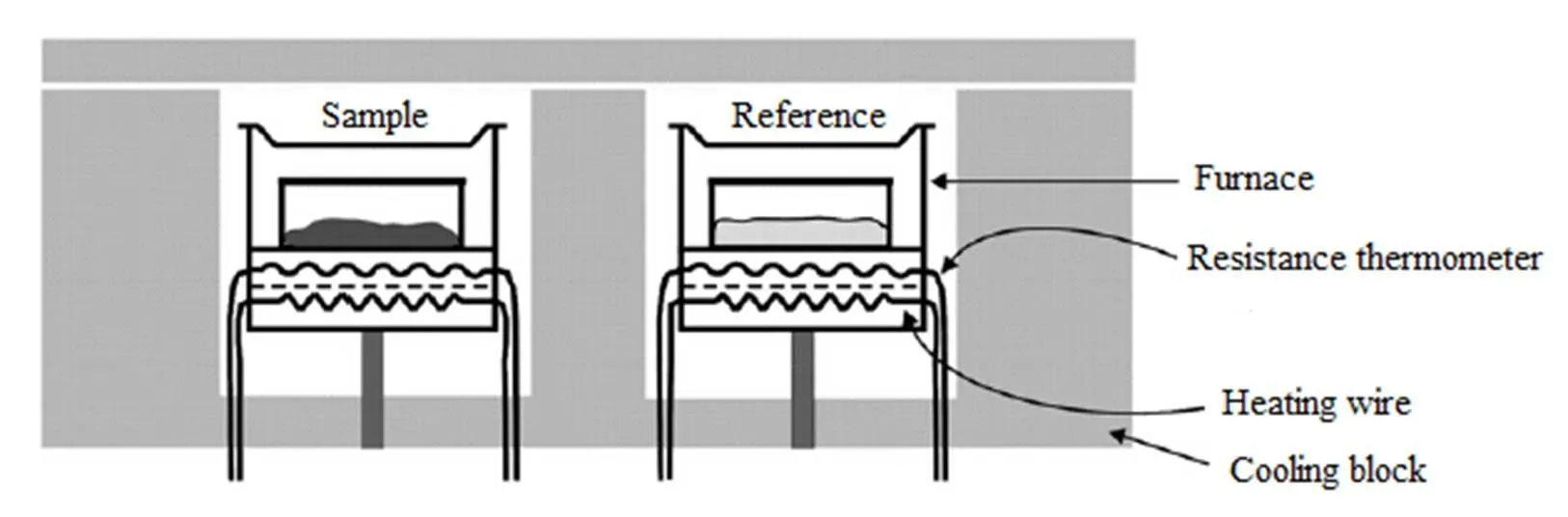
Fig. 1 Structural diagram of DSC
在药学领域中,差示扫描量热技术是测定熔点、玻璃转化温度、组分鉴定、研究药物晶型、纯度、稳定性及其与辅料相互作用、制剂形成等方面的重要手段。其具有样品用量少、分析速度快、温差范围大、制样简单等优点,应用广泛。近年来,随着方法的灵敏度以及研究领域的深入,将热分析技术与傅立叶红外光谱(FTIR)、拉曼光谱、X射线衍射等技术联用是热分析技术发展的新领域[1]。此外,调制DSC和快速扫描DSC的普及应用为药剂领域的一些机理研究做出了重大贡献。
本文作者综述了近几年来差示扫描量热技术在药剂学中的应用,并介绍了该技术在药剂研究中的最新进展。
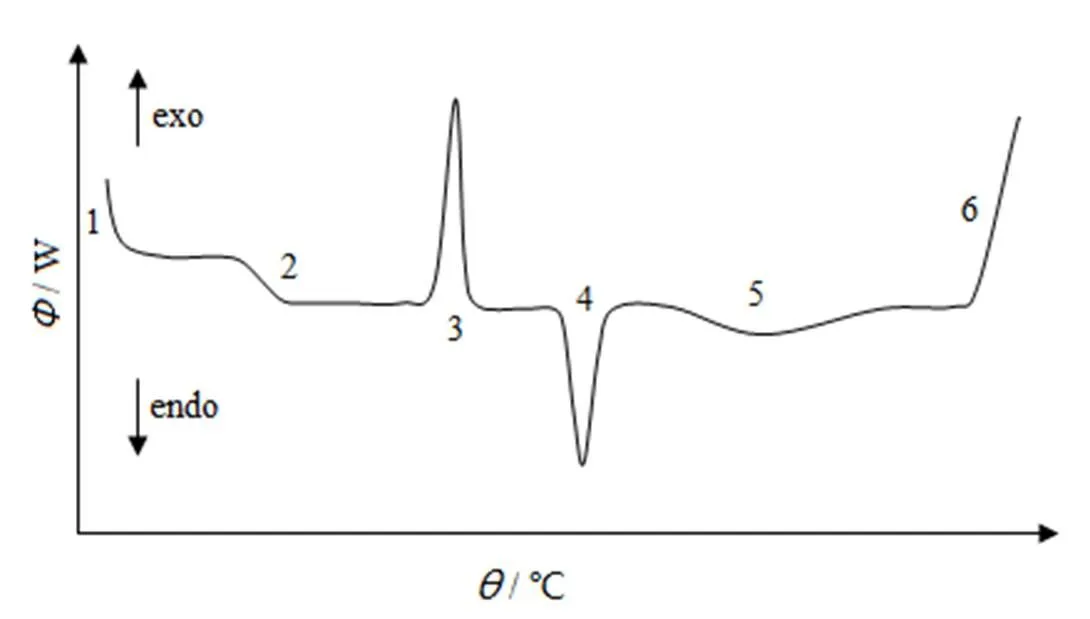
1—Initial deviation;2—Glass transition;3—Crystallization;4—Melting;5—Evaporation;6—Decomposing
1 DSC在药剂学中的应用
DSC作为一种热分析技术,在药剂学中有广泛的应用。其本身作为一种分析工具可用来测定物质的一些理化参数(如熔点、熔融焓、玻璃化转变温度等),如何将这些参数和具体的药剂学问题联系起来则是关键。如:根据熔点的不同区分同一种物质的不同晶型并判断其稳定性[3-4];根据吸热与放热特征峰的偏移、消失、焓值等改变,判断药物和辅料间的相容性[3-4];根据熔融峰的存在与否或熔融焓的大小来判定药物的存在状态(晶态或非晶态)[5-6];根据促透剂处理前后峰位的偏移进行皮肤构造解析[7];根据固体分散体玻璃化转变温度的大小来预测其物理稳定性[8];测定细胞冻结过程中的放热量进而得知细胞膜的渗透性[9];测定体系的结晶度随时间的变化来研究其结晶动力学[10-11]。此外,DSC还可用于物质的鉴别及热稳定性的研究,绘制二元体系的相图,测定药物的纯度,测定聚合物的结晶度[12],指导成膜或老化温度的选择及冻干程序的设定[13]等。
1.1 测定药物纯度
晶型化合物的纯度可用熔融焓值(ΔH),由Van 't Hoff方程(式1)计算得到,即熔点的下降与杂质所占的分数成正比[14]。用DSC法测定纯度的优势在于,分析速度较非水滴定法、HPLC法等方法快,且操作简单、样品量少,无需知道杂质的类型,无化学试剂消耗。用DSC法进行纯度测定可用于评价不同批次药品的质量,计算无定型含量等。
s=e-(Re2)/( ΔH0) (1)
其中,s为样品温度(K),e为纯组分的熔点(K),R为气体常数(8.314 J∙(mol-1∙K-1),为杂质的摩尔分数,ΔH0为纯化合物的熔融焓值,为s时样品融化分数。
G. Bruni等采用DSC法测定那格列奈多晶型混合物中,晶型H和B两种晶型的含量及纯度。结果显示两种晶型在DSC曲线上呈现2个吸热峰,并根据焓值进行含量计算[15]。Caroline McGregor等也用同法测定了制剂中两种晶型混合物的纯度[16]。
DSC法测定纯度虽然简单方便,但也有其局限性。要求杂质不能与样品反应,不能形成固溶体;低扫描速度(<5 ℃∙min-1,通常2 ℃∙min-1)和小样品量(1~3 mg),且要求样品的纯度在98%~99.95%内。
另外,药物随着温度降低可再次形成晶体,在DSC曲线上表现为放热峰,释放的热量取决于晶体化合物的晶格能,但有些无定型的成分无此过程。由此,DSC还可用于结晶度的定量[17-18]。
1.2 研究药物晶型判定药物存在状态
有机化合物中大约有1/3以上的化合物存在多晶型问题。多晶型可造成药物的溶解度、溶出速率、作用部位、稳定性、生物利用度、有害溶剂残留种类与含量不同,从而造成药物的药效与毒性及不良反应间存在较大差异[15]。对于药学工作者来说,了解药物和辅料的晶型和无定型性质是非常重要的。由于多晶型晶格能差使同质异晶的熔点、分解、脱水等现象有差异,因而应用DSC技术测定药物的吸热、放热情况,可快速鉴别药物的晶型及转变规律[19]。如对indiplon、阿戈美拉汀、卡马西平、氯吡格雷的多晶型研究[20-23]。刘毅等[24]以DSC法研究盐酸美西律的多晶型特征,DSC曲线出现两个特征性吸热峰,以温度较高的吸热峰为主,提示样品中存在两种晶型,并且以晶型Ⅱ为主;而经过加热处理的样品DSC图谱中只出现晶型Ⅱ的吸热峰,说明晶型Ⅰ在加热处理过程中已完全转变为晶型Ⅱ。
同理,可根据熔融峰的存在与否或熔融焓值的大小来判定药物的存在状态(晶态或非晶态),由此也可判断固体分散体、微球、微丸、包合物等制剂是否制备成功。具体方法为,对药物、辅料、药物与辅料以相应比例的物理混合物、以及制剂进行DSC分析,根据DSC曲线中各物质特征热力学峰位置的迁移或消失来证明制剂的形成[25]。以固体分散体为例,固体分散体中药物分散状态有胶体状态、无定型态、分子状态、亚稳定态等,其DSC图谱与原药、辅料相比变化明显,药物的特征峰甚至完全消失。若制剂中有药物晶体,则有吸热峰存在;药物的晶体越多,吸热峰总面积越大。从而可粗略判断是否形成固体分散体。如任君刚、邓春霞、K. Wlodarskia等采用溶剂-熔融法、喷雾干燥法制备硝苯地平、依托度酸、他达拉非固体分散体,应用DSC法表征发现,制剂中药物的熔融吸热峰完全消失,而物理混合物中仍存在该吸热峰,提示药物可能以无定型的形式存在于制剂中,证明形成了固体分散体[26-28]。Qi Yao等用DSC法证实,苄氯菊酯的第二个熔化吸热峰经-环糊精包合后消失,确认包合物的形成[29]。
1.3 测定高分子聚合物的玻璃转化温度
在药剂学中,将晶态药物转变为无定型药物可增加难溶性药物的溶出速率和溶解度[30]。然而无定型系统是热力学不稳定体系,随时间延长可能会析出药物结晶。向无定型药物中加入高分子聚合物,将药物以无定形态高度分散于高分子材料中,可以提高难溶性药物溶出度和生物利用度[31]。相较于单纯的无定型药物,聚合物的玻璃转化温度值较高,所以提高了无定型药物系统的物理稳定性。还有一些自主合成的具有两亲性、生物可降解的嵌段共聚物在药物传递领域备受青睐。这些高分子材料可形成胶束、水凝胶、微纳米球等作为药物载体,具有缓释、控释、靶向作用等优点。通过DSC法测定高分子聚合物的玻璃转化温度,来判断聚合物的形成、热稳定性、以及具有温度敏感性的聚合物的相转变行为等[32]。李东升等[33]就采用DSC法对含苯环侧基聚芳硫醚砜-聚砜嵌段共聚物进行了表征,结果表明共聚物形成,且具有较高的玻璃转化温度,证明该共聚物有良好的耐高温性。
玻璃转化温度对于判定无定型化合物在特定温度下是否有结晶倾向很重要。如果材料的储存温度低于玻璃转化温度,结晶速率则大大降低。另外,在制备储藏过程中,如何防止无定型制剂析晶,增加稳定性,是处方筛选的重要依据。Pei T. Mah等人利用DSC法测定格列苯脲制剂中无定型的玻璃转化温度,并对制备过程中是否有结晶出现进行检测[34],为处方工艺改进提供依据。
然而,大多数高分子或无定型的玻璃转化都比较微弱,受实验参数的影响较大[35]。对于较难测定的玻璃转化温度推荐使用调制DSC。
1.4 判定药物与辅料的相容性以及药物间的配伍禁忌
药用辅料与药物可发生物理和化学作用,可使药物分子发生异构化、聚合、晶型转化等变化[36]。两者是否相容是高质量药品处方设计和研究的基本内容,对于具有多种主药成分的处方更是如此。采用科学、合理的方法和手段,对药用辅料进行相容性研究及安全性评价,是药品研发的关键。目前,在众多方法中以DSC法最为常用。DSC法能够快速筛选药物辅料兼容性,其优点在于:无需长期储存;在制剂研发早期即可进行,无需建立色谱方法进行稳定性研究[1]。通过比较药物、辅料二元或多元混合物与单一物质的DSC曲线,比较吸热、放热特征峰的偏移、消失、焓值等改变,判断药物和辅料间、或药物与药物间有无物理化学作用。如Bogdan Tiţa等用DSC法评估了固体剂型中酮洛芬与几种常用药用辅料的相容性,发现酮洛芬与淀粉、胶体二氧化硅、微晶纤维素、和-乳糖、滑石粉以质量比1∶1物理混合后,DSC曲线为单独组分DSC曲线的叠加,熔点并无改变,证明药物与以上辅料之间无配伍禁忌;然而,酮洛芬与PVP和硬脂酸镁的混合物DSC曲线变化明显,证明药物与其有配伍反应,药物与这两种材料不能直接接触。这一结果提示,在制备酮洛芬固体制剂时,应包制隔离衣以提高药物稳定性并避免在处方中加入上述辅料[37]。王曦培等采用DSC法判定了四联抗结核药物配伍稳定性[38]。结果显示,不同配伍混合物中特征峰有变化并有新的吸热峰产生,说明药物之间存在配伍禁忌,为今后制剂的设计提供参考。
但DSC法测定药物与辅料兼容性不是在平衡条件下进行的,因而并不能作为平衡期、长期稳定性研究药物辅料间相互作用的判定标准。并且,当检测到辅料间有相互作用,还需使用HPLC法进一步确证。
1.5 研究皮肤透过机理
Sarah A等[8]采用DSC法对胰脂肪酶处理前后的皮肤进行解析,研究其对水溶性大分子的透皮吸收促进机理。结果显示,皮肤经胰脂肪酶处理后,由皮肤角质层中排列整齐的脂质产生的吸热峰发生明显变化,这说明胰脂肪酶可能直接作用于皮肤角质层的脂质部分,使其结晶排列状态发生变化、部分溶解或转变为无序状态,进而促进药物的透皮吸收。另有文献报道,利用DSC技术进行促透剂与蛇皮肤角质层作用机理研究[39]。
1.6 冷冻干燥工艺优化的研究
共熔点(共晶点)、玻璃转化温度是冷冻干燥工艺中的重要参数,对于确定预冻温度和升华温度具有重要意义。通常情况下,一次升华干燥的最高许可温度不得高于共熔点(共晶点)或玻璃转化温度。这样能够保持物料的稳定,避免塌陷等现象。左建国等利用DSC法研究了蔗糖水溶液的过冷度、玻璃转化温度及最大冻结浓缩溶液中的含水量等特性,分析了溶液浓度和热历史对冻干过程的影响。结果表明,过冷度和最大冻结浓缩溶液的玻璃化转变温度均与热历史有关;降温时溶液中的水分能否充分结晶受浓度和降温速率的共同影响[13]。这一结论对于以蔗糖为冻干保护剂的冻干品的工艺优化提供了参考。
2 DSC的应用进展
2.1 调制温度式差示扫描量热技术(MDSC)
调制温度式差示扫描量热技术,简称调制DSC或MDSC,是指在传统DSC技术的线性变温程序上叠加一个正弦振荡变化的温度序以产生一个随时间连续增加但不是线性升温程式[40]。这一振荡升温程序测得的热流变化经Fourier转变,可分解为与升温速率相关和不相关的两部分,即可逆热流和不可逆热流。两者之和为总热流,即传统DSC检测到的信号。调制DSC特有的升温方式可得到物质热松弛行为的信息,用于检测微弱转变,研究多组分共混体系,研究结晶和熔融过程,分离可逆和不可逆过程重叠的复杂热转变等[41-43]。
调制DSC的主要缺点是扫描速率慢,测定一个样品需要数小时才能完成。在实际工作中,不如传统DSC应用广泛。
2.2 快速扫描DSC
DSC程序的升温速率一般在0.2~50 ℃∙min-1。近年来发展的快速扫描DSC,其升温、降温速率可达到750 ℃∙min-1,还有些设备配有直径更小的加热炉,升温能力甚至可达到2 000 ℃∙min-1。极快的升温、降温速率可使一些动力学过程,如脱水、分解等转变向更高的温度范围移动,从而使原本被这些转变所掩盖(重叠在一起)的其他观测目标,如熔点、玻璃转化温度,分离出来[44]。这一技术能够探测被隐藏的微弱热变化过程,对于测定高分子的玻璃转化温度,尤其是未经干燥的高分子样品非常重要,因其常被样品中所含水分的挥发过程所遮掩[45-46]。
2.3 DSC与其他技术联用
尽管DSC已在药剂学中得到广泛应用,但仅靠单一的技术并不能得到准确的结论,需要与其他技术联用或结合做以佐证。如与傅立叶红外光谱FTIR、拉曼光谱仪[47]、X射线衍射仪[48]、热台显微镜、热重分析仪等多种技术手段联用。
DSC的主要功能是测定物质的热性质,FTIR则为鉴定化合物的主要官能团,将两种技术联合应用可在一次实验中同时获得试样的热性质和光谱信息,即DSC测量样品的吸热、放热反应,而FTIR同时给出热变化所对应的组分变化[49]。FTIR能明确指出是何种质变引起了DSC的热流变化。这一联用技术的优点是:两种方法使用同一试样;热环境和化学环境相同;任何热效应都能直接找到化学变化与之相对应[50]。可用于测定多晶型或溶剂化物的相转变、脱溶剂及皮肤脂质的热致转变、硅酮弹性体的固化动力学、鱿鱼油对微囊的保护作用、高聚物的玻璃转化温度、Eudragit聚合物分子间酯缩合反应、-晶状体球蛋白的热稳定性和可逆性等[51]。
Tieh-kang Wu等采用DSC-FTIR联用技术对制剂的共晶进行筛选和检测[52]。作者选取12个原料药及共晶形成物的复合物,筛选并检测共晶的形成。结果显示,IMC和SAC的熔点分别为161、229℃,而其物理混合物的吸热峰在153、183 ℃处,认为153 ℃为共熔混合物熔融,183 ℃为IMC/SAC共晶的熔点,这与用溶剂挥散法制得的IMC/SAC共晶的DSC吸热峰183 ℃吻合。相应的从FTIR图谱可以观察到,在153 ℃前,IMC/SAC物理混合物图谱与单独组分的红外图谱相比没有变化,而当温度高于153 ℃时,在1736、1718、1684 cm-1处出现3个新峰,与溶剂挥散法制备的IMC/SAC共晶样品的红外谱图吻合,证明IMC/SAC共晶的形成(图3)。这一结果表明,DSC-FTIR联用技术可以快速、直接筛选并检测IMC/SAC共晶形成。作者用同法,对另外几组共晶也进行了筛选和检测,得出相同的结论。可以说,DSC-FTIR联用技术是实时筛选和确证共晶形成的强有效手段。
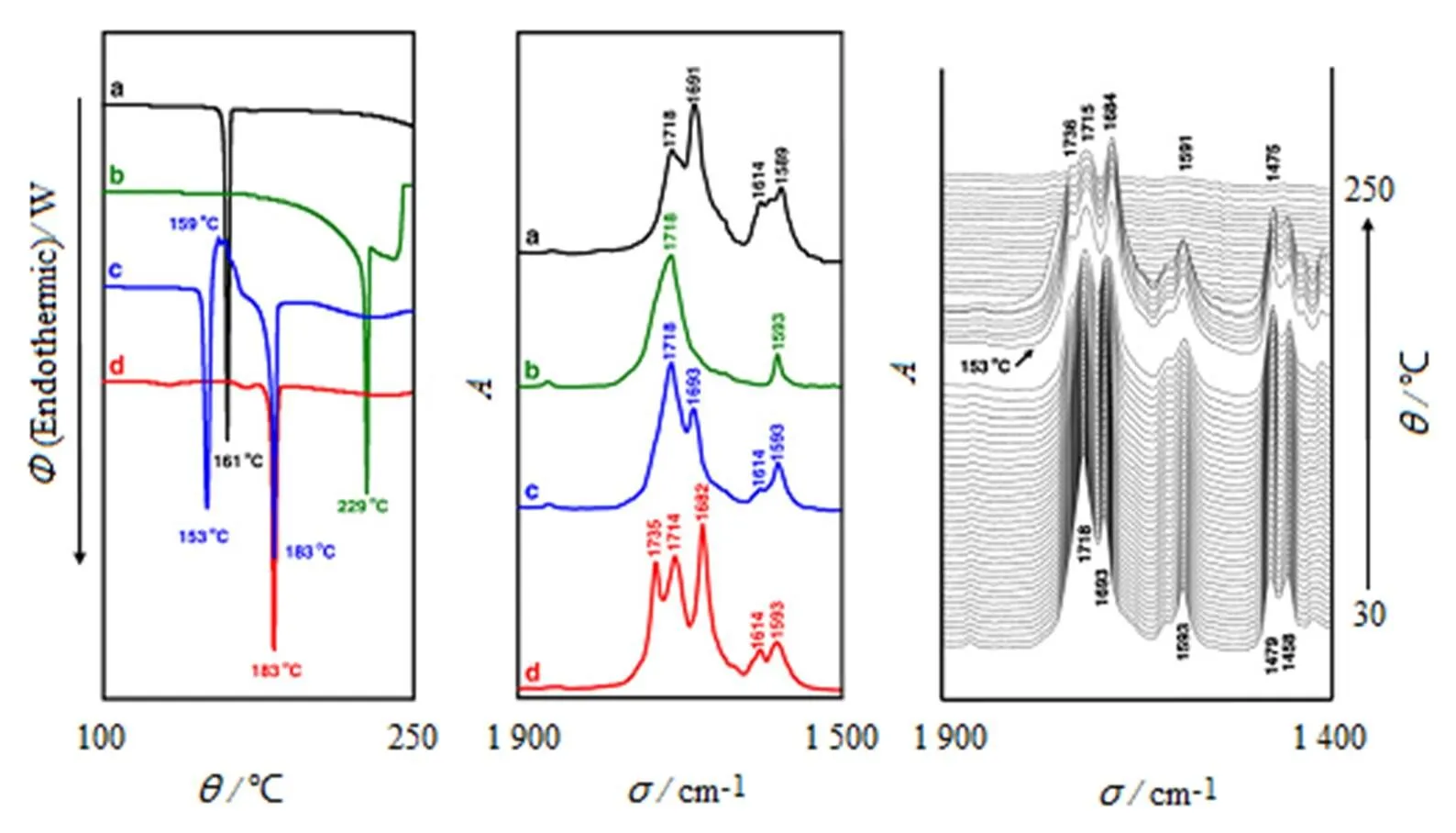
Fig. 3 The DSC thermograms and FTIR spectra of IMC (a), SAC (b), physical mixture (c) and solvent- evaporated sample (d) of IMC/SAC, as well as thermal-dependent three dimensional FTIR spectral plot of the physical mixture of IMC/SAC
与DSC-FTIR联用技术类似,DSC与拉曼光谱仪联用也能同时对样品的热信息和结构、分子间作用力进行分析。具有高效、同步、节约样品量的优点,在制剂的工艺分析、机理研究中应用较多[53]。Jun Huang等采用DSC-拉曼联用技术,检测两种存在制剂多晶型化合物甘露醇和BMS-A的多晶型[54]。Sébastien Hubert等应用该技术对咖啡因片剂制备过程中的相转变进行分析和监控[55]。
3 结语
DSC技术因其操作简便、测量迅速、图谱易分析、所需试量小等特点,在药剂学领域中已得到广泛应用。随着多种热分析技术之间相互结合以及热分析仪和其他技术如红外光谱和显微镜等联用技术的蓬勃发展,必将进一步拓展热分析技术在药剂学中的应用范围。
[1] CLAS S D, DALTON C R, HANCOCK B C. Differential scanning calorimetry: applications in drug development[J].Pharm Sci Technolo Today, 1999, 2(8): 311-320.
[2] BUHR J, WIDMANN G. 热分析应用手册: 药物和食品[M]. 陆立明, 译. 上海: 东华大学出版社, 2011: 2.
[3] LIN S Y, WANG S L. Advances in simultaneous DSC–FTIR microspectroscopy for rapid solid-state chemical stability studies: Some dipeptide drugs as examples [J]. Adv Drug Deliv Rev, 2012, 64: 461-478.
[4] FORD J L, MANN T E. Fast-Scan DSC and its role in pharmaceutical physical form characterisation and selection [J]. Adv Drug Deliv Rev, 2012, 64: 422-430.
[5] AIGNERA Z, BERKESIB O, FARKASA G, et al. DSC, X-ray and FTIR studies of a gemfibrozil/dimethyl-β-cyclodextrin inclusion complex produced by co-grinding[J]. J Pharm Biomed Anal, 2012, 57: 62- 67.
[6] LI W, QUAN P, ZHANG Y, et al. Influence of drug physicochemical properties on absorption of water insoluble drug nanosuspensions[J]. Int J Pharm, 2014, 460(1/2): 13-23.
[7] IBRAHIM S A, LI S K. Chemical enhancer solubility in human stratum corneum lipids and enhancer mechanism of action on stratum corneum lipid domain[J]. Int J Pharm, 2010, 383(1/2): 89-98.
[8] TIAN Y, BOOTH J, MEEHAN E, et al. Construction of drug−polymer thermodynamic phase diagrams using flory−huggins interaction theory: Identifying the relevance of temperature and drug weight fraction to phase separation within solid dispersions [J].Mol Pharm, 2013, 10: 236-248.
[9] 王雅博,诸凯,张于峰, 等. 冻结过程中肾细胞体积变化的实验研究与数值计算[J]. 天津大学学报(自然科学与工程技术版), 2014, 47(2): 149-154.
[10] 黄浪, 王海刚, 王清, 文. 木粉/聚丙烯复合材料的非等温结晶动力学分析[J]. 中国工程科学, 2014, 16(4): 21-24.
[11] 马东旭,王晶禹. 纳米HNS的等温结晶动力学研究[J]. 中北大学学报(自然科学版), 2014, 35(2): 161-166.
[12] 朱桂新,王诚,张顺花. 纳米云母对聚丙烯结晶形态和结晶性能的影响[J]. 高分子材料科学与工程, 2014, 30(3): 64-67.
[13] 左建国,华泽钊,刘宝林. 冷冻干燥过程中溶液冻结特性的DSC研究[J]. 低温工程, 2005, 3: 48-51.
[14] MATHKAR S, KUMAR S, BYSTOL A, et al. The use of differential scanning calorimetry for the purity verification of pharmaceutical reference standards[J]. J Pharm Biomed Anal, 2009, 49: 627-631.
[15] BRUNI G, BERBENNI V, MILANESE C, et al. Determination of the nateglinide polymorphic purity through DSC[J]. J Pharm Biomed Anal, 2011, 54(5): 1196-1199.
[16] MCGREGOR C, BINES E. The use of high-speed differential scanning calorimetry (Hyper-DSC™) in the study of pharmaceutical polymorphs[J]. Int J Pharm, 2008, 350(1/2): 48-52.
[17] ZIDAN A S, RAHMAN Z, SAYEED V, et al. Crystallinity evaluation of tacrolimus solid dispersions by chemometric analysis[J]. Int J Pharm, 2012, 423(2): 341-350.
[18] WIDJAJA E, KANAUJIA P, LAU G, et al. Detection of trace crystallinity in an amorphous system using Raman microscopy and chemometric analysis[J]. Eur J Pharm Sci, 2011, 42(1/2): 45-54.
[19] LÁNGA P, VÁRKONYIB E, ULRICHC J, et al. Analysis of the polymorph changes of a drug candidate[J]. J Pharm Biomed Anal, 2015, 102: 229-235.
[20] FURUTA H, MORI S, YOSHIHASHI Y, et al. Physicochemical and crystal structure analysis of pranlukast pseudo-polymorphs II: Solvate and cocrystal[J]. J Pharm Biomed Anal, 2015, 111: 44-50.
[21] DU W, ZHOU Y F, GONG Y F, et al. Investigation of physicochemical properties andevaluation of agomelatine polymorphs[J]. Asian Journal of Pharmaceutical Sciences, 2013, 8(3): 181-190.
[22] LIMWIKRANT W, NAGAI A, HAGIWARA Y, et al. Formation mechanism of a new carbamazepine/malonic acid cocrystal polymorph[J]. Int J Pharm, 2012, 431(1/2): 237-240.
[23] KHOMANE K S, BANSAL A K. Differential compaction behaviour of roller compacted granules of clopidogrel bisulphate polymorphs[J]. Int J Pharm, 2014, 472(1/2): 288-295.
[24] 刘毅, 岳志华, 宁保明, 等.盐酸美西律多晶型研究[J]. 药物分析杂志, 2008, 28(9): 1503-1505.
[25] KAUR P, SINGH S K, GARG V, et al. Optimization of spray drying process for formulation of solid dispersion containing polypeptide-k powder through quality by design approach[J]. Powder Technology, 2015, 284: 1-11.
[26] 任君刚, 邹梅娟, 王悦, 等. 硝苯地平聚乙二醇(PEG)固体分散体的制备[J]. 中国药剂学杂志, 2006, 4(5): 195-200.
[27] 邓春霞, 邹梅娟, 于淑香, 等. 依托度酸固体分散体的制备[J]. 中国药剂学杂志, 2007, 5(3): 88-93.
[28] WLODARSKIA K, SAWICKIA W, KOZYRAB A, et al. Physical stability of solid dispersions with respect to thermodynamic solubility of tadalafil in PVP-VA[J]. Eur J Pharm Biopharm, 2015, 96: 237-246.
[29] YAO Q, YOU B, ZHOU S, et al. Inclusion complexes of cypermethrin and permethrin with monochlorotriazinyl- beta-cyclodextrin: A combined spectroscopy, TG/DSC and DFT study[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2014, 117: 576-586.
[30] LÖBMANN K, LAITINEN R, GROHGANZ H, et al. Coamorphous drug systems enhanced physical stability and dissolution rate of indomethacin and naproxen[J]. Mol Pharm, 2011, 8: 1919-1928.
[31] KONNO H, HANDA T, ALONZO D, et al. Effect of polymer type on the dissolution profile of amorphous solid dispersions containing felodipine[J]. Eur J Pharm Biopharm, 2008, 70: 493-499.
[32] KALOGERAS I M. A novel approach for analyzing glass-transition temperature vs. composition patterns: Application to pharmaceutical compound + polymer systems[J]. Eur J Pharm Sci, 2011, 42(5): 470-483.
[33] 李东升, 张刚, 王孝军, 等. 含苯环侧基聚芳硫醚砜-聚砜嵌段共聚物的制备及表征[J]. 高分子材料科学与工程, 2014, 30(3): 153-157.
[34] MAH P T, LAAKSONEN T, RADES T, et al. Differential scanning calorimetry predicts the critical quality attributes of amorphous glibenclamide[J]. Eur J Pharm Sci, 2015, 80: 74-81.
[35] READING M, HOURSTON D J. Modulated Temperature Differential Scanning Calorimetry. Theoretical and Practical Applications in Polymer Characterization [M]. Netherlands: Springer, 2006: 13-16.
[36] FATHIMA N, MAMATHA T, QURESHI H K, et al. Drug-excipient interaction and its importance in dosage form development [J]. Journal of Applied Pharmaceutical Science, 2011, 1(6): 66-71.
[37] TITA B, FULIAS A, BANDUR G, et al. Compatibility study between ketoprofen and pharmaceutical excipients used in solid dosage forms[J]. J Pharm Biomed Anal, 2011, 56(2): 221-227.
[38] 王曦培,王思玲,姜同英, 等. 四联抗结核药物配伍稳定性的研究[J]. 中国药剂学杂志, 2009, 7(3): 154-160.
[39] BABY A R, LACERDA A C, VELASCO M V, et al. Evaluation of the interaction of surfactants with stratum corneum model membrane from Bothrops jararaca by DSC[J]. Int J Pharm, 2006, 317: 7-9.
[40] COLEMAN N J, CRAIG D. Modulated temperature differential scanning calorimetry: a novel approach to pharmaceutical thermal analysis[J]. Int J Pharm, 1996, 135: 13-29.
[41] SAKLATVALA R D, SAUNDERS M H, FITZPATRICK S.A comparison of high speed differential scanning calorimetry (Hyper-DSC) and modulated differential scanning calorimetry to detect the glass transition of polyvinylpyrrolidone: the effect of water content and detection sensitivity in powder mixtures (a model formulation) [J].Journal of Drug Delivery Science and Technology, 2005, 15(4): 257-260.
[42] LIN Y, SHI Z, WILDFONG P L.Thermal conductivity measurements for small molecule organic solid materials using modulated differential scanning calorimetry (MDSC) and data corrections for sample porosity[J].J Pharm Biomed Anal, 2010, 51(4): 979-984.
[43] LAI H L, PITT K, CRAIG D Q. Characterisation of the thermal properties of ethylcellulose using differential scanning and quasi-isothermal calorimetric approaches[J].Int J Pharm, 2010, 386(1/2): 178-184.
[44] FORD J L, MANN T E. Fast-Scan DSC and its role in pharmaceutical physical form characterisation and selection[J].Adv Drug Deliv Rev, 2012, 64: 422-430.
[45] GUNS S, KAYAERT P, Martens J A, et al. Characterization of the copolymer (ethyleneglycol-gvinylalcohol) as a potential carrier in the formulation of solid dispersions[J]. Eur J Pharm Biopharm, 2010, 74: 239-247.
[46] BUCKTON G, ADENIYI A A, SAUNDERS M, et al. Hyper DSC studies of amporphous polyvinylpyrrolidone in a model wet granulation system[J]. Int J Pharm, 2006, 312 (1/2): 61-65.
[47] WOŁOSZYN Ł, ILCZYSZYN M M, KINZHYBALO V. X-ray diffraction, spectroscopic (IR, Raman) and DSC studies of bis(betainium)-toluenesulfonate monohydrate crystal. Vibrational spectroscopy[J].Vibrational Spectroscopy, 2015, 76: 6-21.
[48] LI Y, CHOW P S, TAN R B.Quantification of polymorphic impurity in an enantiotropic polymorph system using differential scanning calorimetry, X-ray powder diffraction and Raman spectroscopy[J].Int J Pharm, 2011, 415: 110-118.
[49] SPRAGG R A. Combining FTIR microspectroscopy with different scanning calorimetry[J]. Analusis, 2000, 28(1): 64-67.
[50] DEGAMBER B,WINTER D,TETLOW J. Simultaneous DSC/FTIRS/TMA. Meas Sci Technol, 2004, 15(9): L5-L10.
[51] LIN S Y, WANG S L. Advances in simultaneous DSC–FTIR microspectroscopy for rapid solid-state chemical stability studies: Some dipeptide drugs as examples[J]. Adv Drug Deliv Rev, 2012, 64(5): 461-478.
[52] WU T K, LIN S Y, LIN H L, et al. Simultaneous DSC-FTIR microspectroscopy used to screen and detect the co-crystal formation in real time[J].Bioorg Med Chem Lett, 2011, 21(10): 3148-3151.
[53] SKRDLA P J, ZHANG D.Disproportionation of a crystalline citrate salt of a developmental pharmaceutical compound: Characterization of the kinetics using pH monitoring and online Raman spectroscopy plus quantitation of the crystalline free base form in binary physical mixtures using FT-Raman, XRPD and DSC[J]. J Pharm Biomed Anal, 2014, 90: 186-191.
[54] HUANG J, DALI M.Evaluation of integrated Raman-DSC technology in early pharmaceutical development: Characterization of polymorphic systems[J].J Pharm Biomed Anal, 2013, 86: 92-99.
[55] HUBERT S, BRIANCON S, HEDOUX A, et al.Process induced transformations during tablet manufacturing: Phase transition analysis of caffeine using DSC and low frequency micro-Raman spectroscopy[J].Int J Pharm, 2011, 420(1): 76-83.
Applications and advances of differential scanning calorimetry in pharmaceutics
Jie Liu*, Li Yang, Liang Fang
(,,110016,)
Differential scanning calorimetry (DSC) is widely used in pharmaceutics as a thermal analysis technique for many years; it can provide detailed information about both physical and energetic properties of a chemical substance with the advantages of less sample consumption, fast analysis, broad temperature range, simple sample preparation, and convenient operation. This review is intended to provide an overview of latest applications and advances of DSC in the field of pharmaceutics.
pharmaceutics; qualitative analysis; quantitative analysis; differential scanning calorimetry; application; advances
(本篇责任编辑:赵桂芝)
(2017)05–0119–10
10.14146/j.cnki.cjp.2017.05.003
R94
A
2017-02-23
作者介绍:刘婕(1985-), 女(汉族), 辽宁沈阳人, 实验员, 硕士, 主要从事大型仪器设备应用的研究, Tel. 13940104733, E-mail tctctc7028@163.com。
