不同pH下胞外多糖和脂多糖对烟草青枯菌根部定殖的影响
2017-11-07王贻鸿赵云峰孔凡玉王新伟王振华张晓阳彭德元
王贻鸿,赵云峰,孔凡玉,王新伟,王振华,张晓阳,彭德元,王 静*
(1.中国农业科学院烟草研究所,烟草行业病虫害监测与综合治理重点开放实验室,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.青岛农业大学,青岛 266109;4.湖南省烟草公司张家界市公司,湖南 张家界 427000)
不同pH下胞外多糖和脂多糖对烟草青枯菌根部定殖的影响
王贻鸿1,2,赵云峰3,孔凡玉1,王新伟1,王振华4,张晓阳4,彭德元4,王 静1*
(1.中国农业科学院烟草研究所,烟草行业病虫害监测与综合治理重点开放实验室,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.青岛农业大学,青岛 266109;4.湖南省烟草公司张家界市公司,湖南 张家界 427000)
通过设定不同pH梯度,研究烟草青枯菌胞外多糖(Exopolysaccharides,EPS)和脂多糖(Lipopolysaccride,LPS)分泌量的差异及其对烟草根部吸附青枯菌数量的影响。结果表明,pH为 6.5时 EPS单产量和总产量均最大,分别达到3.27×10-12和50.12×10-2g,pH 8.0时总产量和单产量最小。pH 7.0时,LPS的总产量最大,为9.41×10-3g,pH 7.5时单产量最大,为17.51×10-15g。同一pH梯度的EPS单产量远大于LPS单产量。EPS促进烟株根部吸附和侵入青枯菌,而LPS起抑制作用,且相同浓度下EPS促进作用占主导。当pH为6.6时,添加EPS的菌液处理的烟株根表吸附和根内侵入青枯菌数量最大,分别达到15.43×108和10.73×109cfu/g;堆积在根表的杆状青枯菌菌体及导管横切面堵塞的青枯菌及其分泌物的数量最多,根尖畸形严重。因此,偏酸性条件下,青枯病菌 EPS分泌量增多,促进青枯菌与烟草根部的识别和吸附,进一步提高病害发生程度,而中性和偏碱性条件有利于LPS分泌,降低病害发生。
pH;胞外多糖;脂多糖;烟草青枯菌;定殖
烟草青枯病是由茄科劳尔氏菌(Ralstonia solanacearum)引起的一种毁灭性维管束病害,一直是威胁烟草生产的主要根部病害之一[1],尤其在我国南方烟区大面积发生。影响烟草青枯病发生的因素很多,其中土壤环境最为重要,包括如土壤类型、酸碱度、微量元素含量等[2]。近年来,烟草大面积连作、环境污染、酸性肥料施用等因素导致我国植烟土壤酸化现象日趋严重[3],加重了土传病害包括烟草青枯病的发生,制约烟草产量和质量[4]。
青枯菌对寄主根表的吸附和根内侵入是其成功侵染的必要条件,EPS和LPS在病原与寄主的识别中发挥重要作用[5]。青枯菌通常可从烟草根部、茎部或导管受伤部位侵入,在导管中生长时产生大量胞外多糖(Exopolysaccharides, EPS),EPS阻碍植物体内水分的运输,从而引起植物萎蔫[6]。研究表明,EPS能促进细菌在寄主体内的扩散和定殖,EPSI缺陷突变型细菌在番茄茎杆内移动速度大大降低[7-9]。脂多糖(Lipopolysaccride, LPS)是青枯菌外膜一种多糖,能占据植物细胞的结合位点,抑制了含EPS细菌在接种时的吸附识别过程[10]。
目前,尚未见pH对烟株根表吸附和根内侵入青枯菌影响的研究报道,因此,本文通过设定不同pH梯度,研究EPS和LPS对烟株根表吸附及根内侵入青枯菌数量的影响,明确不同pH条件下EPS和LPS与青枯病发生的关系,为探明酸性土壤中烟草青枯病菌与根部的识别机制及改善农业防控措施提供理论依据。
1 材料与方法
1.1 试验材料
供试烤烟品种为K326(大十字期)。供试菌株:R. solanacearum,分离自湖南张家界市慈利县江垭镇烟草病株,经鉴定为1号生理小种生物型Ⅲ。供试培养基和试剂:营养琼脂培养基(NA)、营养肉汤培养基(NB)及 2,3,5-氯化三苯基四氮培养基(TTC)的制备参照文献[11]。酸碱缓冲液制备参照文献[12]。LPS提取试剂盒购自 iNtRON公司。戊二醛、95%乙醇、氯仿、正丁醇均为国产分析纯。
1.2 试验方法
1.2.1 pH对青枯菌分泌EPS和LPS的影响 取100 μL浓度为108cfu/mL标准菌液加入到pH分别为5.5、6.0、6.5、7.0、7.5、8.0的NB培养基中振荡培养,每处理3次重复。32 h后,各取1 mL培养液经梯度稀释后涂布于TTC平板计数并计算菌液浓度,公式如下:
细菌浓度(cfu/mL)=菌落数(cfu)×稀释倍数/涂板菌液量(mL)[13]
同时,各pH处理另取100 mL青枯菌培养液,5000 r/min离心5 min,取上清液用于EPS及LPS的提取。HUSAIN酒精沉淀法[14]结合SEVAG[15]脱蛋白法提取EPS;WESTERMAN热酚水法[16]结合酶解法和醇沉法[17]提取LPS,分别称量EPS和LPS干质量,结合菌液的浓度计算各自的单产量和总产量[18]。
1.2.2 不同pH条件下,EPS和LPS对根部吸附识别和侵入青枯菌的影响 采用菌悬液浸根接种的方法进行测定。试验共设5组处理,菌悬液浓度为3×108cfu/mL,处理 1 组为 pH 分别为 5.2、5.9、6.6、7.3的标准菌液中各加浓度为8 mg/mL的EPS;处理2组为上述各pH的标准菌液加入8 mg/mL的LPS;处理 3组为上述各 pH的标准菌液加入 8 mg/mL的EPS和LPS;CK组为上述各pH的标准菌液;CK0组为上述各pH的无菌酸性缓冲液。烟苗幼根经表面消毒后,浸入上述各处理的菌液中,并置于昼夜温度为 32 ℃/30 ℃、湿度 75%的人工气候室内接种培养,每处理15株,3次重复。分别于接种后1 h、24 h和48 h取样,每次每处理取1株烟苗的完整须根,截取根尖处长度为2 cm的根于无菌水中充分涤荡后,取适量含菌液于TTC平板涂板计数,即为青枯菌的根表吸附量;取出的根尖再经70%酒精表面消毒30 s、无菌水冲洗3次并在无菌状态下吹干水分、称量后研磨,取适量研磨液于TTC平板涂板计数,即为青枯菌的根部侵入量。菌量计算公式如下:
细菌浓度(cfu/mL)=菌落数(cfu)×稀释倍数/涂板菌液量(mL)
吸附或侵入菌量(cfu/g)=细菌浓度(cfu/mL)×分离用水量(mL)/根鲜质量(g)
1.2.3 根部吸附和侵入青枯菌的扫描电镜观察青枯菌根部的接种与取样方法同1.2.2,取接种24 h的样品观察根冠和根冠后区域(伸长区和根毛区)根表吸附青枯菌的数量和致畸程度,取接种48 h的样品观察根尖横切面导管中青枯菌分泌物量及致畸程度。电镜样品处理方法如下:取样后,将样品浸泡于 4%的戊二醛溶液中,4 ℃冰箱保存,参照文献[19-20]的方法对根尖细胞及根尖横切面细胞进行扫描电镜(XL-3, Philips company, Holland)观察。
1.3 数据分析
采用 Excel 2010对数据进行基本处理,DPS 9.50统计软件Duncan新复极差法进行多重比较。
2 结 果
2.1 pH对EPS与LPS产量的影响
由图1可见,以不同pH条件培养的青枯菌分泌的 EPS单产量和总产量差异较大。振荡培养至32 h时,pH 6.5的EPS单产量和总产量最大,pH 8.0的单产量和总产量最小,即pH 6.5时EPS单产量和总产量大于pH 7.0的中性条件及pH 7.5、8.0的碱性条件。LPS总产量在 pH 7.0时最大,其次是pH 6.5,再次是pH 7.5的碱性环境,LPS单产量在pH 7.5时最大,pH 8.0次之,中性和酸性条件下偏小。另外,在试验所设pH范围内,青枯菌每个菌落形成单位分泌的EPS质量远大于LPS分泌量,二者之间相差103倍。
2.2 不同pH条件下EPS和LPS对根表吸附和根内侵入青枯菌数量的影响
2.2.1 对烟株根表吸附青枯菌的影响 结果如表 1所示,接种后 1 h,各处理的根表吸附青枯菌量与CK组相当;青枯菌液接种后24 h的根表吸附菌量,pH 6.6最大,其次为pH 7.3,pH 5.9和5.2最低;EPS和LPS对pH 5.9、6.6和7.3处理的根表吸附量分别表现为显著促进和抑制作用,与CK差异显著,而pH 5.2条件下EPS的促进作用和LPS的抑制作用与CK组差异不显著。除此之外,上述3个pH处理同时加入等浓度的LPS和EPS时,根表吸附量与CK组差异显著;因此,相对于LPS的抑制作用,EPS对根表吸附量的促进作用占主导。无菌酸性缓冲液处理组(CK0)烟苗根表未检测到青枯菌。
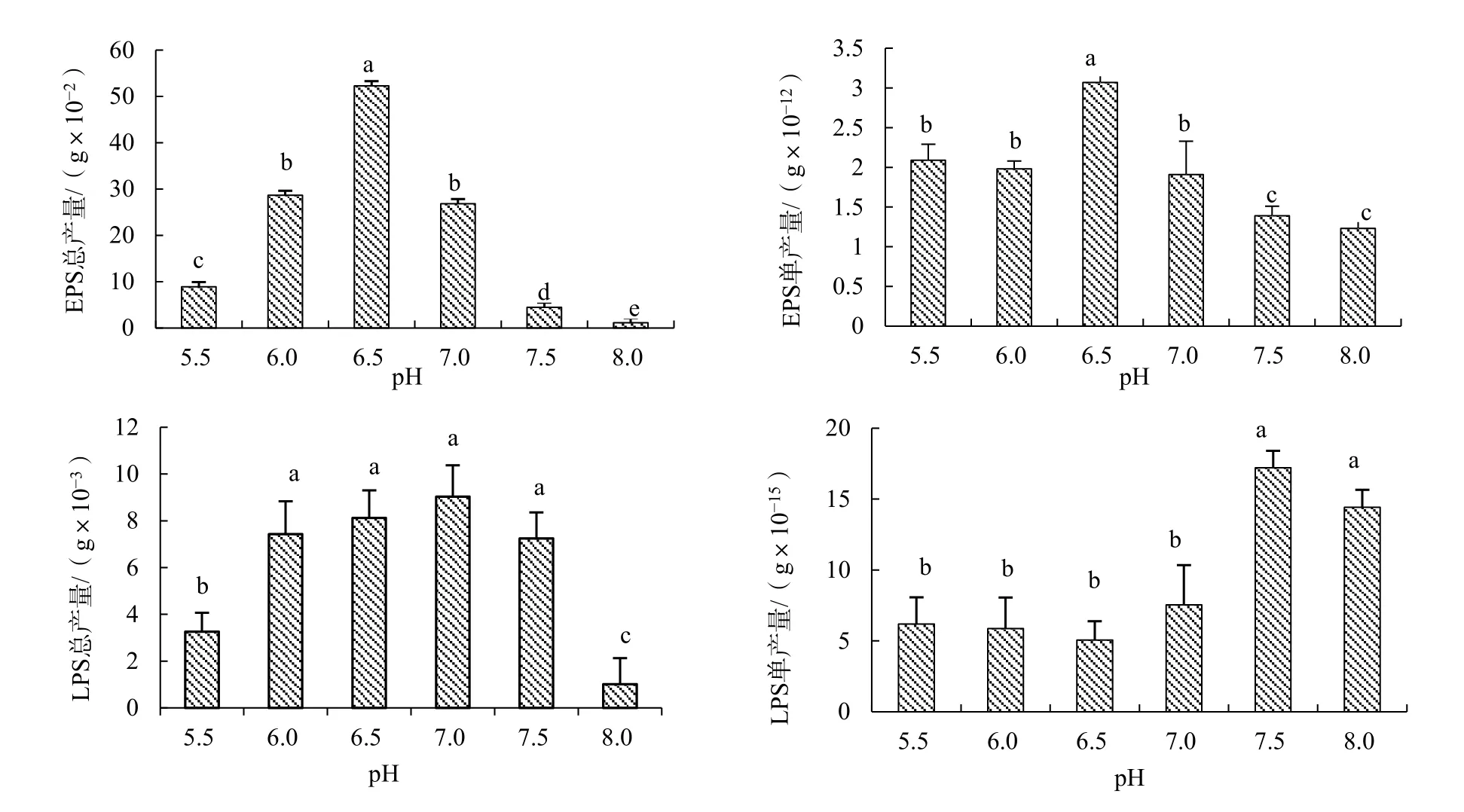
图1 不同pH值条件下青枯菌EPS与LPS产量Fig. 1 The production of EPS and LPS of R.solanacearum at different pH values

表 1 不同pH条件下EPS与LPS对烟株根表吸附青枯菌量的影响Table 1 Effects of EPS and LPS on the amounts of R. solanacearum adsorbed onto surface of tobacco roots at different pH values 108 cfu/g
2.2.2 对烟株根内侵入青枯菌量的影响 结果如表2所示,接种后第48小时,pH 6.6的青枯菌液CK处理的根内侵入菌量最大,其次为pH 7.3,pH 5.9和5.2的侵入量最低,即pH 6.6的根内侵入量大于pH 7.3;EPS和LPS对pH 5.9、6.6和7.3三个处理的根内侵入量分别表现为显著的促进和抑制作用,与CK差异显著,而pH 5.2条件下EPS的促进作用和LPS的抑制作用与对照组差异不显著。上述3个pH处理同时加入等浓度的LPS和EPS时,根表吸附量与CK差异显著,因此,相对于LPS的抑制作用,EPS对根内侵入量的促进作用占主导。无菌酸性缓冲液处理组烟苗根内未检测到青枯菌。
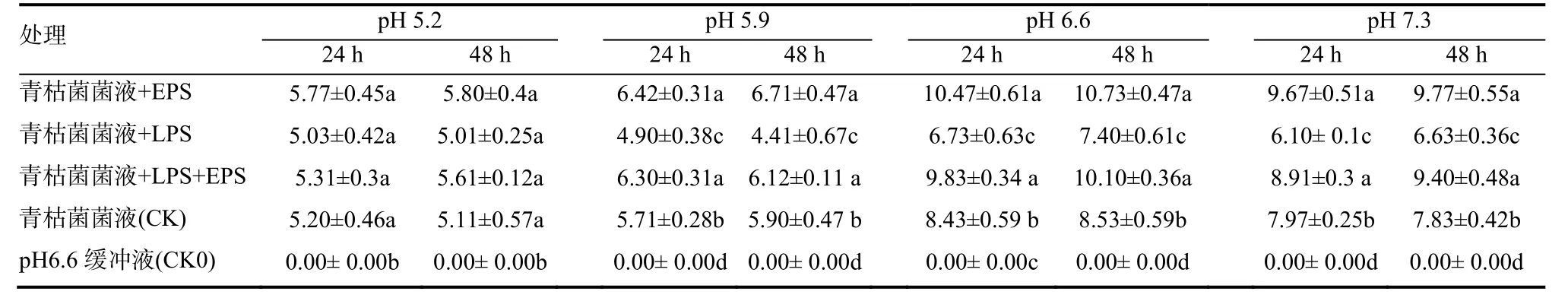
表2 不同pH条件下EPS与LPS对烟株根内青枯菌侵入量的影响Table 2 Effects of EPS and LPS on the amounts of R. solanacearum invading into tobacco roots at different pH 108 cfu/g
2.3 根尖表面吸附青枯菌的扫描电镜观察
浸根接种后第 24小时,无菌酸性缓冲液处理的根尖细胞排列紧密整齐,根冠生长正常(图2-A1),且根冠后区域细胞表面干净,未见青枯菌分布(图2-A4);pH 5.2和6.6的青枯菌液处理的根尖外皮层细胞被破坏,肿胀、变形、排列混乱,根冠整体膨大畸形(图2-A2、A3)。青枯菌液处理根冠后区域表面吸附的青枯菌量,pH 6.6时最大(图2-B3),其次是pH 7.3的碱性条件(图2-B4),再次为pH 5.9(图2-B2),pH 5.2时最小(图2-B1)。与CK处理比较,外加EPS的各处理根尖表皮细胞分布的青枯菌数量更多,且表皮细胞排列混乱、根组织被破坏程度加重。同样是外加EPS的处理,pH 6.6条件下的根冠后区域吸附菌量(图2-C3)明显高于其他3个pH处理,其次为pH 7.3(图2-C4),略大于pH 5.9(图2-C2)及pH5.2(图2-C1);而外加LPS的各pH菌悬液处理的根表吸附菌量及表皮细胞的破坏程度(图2-D1、D2、D3、D4)低于CK处理。
2.4 根尖横切面的扫描电镜观察
浸根接种后48 h,无菌酸性缓冲液处理的根尖横切面维管束细胞(包括木质部细胞和韧皮部细胞)间脉络清晰、形状规则,排列整齐(图 3-A1),然而不同pH青枯菌液各处理的根组织均有细菌定殖,细菌主要堆积于维管束,且维管束细胞遭到不同程度的破坏(图3-B1,2,3,4),其中,pH 6.6处理横切面有大量青枯菌和其分泌的白色胞外混和物堆积在维管束内并破坏组织细胞,导致该部位畸形严重(图3-B3),且pH 6.6处理的维管束分布的白色物质数量多于其他几个pH的菌液处理。
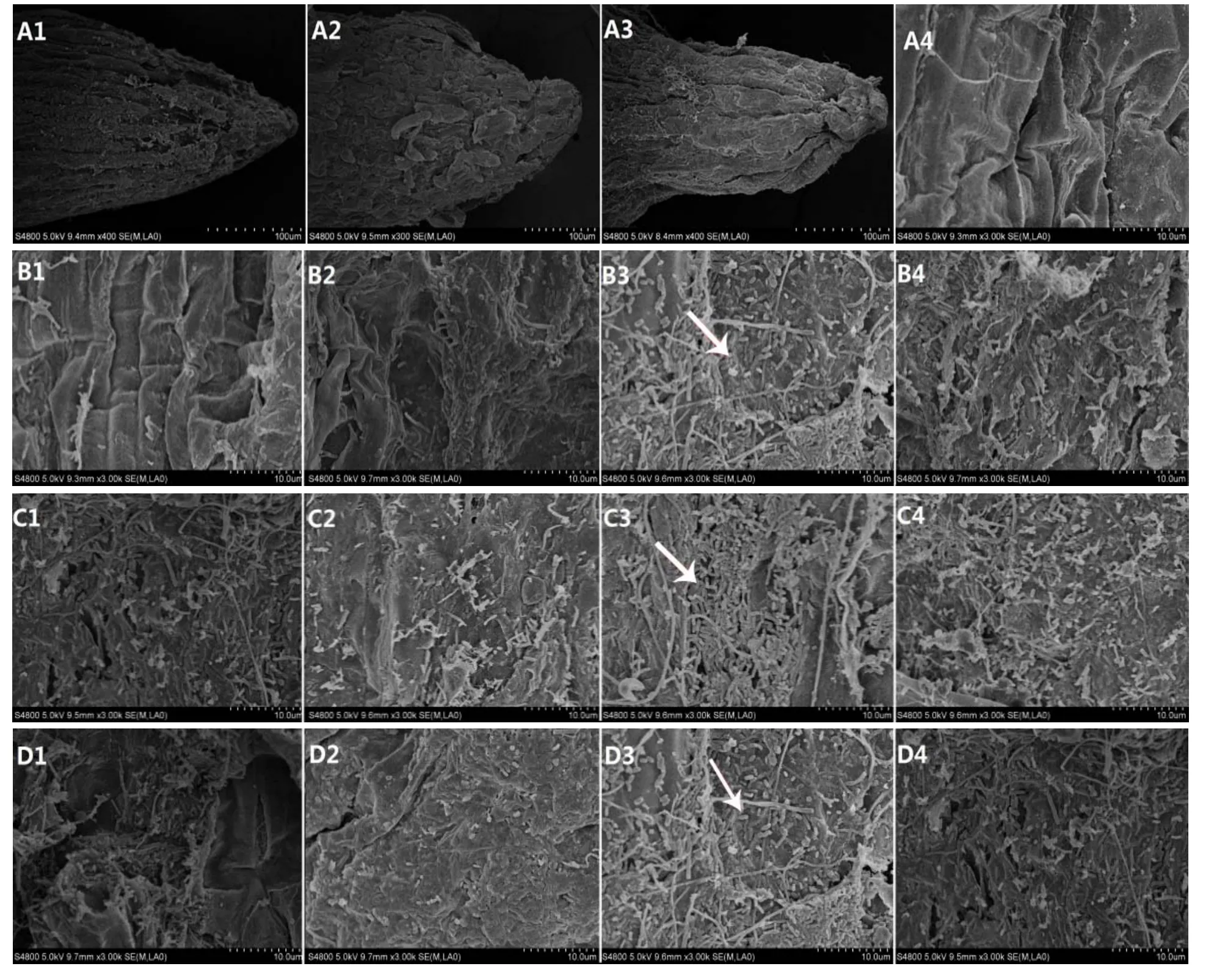
图2 烟株根表吸附青枯菌的扫描电镜观察Fig. 2 Observation on the adsorption of R.solanacearum onto tobacco roots surface by scanning electron microscopy
与不同pH菌悬液处理比较,加EPS处理的各根尖横切面,有更多的菌体及其分泌混和物堆积于维管束内,其堵塞程度及对细胞的破坏程度更强(图3-C1、C2、C3、C4),且pH 6.6处理的细胞间散布的菌体混和物及其对组织的畸形程度最大(图3-C3);而加LPS的各pH处理的根尖横切面白色物质数量及对细胞的破坏程度(图3-D1、D2、D3、D4)明显低于青枯菌液处理。
3 讨 论
目前研究表明,土壤酸化与烟草青枯病的发生密切相关。EPS和LPS作为主要识别子在青枯菌与寄主吸附识别中发挥重要作用[21]。LPS作为一种膜外多糖,容易被寄主植物识别,从而引起较强的防卫反应[22]。EPS能保护青枯菌免受寄主植物的抗病防御[23],保护鞭毛和LPS免受寄主的识别与攻击[24],从而促进了青枯菌与烟株根表细胞的吸附识别。本试验结果显示,pH 6.0、6.5时单个青枯菌分泌的EPS量高于pH 7.0的中性和pH 7.5、8.0的碱性条件,从而促进病原与寄主的吸附识别,加重青枯病的发生;pH 7.0的中性和pH 7.5碱性条件下,LPS单产量与总产量高于酸性条件,其对吸附识别过程的抑制作用较强,而pH 8.0时青枯菌的数量最少,LPS总产量最低,单产量仅次于pH 7.5;因此,土壤环境的酸碱度可以通过作用于EPS和LPS识别子的分泌量来影响吸附识别过程进而控制青枯病的发生程度。

图3 烟株根尖横切面维管束细胞的扫描电镜观察Fig. 3 Observation on the transverse section of vascular cells in tobacco root tips with scanning electron microscopy
通过试验进一步发现,EPS促进青枯菌在烟株根部的吸附和侵入,而LPS则表现为一定程度的抑制作用,与王胜坤等[25]研究结果基本一致,说明EPS和LPS对青枯菌在桉树和烟草根部定殖过程的作用是相同的。本研究同时还测定了不同pH条件EPS和LPS对烟株根表吸附和根内侵入青枯菌数量的影响,扫描电镜观察显示,接种24 h时,根表吸附的青枯菌对根组织已经造成严重的破坏,根冠后区域肿胀变形;接种48 h时,根内侵入的青枯菌迅速繁殖并堆积于维管束,维管束壁细胞破裂,堵塞导管,从而堵塞发达的疏导系统,影响水分和养分的运输,造成烟株萎蔫。等浓度的EPS和LPS菌液处理中,EPS的促进作用占主导,再加上同条件下EPS单产量远大于LPS单产量,EPS对烟株根表吸附及根内侵入的促进作用在吸附识别中发挥主要作用。因此,不同pH条件EPS及LPS分泌量及其在吸附识别中的作用是影响烟草青枯病发生的重要原因之一,为揭示酸性土壤中烟草青枯菌与根部的识别机制以及改善农业防控措施提供理论依据。
研究表明[26],pH 6.5的酸性土壤适宜烟草生长。而本试验结果表明,pH 6.6的酸性条件下,烟草青枯菌分泌的EPS单产量和总产量均最大,烟株根表识别吸附青枯菌量最大,根尖及根冠后区域细胞破损程度和对烟株维管束的阻塞程度最严重,最有利于青枯病发病。适宜青枯病发病的pH条件恰与烟草宜生长的土壤pH条件接近,使得通过调节土壤pH的方法降低青枯病发病率的可行性降低。而土壤中微生物群落对烟株根表识别吸附青枯菌量存在一定影响,因此在生产中有可能通过增施耐酸性有益菌来提高土壤微生物活性、筛选耐酸拮抗菌等防治酸性土壤中烟草青枯病的发生[27]。
另外值得注意的是,对湖南张家界市慈利县烟区100份病株根际土样pH进行测定,结果显示,pH 6.0~6.6范围内的土样数量的百分比为52%,而pH<6.0的土样的百分比为38%,此pH范围并不适宜青枯菌的生长,分析其导致青枯病发生的原因,其一可能是pH较低的土壤的烟株自身抗病能力减弱[28],其二可能是根际微生物菌群结构与丰度变差,有益微生物减少,微生物群落间相互抑制的作用小[29],使得青枯菌能长期生存并在较小的浓度下持续侵染,因此应进一步围绕酸性土壤中烟株的抗病能力及其微生物群落结构多样性开展相关研究。
4 结 论
pH与烟草根部吸附和侵入青枯菌过程密切相关。青枯菌的EPS在酸性条件下分泌旺盛,LPS在中性和碱性条件下分泌旺盛,但EPS分泌量远大于LPS分泌量。EPS促进青枯菌在烟草根部吸附和侵入,促进青枯菌对根表皮细胞及导管细胞的致畸程度,LPS抑制青枯菌在根部的吸附和侵入。与LPS的抑制作用相比,EPS的促进作用占主导,且在pH 6.6时促进作用最明显。pH 7.0的中性和pH 7.5的碱性条件下,不利于青枯病发生。
[1] HAYWARD A C. Biology and epidemiology of bacterial wilt caused by Pseudomonas solanacearum[J]. Annual review of phytopathology, 1991, 29(1): 65- 87.
[2] 张东,扈强,杜咏梅,等. 植烟土壤酸化及改良技术研究进展[J]. 中国烟草科学,2013,34(5):113-118.
[3] 魏国胜,周恒,朱杰,等. 土壤pH值对烟草根茎部病害的影响[J]. 江苏农业科学,2011(1):140-143.
[4] SEO S, GOMI K, KAKU H, et al. Identification of natural diterpenes that inhibit bacterial wilt disease in tobacco, tomato and Arabidopsis[J]. Plant and cell physiology, 2012,53(8): 1432-1444.
[5] 董汉松,王金生,方中达. 菌体脂多糖在大白菜软腐欧文氏菌对寄主根表吸附中的作用[J]. 微生物学报,1993,33(2):144-150.
[6] KAO C C, SEQUEIRA L. A Gene Cluster Required for Coordinated Biosynthesis of Lipopolysaccharide and Extracellular Polysaccharide Also Affects Virulence of Pseudomonas solanacearum[J]. Journal of bacteriology,173(24): 7841-7847.
[7] DENNY T P. Involvement of bacterial polysaccharides in plant pathogenesis[J]. Annual review of phytopathology,1995, 33: 173-197.
[8] DENNY T P. Autoregulator-dependent control of extracellular polysaccharide production in phytopathogenic bacteria[J]. European journal of plant pathology, 1999, 105: 417-430.
[9] SCHELL M A. Control of virulence and pathogenicity genes of Ralstonia solanacearum by an elaborate sensory network[J]. Annual review of phytopathology, 2000, 38:263-292.
[10] RAZOU I A, VASSE J, MONTROZIER H, et al.Detection and visualization of the major acidic exopolysaccharide of Ralstonia solanacearum and its role in tomato roots infection and vascular colonization[J].European journal of plant pathology, 1998, 104: 795-809.
[11] 方中达. 植病研究方法[M]. 北京:中国农业出版社,1998:122-125.
[12] 史敏晶,陈月异,田维敏. pH值对巴西橡胶树胶乳β-1,3-葡聚糖酶结合黄色体膜的影响[J],热带作物学报,2009,30(7):891-895.
[13] VALDAMERI G, KOKOT T B, PEDROSA F O, et al.Rapid quantification of rice roots-associated bacteria by flow cytometry[J]. Applied microbiology, 2015, 60(3):237-241.
[14] HUSAIN A, KELMAN A. The role of pectic and cellulolytic enzymes in pathogenesis by Pseudomonas solanacearum[J]. Phytopathology 1958, 48(7): 377-386.
[15] PENG Y, ZHANG L, ZENG F, et al. Structure and antitumor activity of extracellular polysaccharides from mycelium[J]. Carbohydrate polymers, 2003,54: 297.
[16] WESTERMAN R B, HE S, KEEN E, et al. Production and Characterization of Monoclonal Antibodies Specific for the Lipopolysaccharide of Escherichia coli O157[J].Journal of clinical microbiology, 1997, 35(3): 679-684.
[17] 刘红亮,陈学忠,李克生,等. 肠出血性大肠杆菌O157∶H7脂多糖抗原的提取鉴定及间接ELISA法的建立[J].中国人兽共患病学报,2011,27(7):637-644.
[18] 李洪. CaCO3对青枯菌生长的影响及土壤中青枯菌的定量PCR[D]. 重庆:西南大学,2012.
[19] 王丽,汪矛,杨世杰. 青枯菌侵染番茄幼根的扫描电镜观察[J]. 农业生物技术学报,1999,7(2):157-162.
[20] 李剑平. 扫描电子显微镜对样品的要求及样品的制备[J]. 分析测试技术与仪器,2007,13(1):74-77.
[21] 叶淑春,罗焕亮,王军. 木麻黄青枯菌的致病性与其对寄主根表吸附的关系研究[J]. 广东林业科技,1999,15(4):39-43.
[22] SEO S, MATTHEWS K R. Influence of the Plant Defense Response to Escherichia coli O157: H7 cell surface structures on survival of that enteric pathogen on plant surfaces[J]. Applied and environmental microbiology. 2012, 78(16): 5882-5889.
[23] SCHOUTEN H J. A possible role in pathogenesis for the swelling of extracellular slime of Erwinia amylovora at increasing water potential[J]. Netherlands journal of plant pathology, 1989, 95: 169-174.
[24] 罗焕亮,王军,邵志芳,等. 木麻黄青枯菌的根表吸附及根内增殖与其致病性关系[J]. 林业科学研究,2002,15(1):21-27.
[25] 王胜坤,王军,徐大平. 胞外多糖和脂多糖在青枯菌对尾巨桉根部吸附和侵入过程中的作用研究[J]. 林业科学研究,2007,20(2)176-180.
[26] 刘国顺. 烟草栽培学[M]. 北京:中国农业出版社,2009:122-125.
[27] 袁英英,李敏清,胡伟,等. 生物有机肥对番茄青枯病的防效及对土壤微生物的影响[J]. 农业环境科学学报,2011,30(7):1344-1350.
[28] WANG L, CAI K Z, CHEN Y T, et al. Silicon-mediated tomato resistance against Ralstonia solanacearum is associated with modification of soil microbial community structure and activity[J]. Biological trace element research, 2013, 152(2): 275-283.
[29] HÖGBERG M N, HÖGBERG P, MYROLD D D. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three? [J].Ecosystem ecology, 2007, 150(1): 590-601.
Effect of Exopolysaccharides and Lipopolysaccride on Colonization of Tobacco Roots by Ralstonia solanacearum at Different pH Values
WANG Yihong1,2, ZHAO Yunfeng3, KONG Fanyu1,WANG Xinwei1, WANG Zhenhua4, ZHANG Xiaoyang4,PENG Deyuan4, WANG Jing1*
(1. Tobacco Research Institute, CAAS, Key Laboratory of Tobacco Pest Monitoring Controlling & Integrated Management, Qingdao 266101, China; 2. Graduate School of CAAS, Beijing 100081, China; 3. Qingdao Agricultural University, Qingdao 266109, China;4. Zhangjiajie Company of Hunan Tobacco Company, Zhangjiajie, Hunan 427000, China)
In this study, the difference of the secretion of exopolysaccharides and lipopolysaccharide of R.solanacearum and their effects on the number of R. solanacearum adsorbed in tobacco roots were studied at different pH values. The results showed that the maximum single and total yield of EPS were 3.27×10-12and 50.12×10-2g at pH 6.5, respectively. While the minimum single and total yield of EPS were at pH 8.0. The maximum total yield of LPS was 9.41×10-3g at pH 7.0, and the maximum single yield was 17.51×10-15g at pH 7.5; In addition, the single yield of EPS was much higher than LPS at the same pH value. EPS had a promotive effect on the adsorption and invasion of R.solanacearum in tobacco roots, while LPS had a suppressive effect, and the promotive effect of EPS played a major role at the same concentration. When added EPS under the pH6.6, the number of R.solanacearum adsorbed and invaded in the root surface were the maximum, reaching 15.43×108and 10.73×109cfu/g mf (fresh matter) respectively,and the bacterial number of R.solanacearum deposited on the root surface and clogged in the cross section with its secretion were the most, and root tip deformitied seriously. Therefore, EPS secretion was increased under acidic conditions, which promoted the identification and adsorption of R.solanacearum on tobacco roots, and the degree of disease occurrence was further improved. LPS secretion was increased under neutral and alkaline conditions, which reduced disease occurrence.
pH; EPS; LPS; Ralstonia solanacearum; colonization
S435.72
1007-5119(2017)05-0024-08 DOI:10.13496/j.issn.1007-5119.2017.05.005
中国农业科学院科技创新工程(ASTIP-TRIC04);湖南省烟草公司张家界市公司科技项目“张家界烟区重要土传病害发生的微生态基础与调控技术研究”(201503);四川省烟草公司科技项目“烟草主要病虫害绿色防控技术研究与应用”(SCYC201604)
王贻鸿(1990-),男,在读硕士,研究方向为烟草病害防治。E-mail:wyhbeyond666@163.com。*通信作者,E-mail:wjing323@163.com
2016-12-13
2017-05-10
