抗青枯内生细菌的筛选及其对烟草青枯病的防治效果
2017-11-07姜乾坤邸慧慧向必坤赵秀云彭五星董善余
姜乾坤,彭 阁,王 瑞,谭 军,邸慧慧,向必坤,赵秀云,彭五星,董善余
(1.华中农业大学农业生命科学技术学院,武汉 430070;2.湖北省烟草公司恩施州公司,湖北 恩施 445000;3.湖北省烟草公司恩施州公司宣恩县烟叶分公司,湖北 宣恩 445500;4.湖北省烟草公司宜昌市公司 湖北 宜昌 443000)
抗青枯内生细菌的筛选及其对烟草青枯病的防治效果
姜乾坤1,彭 阁1,王 瑞2,谭 军2,邸慧慧2,向必坤2,赵秀云1,彭五星3*,董善余4
(1.华中农业大学农业生命科学技术学院,武汉 430070;2.湖北省烟草公司恩施州公司,湖北 恩施 445000;3.湖北省烟草公司恩施州公司宣恩县烟叶分公司,湖北 宣恩 445500;4.湖北省烟草公司宜昌市公司 湖北 宜昌 443000)
烟草青枯病是由青枯雷尔氏菌引起的一种土传细菌性烟草病害,主要危害烟草的根茎,严重影响烟草的产量。从青枯病发病田健康烟株分离内生细菌55个,通过平板拮抗实验筛选,R-3、R-7、R-9菌株对青枯雷尔氏菌有明显的拮抗作用。gyrB基因序列分析表明,R-3、R-7、R-9均为贝莱斯芽胞杆菌(Bacillus velezensis)。3个菌株的发酵液经115 ℃高温处理均能保持对青枯雷尔氏菌的抑制活性,说明 3株贝莱斯芽胞杆菌可产生耐高温的抑菌物质。田间试验结果表明,R-3、R-7和R-9均可长期定殖于烟草根和茎中,对青枯病的防治效果分别为55.72%、48.34%和50.71%。
烟草青枯病;植物内生菌;贝莱斯芽胞杆菌;定殖能力;防治效果
烟草青枯病是由青枯雷尔氏菌(Ralstonia solanacearum)引起的一种土传细菌性烟草病害,是典型的维管束病害,主要危害烟草的根、茎。1864年在印度尼西亚首先报道了青枯病对烟草的毁灭性危害,此后迅速蔓延至主要产烟国家[1]。该病是热带、亚热带烟区的主要病害,在我国南方普遍发生,近几年有从南向北蔓延之势,已成为烟叶生产的毁灭性灾害[2]。
目前,烟草青枯病的防治研究已是最热门课题之一,防治方法一般分为农业防治、选育和栽培高抗品种、化学防治、生物防治等[3]。在我国,化学防治仍是控制烟草青枯病的主要技术手段。生物防治具有经济、安全无公害、长效等特点,是防治烟草青枯病研究的热门方向,但是生物防治起步晚,生物资源匮乏,在田间防效显著的菌株报道也有不少,但青枯病仍较为严重,很难彻底根除。1992年,KLOEPPER等[4]首次提出“植物内生菌”的概念,植物内生菌是生活史的一定阶段或者全部阶段生活于健康植物的各种组织和器官内部的真菌或者细菌。植物内生菌能产生多种活性物质,这些活性物质除了在生物防治中应用外,还可作为外源基因载体及新药的来源,在农业和医药卫生领域有着巨大的应用潜力[5]。利用植物内生菌防治植物病害是生物防治的重要方法,内生菌和病原菌具有相同的生态位,相互竞争空间和营养,使病原菌缺乏营养而死亡,从而达到抵御病害的目的[6]。
本研究从发病烟区的健康烟株中分离筛选出对青枯雷尔氏菌有拮抗作用的内生细菌,并进行了分子鉴定和田间试验,为烟草青枯病的生物防治提供了科学依据。
1 材料与方法
1.1 材料
供试菌株:青枯雷尔氏菌分离自发病的烟株。
培养基:LB培养基(蛋白胨1%,酵母粉0.5%,NaCl 1%),发酵培养基(小麦粉1%,豆粕粉1%,K2HPO40.5%,pH 7.0)。
1.2 内生细菌的分离纯化
试验于2016年5—9月在湖北恩施市城郊烟草基地从云烟 87青枯病发病烟田中挑选健康烟株,分离根、茎、叶中的内生细菌。分别称取0.5 g的根、茎、叶进行表面消毒,75%乙醇10~30 s,无菌水冲洗2次,0.1%升汞1~3 min,无菌水冲洗3次[7],然后,加入5 mL无菌水研磨充分,稀释10倍涂布于LB平板,于37 ℃培养48 h,挑取菌落形态不同的细菌分离纯化,将纯化菌株-20 ℃甘油管保存。
1.3 筛选拮抗青枯雷尔氏菌的内生菌
1.3.1 拮抗细菌初筛 接种青枯雷尔氏菌于LB中,37 ℃,180 r/min,过夜培养,稀释10倍后,均匀喷洒于LB平板上。挑取37 ℃培养24 h的内生菌单菌落点接于平板上,每个平板共测试 4个菌株,每个菌株重复3次,37 ℃培养48 h,筛选产生抑菌圈的菌株。
1.3.2 拮抗细菌的复测 选取有抗菌活性的菌株,接种LB中,28 ℃,180 r/min,培养48 h。发酵液10 000 r/min离心10 min,取上清液115 ℃灭菌10 min,4 ℃保存备用。将青枯雷尔氏菌均匀喷洒于LB平板上。平板上放置4个无菌滤纸片,每个滤纸片加10 μL发酵液,37 ℃培养24 h后,观察有无抑菌圈产生。
1.4 拮抗细菌gyrB基因序列分析鉴定
gyrB基因扩增引物和反应条件参考 SATOSHI等方法[8]。将gyrB基因扩增产物纯化后测序,通过NCBI数据库进行BLAST比对,采用MEGA5.2软件构建拮抗菌的系统发育树。
1.5 拮抗细菌定殖能力鉴定
1.5.1 抗利福平的拮抗细菌的诱变 在LB固体培养基中加入2 μg/mL利福平,取100 μL菌液涂布,37 ℃培养2~4 d,待菌落生长后,挑选单菌落转移至5 μg/mL的利福平抗性平板上,经培养后筛选抗性菌落。逐步提高利福平的浓度分别至10、20、40、60 μg/mL,最后获得抗60 μg/mL利福平菌株。将抗性菌株在添加60 μg/mL利福平的LB平板上连续传代3~5次,稳定抗性菌株的抗性。检测利福平抗性菌株对青枯雷尔氏菌的拮抗能力,选择抗菌活性与出发菌株相似的抗性菌株用于定殖研究。
1.5.2 拮抗细菌在烟草体内的定殖试验 按 1%接种抗利福平的拮抗菌株于LB中,37 ℃,180 r/min发酵48 h。烟草移栽7 d后每棵苗灌溉50 mL发酵液,每个菌处理18棵烟株,每6棵烟株为1组,3组平行试验,以灌溉50 mL水的烟株作为对照组。分别在7,14,21,28,45,60 d后,检测烟草根和茎中拮抗细菌的浓度:清洗烟草根表面的根际土,晾干表面水分,称取0.5 g根和茎,对根和茎进行表面消毒,方法同上。加入5 mL无菌水研磨充分,研磨液稀释 10倍、100倍,取100 μL涂布于 60 μg/mL利福平LB平板,37 ℃培养48 h,记录菌落数,重复3次,计算每克根、茎中拮抗细菌的含量:每克根(茎)中拮抗细菌含量=平板菌落数×稀释倍数×(无菌水质量+根(茎)质量)×10/根(茎)质量。备注:1 mL无菌水质量为1 g。
1.6 田间试验
选取定殖能力好的拮抗菌株,按1%接种于2.5 L发酵培养基中,37 ℃,180 r/min发酵48 h,稀释10倍,浇灌于田间烟株根围土壤中。每个小区100株烟草,2个月后进行病情调查。分别以4%春雷霉素和清水浇灌烟株作为药剂对照和空白对照。每个处理设置3个小区。青枯病的病情指数按照中华人民共和国烟草行业标准烟草病害分级及调查方法调查,发病率、病情指数和防治效果按下式计算:
发病率=发病植株/调查植株总数×100%
病情指数=Σ[(病情级数×此级株数)/(最高级数×总株数)]×100
防治效果(%)=(对照组病情指数-处理组病情指数)/对照组病情指数×100。
2 结 果
2.1 内生菌株的分离纯化
从烟草体内共分离出 55株内生细菌,叶中分离出22株,根中22株,茎中11株。根和叶中内生细菌比较多,茎中相对较少。
2.2 拮抗内生细菌的初筛
从55株内生细菌中,共筛选出3株拮抗细菌,分别为R-3,R-7和R-9,均来自烟草根中,对青枯雷尔氏菌有明显的抗菌活性(图1)。
2.3 发酵产物的拮抗效果
复测结果表明,高温处理后的 R-3、R-7、R-9发酵液对青枯雷尔氏菌仍有明显的拮抗作用,其中,R-3和R-9发酵液的抗菌活性高于R-7菌株(图2)。表明3个菌株可产生耐高温的抗菌活性物质。
2.4 拮抗细菌gyrB基因序列分析及分子鉴定
以 3株拮抗细菌的基因组为模板,扩增 gyrB基因,得到大小为1300 bp左右的条带,与芽胞杆菌gyrB理论值相符。测序结果与GeneBank中已知序列比对,并构建系统发育树(图3)。对系统发育树结果进行分析,R-3,R-7,R-9鉴定为贝莱斯芽胞杆菌(Bacillus velezensis)。
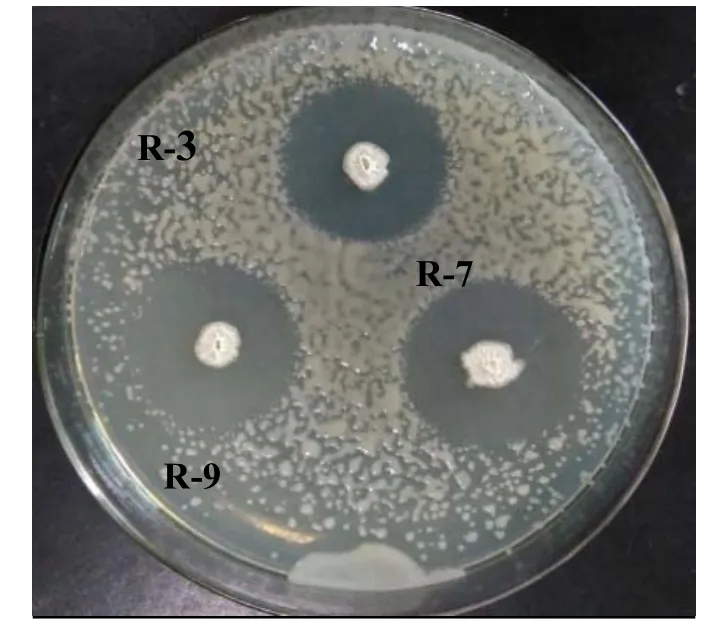
图1 拮抗细菌对青枯雷尔氏菌的抑菌效果Fig. 1 Antagonistic effects of antagonistic bacteria against Ralstonia solanacearum

图2 拮抗细菌发酵液对青枯雷尔氏菌的抑菌效果Fig. 2 Antagonistic effects of liquid fermentation of antagonistic bacteria against Ralstonia solanacearum
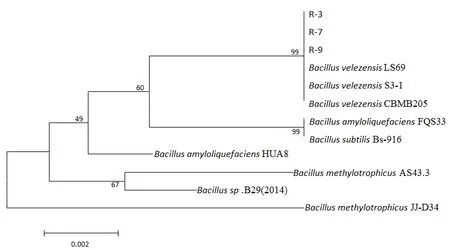
图3 根据gyrB基因序列构建的系统发育树Fig. 3 Phylogenetic tree constructed by gyrB gene sequences
2.5 拮抗细菌定殖能力鉴定
2.5.1 抗利福平拮抗细菌的诱变 通过逐步提高利福平浓度的方法,获得抗高浓度利福平(60 μg/mL)的抗性菌株。和野生型相比,利福平抗性菌株的菌落形态与野生菌相似,且对青枯雷尔氏菌有较强的拮抗作用(图4)。

图4 抗利福平拮抗细菌对青枯雷尔氏菌的抑菌效果Fig. 4 Antagonistic effects of rifampicin resistant bacteria against Ralstonia solanacearum
2.5.2 拮抗细菌定殖试验 分别培养 3株抗利福平的拮抗菌株,将发酵液接种烟草苗。于不同时间点,检测烟草根和茎中拮抗细菌的浓度(图 5,图6);而对照组在利福平抗性平板上未检测到细菌的生长。结果表明,R-3、R-7、R-9菌株可经过灌根处理进入烟草根中,并转移至茎中,具有良好的定殖能力和转导能力;3个菌株在烟草根组织的定殖能力高于茎组织。3个菌株的定殖能力依次是R-3 >R-7 > R-9。在烟草根中,在14 d内R-3、R-7的浓度逐渐增加,在14 d浓度达到最高,分别为8.83×106cfu/g、5.96×106cfu/g,之后开始逐渐降低,28 d后趋于平稳;而R-9菌株波动比较大,整体呈下降趋势,在7 d浓度最高为1.24×106cfu/g(图5)。在烟草茎中,R-3在21 d内逐渐下降,之后趋于平稳,7 d时浓度最高为8.63×105cfu/g;而R-7在21 d内有上升趋势,之后略微下降,最后趋于平稳,在21 d时浓度最高为2.1×105cfu/g;R-9在14 d内浓度逐渐上升,之后开始下降,且变化幅度较大,在14 d时浓度最高为2.66×105cfu/g(图6)。
2.6 拮抗细菌对烟草青枯病的防治效果
从表1可见,贝莱斯芽胞杆菌R-3、R-7、R-9对烟草青枯病均有防治效果,其中R-3菌株的防治效果最好,防效为55.72%,3个菌株的防治效果均明显(p <0.05)高于春雷霉素,表明其防治效果优于抗生素,3株内生拮抗细菌在防治烟草青枯病上具有很大的潜力。
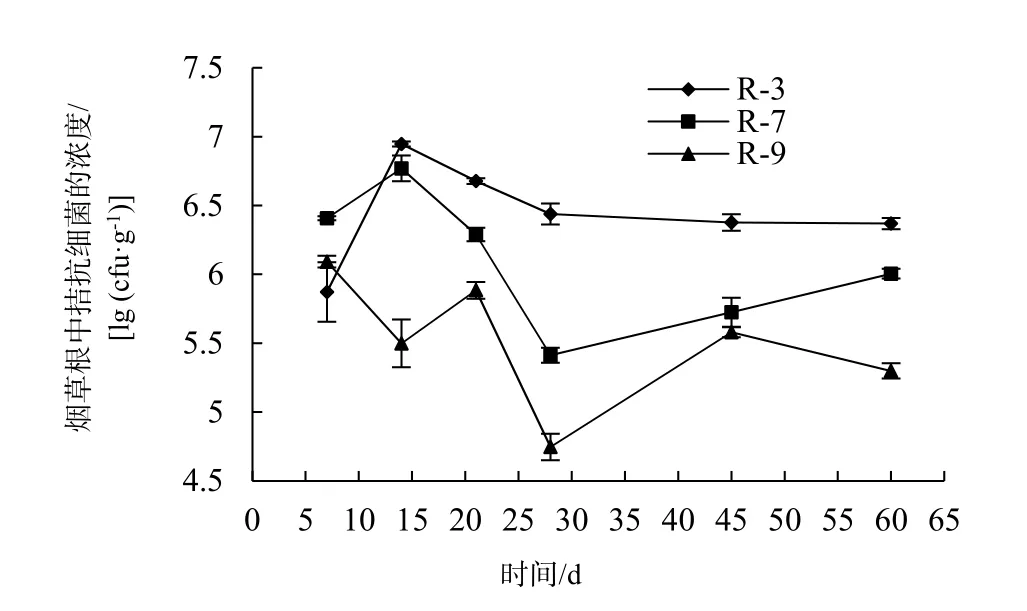
图5 不同时间烟草根中拮抗细菌的浓度Fig. 5 The concentration of antagonistic bacteria in tobacco root at different time points
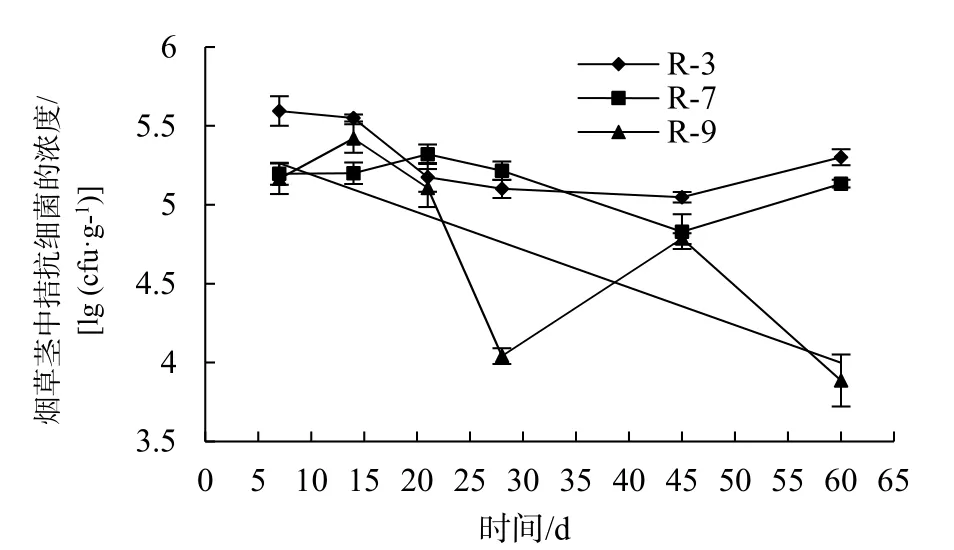
图6 不同时间烟草茎中拮抗细菌的浓度Fig. 6 The concentration of antagonistic bacteria in tobacco stem at different time points
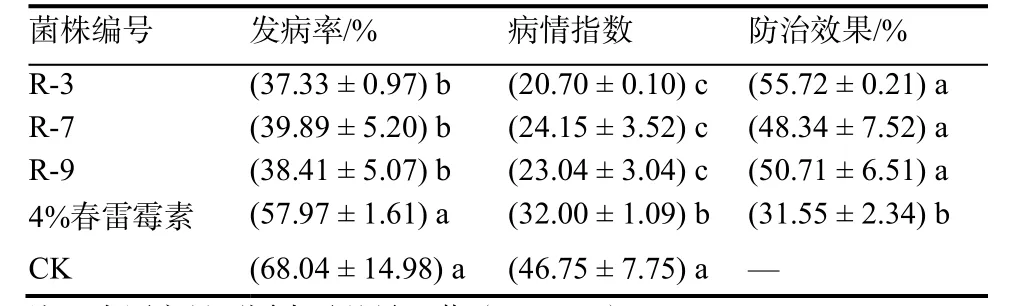
表1 拮抗细菌对烟草青枯病的防效Table 1 Control efficacy of antagonistic bacteria to tobacco bacterial wilt
3 讨 论
传统的生防菌种大多来自土壤,从土壤中筛选出的拮抗细菌通过抑制土传病原菌的繁殖达到防病的效果,对寄生在植物维管束的病原菌(如青枯雷尔氏菌)虽然有一定的防治效果但很难从根本上进行防治。内生拮抗细菌能进入植物组织,与病原菌竞争空间与营养,可在植物内部抑制病原菌的繁殖,能更好地防治病原菌,较传统的土壤细菌更有优势,且有报道一些内生细菌能促进植物的生长[9]。因此,内生拮抗细菌逐渐成为防治植物病害的一个重要菌种资源。例如,BEN ABDALLAH等[10]从银叶茄(Solanum elaeagnifolium)中分离出2株芽胞杆菌SV101、SV104,可成功定殖于番茄中,防治番茄枯萎病,并促进番茄生长。SOARES等[11]从常春藤中分离出一株解淀粉芽胞杆菌(B.amyloliquefaciens)C6c,能抑制病原菌极细链格孢菌(Alternaria tenuissima),同时还能促进植物生长。本研究从发病烟区中健康烟株根、茎、叶中分离55株内生细菌,具有拮抗作用的细菌均来自根部,显然根部是拮抗细菌预防青枯雷尔氏菌入侵烟草的重要场所,但具体的抗病机理仍需进一步探索。除了根、茎、叶中有内生菌,也有报道从植物种子中分离出内生菌。周岗泉等[12]从烟草种子中分离出对青枯雷尔氏菌有拮抗作用的细菌,部分菌株前期防治效果高达95%以上,同时证明内生菌可促进烟草种子的萌发。
在生物防治中,芽胞杆菌是大家所青睐的菌株。芽胞杆菌是一类好氧和兼性厌氧、产生抗逆性强的内生孢子的杆状细菌,而且具有易培养、易保存、有效期长等特点[13]。芽胞杆菌是土壤和植物微生态中的优势微生物种群,具有较强的抗菌防病能力,许多优良的菌株已成功应用于植物病害的防治。许大风等[14]从青枯病发病烟田中健康烟株根际土中筛选出6株对青枯病有较强拮抗作用的菌株,其中XC4抑菌活性较强且效果稳定,通过发酵优化XC4菌株抑菌效果提高了72%。夏艳等[15]从烟田中分离出2株解淀粉芽胞杆菌和1株甲基营养型芽胞杆菌,对青枯病的防效均达到60%以上。本试验从生防角度出发,从烟草根中分离出的3株拮抗细菌,经gyrB基因序列鉴定为贝莱斯芽胞杆菌(B. velezensis)。MENG等[16]发现,贝莱斯芽胞杆菌BAC03对马铃薯疮痂病菌(Streptomyces scabies)有较强的拮抗作用,且能促进植物的生长,以及产生吲哚-3-乙酸、氨等活性物质。LIU等[17]从海洋中分离的贝莱斯芽胞杆菌H3能产出表面活性素,对多种细菌(金黄色葡萄球菌、分支杆菌、肺炎克雷伯菌、绿脓假单胞杆菌等)具有明显的抗菌活性。目前,尚未见报道该类芽胞杆菌对烟草青枯病的防治效果。
3株芽胞杆菌防治青枯病的机理目前尚不清楚,有可能和它产生的抗菌物质有关。芽胞杆菌属是一类重要的植物病原菌拮抗菌,易于定向分离,可产生多种抗菌物质包括多肽类、脂肽类、蛋白类等,是自然界广泛存在的非致病菌[18-19]。王静等[20]对青枯病生防菌株芽胞杆菌 SH7产生的抑菌物质进行了粗提,该物质可以被硫酸铵沉淀,初步鉴定为蛋白类物质。本试验筛选的3株内生拮抗细菌的发酵液经115 ℃灭菌后仍具有抗菌活性,推测拮抗细菌产生的抑菌物质是其防治青枯病的主要机制,而且这种物质耐高温,这有待于进一步的研究。另外内生菌的定殖能力也是防止病原菌入侵的重要因素,内生菌定殖能力越强,其在植物体内繁殖后,能更好地竞争空间和营养,从而抑制病原菌的生长,达到防治的目的。
4 结 论
本试验筛选的3株拮抗内生细菌对烟草青枯病有较好的防效,产生的抑菌物质耐高温,有良好的应用前景。内生菌株在烟株体内的定殖能力越强(如 R-3菌株),其田间防治效果越好,表明内生细菌在植物体内的定殖能力与其防病效果密切相关。今后将围绕3个内生菌株的生防机制及其抑菌物质的分离纯化、发酵工艺进行深入研究。
[1] 周训军,王静,杨玉文,等. 烟草青枯病研究进展[J]. 微生物学通报,2012(10):1479-1486.
[2] 李勇,卓东. 烟草青枯病综合防治方法及其研究进展[J].南方农业(园林花卉版),2011(6):43-45.
[3] 陈程,黎定军,陈武. 烟草青枯病生物防治研究进展[J].作物研究,2011(6):639-642.
[4] 陈泽斌,靳松,张永福,等. 植物内生菌生物防治研究进展及存在的问题[J]. 昆明学院学报,2014(3):40-42.
[5] 胡桂萍,郑雪芳,尤民生,等. 植物内生菌的研究进展[J]. 福建农业学报,2010(2):226-234.
[6] 匡传富,雷成建,江浩. 几种内生菌防治烟草青枯病药效研究[J]. 现代农业科技,2012(20):125-133.
[7] 李艳嫦,程飞白,陈泽鹏,等. 拮抗烟草青枯病菌的内生细菌筛选、鉴定及定殖研究[J]. 中国烟草学报,2011(5):74-80.
[8] YAMAMOTO S, HARAYAMA S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains.[J].Applied environmental microbiology, 1995, 61(3):1104-1109.
[9] JI S H, GURURANI M A, CHUN S C. Isolation and characterization of plant growth promoting endophytic diazotrophic bacteria from Korean rice cultivars[J].Microbiological research, 2013, 169(1): 83-98.
[10] ABDALLAH R A B, JABNOUN-KHIAREDDINE H,NEFZI A, et al. Biocontrol of Fusarium wilt and growth promotion of tomato plants using endophytic bacteria isolated from solanum elaeagnifolium, Stems[J].Biological control, 2016, 97: 80-88.
[11] SOARES M A, LI H Y, BERGEN M, et al. Functional role of an endophytic Bacillus amyloliquefaciens, in enhancing growth and disease protection of invasive English ivy ( Hedera helix, L.)[J]. Plant & soil, 2015:1-17.
[12] 周岗泉,张建华,陈泽鹏,等. 烟草内生细菌及其对烟草青枯病的生物防治研究[J]. 中国烟草学报,2008,29(2):31-34.
[13] 冯吉,黎妍妍,程玲,等. 烟草青枯病的生物防治研究进展[J]. 安徽农业科学,2016(1):203-205.
[14] 许大风,倪海军,季学军,等. 烟草青枯病拮抗菌的筛选及发酵条件试验[J]. 烟草科技,2016(3):24-29.
[15] 夏艳,徐茜,董瑜,等. 烟草青枯病菌拮抗菌的筛选、鉴定及生防特性研究[J]. 中国生态农业学报,2014(2):201-207.
[16] MENG Q X, JIANG H, HAO J J. Effects of Bacillus velezensis strain BAC03 in promoting plant growth[J].Biological Control, 2016, 98:18-26.
[17] LIU X Y, REN B, CHEN M, et al. Production and characterization of a group of bioemulsifiers from the marine Bacillus velezensis strain H3[J]. Applied microbiology & biotechnology, 2010, 87(5):1881-1893.
[18] 翟秋倩,刘丽,李俊峰. 芽胞杆菌防治烟草病虫害的研究进展[J]. 氨基酸和生物资源,2016(3):7-11.
[19] 刘洋,朱天辉,郑磊,等. 一株内生拮抗细菌的分离鉴定及其抗菌机理研究[J]. 植物保护,2016(1):33-39.
[20] 王静,赵廷昌,李玉高,等. SH7对烟草青枯病的抑菌、防病作用及其抑菌物质的初步研究[J]. 中国烟草科学,2007,28(2):41-44.
Selection of Endophytic Antagonistic Bacteria for Control of Tobacco Bacterial Wilt
JIANG Qiankun1, PENG Ge1, WANG Rui2, TAN Jun2, DI Huihui2, XIANG Bikun2,ZHAO Xiuyun1, PENG Wuxing3*, DONG Shanyu4
(1. College of Life Science and Technology, Huazhong Agricultural University, Wuhan 430070, China; 2. Enshi Tobacco Company of Hubei Province, Enshi, Hubei 445000, China; 3. Xuan’en Tobacco Company of Enshi Tobacco Company, Xuan’en, Hubei 445500,China; 4. Yichang Tobacco Company of Hubei Province, Yichang, Hubei 443000, China)
Tobacco bacterial wilt is a soil-borne bacterial disease caused by Ralstonia solanacearum, which is mainly harmful to the roots and stems of tobacco and seriously affects tobacco yield. Fifty-five endophytic bacterial strains were isolated from healthy tobacco planted in diseased soils. Among them, strains R-3, R-7 and R-9 had obvious antagonistic effects on R. solanacearum in plate antagonistic experiments. Based on gyrB gene sequence, R-3, R-7 and R-9 all belong to Bacillus velezensis. After heated at 115 ℃, the liquid fermentation of the 3 strains still had antibacterial activities, indicating that these strains produced heat resistant substances. Field experiments showed that R-3, R-7 and R-9 were all able to chronically colonize in the root and stem of tobacco,and their control efficiency against bacterial wilt were 55.72%, 48.34% and 50.71%, respectively.
tobacco bacterial wilt; plant endophytic bacteria; bacillus velezensis; colonization; control efficiency
S435.72
1007-5119(2017)05-0013-05 DOI:10.13496/j.issn.1007-5119.2017.05.003
中国烟草总公司科技重点项目“基于宏基因组学的植烟土壤健康评价研究与应用”(110201402016)
姜乾坤(1989-),男,硕士研究生,研究方向为微生物农药。E-mail:1522568857@qq.com。*通信作者,E-mail:365850331@qq.com
2016-11-01
2017-01-09
