梅花针叩刺增强咪喹莫特治疗SKH⁃1小鼠皮肤鳞状细胞癌的疗效
2017-11-03张付贺石磊罗敏刘沛周忠霞张国龙王秀丽
张付贺 石磊 罗敏 刘沛 周忠霞 张国龙 王秀丽
200443上海,安徽医科大学上海皮肤病临床学院(张付贺、王秀丽);上海市皮肤病医院 同济大学医学院光医学研究所(石磊、罗敏、刘沛、周忠霞、张国龙)
·论著·
梅花针叩刺增强咪喹莫特治疗SKH⁃1小鼠皮肤鳞状细胞癌的疗效
张付贺 石磊 罗敏 刘沛 周忠霞 张国龙 王秀丽
200443上海,安徽医科大学上海皮肤病临床学院(张付贺、王秀丽);上海市皮肤病医院 同济大学医学院光医学研究所(石磊、罗敏、刘沛、周忠霞、张国龙)
目的评估咪喹莫特联合梅花针治疗SKH⁃1小鼠皮肤鳞状细胞癌(鳞癌)的疗效,探讨其免疫学机制。方法将紫外线诱导成瘤的40只SKH⁃1皮肤鳞癌小鼠随机分4组,每组10只:对照组无处理;梅花针组:每天梅花针叩刺所有瘤体1次;咪喹莫特组:每天外涂5%咪喹莫特乳膏1次,剂量为1.2 g/kg;联合组:先梅花针叩刺所有瘤体,止血后再外涂5%咪喹莫特乳膏1次,剂量同前。各组小鼠连续治疗30 d。每日观察并拍照记录各组小鼠肿瘤形态学变化,每3 d测量1次瘤体大小,比较4组瘤体体积变化及小鼠生存率变化。治疗结束后取各组小鼠瘤体,比较4组瘤体组织病理学变化。实时荧光定量PCR检测各组小鼠瘤体内干扰素(IFN)⁃α、IFN⁃β、白细胞介素1β(IL⁃1β)、肿瘤坏死因子α(TNF⁃α)及IL⁃12 mRNA表达。结果联合组小鼠背部瘤体生长缓慢,部分小的瘤体有消退现象;对照组、梅花针组和咪喹莫特组瘤体一直在增长,但梅花针组、咪喹莫特组生长速度较对照组慢。治疗前,4组小鼠瘤体体积差异无统计学意义(F=0.90,P>0.05)。治疗24 d后,4组小鼠瘤体体积差异有统计学意义(F=5.16,P<0.05),LSD⁃t检验示,联合组瘤体体积显著低于对照组(P<0.01),余各组间差异均无统计学意义(P>0.05)。经Log⁃rank检验,4组小鼠生存率曲线分布不同(χ2= 8.32,P<0.05),联合组生存情况优于对照组(χ2=4.62,P=0.03),而梅花针组、咪喹莫特组与对照组、联合组比较,小鼠生存率差异均无统计学意义(P>0.05)。组织病理学检查显示,对照组、梅花针组细胞异形性明显,排列密集,可见大量的肿瘤细胞,部分可见角化珠,咪喹莫特组肿瘤细胞少许死亡;联合组肿瘤细胞大量死亡,核异形不明显,角化增多。实时荧光定量PCR显示,联合组IFN⁃α、IFN⁃β、IL⁃12、IL⁃1β及TNF⁃α mRNA相对表达量均显著高于对照组、梅花针组和咪喹莫特组(均P<0.05),咪喹莫特组IL⁃1β mRNA相对表达量显著高于对照组(P<0.01),余各组间比较差异均无统计学意义(P>0.05)。结论 梅花针叩刺能有效增强咪喹莫特抗SKH⁃1小鼠皮肤鳞癌活性及免疫学效应。
肿瘤,鳞状细胞;梅花针疗法;疾病模型,动物;小鼠;咪喹莫特
目前咪喹莫特治疗皮肤鳞状细胞癌(简称鳞癌)已有不少临床报道[1⁃4],其通过上调单核细胞和巨噬细胞相关细胞因子,如干扰素α(IFN⁃α)、IFN⁃β、肿瘤坏死因子α(TNF⁃α)、白细胞介素1β(IL⁃1β)和IL⁃12等,激活天然免疫发挥抗肿瘤作用[5]。梅花针叩刺是我国传统医学中一种简单实用的治疗方式,王佩茹等[6]首次采用梅花针联合氨基酮戊酸光动力疗法(ALA⁃PDT)治疗皮肤肿瘤,发现其可提高ALA透皮能力,增强ALA⁃PDT治疗光线性角化病、基底细胞癌及皮肤鳞癌的疗效。我们采用梅花针叩刺辅助治疗,以增加咪喹莫特的渗透深度,促进其在鳞癌组织内均匀分布,探讨其免疫调节作用及抗皮肤鳞癌疗效。
材料和方法
一、试剂与仪器
5%咪喹莫特乳膏(四川明欣药业有限责任公司),梅花针(华佗牌单头皮肤针),SS⁃03B型紫外线光疗仪(上海希格玛高科技有限公司),Funglyn FTC⁃ 3000实时荧光定量PCR仪[加拿大枫岭生物技术(上海)有限公司]。
二、鳞癌动物模型建立
皮肤正常的6~8周雌性SKH⁃1无毛小鼠(从美国Jakson动物实验中心引进,由上海公共卫生中心负责繁育),体质量30 g左右,于20℃~24℃下给予普通饲料和水饲养。照射光源为SS⁃03B型紫外线光疗仪(只含10%UVB和90%UVA),待输出功率稳定后,每次取1笼小鼠(每笼5只),在光源距小鼠背部30 cm处照射,剂量为最小红斑量(每天UVB 240 mJ/cm2和UVA 2 160 mJ/cm2),每周连续照射5 d,直至背部出现红斑、丘疹(约6个月),当丘疹直径≥1 mm且持续2周不消退,即为成功建立SKH⁃1无毛小鼠皮肤鳞癌模型[7]。
三、实验动物分组及处理
选取成功构建的多发性皮肤鳞癌模型小鼠40只,体质量27~31 g,瘤体直径3~5 mm,且瘤体生长均匀。依次对小鼠断趾标记,随机数字表法分4组,每组10只。对照组:不做任何处理;梅花针组:用梅花针垂直均匀叩刺小鼠背部所有瘤体,直至瘤体出现点状出血,每天1次;咪喹莫特组:所有瘤体外涂咪喹莫特乳膏,轻柔至充分吸收,每天1次,剂量为1.2 g/kg;联合组:先采用梅花针叩刺,处理同梅花针组,然后用生理氯化钠溶液浸湿棉签擦拭血迹并压迫止血后,所有瘤体外涂咪喹莫特乳膏,轻柔至药物充分吸收,每天1次,各组小鼠连续治疗30 d。
四、疗效判定
1.瘤体变化及生存情况:每天用相机采集小鼠背部大体照片,观察各组小鼠肿瘤形态学变化。每3 d测量瘤体体积,计数直径≥1.0 mm的瘤体数目,以精密电子游标卡尺测量瘤体的最大长径(a)和垂直短径(b),瘤体体积=ab2/2,计算每只小鼠背部所有直径≥1.0 mm的瘤体体积之和,绘制瘤体体积变化曲线。小鼠死亡的判定标准依据肿瘤的长径>15 mm或小鼠出现恶病质或溃疡[8]。当小鼠死亡时瘤体体积不再计算,末次治疗结束后统计小鼠的生存率。
2.组织病理学检查:末次治疗后,各组随机取1只小鼠,用7%水合氯醛麻醉后,颈椎脱臼法处死。用6 mm环钻钻取皮肤荷瘤小鼠局部治疗区域的瘤体,4%多聚甲醛固定,石蜡包埋、切片、HE染色,显微镜下观察肿瘤组织病理学变化。
3.实时荧光定量PCR检测IFN⁃α、IFN⁃β、TNF⁃α、IL⁃1β和IL⁃12 mRNA的表达:另取12只成瘤小鼠,随机数字表法分4组,每组3只,各组处理方法同前。各组小鼠开始治疗后72 h,取治疗部位肿瘤组织并提取RNA,分别设计各目的基因IFN⁃α、IFN⁃β、TNF⁃α、IL⁃1β、IL⁃12特异性引物,引物序列见表1。按反转录试剂盒说明书合成反转录脱氧核糖核苷酸(cDNA),按qPCR试剂盒说明书扩增目的条带。实验重复3次。采用Thermal cycler软件包计算Ct值,分析荧光强度。各促炎性因子mRNA相对表达量用2-ΔΔCt表示。

表1 实时荧光定量PCR扩增引物序列
五、统计学处理
采用GraphPad Prism 5软件进行分析。计量资料均以±s表示,多组间比较采用单因素方差分析,两两多重比较用LSD⁃t检验,两组间生存率的比较用Log⁃rank检验,以P<0.05为差异有统计学意义。
结果
一、小鼠瘤体形态及体积变化
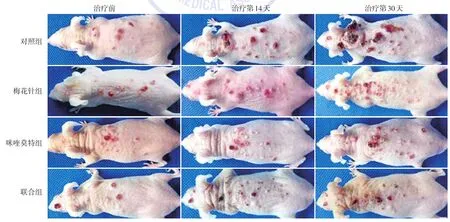
图1 4组SKH⁃1无毛鳞状细胞癌小鼠肿瘤形态变化 对照组小鼠背部瘤体逐渐增大、增多;梅花针组和咪喹莫特组瘤体增长缓慢;联合组瘤体生长缓慢,部分小瘤体有消退现象
4组小鼠肿瘤形态学变化见图1。联合组小鼠背部瘤体生长缓慢,部分小的瘤体有消退现象;对照组、梅花针组和咪喹莫特组瘤体一直在增长。4组小鼠瘤体体积随时间变化曲线见图2。对照组瘤体生长最快,咪喹莫特组、梅花针组瘤体生长较对照组缓慢,联合组瘤体增长最慢。单因素方差分析显示(表2),4组小鼠治疗前瘤体体积差异无统计学意义(F=0.90,P>0.05),治疗24 d后差异有统计学意义(F=5.16,P<0.05);LSD⁃t检验示,联合组瘤体体积显著低于对照组(P<0.01),余各组间差异均无统计学意义(P>0.05)。
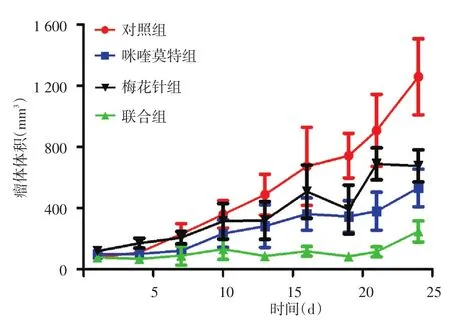
图2 4组SKH⁃1无毛鳞状细胞癌小鼠瘤体体积随时间变化曲线 对照组瘤体体积生长最快,咪喹莫特组、梅花针组生长较对照组缓慢,联合组增长最慢
表2 4组SKH⁃1无毛鳞状细胞癌小鼠治疗前和治疗24 d时瘤体体积变化(±s,mm3)
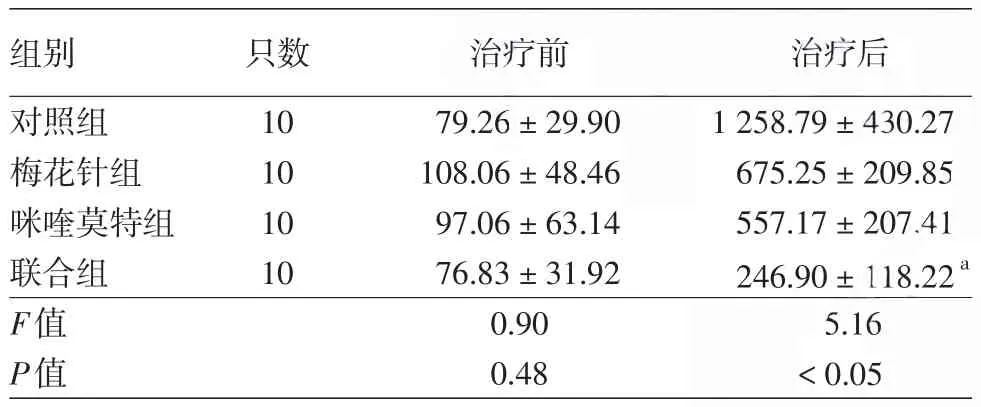
表2 4组SKH⁃1无毛鳞状细胞癌小鼠治疗前和治疗24 d时瘤体体积变化(±s,mm3)
注:n=3。a:与对照组比较,差异有统计学意义,P<0.05;其余各组间比较差异无统计学意义
组别对照组梅花针组咪喹莫特组联合组F值P值只数10 10 10 10治疗前79.26±29.90 108.06±48.46 97.06±63.14 76.83±31.92 0.90 0.48治疗后1 258.79±430.27 675.25±209.85 557.17±207.41 246.90±118.22a 5.16<0.05
二、小鼠生存情况
对照组小鼠在实验开始后的第15、19天各死亡1只,第21天死亡3只,第25天全部死亡;咪喹莫特组第17、28天各死亡2只;梅花针组第11、18、28天各死亡2只,第30天全部死亡;联合组观察30 d无死亡。经Log⁃rank检验,4组小鼠生存率曲线分布不同(图3,χ2=8.32,P<0.05)。两两比较显示,联合组小鼠生存情况优于对照组,差异有统计学意义(χ2=4.62,P=0.03),而梅花针组、咪喹莫特组与对照组、联合组比较,差异无统计学意义(均P>0.05)。
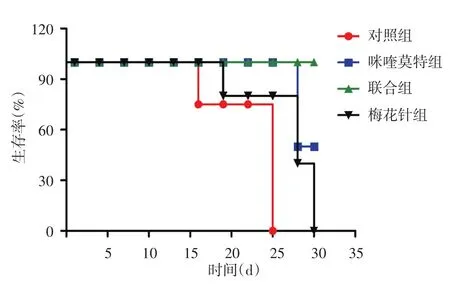
图3 4组SKH⁃1无毛鳞状细胞癌小鼠生存率变化曲线 联合组小鼠生存情况明显优于对照组
三、组织病理学

图4 4组SKH⁃1无毛鳞状细胞癌小鼠治疗结束后肿瘤组织HE染色(4A~4D:HE×20;4E~4H:HE×100) 对照组、梅花针组细胞异形性明显,排列密集,可见大量的肿瘤细胞,部分可见角化珠;咪喹莫特组肿瘤细胞少许死亡,瘤周伴炎细胞浸润;联合组肿瘤细胞大量死亡,核异形不明显,角化增多
表3 各组SKH⁃1无毛鳞状细胞癌小鼠开始治疗72 h后细胞因子mRNA相对表达量(±s)
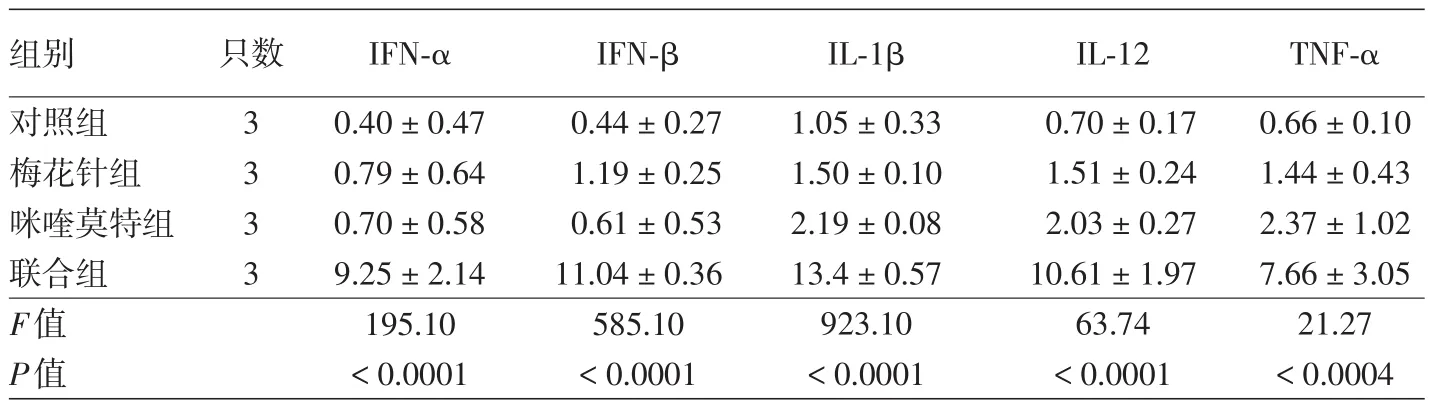
表3 各组SKH⁃1无毛鳞状细胞癌小鼠开始治疗72 h后细胞因子mRNA相对表达量(±s)
注:IFN:干扰素;IL:白细胞介素;TNF:肿瘤坏死因子
组别对照组梅花针组咪喹莫特组联合组F值P值只数3 3 3 3 IFN⁃α 0.40±0.47 0.79±0.64 0.70±0.58 9.25±2.14 195.10<0.0001 IFN⁃β 0.44±0.27 1.19±0.25 0.61±0.53 11.04±0.36 585.10<0.0001 IL⁃1β 1.05±0.33 1.50±0.10 2.19±0.08 13.4±0.57 923.10<0.0001 IL⁃12 0.70±0.17 1.51±0.24 2.03±0.27 10.61±1.97 63.74<0.0001 TNF⁃α 0.66±0.10 1.44±0.43 2.37±1.02 7.66±3.05 21.27<0.0004
各组小鼠治疗结束后,切取肿瘤HE染色。对照组见大量的鳞癌细胞,伴明显的核异形,浸润明显,较少角化;梅花针组、咪喹莫特组肿瘤细胞间可见大量的炎症细胞浸润,伴核异形;联合组核异形不明显,角化明显。见图4。
四、各组小鼠细胞因子mRNA变化
单因素方差分析显示,4组IFN⁃α、IFN⁃β、IL⁃12、IL⁃1β及TNF⁃α mRNA相对表达量差异均有统计学意义(表3)。经LSD⁃t检验,联合组IFN⁃α、IFN⁃β、IL⁃12、IL⁃1β及TNF⁃α mRNA相对表达量均高于对照组、梅花针组和咪喹莫特组,差异均有统计学意义(P<0.05);咪喹莫特组IL⁃1β mRNA相对表达量高于对照组(P=0.005);其余各组间细胞因子mRNA相对表达量差异均无统计学意义(P>0.05)。
讨论
梅花针叩刺是我国传统医学一种简单实用的治疗方式,我们的研究证实,咪喹莫特联合梅花针治疗小鼠多发性皮肤鳞癌有一定疗效。5%咪喹莫特乳膏治疗皮肤原位鳞癌已证明有效[9]。虽然侵袭性皮肤鳞癌最好的治疗方法是手术切除,但外用5%咪喹莫特乳膏可能是一个合理的替代方法,尤其对老年及身体状况较差的患者[1]。
本研究结果显示,单纯梅花针叩刺或外涂咪喹莫特稍能延缓小鼠瘤体体积增长,提高小鼠生存率,而联合组与其余三组相比,能明显延缓小鼠瘤体体积增长,显著提高小鼠生存率。组织病理学显示,对照组、梅花针组细胞异形性明显,无肿瘤细胞死亡,咪喹莫特组肿瘤细胞少许死亡、部分角化,而联合组肿瘤细胞大量死亡,核异形不明显,角化增多,提示咪喹莫特联合梅花针可更好地清除小鼠皮肤鳞癌。有文献[10]报道,咪喹莫特治疗皮肤肿瘤72 h后,参与天然免疫的细胞因子如IFN⁃α、IFN⁃β、TNF⁃α、IL⁃1β表达量显著升高。本研究在各组小鼠开始治疗后72 h实时荧光定量PCR显示,联合组IFN⁃α、IFN⁃β、TNF⁃α、IL⁃1β和IL⁃12细胞因子mRNA相对表达量显著高于其他3组。其可能的机制是咪喹莫特诱导肿瘤细胞释放肿瘤抗原,募集大量的炎症细胞因子到肿瘤部位,直接杀伤肿瘤细胞;咪喹莫特还可通过诱导IFN⁃α、IFN⁃β、TNF⁃α、IL⁃12等促炎细胞因子的分泌,活化树突细胞、巨噬细胞和其他与Toll样受体7(TLR⁃7)结合的细胞,从而激活天然免疫反应[5,11];咪喹莫特在小鼠体内诱导天然免疫细胞分泌的趋化因子如IL⁃1β、IL⁃12和IFN,引起肿瘤表面的死亡受体和死亡受体配体的暴露或分泌上调,增强对肿瘤细胞的杀伤作用[12]。本研究中,联合组中各种免疫相关的细胞因子表达最高,更加佐证了梅花针叩刺增加药物渗透深度,增强了招募炎性细胞因子的能力。
有报道外涂咪喹莫特可治愈表浅皮肤鳞癌[2⁃4],本研究中SKH⁃1小鼠皮肤鳞癌生长迅速,以致于外涂咪喹莫特,即便联合梅花针也未能完全治愈。但本研究显示,梅花针叩刺辅助给药能有效增强咪喹莫特抗SKH⁃1小鼠皮肤鳞癌活性及免疫学效应。
[1]Tiodorovic⁃Zivkovic D,Zalaudek I,Longo C,et al.Successful treatment of two invasive squamous cell carcinomas with topical 5%imiquimod cream in elderly patients[J].Eur J Dermatol, 2012,22(4):579⁃580.DOI:10.1684/ejd.2012.1771.
[2]Love WE,Bernhard JD,Bordeaux JS.Topical imiquimod or fluorouracil therapy for basal and squamous cell carcinoma:a systematic review[J].Arch Dermatol,2009,145(12):1431⁃1438.DOI:10.1001/archdermatol.2009.291.
[3]Papakostas D,Stockfleth E.Topical treatment of basal cell carcinoma with the immune response modifier imiquimod[J]. FutureOncol,2015,11(22):2985⁃2990.DOI:10.2217/fon.15.192.
[4]Waalboer⁃Spuij R,Holterhues C,van Hattem S,et al.Patient perception of imiquimod treatment for actinic keratosis and superficial basal cell carcinoma in 202 patients[J].Dermatology, 2015,231(1):56⁃62.DOI:10.1159/000381420.
[5]Bubna AK.Imiquimod⁃its role in the treatment of cutaneous mali⁃gnancies[J].Indian J Pharmacol,2015,47(4):354⁃359.DOI: 10.4103/0253⁃7613.161249.
[6]王佩茹,张玲琳,周忠霞,等.梅花针叩刺增强氨基酮戊酸光动力治疗光线性角化病、基底细胞癌、鳞状细胞癌的研究[J].中华皮肤科杂志,2015,48(2):80⁃84.DOI:10.3760/cma.j.issn. 0412⁃4030.2015.02.003.
[7]Wang X,Shi L,Tu Q,et al.Treating cutaneous squamous cell carcinoma using 5⁃aminolevulinic acid polylactic⁃co⁃glycolic acid nanoparticle⁃mediated photodynamic therapy in a mouse model[J].Int J Nanomedicine,2015,10:347⁃355.DOI:10.2147/IJN. S71245.
[8]Huang N,Wang H,Zhao J,et al.Single⁃wall carbon nanotubes assisted photothermal cancer therapy:animal study with a murine model of squamous cell carcinoma[J].Lasers Surg Med,2010,42(9):638⁃648.DOI:10.1002/lsm.20968.
[9]Patel GK,Goodwin R,Chawla M,et al.Imiquimod 5%cream monotherapy for cutaneous squamous cell carcinomain situ(Bowen′s disease):a randomized,double⁃blind,placebo⁃controlled trial[J].J Am Acad Dermatol,2006,54(6):1025⁃1032.DOI:10.1016/j.jaad.2006.01.055.
[10]Holcmann M,Drobits B,Sibilia M.How imiquimod licenses plasmacytoid dendritic cells to kill tumors[J].Oncoimmunology, 2012,1(9):1661⁃1663.DOI:10.4161/onci.22033.
[11]Ueyama A,Yamamoto M,Tsujii K,et al.Mechanism of pathogenesis of imiquimod⁃induced skin inflammation in the mouse:a role for interferon⁃alpha in dendritic cell activation by imiquimod[J].J Dermatol,2014,41(2):135⁃143.DOI:10.1111/ 1346⁃8138.12367.
[12]Singh M,Khong H,Dai Z,et al.Effective innate and adaptive antimelanoma immunity through localized TLR7/8 activation[J]. J Immunol,2014,193(9):4722⁃4731.DOI:10.4049/jimmunol. 1401160.
Plum⁃blossom needle tapping enhances the efficacy of topical imiquimod immunotherapy for cutaneous squamous cell carcinoma in SKH⁃1 mice
Zhang Fuhe,Shi Lei,Luo Min,Liu Pei,Zhou Zhongxia,Zhang Guolong,Wang Xiuli
Shanghai Skin Disease Clinical College of Anhui Medical University,Shanghai 200443,China(Zhang FH,
Wang XL);Shanghai Skin Disease Hospital,Institute of Photomedicine,Tongji University School of Medicine,
Wang Xiuli,Email:wangxiuli20150315@163.com
ObjectiveTo assess the therapeutic effect of plum⁃blossom needle tapping combined with topical imiquimod immunotherapy on cutaneous squamous cell carcinoma(SCC)in SKH⁃1 mice,and to explore the immunological mechanism.MethodsA total of 40 SKH⁃1 mice with ultraviolet light⁃induced cutaneous SCC were randomly and equally divided into 4 groups:control group receiving no treatment,plum⁃blossom needle group receiving plum⁃blossom needle tapping on all the tumors once a day, imiquimod group topically treated with imiquimod 5%cream at a dose of 1.2 g/kg once a day,combination group firstly treated with plum⁃blossom needle tapping on all the tumors,and after the stop of bleeding topically treated with imiquimod 5%cream at the same dose as the imiquimod group once a day.All the mice were treated for 30 days.Morphological changes of tumors in all groups were photographed and recorded every day.The tumor size was measured once every three days,and changes of total tumor volume and survival rate of the mice were compared among the 4 groups.At the end of treatment,tumor tissues were resected,and histopathological changes were compared among the 4 groups.Real⁃time fluorescence⁃based quantitative PCR(qRT⁃PCR)was performed to measure the mRNA expression of interferon⁃α(IFN⁃α), IFN⁃β,interleukin⁃1β(IL⁃1β),tumor necrosis factor⁃α(TNF⁃α)and IL⁃12 in tumor tissues.ResultsIn the combination group,tumors on the back of mice grew slowly,and some even regressed.However,tumors grew fast in the control group,plum⁃blossom needle group and imiquimod group,and grew more slowly in the plum⁃blossom needle group and imiquimod group than in the control group.Before the treatment,there was no significant difference in the total tumor volume among the 4 groups(F=0.90,P>0.05).After 24⁃day treatment,the total tumor volume significantly differed among the 4 groups(F=5.16,P<0.05).The LSD⁃ttest showed that the total tumor volume significantly decreased in the combination group compared with the control group(P<0.01),but no significant difference was observed among the other groups(P>0.05).Log⁃rank test revealed that survival curves significantly differed among the 4 groups(χ2=8.32,P<0.05).The survival rate was significantly higher in the combination group than in the control group(χ2= 4.62,P=0.03),but did not differ between the plum⁃blossom needle group or imiquimod group and the control group or combination group(allP>0.05).Histopathological examination showed atypical cells arranged closely,a large number of tumor cells and some keratin pearls in the control group and plum⁃blossom needle group,few dead tumor cells in the imiquimod group,and plenty of dead tumor cells,mild nuclear atypia and increased keratinization in the combination group.qRT⁃PCR revealed that the relative mRNA expression levels of IFN⁃α,IFN⁃β,IL⁃12,IL⁃1β and TNF⁃α were significantly higher in the combination group than those in the control group,plum⁃blossom needle group and imiquimod group(P<0.05).The imiquimod group showed significantly higher mRNA expression of IL⁃1β than the control group(P<0.01),but no significant differences were observed among the other groups(P>0.05).ConclusionPlum⁃blossom needle tapping can effectively enhance the anti⁃SCC activity and immunological effects of imiquimod in SKH⁃1 mice.
Neoplasms,squamous cell;Imiquimod;Plum⁃blossom needle therapy;Disease models, animal;Mice;Imiquimod
王秀丽,Email:wangxiuli20150315@163.com
10.3760/cma.j.issn.0412⁃4030.2017.04.009
国家自然科学基金(81601601);上海市卫计委科研课题(201640016);上海市青年科技英才扬帆计划项目(15YF1410700);上海申康医院发展中心临床科技创新项目(SHDC12015123)
Shanghai 200443,China(Shi L,Luo M,Liu P,Zhou ZX,Zhang GL)
Fund programs:National Natural Science Foundation of China(81601601);Key Project of Shanghai Municipal Health and Family Planning Commission(201640016);Yang Fan Program of Science and Technology Commission of Shanghai Municipality(15YF1410700);The Joint Project of New Frontier Technology of Shanghai Shen-kang Hospital Development Center(SHDC12015123)
2016⁃06⁃16)
(本文编辑:周良佳 颜艳)
