对《中国药典》2015年版一部含雄黄制剂标准的建议
2017-11-01李景辉
贾 超,李景辉,朱 琳
·药房·药事管理·
对《中国药典》2015年版一部含雄黄制剂标准的建议
贾 超,李景辉,朱 琳
目的完善《中国药典》2015年版一部含雄黄制剂的标准。方法对《中国药典》2015年版一部收载的含雄黄制剂标准中雄黄相关项目进行统计分析。结果《中国药典》2015年版一部共收载含雄黄的制剂37个,在质量标准正文中雄黄炮制、雄黄鉴别、三氧化二砷限量检查、雄黄含量测定及注意等项目中存在一些问题。结论提出完善含雄黄制剂标准的建议。
《中国药典》;雄黄;制剂
0 引言
雄黄为硫化物类矿物雄黄族雄黄,主含二硫化二砷(As2S2);具有解毒杀虫、燥湿祛痰、截疟的功能;用于痈肿疔疮、蛇虫咬伤、虫积腹痛、惊痫、疟疾。辛、温,有毒[1]。由于雄黄有毒,制定含雄黄的中药制剂标准时应关注其毒性,以确保用药安全。笔者在检验工作中发现含雄黄的中药制剂标准尚需完善,为此对《中国药典》2015年版一部收载的含雄黄的全部制剂标准进行统计分析,并对存在的问题提出建议。
1 资料与方法
《中国药典》2015年版一部[1]共收载含雄黄的制剂37个,将每个制剂标准中雄黄炮制、雄黄鉴别、三氧化二砷限量检查、雄黄含量测定、儿童用药情况及注意6个项目的内容进行列表分析;同时,将《中国药典临床用药须知》中药成方制剂卷2010年版[2](以下简称“《临床用药须知》”)中相应品种的禁忌和雄黄相关的注意事项也列入表内进行比较分析,具体情况见表1。
2 结果
2.1 雄黄的炮制 37个制剂中雄黄全部经水飞法炮制;12号牛黄清宫丸仅要求雄黄水飞,没有水飞后粉末的等级要求;18号六应丸要求水飞成细粉,19号庆余辟瘟丹要求水飞成最细粉;其余34个品种均要求水飞成极细粉。
2.2 雄黄鉴别、三氧化二砷检查及雄黄含量测定 37个品种中,32个品种有雄黄鉴别(其中29个品种为显微鉴别,2个品种为理化鉴别,1个品种既有显微鉴别又有理化鉴别);11个品种有三氧化二砷限量检查;1个品种有雄黄含量测定。从表1可以看出,仅1个品种3个项目都有。
2.3 《中国药典》2015年版一部儿童用药情况及注意项下内容 通过药品名称、[功能与主治]和[用法与用量]项目可以确定7个品种为儿科专用品种,13个品种儿童可用,17个品种未提及儿童。10个品种无注意内容,其中包括7个儿科专用品种,2个儿童可用品种,1个未提及儿童品种;27个品种有注意内容,其中24个品种有关于孕妇的用药提示(孕妇禁用12个品种、孕妇忌服5个品种、孕妇禁服3个品种及孕妇慎用4个品种),另3个品种无孕妇用药提示。37个品种均无哺乳期妇女用药提示。
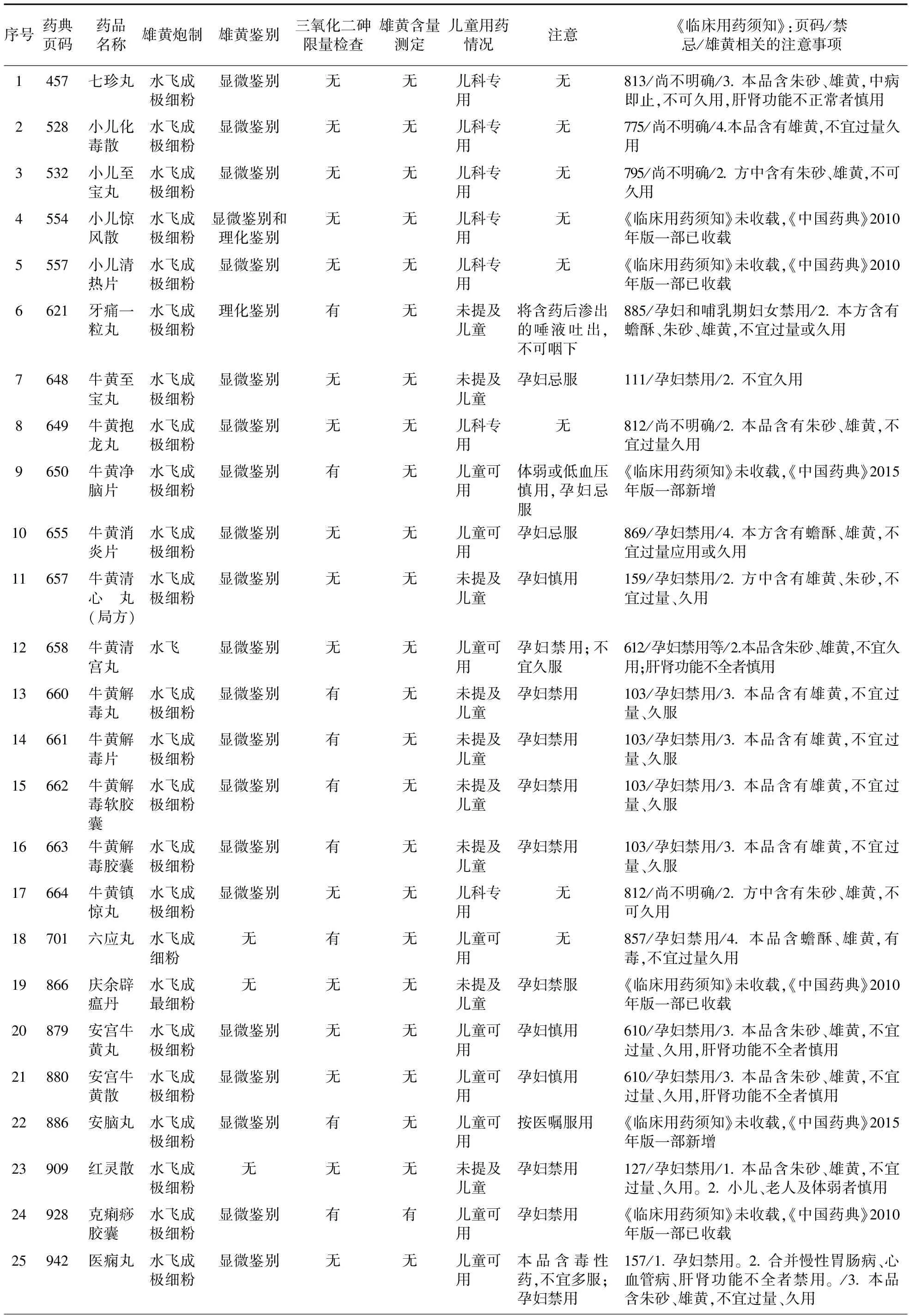
表1 《中国药典》2015年版一部收载含雄黄制剂标准中相关项目情况

续表
2.4 《临床用药须知》收载的禁忌和雄黄相关的注意事项 10个品种未被收载入《临床用药须知》,其中8个品种《中国药典》2010年版一部已收载,2个品种是《中国药典》2015年版一部新增品种。27个品种已收载入《临床用药须知》,其中禁忌尚不明确的有6个品种,孕妇禁用的有20个品种,另6号牙痛一粒丸明确孕妇和哺乳期妇女禁用。20个品种已明确提示雄黄的注意事项;35号和37号2个品种虽未提及雄黄,但明确含有毒药物或重金属药物;7号、28号和34号提示不宜久用等;27号和32号2个品种未明确提示雄黄相关的注意事项。
2.5 《中国药典》2015年版一部与《临床用药须知》收载的有关孕妇用药禁忌的比较 6号牙痛一粒丸、18号六应丸、26号局方至宝散在《中国药典》2015年版一部注意项下没有关于孕妇的用药提示,而在《临床用药须知》相应品种禁忌项下明确为孕妇禁用。11号牛黄清心丸(局方)、20号安宫牛黄丸、21号安宫牛黄散、33号速效牛黄丸4个品种在《中国药典》2015年版一部中注意项下为孕妇慎用,而在《临床用药须知》中11号牛黄清心丸(局方)、20号安宫牛黄丸、21号安宫牛黄散3个品种禁忌项下明确为孕妇禁用;33号速效牛黄丸未被收载入《临床用药须知》。
3 讨论及建议
3.1 建议完善雄黄的炮制 《国家药品标准(中药)研究制定技术要求》各论中药成方制剂中规定:标准中的“制法”项作为一个法定的公共标准,对同品种要有其普适性,应按实际生产情况简要表述工艺流程中的主要步骤[3]。《国家药品标准(中药)正文各论编写细则》第三部分中药制剂标准编写细则中规定:制法项应如实概括药品规模化生产的关键工艺过程;并举例说明了书写格式[3]。按照该要求,建议12号牛黄清宫丸在标准中应明确水飞炮制后的粉末等级。
生雄黄与雄黄粉为雄黄的不同炮制品种,解毒杀虫、燥湿祛痰、截疟等作用相似,雄黄粉为经炮制水飞而成的极细粉,可除杂质,降低毒性,便于内服、外用[4]。18号六应丸中雄黄水飞成细粉,19号庆余辟瘟丹中雄黄水飞成最细粉,应考察其在毒性与疗效上与极细粉是否存在差异,是否有必要水飞成极细粉,以进一步降低毒性。
3.2 建议完善质量标准中雄黄鉴别、三氧化二砷检查及雄黄含量测定 雄黄主要成分是As2S2,并含有少量三氧化二砷(As2O3);As2S2在加热时也可转化为As2O3;As2O3即为构成砒霜的主要成分,是雄黄主药的毒性成分[4]。《国家药品标准(中药)研究制定技术要求》各论中药成方制剂中规定含有毒性药材的制剂,原则上应制定有关毒性成分的检查项目,以确保用药安全;含雄黄、朱砂的制剂应采用专属性的方法对可溶性砷、汞进行检查并制定限度[3]。含量测定项目测定成分的选定应以临床功效为导向,首选制剂处方中君药、臣药的主要药效作用的活性成分、类别成分或组分,贵细药及毒性药材中的有效成分、有毒成分进行含量测定[3]。《国家药品标准(中药)正文各论编写细则》第三部分中药制剂标准编写细则中规定毒性成分的限量检查应在标准中单列检查项[3]。检测指标为毒性药中的成分,其含量限度均须规定被测成分的限量范围[3]。24号克痢痧胶囊的含量测定规定为:“本品每粒含雄黄以As2S2计,应为6.3~10.8 mg”,符合该要求。按照该要求,建议26个无As2O3限量检查的品种及36个无雄黄含量测定的品种,应依据处方量的大小、用法用量等因素,经风险评估确定是否需增加该两项,同时制定雄黄含量测定项目时,应规定雄黄的限量范围。对于无雄黄鉴别的5个品种,应考虑是否需增加其显微鉴别或理化鉴别。
3.3 建议明确儿童用药情况及完善注意项下内容 《国家药品标准(中药)正文各论编写细则》第三部分中药制剂标准编写细则对注意的书写要求包括药物的不良反应、用药禁忌和注意事项3个方面的内容。不良反应指在常规剂量下出现的与治疗无关的副作用、毒性和过敏反应;用药禁忌系指忌用和禁用该药品的人群和疾病情况;注意事项系指用药时必须注意的问题,如饮食禁忌等[3]。建议《中国药典》按照该要求补充完善注意项目的内容,同时应特别关注特殊人群的用药注意。
在[功能与主治]和[用法与用量]项目中均未提及儿童的药物儿童是否可用,建议在凡例中统一说明。关于孕妇“禁用”、“忌服”和“禁服”,建议统一说法或在凡例中明确其定义。
3.4 建议完善《临床用药须知》收载的禁忌和有关雄黄的注意事项 《临床用药须知》(中药卷成方制剂)编写细则中规定:注意事项根据中药理论和用药禁忌要求,分别从证候禁忌、配伍禁忌、妊娠禁忌、饮食禁忌、特殊人群(老年人、儿童、过敏体质)的使用禁忌及毒副作用来分项说明[4]。其中特殊人群禁忌应明确哺乳期、老年人、儿童、过敏体质者使用的注意事项;毒副作用应明确处方中是否配伍有毒及重金属元素的药物,如马兜铃酸、番木鳖碱及朱砂、雄黄等药物[3]。
《临床用药须知》中[禁忌]和[注意事项]内容较全,但有7个品种未按要求明确提及雄黄,27个品种中仅1个品种明确哺乳期妇女禁用,其他品种均无哺乳期妇女的用药提示,建议进一步完善明确;同时建议《临床用药须知》再版时,将《中国药典》相应品种全部收载。
3.5 《中国药典》与《临床用药须知》收载的有关孕妇用药禁忌应一致 《中国药典》2015年版一部雄黄项下[注意]规定内服宜慎;不可久用;孕妇禁用[1]。那么,是否含雄黄的制剂孕妇都要禁用,建议明确说明。
《中国药典》是国家为保证人民用药安全有效、质量可控而制定的技术规范,是我国药品生产、经营、使用以及检验和监督管理所共同遵循的法定依据[5];《临床用药须知》是《中国药典》配套丛书之一。建议二者内容应一致;同时建议在《中国药典》凡例或《临床用药须知》中明确禁用、慎用的定义,以指导临床用药。
[1] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:336-337.
[2] 国家药典委员会.《中国药典临床用药须知》中药成方制剂卷[S].北京:中国医药科技出版社,2011.
[3] 国家药典委员会.国家药品标准工作手册[S].第4版.北京:中国医药科技出版社,2013:15-17,53,66-67,79,82,463-464.
[4] 国家药典委员会.《中国药典临床用药须知》中药饮片卷[S].北京:中国医药科技出版社,2010:1211-1213.
[5] 张伟,兰奋,洪小栩.2015年版《中国药典》编制概况[J].中国药品标准,2015,16(5):323.
SuggestiononstandardforpreparationscontainingrealgarinChinesePharmacopoeia(2015editionVolumeⅠ)
JIA Chao,LI Jing-hui,ZHU Lin
(Liaoning Benxi Institute for Drug Control,Benxi 117000,China)
ObjectiveTo improve the standard for preparations containing realgar in Chinese Pharmacopoeia (2015 edition Volume Ⅰ).MethodsThe seleted items of realgar-containing preparation standard in Chinese Pharmacopoeia (2015 edition Volume Ⅰ) were analyzed statistically.ResultsThere were 37 preparations containing realgar in Chinese Pharmacopoeia (2015 edition Volume Ⅰ).There were some problems in the quality standard text,including processing and identification of realgar,limit test of arsenic trioxide,determination of realgar content and attention items.ConclusionSuggestions on improvement of standard of preparations containing realgar.
Chinese Pharmacopoeia;Realgar;Preparation
2017-02-06
辽宁省本溪市药品检验所,辽宁 本溪 117000
10.14053/j.cnki.ppcr.201710031
