参茸益精片对急性高原缺氧脑损伤的保护作用研究
2017-11-01王海伟王自勤吕宏迪
王海伟,王自勤,苏 丹,霍 坚,吕宏迪*
参茸益精片对急性高原缺氧脑损伤的保护作用研究
王海伟1,王自勤2,苏 丹1,霍 坚1,吕宏迪1*
目的观察参茸益精片对急性高原缺氧脑损伤的保护作用,并探讨其分子机制。方法将SD大鼠随机分为空白对照组(对照组)、高原急性缺氧模型组(模型组)和参茸益精片治疗组(治疗组),每组6只。建立急性高原缺氧脑损伤大鼠动物模型,治疗组灌胃参茸益精片。观察大鼠脑组织SOD活性和MDA水平的变化,Western blot和RT-PCR检测胆碱乙酰转移酶(Choline acetyltransferase,ChAT)和蛋白激酶C(Protein kinase C,PKC)表达水平的变化。结果与对照组比较,模型组大鼠脑组织SOD活性显著降低(P<0.01),MDA水平显著增加(P<0.01);治疗组大鼠脑组织SOD活性显著增加(P<0.01),MDA水平显著降低(P<0.01)。模型组大鼠脑组织ChAT和PKC表达水平显著降低(P<0.05),治疗组ChAT和PKC表达水平显著升高(P<0.05)。结论参茸益精片可以保护急性高原缺氧引起的脑损伤,可能与其调节ChAT和PKC的表达水平有关。
参茸益精片;急性高原缺氧;脑损伤;胆碱乙酰转移酶;蛋白激酶C
0 引言
高原急性缺氧易引起脑损伤,在高原地区的临床发病率持续增高,对当地居民的身体健康危害严重,但其发生的分子机制复杂,影响因素众多[1-3]。阐明高原急性缺氧引起脑损伤的分子机制,探寻有效的临床治疗靶点和预防治疗方案,是目前本领域国内外研究的热点。
参茸益精片主要由西洋参、黄芪等14味中药组成,具有复脉固脱、补脾益肝、生津养血、安神益智壮肾阳、益精血、强筋骨等功能,可用于丙肝、乙肝常规治疗后以及肿瘤患者放化疗后白细胞减少、血红蛋白低、高原反应及消化不良等症[4-6]。但参茸益精片是否可以保护高原急性缺氧引起的大鼠脑损伤,其具体分子机制如何,目前尚未见相关报道。本实验通过建立急性高原缺氧大鼠动物模型,以大鼠高脂血症动物模型为研究对象,通过Western blot和RT-PCR等,观察胆碱乙酰转移酶(Choline acetyltransferase,ChAT)和蛋白激酶C(Protein kinase C,PKC)表达的变化,分析参茸益精片保护高原急性缺氧引起的大鼠脑损伤的分子机制,为其临床应用提供实验基础和理论依据。
1 材料与方法
1.1 急性高原缺氧大鼠动物模型的建立 SD大鼠(180~200 g)由一五九医院实验动物中心提供,随机分为空白对照组(对照组)、高原急性缺氧模型组(模型组)和参茸益精片治疗组(治疗组),每组6只,低压氧舱中常规喂养动物,自由饮水,建立高原缺氧大鼠动物模型,治疗组在饲喂饲料的同时,灌胃参茸益精片0.5 mg/kg。治疗8周后,检测大鼠脑部相关指标变化。
1.2 Western blot分析 取大鼠脑组织,PBS冲洗,加入裂解液,机械匀浆处理,12 000 r/min离心30 min。SDS-PAGE凝胶电泳分离蛋白,转膜,5%奶粉孵育1 h,封闭非特异性背景染色,再分别加入ChAT、水通道蛋白-4(AQPs-4)和PKC一抗(1∶1 000)孵育,4 ℃过夜后,与二抗室温孵育。ECL发光试剂盒发光显影,收集图像。
1.3 RT-PCR分析 分别取大鼠脑组织,TRIZOL法提取总RNA,通过RT-PCR分析LDLR、VCAM-1和VEGF mRNA水平的变化。ChAT上游引物5′-CCTCG-TCTGTGGAGTTTGCG-3′,下游引物5′-AGATTGCTTGGCTTGGTTGG-3′;PKC上游引物5′-GCCGTCCACCTGT TTCC-3′,下游引物5′-AGGCCCTGCTTTCCAAT-3′;AQPs-4上游引物5′-TTGGACCATCATAGGC-3′,下游引物5′-GCATGTGATCGAC-3′;β-actin上游引物5′-GAAGTGTGACGTTGACATCCG-3′,下游引物5′-GCCTAGAAGCATTTG CGGTG-3′。琼脂糖凝胶(1%)电泳分离RT-PCR产物,凝胶成像仪观察图像,分析组间差异。
1.4 脑组织中SOD和MDA活性分析 取大鼠脑组织,组织匀浆,2 000 r/min离心10 min,取上清,按照试剂盒的要求,分析SOD、MDA活性。

2 结果
2.1 参茸益精片对高原急性缺氧大鼠ChAT、AQPs-4和PKC表达的影响 ChAT和PKC与大鼠高原急性缺氧造成的脑损伤密切相关,结果显示,与对照组比较,模型组大鼠脑组织ChAT和PKC的表达均明显降低,AQPs-4表达增加(P<0.05),与模型组比较,治疗组大鼠脑组织ChAT和PKC表达均显著增加,AQPs-4表达降低(P<0.05),见图1~图3。
2.2 参茸益精片对高原急性缺氧大鼠ChAT、AQPs-4和PKC mRNA表达的影响 RT-PCR结果显示,与对照组比较,模型组大鼠脑组织中ChAT、PKC mRNA表达均明显降低,AQPs-4表达增加(P<0.01);与模型组比较,治疗组ChAT、 PKC mRNA表达均显著增加,而AQPs-4表达降低(P<0.01)。见图4~图6。
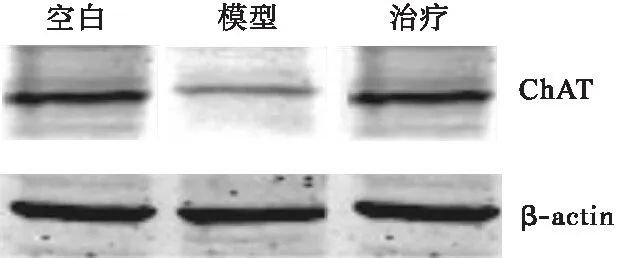
图1 参茸益精片对高原急性缺氧大鼠ChAT表达的影响

图2 参茸益精片对高原急性缺氧大鼠PKC表达的影响
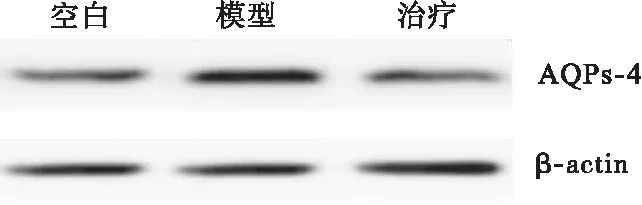
图3 参茸益精片对高原急性缺氧大鼠AQPs-4表达的影响
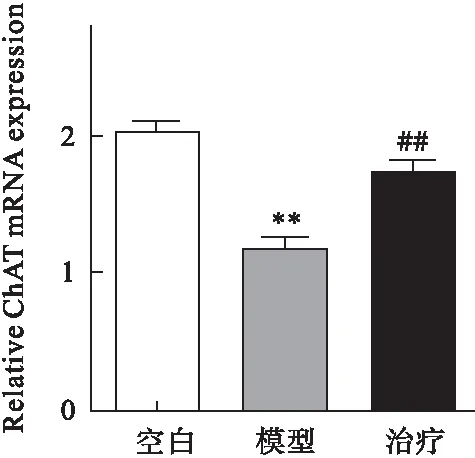
图4 参茸益精片对高原急性缺氧大鼠ChAT mRNA表达的影响

图5 参茸益精片对高原急性缺氧大鼠PKC mRNA表达的影响
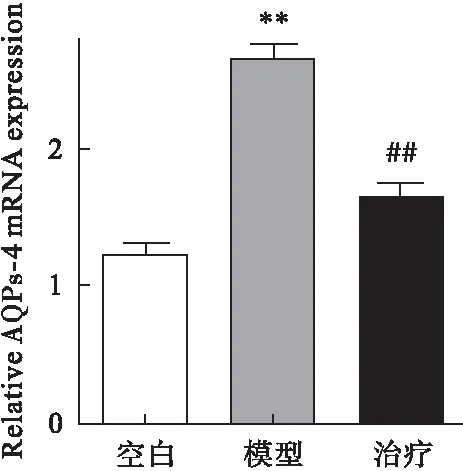
图6 参茸益精片对高原急性缺氧大鼠AQPs-4 mRNA表达的影响
2.3 参茸益精片对高原急性缺氧大鼠脑组织中SOD、MDA活性的影响 与对照组比较,模型组大鼠脑组织中SOD活性显著降低(P<0.05),而MDA活性显著升高(P<0.05)。与模型组比较,治疗组SOD活性显著升高(P<0.05),而MDA活性显著降低(P<0.05),并呈现一定的剂量依赖性。见表1。
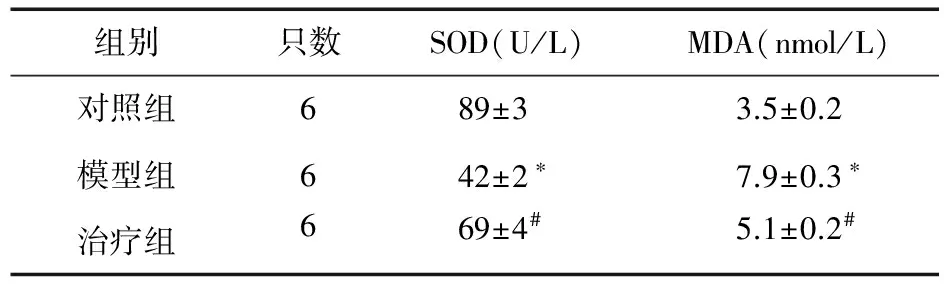
表1 参茸益精片对高原急性缺氧大鼠脑组织中SOD、MDA活性的影响
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
3 讨论
参茸益精片的主要有效成分是人参皂苷(Ginsenoside)Rg1、Re和黄芪甲苷(Astragaloside A),具有复脉固脱、补脾益肝、生津养血的功效,可以疏通脉管,改善脏器供血,调节人体代谢功能[7-8]。高原急性缺氧易引起脑损伤,在高原地区的临床发病率持续增高,其发生的分子机制复杂,影响因素众多。分析并阐明参茸益精片保护高原急性缺氧引起的大鼠脑损伤的分子机制,将为其临床应用提供实验基础和理论依据。
研究证实,神经元胞体内合成的胆碱乙酰转移酶,在神经元轴突末端辅助乙酰辅酶A转移到胆碱,形成神经递质乙酰胆碱[9-11]。缺血缺氧造成的脑损伤以及阿尔茨海默病引起的脑部功能性障碍,均可显著造成大脑皮质区域胆碱能神经纤维的缺失,影响ChAT的活性;同时,PKC信号通路可影响Caspase活性,诱导皮质区神经元细胞凋亡,从而加重缺血缺氧状态对脑部的损伤,同时,可以调控淀粉样纤维蛋白(Amyloid beta,Aβ)对细胞凋亡进程的影响。AQP-4是一类细胞膜转运蛋白,是血脑屏障的重要组成,广泛存在于中枢神经系统中,主要参与脑组织水的代谢和转运过程[12-14]。缺氧脑损伤或脑水肿状态下,AQP-4表达显著增加,可通过调控MAPKs信号通路,影响ERK1/2磷酸化水平,从而加重神经元细胞的损伤。上述分子均与缺氧造成的脑损伤紧密相关,研究与上述脑损伤病理过程相关的治疗药物和干预手段,可减轻临床脑损伤的危害,具有重要的临床应用价值。
本研究结果表明,ChAT和PKC与大鼠高原急性缺氧造成的脑损伤密切相关,与对照组相比,模型组大鼠脑组织中ChAT和PKC表达均明显降低,AQPs-4表达增加;与模型组相比,治疗组ChAT和PKC表达均显著增加,AQPs-4表达降低。RT-PCR实验表明,上述分子的mRNA表达水平也体现相同的趋势。此外,经参茸益精片治疗后,模型组大鼠脑组织中SOD活性显著增加,而MDA活性降低,提示参茸益精片具有显著的脑保护作用,具有潜在的临床应用前景。
综上所述,参茸益精片能够显著提高高原急性缺氧模型大鼠脑组织相关分子的表达,可能作为临床治疗并预防急性缺氧脑损伤的药物。本研究为参茸益精片的进一步临床应用提供了实验基础和理论依据。
[1] Sharma RK,Choudhary RC,Reddy MK,et al.Role of posterior hypothalamus in hypobaric hypoxia induced pulmonary edema[J].Respir Physiol Neurobiol,2015,205:66-76.
[2] Li J,Qi Y,Liu H,et al.Acute high-altitude hypoxic brain injury:identification of ten differential proteins[J].Neural Regen Res,2013,8(31):2932-2941.
[3] Yu AY,Xu QH,Hu SL,et al.Characteristics of a rat model of an open craniocerebral injury at simulated high altitude[J].Neuroreport,2014,25(16):1272-1280.
[4] 徐泳芳,刘敏.人参、黄芪在仲景方中应用探析[J].中国中医急症,2013,22(9):1557-1559.
[5] 汪晶,杨蕾,金鑫,等.黄芪甲苷对人参皂苷CK肿瘤细胞摄取及抗肿瘤作用的影响[J].中草药,2016,47(13):2308-2312.
[6] 刘月,初杰.人参黄芪的性味与配伍对方剂构成的影响[J].辽宁中医药大学学报,2008,10(5):5-6.
[7] 黄小平,王蓓,邱咏园,等.黄芪甲苷、人参皂苷Rg1、Rb1和三七皂苷R1抗小鼠脑缺血再灌注氧化应激损伤和促进能量代谢的配伍研究[J].湖南中医药大学学报,2014,34(7):5-11.
[8] 杜芹芹,张旭,宋凤瑞,等.人参与金银花、何首乌、黄芪配伍的化学成分变化研究及抗氧化活性测定[J].药学学报,2010,45(6):756-760.
[9] Bedell GM,Wade SL,Turkstra LS,et al.Informing design of an app-based coaching intervention to promote social participation of teenagers with traumatic brain injury[J].Dev Neurorehabil,2016:1-10.
[10]Row BW,Kheirandish L,Cheng Y,et al.Impaired spatial working memory and altered choline acetyltransferase (CHAT) immunoreactivity and nicotinic receptor binding in rats exposed to intermittent hypoxia during sleep[J].Behav Brain Res,2007,177(2):308-314.
[11]Pagida MA,Konstantinidou AE,Tsekoura E,et al.Immunohistochemical demonstration of urocortin 1 in Edinger-Westphal nucleus of the human neonate:colocalization with tyrosine hydroxylase under acute perinatal hypoxia[J].Neurosci Lett,2013,554:47-52.
[12]Ji FT,Liang JJ,Miao LP,et al.Propofol post-conditioning protects the blood brain barrier by decreasing matrix metalloproteinase-9 and aquaporin-4 expression and improves the neurobehavioral outcome in a rat model of focal cerebral ischemia-reperfusion injury[J].Mol Med Rep,2015,12(2):2049-2055.
[13]Moriyama Y,Takagi N,Itokawa C,et al.Injection of neural progenitor cells attenuates decrease in level of connexin 43 in brain capillaries after cerebral ischemia[J].Neurosci Lett,2013,543:152-156.
[14]Yu LS,Fan YY,Ye G,et al.Curcumin alleviates brain edema by lowering AQP4 expression levels in a rat model of hypoxia-hypercapnia-induced brain damage[J].Exp Ther Med,2016,11(3):709-716.
ProtectiveeffectofShenRongYiJingtabletsonacutehigh-altitudehypoxiabraininjury
WANG Hai-wei1,WANG Zi-qin2,SU Dan1,HUO Jian1,LÜ Hong-di1*
(1.159 Hospital of PLA,Zhumadian 463000,China;2.Armed Police Corps Hospital of Henan,Zhengzhou 450052,China)
ObjectiveTo observe the protective effect of Shen Rong Yi Jing tablets on acute high-altitude hypoxia brain injury,and explore its molecular mechanism.MethodsSD rats were randomly divided into blank control group (control group),acute altitude hypoxia model group (model group) and Shen Rong Yi Jing tablets treatment group (treatment group),6 rats in each group.The rat model of acute high-altitude hypoxia brain injury was set up and the SOD and MDA level was detected after treatment with Shen Rong Yi Jing tablets.The expression of ChAT and PKC was evaluated by Western blot and RT-PCR.ResultsCompared with control group,the activity of SOD in the brain tissue of model group decreased significantly (P<0.01),while the level of MDA increased significantly (P<0.01);the activity of SOD in the brain tissue of rats in treatment group increased significantly (P<0.01),while the level of MDA decreased significantly (P<0.01).The expression of ChAT and PKC in brain tissue of model group decreased significantly (P<0.05),while the expression level of ChAT and PKC in treatment group increased significantly (P<0.05).ConclusionShen Rong Yi Jing tablets can protect brain damage caused by acute high-altitude hypoxia,which may be related to the regulation of the expression levels of ChAT and PKC.
Shen Rong Yi Jing tablets;Acute high-altitude hypoxia;Brain injury;ChAT;PKC
2017-02-23
1.解放军第一五九医院,河南 驻马店 463000;2.河南省武警总队医院,河南 郑州 450052
河南省科技立项课题(162102310264);军队后勤科技立项课题(CJN15J090)
*
10.14053/j.cnki.ppcr.201710002
