儿童乳糜泻2例临床分析
2017-11-01钟雪梅张艳玲宁慧娟宫幼喆邹继珍
马 昕 钟雪梅 张艳玲 宁慧娟 朱 丹 宫幼喆 邹继珍
首都儿科研究所附属儿童医院1.消化内科,2.病理科(北京 100020)
儿童乳糜泻2例临床分析
马 昕1钟雪梅1张艳玲1宁慧娟1朱 丹1宫幼喆1邹继珍2
首都儿科研究所附属儿童医院1.消化内科,2.病理科(北京 100020)
目的探讨儿童乳糜泻的诊断及治疗。方法回顾分析2例乳糜泻患儿的临床资料。结果2例患儿均为男性,分别为8岁、2岁,均以慢性腹泻、营养不良为主要表现,合并有贫血、低白蛋白血症。大便苏丹Ⅲ染色阳性,抗肌内膜抗体IgA、抗麦胶蛋白IgA阳性。内镜检查发现十二指肠及小肠黏膜病变;病理均提示小肠绒毛萎缩,隐窝上皮内淋巴细胞浸润,黏膜固有层中多量淋巴细胞及浆细胞浸润。2例患儿给予避免麸质饮食后腹泻很快好转,体质量明显增加。但其中1例未能坚持免麸质饮食,腹泻出现反复。结论儿童乳糜泻在中国少见,需早期诊断及治疗,应严格终生无麸质饮食。
慢性腹泻; 乳糜泻; 儿童
乳糜泻(celiac disease,CD)是由于遗传易感者摄入小麦、大麦和黑麦中的麸质引起多种营养物质吸收障碍的一种小肠自身免疫性疾病。CD在欧洲、澳大利亚及北美较常见,而在亚洲罕见,中国目前报道病例数很少[1,2]。本文报道2例CD患儿的临床、病理、血清学检查以及诊治经过,以期提高儿科医师对本病的认识。
1 临床资料
例1,男,8岁10个月,籍贯河南省。因“排稀便伴体质量下降4年6个月”入院。大便为黄色稀水便,可见未消化物,伴酸臭味,有时可见油花,无黏液脓血,无泡沫,每日2、3次。进食肉类后腹泻加重,大便增至每日5、6次。无发热、腹痛、呕吐、腹胀、皮疹等表现。入院前1个月患儿出现手搐搦。外院行胃镜、结肠镜检查未见异常。发病后患儿可照常上学,但食欲明显下降,不喜吃肉食,主食以粥类及馒头为主。病后患儿智力无倒退,体质量逐渐下降,身高增长缓慢,4岁发病前体质量27 kg、身高115 cm,入院时体质量下降至18 kg、身高122 cm。患儿生后8个月添加辅食,以面食、米饭为主。生后每年患1、2次上呼吸道感染。体格检查:营养不良貌,身材匀称,皮肤干燥,皮下脂肪菲薄,无皮疹;双肺呼吸音清,未闻及干湿啰音;心界不大,心律齐,心音有力,各瓣膜区未闻及杂音;腹部凹陷,未见肠型及蠕动波,腹软不胀,无压痛,肝脾肋下未及,叩鼓音,肠鸣音5次/分;四肢肌容积减少,肌力、肌张力正常;外生殖器正常。实验室检查:血常规红细胞3.5×1012/L,白细胞15.02×109/L,中性粒细胞78%,淋巴细胞18.4%,嗜酸粒细胞0.1%,血红蛋白106 g/L,血小板355×109/L;大便常规白细胞0,红细胞0,脂肪球(+),大便隐血(-),大便苏丹Ⅲ染色阳性,大便寄生虫检查(北京友谊医院热带病研究所)贾第鞭毛虫、阿米巴滋养体及包囊检查为阴性;丙氨酸氨基转移酶 23 U/L,天冬氨酸氨基转移酶 20 U/L,总蛋白 49.7 g/L,白蛋白 29.1 g/L,球蛋白 20.6 g/L;血钙1.54 mmol/L,钾2.42 mmol/L,钠132 mmol/L,磷0.89 mmol/L;凝血酶原时间 24~32 s,部分凝血酶原时间47.3~50 s;C反应蛋白5.5 mg/L,血沉5 mm/h;pH值7.474,剩余碱 -1.8,HCO21.3 mmol/L;血旋毛虫、肺吸虫抗体阴性,管圆线虫IgG阴性;HIV抗体阴性;IgG 2.846 g/L,IgA、 IgM正常,CD8 、CD4均正常;甲状旁腺素 144 pg/mL(15~65 pg/mL);IgE>200 IU/mL,小麦、牛奶、鸡蛋、牛羊肉特异性IgE均为0级;抗肌内膜抗体IgA 209 RU/mL(正常<20 RU/mL),抗麦胶蛋白抗体IgA 251 RU/mL(正常<25 RU/mL),抗麦胶蛋白抗体IgG、抗肌内膜抗体IgG阴性(北京海思特临床检验所)。腹部B超示左上腹胰腺下方、肠系膜动静脉多个肿大淋巴结团,全腹肠管蠕动欠佳,结肠扩张明显。小肠镜检查示十二指肠及小肠黏膜绒毛消失,黏膜粗糙,呈颗粒样改变(图1A)。病理诊断:小肠黏膜组织呈慢性炎症,小肠绒毛萎缩明显;免疫组织化学染色:CD3、CD4、CD8显示黏膜内T淋巴细胞;根据形态及免疫组化结果,计算绒毛尖部上皮内淋巴数>6个/20个小肠上皮细胞(图1B)。拟诊断为CD。建议患儿长期避免麸质饮食,并给予补充高热量饮食以及微量元素。在接受治疗3个月后,患儿腹泻情况有好转,每天排1次欠成形大便,体质量增加0.75 kg,未再出现手搐搦,在当地复查血钙、凝血功能均正常。但3个月后患儿未再严格避免麸质饮食,腹泻反复。
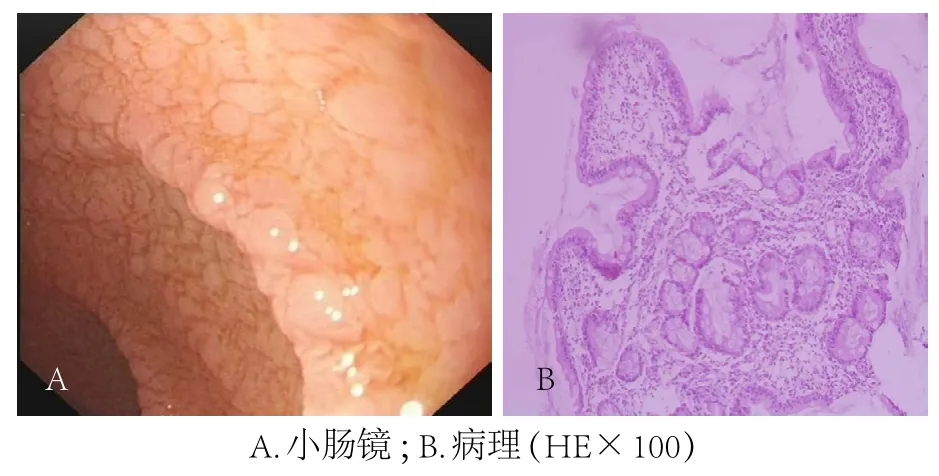
图1 病例1小肠镜及病理表现
例2,男,2岁2个月,籍贯河南省。以排稀便、腹胀1年为主要表现。排黄色稀糊样欠消化大便,每天2、3次,伴有腹胀、体质量下降;入院前3个月更换为氨基酸奶粉喂养,大便性状恢复正常2个月,但仍有腹胀。入院前1个月再次出现大便次数增多及性状改变,7、8次/天,为黄色稀水便。无发热、恶心、呕吐等症状。生后6个月添加辅食,以面食、粥为主要辅食。既往有湿疹史,易患呼吸道感染,否认类似疾病家族史。1岁会走路、说话,发病后逐渐行走无力,坐、站均不稳,仅能发单声字。体格检查:体质量8 kg,身长84 cm,精神反应弱,体型消瘦,皮下脂肪薄,腹壁皮褶厚0.3 cm;呼吸平稳,面色稍苍白,双肺呼吸音粗,未闻及干湿啰音;心音有力,心率98次/分,律齐,未闻及杂音;腹部膨隆,触软,肝脾肋下未及,肠鸣音6次/分;双足背浮肿,末梢暖。实验室检查:血常规白细胞 12.52×109/L,红细胞5.35×1012/L,中性粒细胞39.4%,血红蛋白108 g/L,血小板687×109/L;大便常规阴性,大便苏丹Ⅲ染色阳性,大便寄生虫检查(北京友谊医院热带病研究所)贾第鞭毛虫、阿米巴滋养体及包囊为阴性;血K+2.93 mmol/L,总蛋白43.9 g/L,球蛋白 18.2 g/L,白蛋白 25.7g/L;抗肌内膜抗体IgA 200 RU/mL,抗肌内膜抗体IgG阴性,抗麦胶蛋白抗体IgA 280 RU/mL,抗麦胶蛋白抗体IgG 28 RU/mL(正常<25 RU/mL)(北京海思特临床检验所)。电子胃镜检查示十二指肠球部黏膜水肿、粗糙,组织脆,易出血;十二指肠降部及水平部黏膜略水肿,弥漫分布较多点片状红斑(图2A)。病理示十二指肠病变表现为小肠绒毛萎缩,变平坦,隐窝上皮中间核分裂像,潘氏细胞增多,隐窝上皮内淋巴细胞浸润,黏膜固有层中多量淋巴细胞及浆细胞浸润(图2B)。拟诊为CD。给予避免麸质饮食后1周腹泻即明显好转,3个月体质量增长3 kg,语言及运动功能逐渐恢复,接近正常同龄儿。

图2 病例2胃镜及病理表现
2 讨论
CD是一种摄入麸质食物后引起的一种自身免疫性疾病,发生于有遗传倾向的个体,多种CD特异性自身抗体滴度升高,导致小肠黏膜不同程度的损害,出现多种肠道以及全身症状[3]。CD的高危人群包括自身免疫性疾病患者,如1型糖尿病,以及先天性疾病如IgA缺陷、Down综合征、Turner综合征、Williams综合征等[4]。CD在许多国家都有报道,主要发生于高加索人群。欧洲和美国的多项研究表明,CD的发病率在0.3%~1.3%。虽然CD总的发病率大约是1%,但是仅有10%~15%被诊断并且治疗。对我国上海、济南、武汉、成都4地的118例慢性腹泻患儿进行调查,发现CD患儿14例,占11.9%[1]。本文报道的2例患儿病史较长,曾考虑过敏性腹泻、感染性腹泻、寄生虫病等多种病因,甚至也曾接受内镜检查,但始终未能得到准确的诊断,提示儿科医师应该重视本病,早期诊断和治疗,以提高患儿生活质量。
CD的发病和多种因素有关。个体的遗传易感性、免疫反应和环境因素导致了CD患者的肠道黏膜损伤和肠外并发症。对CD遗传相关基因研究发现,其与HLA-DQ2和HLA-DQ8基因密切相关。这些分子表达在肠道固有层的抗原递呈细胞表面,把麸质肽递呈给CD4+T淋巴细胞,从而引发特异性免疫反应[5]。环境因素包括肠道微生物菌群、初次接触麦胶蛋白的数量和时间、感染以及喂养方式等[6,7]。
CD临床表现复杂多样,大多无特异性。对CD的最初认识是仅在儿童发病,表现为腹泻和吸收不良,但后来逐渐认识到CD可以在任何年龄发病。由于CD主要影响胃肠道,因此把消化道症状称为典型表现;然而,CD也可以完全没有消化道表现而仅表现为多种消化道以外症状,称之为非典型表现[4]。
CD的典型临床表现中腹痛最常见,在加拿大的儿童患者中90%有腹痛表现[8];慢性或间断性腹泻也是常见表现;在儿童和成人患者中慢性便秘也较常见。其他症状包括呕吐、体质量减轻、腹胀,延误诊断的患者可出现恶液质和严重营养不良。由于脂肪吸收不良导致脂溶性维生素缺乏,维生素D缺乏可出现低钙血症、惊厥或手足搐搦,维生素K缺乏可出现凝血功能障碍。本文2例患儿均以严重慢性腹泻为主要表现,大便次数多且含有油性物质是两者共同特点,并且都伴随腹胀症状。长期腹泻造成营养不良,其中例1起病较晚而且病史较长,以体质量下降、身高增长缓慢为主要表现。例2起病早且进展迅速,在体质量进行性下降的同时出现智力、运动发育倒退,所幸这种倒退尚为可逆性,在得到适宜的治疗后随着腹泻好转、营养状况改善,其生长发育也逐渐恢复正常。另外,例1因脂溶性维生素吸收不良出现手足搐搦、凝血功能异常等表现,予以补充脂溶性维生素后上述表现迅速消失,腹泻缓解后手足搐搦症状完全消失,凝血功能也保持正常。
CD的非典型表现中疲劳是非常常见的症状,另有铁剂治疗无效的缺铁性贫血;疱疹性皮炎是CD的皮肤表现,表现为对称性的水疱,伴痒感,多见于肘关节、膝关节伸侧以及臀部;在不同年龄的CD均可以出现肝功能损伤,出现转氨酶升高;关节炎在儿童和成人患者中均可出现;内分泌方面表现为身材矮小、青春期延迟、妇女不明原因的不孕和流产;神经系统方面表现为小脑共济失调、特发性癫痫、外周神经病,以及反复头痛;口腔表现包括牙釉质发育不良、阿弗他溃疡、牙齿萌出延迟等[9]。以上症状可以在缺乏消化道表现时单独存在。本文2例患儿并未发生以上非典型表现。
小肠活组织病理检查是诊断CD的重要方法[10]。CD小肠黏膜呈斑片状损伤,多点组织活检是分析的关键。活检标本应至少有1块取自十二指肠球部,有4块取自十二指肠降部、水平部。病理改变以十二指肠和空肠近端为主,远端变化较轻。CD的小肠黏膜病理特征包括绒毛部分或完全萎缩,隐窝增生,以及上皮内淋巴细胞或浆细胞浸润。按Marsh分类,小肠损害分4期:0期,病变侵及黏膜层;1期,上皮内淋巴细胞数目增加,固有层出现淋巴细胞;2期,隐窝增生伴绒毛萎缩;3期,全部绒毛萎缩。本文2例患儿病理均可见黏膜层及固有层淋巴细胞增多,伴有绒毛萎缩,其中例1分期接近3期,例2基本为2期,病理分期与病程及内镜下黏膜病变程度基本一致。有许多疾病的临床表现与病理变化和CD相似,应注意鉴别。如热带口炎性腹泻、牛奶蛋白或大豆蛋白过敏、HIV肠病、放射性损伤、慢性贫血、贾第鞭毛虫病、Crohn 病等,可通过血清自身免疫抗体试验进行鉴别,自身抗体阳性者考虑CD诊断[11]。
所有CD患者血液中均可检测到1种或多种与肠黏膜组织相关的自身抗体。目前,血清学检查用于CD的筛查,包括抗组织转谷氨酰胺酶抗体(Anti-tTG)、抗肌内膜抗体(EMA)和抗麦胶蛋白抗体(AGA)。血清Anti-tTG-IgA有很高的特异度(96%)和灵敏度(98%),但需注意,IgA免疫缺陷、饮食中谷胶水平低、蛋白丢失性肠病、服用免疫抑制药和<2岁的患者易出现假阴性。而EMA特异度达98%~100%,检测结果较其他乳糜泻抗体更稳定,EMA-IgA有90%以上的灵敏度。HLA-DQ2或HLA-DQ8的表达被认为与CD的发病密切相关,其检测应在未明确诊断CD前进行,如阴性则可以排除CD诊断,可避免十二指肠活检等检查[12]。根据北美小儿胃肠病、肝脏病及营养学会2005年制定的诊断指南[4],对同时有抗肌内膜抗体及抗组织转谷氨酰胺酶抗体阳性,或是抗组织转谷氨酰胺酶抗体>100 AU的患儿,进行十二指肠黏膜活检,合并有小肠黏膜损伤的患儿可拟诊CD,并给予去麸质饮食,观察治疗后临床效果。6个月后复查血清学指标转阴、内镜及病理发现黏膜病变明显改善或麸质激发实验阳性者可确诊CD。由于条件所限本文中2例患儿未能进行抗组织转谷氨酰胺酶抗体及基因检查,但两者抗肌内膜抗体均高滴度阳性,去麸质饮食后症状迅速缓解,例1患儿再次进食含麸质食物后腹泻又加重,例2患儿完全使用氨基酸奶粉喂养时腹泻消失,引入含麸质辅食后腹泻加重,结合其内镜及病理检查,2例患儿均可确诊为CD。在我国,CD仍属于罕见病,检查手段并不系统,因此需要临床医师对此病有深入的认识,能够合理地进行相关检查并且恰当分析检查结果和治疗过程中的反应变化。
CD的传统治疗方法是严格终生避免麸质饮食,包括小麦、大麦和黑麦。患者治疗失败多为饮食控制不当,食用了含有麸质成分的食物有关。例1患儿者因为不能坚持避免麸质饮食而出现病情反复,提示医师需明确地告知饮食控制的目的和方法,并且密切随访。近年也发现有相当一部分患者尤其是成人在严格避食情况下病情并不能完全改善[13]。因此,有必要研究新的治疗方法,如利用酶降解摄入的麦麸[14],或研发一种不含麦麸的谷物[15],或用药物减轻肠道渗透性[16],或用免疫抑制剂进行治疗。
在中国儿童CD确实存在,儿科医师应对本病加深认识,早期诊断,加强随访,饮食治疗可以明显提高患儿的生活质量。
[1]Wang XQ,Liu W, Xu CD, et al.Celiac disease in children with diarrhea in 4 cities in china [J].J Pediatr Gastroenterol Nutr, 2011, 53(4): 368-370.
[2]Wu J, Xia B, von Blomberg BM,et a1.Coeliac disease:emerging in china? [J].Gut, 2010, 59(3): 418-419.
[3]Ludvigsson JF, Leffler DA, Bai JC, et al.The Oslo definitions for coeliac disease and related terms [J].Gut, 2013, 62(1): 43-52.
[4]Hill ID, Dirks MH, Liptak GS, et al.Guideline for the diagnosis and treatment of celiac disease in children:recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition [J].J Pediatr Gastroenterol Nutr, 2005, 40(1): 1-19.
[5]van Belzen MJ, Koeleman BP, Crusius JB, et al.Defining the contribution of the HLA region to cis DQ2-positive celiac disease patients [J].Genes Immun, 2004, 5(3): 215-220.
[6]Di Sabatino A, Corazza GR .Celiac disease [J].Lancet, 2009,373(9673):1480-1493.
[7]Decker E, Hornef M, Stockinger S.Cesarean delivery is associated with celiac disease but not inflammatory bowel disease in children [J].Gut Microbes, 2011, 2(2): 91-98.
[8]Rashid M, Cranney A, Zarkadas M, et al.Celiac disease:evaluation of the diagnosis and dietary compliance in Canadian children [J].Pediatrics, 2005, 116(6): e754-e759.
[9]Cheng J, Malahias T, Brar P, et al.The association between celiac disease, dental enamel defects, and aphthous ulcers in a United States cohort [J].J Clin Gastroenterol, 2010, 44(3):191-194.
[10]Lebwohl B, Rubio-Tapia A, Assiri A, et al.Diagnosis of celiac disease [J].Gastrointest Endosc Clin N Am, 2012,22(4): 661-677.
[11]Paparo F, Petrone E, Tosco A, et al.Clinical, HLA, and small bowel immunohistochemical features of children with positive serum antiendomysium antibodies and architecturally normal small intestinal mucosa [J].Am J Gastroenterol, 2005,100(10): 2294-2298.
[12]Megiorni F, Pizzuti A.HLA-DQA1andHLA-DQB1in Celiac disease predisposition: practical implications of the HLA molecular typing [J].J Biomed Sci, 2012, 19: 88.
[13]Lebwohl B, Granath F, Ekbom A, et al.Mucosal healingand mortality in coeliac disease [J].Aliment Pharmacol Ther,2013, 37(3): 332-339.
[14]Siegel M, Garber ME, Spencer AG, et al.Safety, tolerability,and activity of ALV003: results from two phase 1 single,escalating-dose clinical trials [J].Dig Dis Sci, 2012, 57(2):440-450.
[15]Mitea C, Salentijn EM, van Veelen P, et al.A universal approach to eliminate antigenic properties of alpha-gliadin peptides in celiac disease [J].PLoS One, 2010, 5(12): e15637.
[16]Kelly CP, Green PH, Murray JA, et al.Larazotide acetate in patients with coeliac disease undergoing a gluten challenge: a randomised placebo-controlled study [J].Aliment Pharmacol Ther, 2013, 37(2): 252-262.
Clinical manifestations of celiac disease in two children
MA Xin1, ZHONG Xuemei1, ZHANG Yanling1, NING Huijuan1ZHU Dan1, GONG Youzhe1, ZOU Jizhen2
(1.Department of Gastroenterology, 2.Department of Pathology, Hospital of Capital Institute of Pediatrics, Beijing 100020, China)
ObjectiveTo explore the diagnosis and treatment of celiac disease in children.MethodThe clinical data of 2 children with celiac disease were analyzed retrospectively.ResultsBoth of them were 8-year and 2-year-old males.Chronic diarrhea and malnutrition were the main manifestations combined with anemia and hypoalbuminemia in both of them.The examinations showed that stool Sultan III staining, anti-endometrial antibody IgA, and anti-gliadin IgA were all positive.Endoscopic examination revealed mucosal lesions in duodenal and small bowel.Pathology showed small intestinal villus atrophy,infiltration of lymphocytes in crypt epithelium, and infiltration of lymphocytes and plasma cells in the lamina propria.Diarrhea was quickly improved in both of them after the gluten diet was avoided, and weight increased significantly.However, one of them failed to maintain a gluten free diet and diarrhea recurred.ConclusionsThe celiac disease in children is rare in China.It needs to have early diagnosis and treatment, and should be strictly followed by a lifelong gluten free diet.
chronic diarrhea; celiac disease; child
doi∶10.3969/j.issn.1000-3606.2017.10.003
钟雪梅 电子信箱:zhongxuemei 5566@163.com
2017-01-09)
(本文编辑:蔡虹蔚)
