黄河三角洲刺槐根际与非根际细菌结构及多样性*
2017-11-01丁新景敬如岩黄雅丽陈博杰马风云
丁新景 敬如岩 黄雅丽 陈博杰 马风云†
(1 山东农业大学林学院,山东农业大学生态与环境实验室,山东泰安 271018)
(2 中国科学院西北生态环境资源研究院,兰州 730000)
(3 中国科学院大学,北京 100049)
黄河三角洲刺槐根际与非根际细菌结构及多样性*
丁新景1,2,3敬如岩1黄雅丽1陈博杰1马风云1†
(1 山东农业大学林学院,山东农业大学生态与环境实验室,山东泰安 271018)
(2 中国科学院西北生态环境资源研究院,兰州 730000)
(3 中国科学院大学,北京 100049)
为精确分析黄河三角洲刺槐根际与非根际土壤细菌群落定殖情况,本研究采用高通量测序方法对刺槐根际与非根际土壤细菌结构及多样性进行了研究。研究表明,根际土壤细菌共有36门214属,非根际土壤细菌共有33门153属。变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)细菌丰度超过15%,是根际与非根际土壤中的优势菌落。根际与非根际土壤中酸杆菌门、硝化螺旋菌门(Nitrospirae)丰度差异显著。根际土壤中红游动菌属(Rhodoplanes)、溶杆菌属(Lysobacter)、热单胞菌属(Thermomonas)、链霉菌属(Streptomyces)及非根际土壤中红游动菌属、溶杆菌属、链霉菌属、Kaistobacter细菌丰度超过4%。根际土壤中固氮菌丰度显著高于非根际土壤,解磷、解钾细菌丰度差异不显著。根际与非根际土壤细菌Chao丰富度分别为2 054、2 376,差异显著。根际与非根际土壤细菌之间的权重(Weighted Unifrac)距离在0.12~0.25之间。综上所述,黄河三角洲刺槐根际与非根际土壤细菌结构具有一定差异,多样性差异显著。
黄河三角洲;刺槐;根际;细菌;多样性
微生物是土壤生态系统的重要组成部分,参与土壤中很多生理生化反应,在土壤生态系统的物质转换、能量流动、信息传递中发挥着重要作用[1]。土壤微生物对植物生长具有重要影响。微生物作为植物有机残体的主要分解者能够通过土壤中营养元素的周转,调节植物养分的供应,影响植物的生长、资源分配和化学组成。此外,微生物可以将土壤中植物不能直接利用的N、P转化为有效态,因此在微生物多样性较高的土壤中植物可以吸收更多的营养物质,对外界的胁迫具有更强的恢复能力[1]。如微生物多样性较低土壤中植物对热胁迫和铜胁迫的恢复力也最低,且当多样性下降时某些特定的功能也受到极大影响[1-2]。土壤微生物中细菌数量最大、种类最多,生物学特性各异,繁殖迅速,对土壤肥力的形成、植物营养的转化有极其重要的作用[3]。植物根际土壤是根系与细菌相互作用的媒介,在根系与细菌的共同作用下形成的复杂微生态系统[4-5]。植物根系代谢产生分泌物,其中一些物质可直接影响根际土壤细菌生长、发育和繁殖,使根际细菌数量、种类不同于非根际土壤,形成根际效应[6-7]。根际土壤细菌对植物的生长具有促进作用,如部分细菌与豆科植物根系可以联合固氮,也有部分细菌可以通过产生激素影响植物生长[8]。根际土壤细菌的研究有利于进一步认识植物根系-细菌的共生体系协同进化机制[9]。
黄河三角洲是我国重要的湿地分布区,目前正处于快速开发建设时期,如何在经济快速发展的同时保持良好的生态环境,实现经济的可持续发展,是一个重要的研究课题。为改善和保护该地区的生态环境,黄河三角洲地区自20世纪80年代以来营造了大量防护林,其中刺槐林栽培面积较大,达5 000 hm2,这些防护林在该地区防风固沙、水土保持、土壤改良等方面发挥着重要的作用[10]。鉴于细菌在土壤各种生态过程中具有的重要作用,本研究选择该地区刺槐人工林为研究对象,研究林地根际与非根际土壤细菌群落结构及多样性差异,为人工林的科学管理以及进一步研究黄河三角洲生态系统提供可参考依据。
1 材料与方法
1.1 研究区概况
研究区位于山东省东营市河口区孤岛镇,东、北两侧临渤海,属暖温带半湿润季风气候。该地年平均气温为12.8 ℃,年均无霜期为234 d,年均日照时间约2 728 h,年均降水量为690.5 mm,全年降水分布不均,夏季降水占全年降水量的69%,超过10℃有效积温约4 300 ℃左右[10]。
人工林为1985年营建,株行距为3 m×3 m。林木主要有刺槐(Robinia pseudoacacia)、绒毛白蜡(Fraxinus velutina)、臭椿(Ailanthus altissima)、榆树(Ulmus pumila)、杨树(Populs)、国槐(Sophora japonica)等。林下生长有茅草(Imperata cylindica)、荻(Triarrherca saccharifora)等草本植物。
1.2 样品采集与处理
2014年11月在刺槐纯林中设3个20 m×20 m标准地。每标准地内选取1株标准木,距树干基部0.5 m处设东西南北4个取样点,采集直径小于0.2 cm的刺槐细根,用抖落法获取细根上粘附的土壤作为根际土壤,将每个标准地获取的根际土壤分别混匀;另外在各取样点5~20 cm土层采集非根际土壤。将每标准地根际与非土壤分为2份,一份装入已消毒的密封塑料袋中,液氮保存带回实验室,并在-70℃冷冻条件下备用;1份土样风干过0.20 mm筛,用于测定土壤理化性质[10]。另用环刀法取样测定土壤含水量。
1.3 土壤微生物DNA提取、测序、处理
采用CTAB方法提取样本基因组DNA[11],之后利用琼脂糖凝胶电泳、OD280检测DNA的纯度和浓度。在离心管中将无菌水稀释样品至1 ng μl-1,以稀释后基因组DNA为模板,根据测序区域的选择,使用带条码(Barcode)的特异引物,采用高效和高保真酶进行聚合酶链反应(PCR)。引物对应区域:16S V4区引物为515F-806R。用New England Biolabs公司的建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用MiSeq进行上机测序。
Illumina MiSeq(Illumina高通量测序)测序平台根据Barcode序列将下机数据拆分为不同样品数据,截去Barcode序列和PCR扩增引物序列;将拆分的数据使用FLASH对每个样品的片段(reads)进行拼接,得到的拼接序列为原始标签(Raw Tags);Raw Tags经过更严格过滤处理后[12],得到高质量的标签数据(Clean Tags):Raw Tags从连续低质量值(默认质量阈值为≤ 3)碱基数达到设定长度(默认长度值为3)的第一个低质量碱基位点截断;经过截取后得到的标签(Tags)数据集,进一步过滤掉其中连续高质量碱基长度小于Tags长度75%的Tags[13]。经过以上处理后得到的Tags序列与数据库(UCHIME Algorithm)进行比对,检测嵌合体序列并最终去除其中的嵌合体序列[14]。
1.4 物种注释与丰度计算
用Uparse软件对所有样品的全部有效序列(Effective Tags)聚类[15],默认97%的一致性将序列聚类成为OTUs(群落聚类),Uparse构建OTUs时会选取代表性序列(依据其算法原则,筛选OTUs中出现频数最高的序列),将这些代表性序列集合用RDP Classifier与GreenGene数据库进行物种注释分析。结合物种组成信息结果,得到在该样品中每个物种丰度。
1.5 数据处理
根据每个样本文库的OTUs丰度信息,利用QIIME(Version1.7.0)软件计算样品的α多样性值,包括物种数、Chao指数、香农指数(Shannon index,H)、辛普森指数(Simpson index,D):
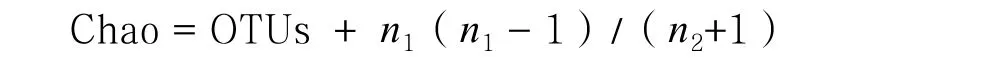
式中, OTUs为实际观测到的 OTU数目;n1为只含有一条序列OTU数目;n2为只含有两条序列的 OTU数目;
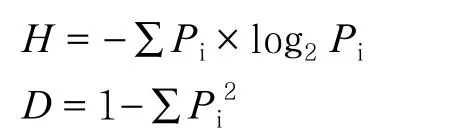
式中,Pi=ni/N,表明第i个物种的相对多度;ni为含有i条序列的 OTU数目;N为所有序列数[16]。
利用QIIME软件分析根际和非根际土壤样品差异性[15],即Weighted Unifrac距离。应用SPSS 22.0 软件完成统计分析,各处理间数据采用方差分析(ANOVA),以 Duncan法检测差异显著性,差异水平p<0.05。
2 结 果
2.1 根际与非根际土壤理化性质
刺槐林根际与非根际土壤理化性质见表1。刺槐根际与非根际土壤含水量、电导率、pH、速效钾、硝态氮含量差异不显著。根际土壤中有效磷、碱解氮、有机质、可溶性有机碳、可溶性有机氮含量显著高于非根际土壤,分别是非根际土壤的88.76%、71.19%、88.50%、88.50%、90.03%。
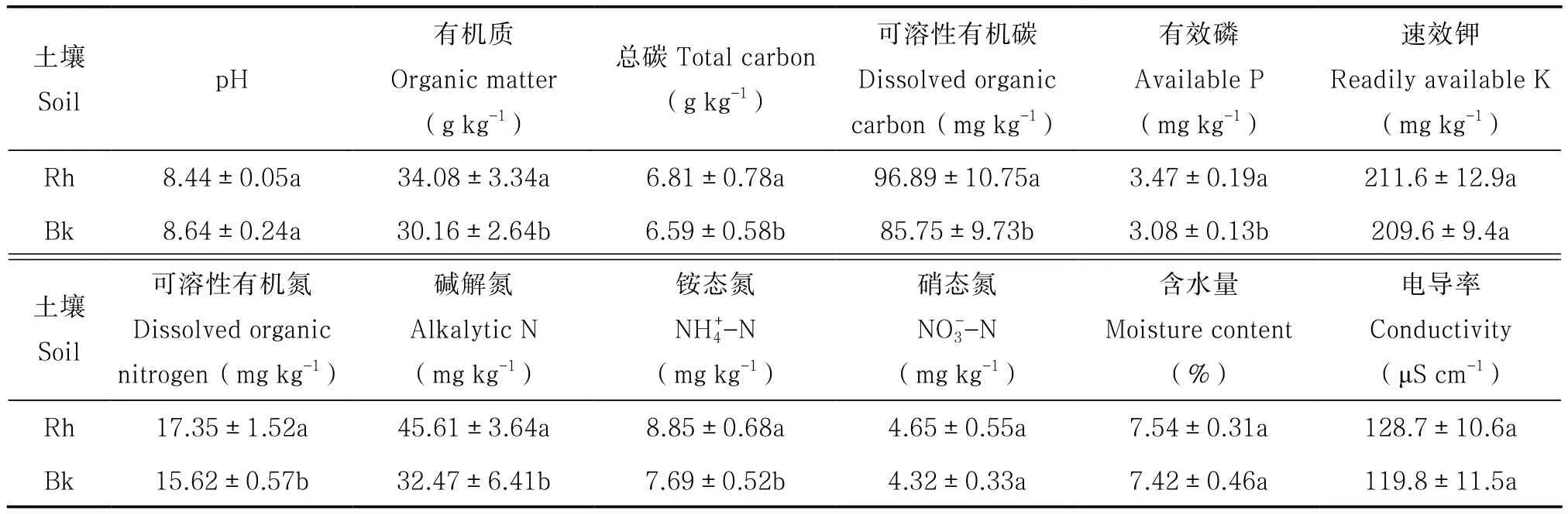
表1 刺槐林土壤理化性质Table 1 Physical and chemical properties of the soil under Robinia pseudoacacia forest
2.2 根际与非根际土壤细菌测序
经测定,黄河三角洲刺槐根际土壤3次重复分别获得42 341、54 992、51 601条有效序列,非根际土壤3次重复分别获得38 657、23 353、54 813条有效序列。对获得的序列进行随机抽样的方法,以抽到的序列数与其所代表的OTU数目构建稀释性曲线,如图1,从图中可以看出,12 360条序列时根际与非根际土壤序列稀释性曲线均趋于平坦,更多的测序数据对发现新的OTU贡献率较小,表明测序数据合理。
2.3 根际与非根际土壤细菌结构组成

图1 根际与非根际土壤细菌稀疏性曲线分析Fig. 1 Sparsity curve analysis of OTUs of rhizosphere and bulk soil
根际与非根际土壤细菌分别有36门和33门,其中分别有9门和8门细菌丰度超过1%(图2),丰度总和分别为97.37%和96.15%。变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)3门细菌在根际与非根际土壤中丰度超过15%,是根际与非根际土壤中的优势菌落。变形菌门细菌在根际土壤中丰度最高,为33.30%,显著高于非根际土壤中的丰度。变形菌门细菌共有5纲,根际土壤中Betaproteobacteria、Alphaproteobacteria、Gammaproteobacteria 3纲细菌丰度分别为12.31%、9.46%、7.83%,显著高于非根际;Deltaproteobacteria细菌在根际与非根际土壤中丰度分别为3.67%、4.04%,差异不显著;根际与非根际中Epsilonproteobacteria细菌丰度低于1%。非根际土壤中酸杆菌门丰度最高,为29.29%,根际土壤中丰度为20.64%,差异显著(p<0.05)。绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、浮游菌门(Planctomycetes)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)5门细菌在根际与非根际土壤中丰度介于1.96%~6.82%,其中硝化螺旋菌门细菌在根际土壤丰度仅为2.39%,而非根际土壤中丰度为6.82%,差异显著(p<0.05)。
根际与非根际土壤中细菌分别有214属和153属,丰度超过1%的属分别有29属和32属(图3),丰度总和分别为76.95%和80.08%。红游动菌属(Rhodoplanes)、溶杆菌属(Lysobacter)、热单胞菌属(T h e r m o m o n a s)、链霉菌属(Streptomyces)4属细菌在根际土壤中丰度超过4%。红游动菌属、溶杆菌属、链霉菌属、Kaistobacter4属细菌在非根际土壤中丰度超过4%。许多属细菌在根际与非根际土壤中丰度差异显著(p<0.05)。如新鞘氨醇杆菌属(Novosphingobium)、气微菌属(Aeromicrobium)、Limnohabitans、海藻球菌属(Phycicoccus)4属细菌在根际土壤中丰度显著高于非根际土壤(p<0.05),其中Limnohabitans、海藻球菌属细菌在根际土壤中丰度超过1%,在非根际土壤中未检测到。Kaistobacter、Candidatus Nitrososphaera、DA101、Ramlibacter、Methylibium5属细菌在非根际土壤中丰度显著高于根际土壤(p<0.05),其中Ramlibacter、Methylibium在非根际土壤中的丰度超过1%,但在根际土壤中未检测到。
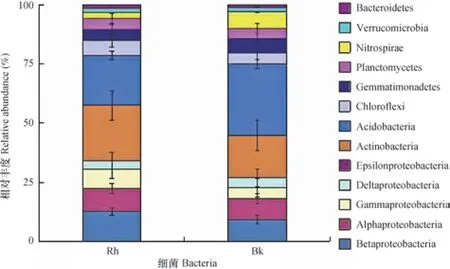
图2 根际与非根际土壤细菌门水平相对丰度Fig. 2 Bacterial abundance of rhizosphere and bulk soil at the phylum level
2.4 根际与非根际土壤细菌功能组成
根际与非根际土壤中具有固氮功能的细菌分别有17属、15属(表2),根际土壤中具有固氮功能的细菌丰度是非根际土壤中的1.21倍,差异显著(p<0.05),其中短波单胞菌属(Brevundimonas)、成对杆菌属(Dyadobacter)、硫杆菌属(Thiobacillus)3属细菌仅在根际土壤中检测到,弗兰克氏菌属(Frankia)细菌仅在非根际土壤中检测到。根际与非根际土壤中具有解磷功能的细菌分别有8属、7属,具有解钾功能的细菌分别有5属、4属,解磷、解钾细菌丰度差异不显著(p>0.05)。窄食单胞菌属(Stenotrophomonas)、芽孢杆菌属(Bacillus)、布克氏菌属(Burkholderia)3属细菌具有减少植株病害的作用,3属细菌在非根际土壤细菌丰度总和是根际土壤的3.93倍,差异显著(p<0.05)。根际与非根际土壤中还分布有植物致病菌假黄单胞菌属(Pseudoxanthomonas)、螺杆菌属(Helicobacter)。

图3 根际与非根际土壤细菌属水平相对丰度Fig. 3 Bacterial abundance of Rhizosphere and bulk soil at the generic level

表2 根际与非根际土壤细菌功能组成Table 2 Bacterial function composition of rhizosphere and bulk soil
2.5 根际与非根际土壤细菌群落多样性
97%序列相似度被认为是种(species)的分类水平,本研究以97%相似度水平归并OTUs计算根际与非根际土壤细菌的α多样性。从表3得知,非根际土壤所测得的细菌物种数、香农指数均高于根际土壤,差异不显著(p>0.05);非根际土壤细菌Chao丰富度为2 376,显著高于根际;根际与非根际土壤细菌辛普森指数差异不显著(p>0.05)。

表3 刺槐根际与非根际土壤细菌多样性分析Table 3 Bacterial diversity index of the rhizosphere and bulk soil under Robinia pseudoacacia
2.6 根际与非根际土壤细菌差异
Weighted Unifrac距离可以用来作为衡量两个样品间的相异系数,其值越小,表示这两个样品在物种多样性方面存在的差异越小[17]。刺槐根际土壤细菌之间的Weighted Unifrac距离在0.17~0.25之间;刺槐根际土壤细菌之间的Weighted Unifrac距离显著高于非根际(p<0.05);根际与非根际土壤细菌之间Weighted Unifrac距离整体偏大(表4)。非根际土壤细菌之间差异较小,根际土壤细菌之间差异较大。
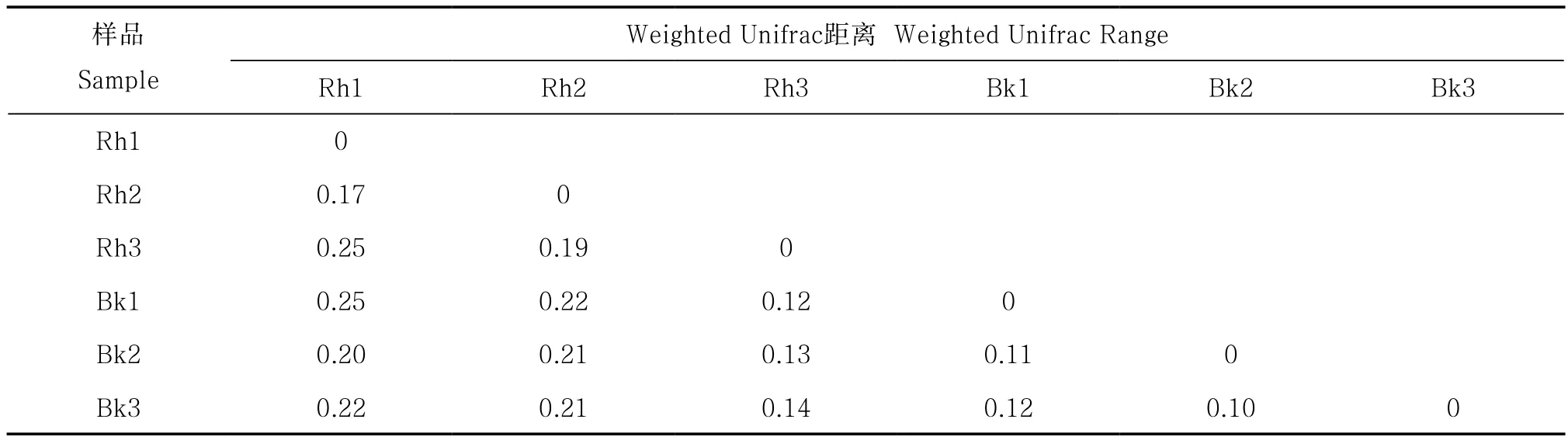
表4 根际与非根际土壤细菌Weighted Unifrac距离Table 4 Bacterial Weighted Unifrac Range between rhizosphere and bulk soil
3 讨 论
3.1 根际与非根际土壤细菌群落结构
黄河三角洲刺槐林土壤中,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门3门细菌土壤中丰度均超过15%,是土壤中的优势群落。王伏伟[15]、柳春林[16]、杨菁[18]等对砂姜黑土、赤红壤、砂壤细菌群落研究后发现变形菌门、放线菌门、酸杆菌门3门细菌是上述3种土壤中的优势群落,杜滢鑫等[19]研究表明变形菌门、放线菌门、酸杆菌门3门细菌在大庆盐碱地中同样占据优势,与本研究结果相同。说明变形菌门、放线菌门、酸杆菌门3门细菌适应性广,能够存在于各种不同的土壤中,环境变化对这3门细菌分布影响不大[15]。
门水平上变形菌门、酸杆菌门、硝化螺旋菌门3门细菌在根际与非根际土壤中丰度差异显著;属水平上新鞘氨醇杆菌属(Novosphingobium)、气微菌属(Aeromicrobium)、Limnohabitans、海藻球菌属(Phycicoccus)、Kaistobacter、Candidatus、Nitrososphaera、DA101、Ramlibacter、Methylibium9属细菌在根际与非根际土壤中相对丰度差异显著。汪其同等[5]研究表明杨树根际和非根际土壤中8属相对丰度较高的细菌丰度存在显著差异。细菌在根际与非根际土壤中丰度差异可能是由于植物根系生长代谢及根系分泌物差异导致根际与非根际土壤的透气性、湿度、pH、土壤颗粒大小、土壤紧实度及土壤N、P、K、有机质含量等不同,不同理化性质的土壤中细菌类群不同,因此根际与非根际土壤细菌群落结构存在差异[20]。
3.2 根系对细菌群落多样性的影响
一般由于植株根系代谢为根际土壤细菌提供较多的碳源,使得根际土壤细菌数量、多样性高于非根际,如杨树人工林根际细菌多样性高于非根际[5];本溪山樱根际与非根际解磷细菌群落存在明显的根际效应[21]。黄河三角洲刺槐根际土壤细菌Chao指数为2 054,而非根际为2 376,根际土壤细菌多样性低于非根际土壤。这应该与土样采集时间有关。试验土样采于11月,该地区11月份降水较少,土壤中水分蒸发强烈,刺槐受到干旱胁迫,根系调整自身根系分泌物的组成和数量来积极响应土壤环境的变化[22]。根系分泌物对根际微生物具有一定的选择性,干旱胁迫促使植物分泌物增加,植物根系对根际细菌的选择性增强,使部分细菌丰度升高,其他细菌丰度降低,根际细菌多样性低于非根际[5]。因此根际土壤细菌多样性降低可以作为植物对干旱胁迫响应的一种表现[23]。
3.3 土壤理化性质对细菌群落结构的影响
许多研究表明酸杆菌门在酸性土壤中丰度较高,如柳春林等[16]研究发现鼎湖山森林土壤中酸杆菌门丰度介于53. 3%~67. 8%,隋心等[24]在三江平原研究发现土壤中酸杆菌门丰度为53%。酸杆菌门是嗜酸性细菌,酸性土壤有利于酸杆菌门的生长[25]。鼎湖山与三江平原土壤为酸性,适于酸杆菌门的生长,而黄河三角洲刺槐根际与非根际土壤中丰度分别为20.64%和29.29%,丰度偏低,可能是碱性土壤不利于酸杆菌门生长。虽然黄河三角洲刺槐林土壤中酸杆菌门细菌丰度较低,但土壤细菌多样性(Chao指数2054~2 376)却高于隋心等[24](Chao指数709~745)、汪其同等[5](Chao指数1931~2260)研究的土壤,可能是碱性环境中酸杆菌门丰度较低,利于其他细菌的生长,从而提高了土壤的细菌多样性。黄河三角洲刺槐林土壤中检测出芽单胞菌门(Gemmatimonadetes),这个门的细菌在海南降香黄檀人工林土壤及鼎湖山森林土壤细菌中均未发现[16],三江平原小叶章土壤中芽单胞菌门丰度极低,仅1%[24],而芽单胞菌门在黄河三角洲刺槐根际与非根际中丰度较高,分别为4.67%和5.95%,这可能是碱性环境不利于酸杆菌门细菌生长从而使芽单胞菌门细菌丰度较高。
刺槐根际与非根际土壤含水量、电导率、pH、速效钾含量差异不显著,根际土壤碱解氮、有效磷、有机质含量显著高于非根际。这可能是刺槐受干旱胁迫后根系分泌物增加引起的,根系分泌物中含有较多的低分子糖、多种氨基酸、有机酸、酮、酚和胺等物质,根系分泌物中氨基酸、有机酸能够将土壤中无效态氮、磷转化为有效态[6],因此刺槐根际土壤碱解氮、有效磷、有机质含量显著高于非根际。根际土壤理化性质发生变化,增强了部分细菌竞争能力[5],如刺槐根际土壤中变形菌门、放线菌门等细菌丰度均显著高于非根际。变形菌门、放线菌门等细菌对土壤资源消耗增长使土壤细菌群落竞争加剧,酸杆菌门、硝化螺旋菌门等细菌食物资源减少,丰度降低,根际土壤细菌多样性低于非根际。
根际土壤为细菌提供了丰富的碱解氮、有效磷、有机质等营养物质,因此根际土壤中微生物数量多于非根际土壤[26],但由于根系分泌物对根际微生物具有一定的选择性[5],因此刺槐根际土壤细菌多样性小于非根际土壤。
4 结 论
黄河三角洲刺槐林根际土壤细菌丰度高于非根际土壤细菌。变形菌门、放线菌门、酸杆菌门细菌是根际与非根际土壤中的共同优势菌落。红游动菌属、溶杆菌属、热单胞菌属、链霉菌属为根际土壤优势群落,红游动菌属、溶杆菌属、链霉菌属、
Kaistobacter细菌为非根际土壤优势群落。根际土壤中固氮菌丰度显著高于非根际土壤,解磷、解钾细菌丰度差异不显著。根际与非根际土壤细菌多样性差异显著。非根际土壤细菌之间物种多样性差异较小,根际土壤细菌之间差异较大。
[1] Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil:A review. Biology and Fertility of Soils,1999,29:111—129
[2] Griffiths B S,Ritz K,Bardgett R D,et al. Ecosystem response of pasture soil communities to fumigationinduced microbial diversity reductions:An examination of the biodiversity-ecosystem function relationship.Oikos,2000,90(2):279—294
[3] Kennedy A C. Bacterial diversity in agroecosystems.Agriculture Ecosystems and Environment,1999,74(1):65—76
[4] Ryan P R,Jones D L,Delhaize E. Function and mechanism of organic anion exudation from plant roots.Annual Review of Plant Physiology and Plant Molecular Biology,2001,52:527—560
[5] 汪其同,朱婉芮,刘梦玲,等. 基于高通量测序的杨树人工林根际和非根际细菌群落结构比较. 应用与环境生物学报,2015,21(5):967—973 Wang Q T,Zhu W R,Liu M L,et al. Comparison on bacterial community of rhizosphere and bulk soil of poplar plantation based on pyrosequencing(In Chinese). Chinese Journal of Applied and Environmental Biology,2015,21(5):967—973
[6] Wardle D A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil. Biological Reviews,1992,67(3):321—358
[7] Prosser J. Molecular and functional eliversity in soil micro-organisms. Plant and Soil,2002,244(1):9—17
[8] Schippers B,Bakker A W,Bakker P. Interactions of deleterious and beneficial rhizosphere microorganisms and the effect of cropping practices. Annual Review of Phytopathology,2003,25(1):339—358
[9] Berg G,Grube M,Schloter M,et al. Unraveling the plant microbiome:Looking back and future perspectives. Frontiers in Microbiology,2014,5,DOI:10.3389/fmicb.2014.00148
[10] 李萍,赵庚星,高明秀,等. 黄河三角洲土壤含水量状况的高光谱估测与遥感反演. 土壤学报,2015,52(6):1262—1272 Li P,Zhao G X,Gao M X,et al. Hyperspectral estimation and remote sensing retrieval of soil water regime in the Yellow River Delta( In Chinese). Acta Pedologica Sinica,2015,52(6):1262—1272
[11] 刘璐,何寻阳,谢强,等. 桂西北喀斯特常见豆科植物根瘤菌的遗传多样. 应用生态学报,2015,26(12):3663—3669 Liu L,He X Y,Xie Q,et al. Genetic diversity of rhizobia isolated from common legumes in the Karst area Northwest Guangxi(In Chinese). Chinese Journal of Applied Ecology,2015,26(12):3663—3669
[12] Bokulich N A,Subramanian S,Faith J J,et al.Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing. Nature Methods,2013,10(1):57—59
[13] Caporaso J G,Kuczynski J,Stombaugh J,et al.QIIME allows analysis of high-throughput community sequencing data. Nature Methods,2010,7(5):335—336
[14] 游偲,张立猛,计思贵,等. 枯草芽孢杆菌菌剂对烟草根际土壤细菌群落的影响. 应用生态学报,2014,25(11):3323—3330 You C,Zhang L M,Ji S G,et al. Impact of biocontrol agent Bacillus subtilis on bacterial communities in tobacco rhizospheric soil(In Chinese). Chinese Journal of Applied Ecology,2014,25(11):3323—3330
[15] 王伏伟,王晓波,李金才,等. 施肥及秸秆还田对砂姜黑土细菌群落的影响. 中国生态农业学报,2015,23(10):1302—1311 Wang F W,Wang X B,Li J C,et al. Effects of fertilization and straw incorporation on bacterial communities in lime concretion black soil(In Chinese). Chinese Journal of Eco-Agriculture,2015,23(10):1302—1311
[16] 柳春林,左伟英,赵增阳,等. 鼎湖山不同演替阶段森林土壤细菌多样性. 微生物学报,2012,52(12):1489—1496 Liu C L,Zuo W Y,Zhao Z Y,et al. Bacterial diversity of different successional stage forest soils in Dinghushan( In Chinese). Acta Microbiologica Sinica,2012,52(12):1489—1496
[17] Li T,Long M,Gatesoupe F J,et al. Comparative analysis of the intestinal bacterial communities in different species of carp by pyrosequencing. Microbial Ecology,2014,69(1):25—36
[18] 杨菁,周国英,田媛媛,等. 降香黄檀不同混交林土壤细菌多样性差异分析. 生态学报,2015,35(24):8117—8127 Yang J,Zhou G Y,Tian Y Y,et al. Differential analysis of soil bacteria diversity in different mixed forests ofDalbergia odorifera(In Chinese). Acta Ecologica Sinica,2015,35(24):8117—8127
[19] 杜滢鑫,谢宝明,蔡洪生,等. 大庆盐碱地九种植物根际土壤微生物群落结构和功能多样性. 生态学报,2016,36(3):740—747 Du Y X,Xie B M,Cai H S,et al. Structural and functional diversity of rhizosphere microbial community of nine plant species in the Daqing Saline-alkali soil region(In Chinese). Acta Ecologica Sinica,2016,36(3):740—747
[20] Steenwerth K L,Jackson L E,Calderon F J,et al.Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California. Soil Biology & Biochemistry,2002,34(11):1599—1611
[21] 于翠,吕德国,秦嗣军,等. 本溪山樱根际与非根际解磷细菌群落结构及动态变化. 应用生态学报,2006,17(12):2381—2384 Yu C,Lü D G,Qin S J,et al. Community structure and its dynam ics of phosphobacteria inCerasus sachalinensisrhizosphere and non-rhizosphere(In Chinese). Acta Ecologica Sinica,2006,17(12):2381—2384
[22] Walker T S,Bais H P,Grotewold E,et al. Root exudation and rhizosphere biology. Plant Physiology,2003,132(1):44—51
[23] 吴林坤,林向民,林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望. 植物生态学报,2014,38(3):298—310 Wu L K,Lin X M,Lin W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates( In Chinese). Chinese Journal of Plant Ecology,2014,38(3):298—310
[24] 隋心,张荣涛,钟海秀,等. 利用高通量测序对三江平原小叶章湿地土壤细菌多样性的研究. 土壤,2015,47(5):919—925 Sui X,Zhang R T,Zhong H X,et al. Study on bacterial diversity ofDeyeuxia angustifoliawetland by application of High-throughput sequencing technology in Sanjiang Plain(In Chinese). Soils,2015,47(5):919—925
[25] Schabereiter G C,Saiz J C,Pinar G,et al. Altamira cave Paleolithic paintings harbor partly unknown bacterial communities. FEMS Microbiology Letters,2002,211(1):7—11
Bacterial Structure and Diversity of Rhizosphere and Bulk Soil ofRobinia pseudoacaciaForests in Yellow River Delta
DING Xinjing1,2,3JING Ruyan1HUANG Yali1CHEN Bojie1MA Fengyun1†
(1Forestry College of Shandong Agricultural University,Laboratory of Ecology and Environment,Shandong Agricultural University,Taian,Shandong271018,China)
(2Northwest Institute of Eco-Environment and Resources,Chinese Academy of Sciences,Lanzhou730000,China)
(3University of Chinese Academy of Sciences,Beijing100049,China)
【Objective】 As one of the three major pedogenic river deltas in China and the one that develops the fastest,the Yellow River Delta is an important reserved land resource. Developing mixed forests has been becoming a major strategy to develop the Yellow River Delta,because mixed forests can not only regulate temperature but also improve soil fertility. To improve the ecological system of the Yellow River Delta,a number of forest plantations have been established since the 1950s.Robinia pseudoacaciais the dominant tree species in most of the forest plantations,which contribute significantly to conserving soil and water and improving the ecological system of the Delta. Soil microbial community in plant rhizosphere plays an important role in plant nutrition and plant health. This research aimed to accurately evaluate how soil bacterial communities colonize in rhizosphere and in bulk soils underRobinia pseudoacaciain the Yellow River Delta. 【Method】 With the aid of the Illumina MiSeq technology,this research analyzed structure and diversity of the bacterial communities in the rhizosphere soil and the bulk soil underRobinia pseudoacaciafor comparison. The differences in soil bacterial community between rhizosphere and bulk soil were expressed via the Weighted Unifrac Range of OTUs. 【Result】Results show that the bacterial community in the rhizosphere soil consisted of 214 genera of 36 phyla and that in the bulk soil 153 genera of 33 phyla. Proteobacteria,Actinobacteria and Acidobacteria were the dominant phyla of bacteria in both rhizosphere and bulk soils with relative abundance being more than 15%. Acidobacteria and Nitrospirae varied sharply in relative abundance between the rhizosphere soil and the bulk soil. Chloroflexi,Gemmatimonadetes,Planctomycetes,Nitrospirae,and Verrucomicrobia were the dominant taxa of bacteria with relative abundance being more than 1%.Rhodoplanes,Lysobacter,ThermomonasandStreptomycesin the rhizosphere soil andRhodoplanes,Lysobacter,StreptomycesandKaistobacterin the bulk soil all exceeded 4% in relative abundance. There were 29 and 32 genera of bacteria in the rhizosphere soil and 3 in the bulk soil being more than 1% in relative abundance,respectively. Significant differences were found in relative abundance ofNovosphingobium,Aeromicrobium,Limnohabitans,Phycicoccus,aistobacter,Candidatus Nitrososphaera,DA101,Ramlibacter,andMethylibiumbetween the rhizosphere soil and the bulk soil. Relative abundance ofAzotobacterwas significantly higher in the rhizosphere soil than in the bulk soil,while no significant difference was observed in relative abundance of potassium and phosphorus-dissolving bacteria between the two soils. Chao richness of bacterial community was 2 054 and 2 376 in the rhizosphere soil and in the bulk soils,respectively,showing a significant difference. Weighted Unifrac Range mof the soil bacteria between the rhizosphere and the bulk soil was 0.12~0.25. In this study,all the findings demonstrate that there are some differences in structure between the bacterial communities in the rhizosphere soil and in the bulk soil underRobinia pseudoacaciain Yellow River Delta. 【Conclusion】Significant differences do exist in relative abundance of Proteobacteria,Acidobacteria,and Nitrospirae at the phylum level,andNovosphingobium,Aeromicrobium,Limnohabitans,andPhycicoccusat the genus level between rhizosphere and bulk soils,and significant differences are also observed in bacterial diversity between rhizosphere and bulk soils. Analysis of bacteria 16S rRNA-bacteria dataset shows differernces in structure and diversity of soil bacterial community between the rhizosphere and bulk soila in the Yellow River Delta. But further research is still needed to get more detailed information about soil microorganisms.
Yellow River Delta;Robinia pseudoacacia;Rhizosphere;Bacteria;Diversity
S154.36;S792
A
10.11766/trxb201703230510
* 国家自然科学基金项目(30970499)和世界银行贷款项目( SEAP-KY-2)共同资助 Supported by the National Natural Science Foundation of China(No. 30970499)and the World Bank Loan Project(No. SEAP-KY-2)
† 通讯作者 Corresponding author:马风云,副教授,主要研究方向为生态恢复和重建研究。E-mail:sdmfy@sdau.edu.cn
丁新景(1990—),男,山东菏泽人,硕士研究生,主要从事林业生态工程研究。Tel:18854889053;E-mail:18854889053@163.com
2017-03-23;
2017-05-05;优先数字出版日期(www.cnki.net):2017-06-20
(责任编辑:卢 萍)