电离辐射对肺腺癌细胞A549早衰的影响*
2017-11-01李至荟封江彬李峰生蔡恬静田雪蕾周丁华刘青杰
李至荟 封江彬 李峰生 陆 雪 蔡恬静 李 爽 赵 骅 田雪蕾 周丁华 刘青杰 高 玲*
电离辐射对肺腺癌细胞A549早衰的影响*
李至荟①封江彬②李峰生③陆 雪②蔡恬静②李 爽②赵 骅②田雪蕾②周丁华③刘青杰②高 玲②*
目的:探究不同剂量X射线对肺腺癌细胞A549早衰的影响,为辐射诱导细胞早衰机制的探索提供理论依据。方法:采用不同剂量X射线照射肺腺癌细胞A549,按照X射线吸收剂量情况将实验分为对照组和照射组,对照组X射线吸收剂量为0 Gy,照射组的X射线吸收剂量分别为2 Gy、4 Gy和8 Gy。利用克隆形成率实验检测细胞增殖能力变化,吉姆萨染色观察细胞形态,利用溶酶体红色荧光探针Lyso-Tracker Red检测A549细胞的溶酶体数量变化,ß-半乳糖苷酶染色检测早衰细胞。结果:照射组吸收剂量为2 Gy、4 Gy和8 Gy的A549增殖能力降低,与对照组比较差异有统计学意义(F=186.45,P<0.05),且部分细胞体积变大,溶酶体数量增多,细胞出现早衰。结论:X射线可引起A549细胞增殖能力降低,溶酶体数量增加等细胞早衰症状。
X射线;肺腺癌细胞;早衰
早熟衰老或早衰是指细胞在非端粒信号刺激下发生增殖能力和生理功能下降,是细胞在生长、发育的过程中,形态和功能发生变化,提前出现退行性改变,这种形式的衰老与端粒缩短无关,也与细胞增殖代数无关,即病理性衰老。能够诱导细胞早衰的刺激因素包括DNA受损、氧化应激和一些致癌基因的表达变化等[1-5]。早熟衰老的肿瘤细胞并不立即死亡,甚至可以在较长的时间内仍具有存活力,但却失去了增殖与转移的能力。按着这种特性实施的以细胞衰老为靶标的治疗,虽然在缩小肿瘤体积方面的作用不强,但可通过带瘤生存的方式显著延长肿瘤患者的生存时间。因此,诱导肿瘤细胞的早衰是一个很有研究前景的新的肿瘤治疗策略[6]。本研究探究不同剂量X射线对肺腺癌细胞A549早衰的影响,旨在为辐射诱导细胞早衰机制的探索提供理论依据。
1 材料与方法
1.1 仪器与试剂
(1)Precise直线加速器(瑞典Elekta公司)。
(2)特级胎牛血清和高糖培养基(dulbecco's modified eagle medium,DMEM)。培养基购自美国GIBCO公司;D-Hank's缓冲液、甲醛溶液、姬姆萨染色液和磷酸盐缓冲液(phosphate buffer solution,PBS)均为本实验室配制;溶酶体红色荧光探针Lyso-Tracker Red试剂盒和ß-半乳糖苷酶染色试剂盒购自上海碧云天公司;人肺腺癌细胞A549购自北京协和医学院细胞库。
1.2 细胞培养与分组
(1)细胞培养。细胞株采用含有10%灭活胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养液培养。
(2)分组。按照X射线吸收剂量情况将实验分为对照组和照射组,对照射组的X射线吸收剂量为0 Gy,照射组的X射线吸收剂量分别为2 Gy、4 Gy和8 Gy。
1.3 X射线照射
X射线照射使用Precise直线加速器产生的X射线单次照射细胞,源靶距为100 cm,能量为6 MV,照射组吸收剂量分别为2 Gy、4 Gy和8 Gy,采用电离室进行剂量校准。
1.4 克隆形成率实验
常规消化指数生长期的细胞,用DMEM培养液悬成单细胞后置于10 ml离心管中,密封照射,两组细胞分别接种后置于5 ml预温37 ℃培养液的60 mm培养皿中,接种500个细胞。以十字方向轻轻晃动培养皿,使细胞分散均匀。将培养皿移入CO2培养箱,在温度为37 ℃、CO2体积分数为5%和湿度为95%的环境下静置培养7 d后终止培养。用预温的D-Hank's缓冲液洗涤2遍后再用甲醇固定20 min,去甲醇,姬姆萨染色液染色15 min,冲洗晾干后解剖显微镜下计数克隆数,计算克隆形成率(colony forming efficiency,CFE)为公式1:

计算存活分数(survival fraction,SF)为公式2:

1.5 溶酶体红色荧光探针Lyso-Tracker Red染色实验
取少量Lyso-Tracker Red按照1∶20000的比例加入到细胞培养液中,使最终浓度为75 nmol/LnM。
使用前37 ℃预温育。去除细胞培养液,加入1 ml配制好的并37 ℃预温育的Lyso-Tracker Red染色工作液,与细胞37 ℃共孵育60 min。去除Lyso-Tracker Red染色工作液,加入新鲜的细胞培养液,用荧光显微镜进行观察,可观察到溶酶体呈明亮红色荧光染色。
1.6 β-半乳糖苷酶染色实验
将在6孔板中培养的细胞吸除细胞培养液,用PBS洗涤1次,加入1 mlβ-半乳糖苷酶染色固定液,室温固定15 min。吸除细胞固定液,用PBS洗涤细胞3次,每次3 min。吸除PBS每孔加入1 ml染色工作液,于37 ℃孵育过夜,用保鲜膜封住6孔板防止蒸发。在普通光学显微镜下观察拍摄。
1.7 统计学方法
应用SPSS 12.0统计软件进行数据处理,数据符合正态分布,两组比较采用独立样本,每个照射组均与对照组配对,照射组与对照组之间的比较采用单因素方差分析,以α=0.05为检验水准,以P<0.05为差异有统计学意义。
2 结果
2.1 不同剂量X射线照射对细胞增殖的影响
不同剂量X射线照射后,细胞增殖能力均受到显著抑制,照射组中吸收剂量为2 Gy时克隆形成率是对照组的67%,吸收4 Gy时细胞增殖能力降低50%,是对照组的49%,吸收8 Gy时克隆形成率仅是对照组的25%,两组细胞增殖能力比较,其差异有统计学意义(F=186.45,P<0.05),见表1。
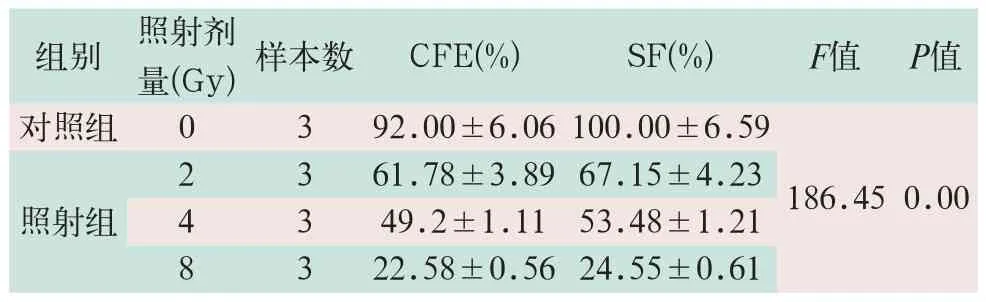
表1 克隆形成率检测不同剂量X射线对A549细胞增殖的影响(%,x-±s)
2.2 不同剂量X射线照射对细胞形态的影响
经X射线照射后的A549细胞,利用姬姆萨染色液染色后在显微镜下观察其细胞形态学改变,照射组吸收剂量为2 Gy、4 Gy和8 Gy的细胞形状均变大、变平,并且随着剂量的增大,其形态学变化越明显, 如图1所示。

图1 两组不同剂量X射线照射后A549细胞形状变化(姆萨染色,×100)
2.3 不同剂量X射线照射对细胞溶酶体的影响
溶酶体数量的变化是早衰的另一个特征,因此,利用溶酶体红色荧光探针Lyso-Tracker Red检测照射后A549细胞的溶酶体数量变化,照射后细胞内溶酶体红色荧光显示,溶酶体数量增多,如图2所示。

图2 溶酶体红色荧光探针检测X射线照射A549细胞后细胞胞内溶酶体数量的改变(Lyso-Tracker Red染色,×100)
2.4 不同剂量X射线照射对细胞衰老的影响
利用ß-半乳糖苷酶染色实验检测两组经X射线照射后A549细胞中的早衰细胞比例。照射组吸收剂量分别为2 Gy、4 Gy和8 Gy;对照组为0 Gy,A549细胞中出现部分早衰细胞,但两组间差异无统计学意义(如图3所示)。

图3 ß-半乳糖苷酶染色检测不同剂量电离辐射照射A549细胞后早衰细胞(ß-半乳糖苷酶染色,×100)
3 讨论
在众多的衰老假说中,衰老蛋白质学说研究的较为充分。本研究表明,体内存在着衰老基因和抗衰老基因两类,相互作用调控细胞的衰老过程。多项研究表明,诱发细胞衰老的刺激信号主要有端粒脱帽、DNA损伤、氧化应激、癌基因过表达以及营养状况不良等[7]。
电离辐射诱导的早衰取得了部分进展,有研究结果表明,电离辐射可诱导乳腺癌MCF-7细胞和人间充质干细胞等发生早衰[8]。Wang等[9]的研究表明,吸收剂量为8 Gy的γ射线可诱导骨髓基质细胞经由p53/p21通路诱导细胞早衰。Kim等[10]发现,在肝癌细胞HepG2中,辐射诱导的细胞早衰不依赖于p53/p21通路,而是由p16介导。2013-2014年陆续有课题报道,辐射可诱发包括肺癌细胞在内的各种细胞发生早熟衰老,但其研究仅限于揭示早衰现象及检测下游早衰相关分子p53和p16等,而对其更上游的与放射损伤早期反应密切关联的调节机制还有待更深入的研究阐述[11-15]。
本研究结果表明,不同剂量X射线可引起肺腺癌细胞A549发生不同程度的早衰,出现一系列早衰的症状,具体表现为细胞增殖能力显著性降低,细胞形态变大变平,细胞内溶酶体数量增加,ß-半乳糖苷酶染色为蓝色阳性。对于X射线引起的肺腺癌细胞A549所发生的不同程度早衰需要开展进一步的研究,以阐明辐射引发的早衰上游信号通道。
[1]Ferrer I.Diversity of astroglial responses across human neurodegenerative disorders and brain aging[J].Brain Pathol,2017,27(5):645-674.
[2]Martínez-Zamudio RI,Robinson L,Roux PF,et al.SnapShot:Cellular Senescence Path-ways[J].Cell,2017,170(4):816-816.
[3]Hatanaka F,Ocampo A,Izpisua Belmonte JC.Keeping the Rhythm while Changing the Lyrics:Circadian Biology in Aging[J].Cell,2017,170(4):599-600.
[4]Aftab A,Shah AA.Behavioral Emergencies:Special Considerations in the Geriatric Psychiatric Patient[J].Psychiatr Clin North Am,2017,40(3):449-462.
[5]Morton L.Sexuality in the Older Adult[J].Prim Care,2017,44(3):429-438.
[6]Cerella C,Grandjenette C,Dicato M,et al.Roles of Apoptosis and Cellular Senescence in Cancer and Aging[J].Curr Drug Targets,2016,17(4):405-415.
[7]Jones KR,Elmore LW,Jackson-Cook C,et al.p53-Dependent accelerated senescence induced by ionizing radiation in breast tumour cells[J].Int J Radiat Biol,2005,81(6):445-458.
[8]Cmielova J,Havelek R,Soukup T,et al.Gamma radiation induces senescence in human adult mesenchymal stem cells from bone marrow and periodontal ligaments[J].Int J Radiat Biol,2012,88(5):393-404.
[9]Wang D,Jang DJ.Protein kinase CK2 regulates cytoskeletal reorganization during ionizing radiation-induced senescence of human mesenchymal stem cells[J].Cancer Res,2009,69(20):8200-8207.
[10]Kim TR,Lee HM,Lee SY,et al.SM22αinduced activation of p16INK4a/retinoblastoma pathway promotes cellular senescence caused by a subclinical dose of γ-radiation and doxorubicin in HepG2 cells[J].Biochem Biophys Res Commun,2010,400(1):100-105.
[11]Luo H,Yount C,Lang H,et al.Activation of p53 with Nutlin-3a radiosensitizes lung cancer cells via enhancing radiation-induced premature senescence[J].Lung Cancer,2013,81(2):167-173.
[12]Luo H,Wang L,Schulte BA,et al.Resveratrol enhances ionizing radiation-induced premature senescence in lung cancer cells[J].Int J Oncol,2013,43(6):1999-2006.
[13]Azad A,Bukczynska P,Jackson S,et al.Co-targeting deoxyribonucleic aciddependent protein kinase and poly (adenosine diphosphate-ribose) polymerase-1 promotes accelerated senescence of irradiated cancer cells[J].Int J Radiat Oncol Biol Phys,2014,88(2):385-394.
[14]Beach TA,Johnston CJ,Groves AM,et al.Radiation induced pulmonary fibrosis as a model of progressive fibrosis:Contributions of DNA damage,inflammatory response and cellular senescence genes[J].Exp Lung Res,2017,43(3):134-149.
[15]McRobb LS,McKay MJ,Gamble JR,et al.Ionizing radiation reduces ADAM10 expression in brain microvascular endothelial cells undergoing stressinduced senescence[J].Aging(Albany NY),2017,9(4):1248-1268.
Effect of ionizing radiation on premature senility of human lung adenocarcinoma A549
LI Zhi-hui, FENG Jiang-bin, LI Feng-sheng, et al//
China Medical Equipment,2017,14(10):134-136.
Objective: To investigate the effect of different dosages X-ray for premature senility of lung adenocarcinoma cell line A549, and provide the theoretical basis for exploring the radiation-induced mechanism of premature senility. Methods: Different dosages X-ray were adopted to radiate lung adenocarcinoma A549 cells, and all of A549 cells were divided into control group and radiation group as the adsorbed dosage of X-ray. The adsorbed dosage of control group was 0 Gy, and the adsorbed dosages of three radiation groups were 2 Gy, 4 Gy and 8 Gy, respectively. The cloning efficiency experiment was used to detect the change of cell proliferative capacity,and giemsa staining was used to observe the change of cellular morphology, and lysosome red fluorescence probe(Lyso-Tracker Red) was used to detect the change of lysosome amount. Besides, β-galactosidase staining was used to detect cell of premature senility. Results: The proliferative capacities of A549 in all of radiation groups were decreased, and the differences of proliferative capacities between three radiation groups and control group were statistically significant (F=186.45, P<0.05). Besides, in some cells of radiation groups, the volume of cell became larger, the amount of lysosome was increase and these cell appeared premature senility. Conclusion: X-ray can lead to some symptoms of cellular premature senility include the decrease of proliferative capacity of A549 cell and the increase of lysosome amount.
X-ray; Lung adenocarcinoma cell; Premature senility
Department of General Surgery, The Second Clinical Medical College of Shanxi Medical University, Taiyuan 030001, China.
10.3969/J.ISSN.1672-8270.2017.10.039
李至荟,男,(1990- ),硕士研究生,山西医科大学第二临床医学院,研究方向:肝胆胰诊疗。
2017-06-29
1672-8270(2017)10-0134-03
R811.5
A
国家自然科学基金面上项目(31570852)“ STAT3调控caveolin-1介导的抗早衰在肿瘤辐射抗性中的作用及机制研究”
①山西医科大学第二临床医学院 山西 太原 030001
②中国疾病预防控制中心辐射防护与核应急中国疾病预防控制中心重点实验室 北京 100088
③火箭军总医院肝胆外科 北京 100088
*通讯作者:gaolingxinxin@126.com