Rab7介导线粒体和溶酶体互作机制新进展
2020-12-09陈研色潘庆军刘华锋王淑君
陈研色,潘庆军,刘华锋,王淑君
(湛江市慢性肾脏病防控重点实验室,广东医科大学附属医院肾脏疾病研究所,广东 湛江 524001)
近年,细胞器在物理和功能层面相互作用成为新的研究领域,随之,线粒体与溶酶体的相互作用也被科学家逐渐认识。溶酶体不仅是细胞中物质的降解中心,更是许多物质代谢过程和细胞生长的重要代谢传感器[1],类似的,线粒体也作为决定细胞的命运的主要的代谢中心被科学家重新认识[2]。两者通过细胞器间的相互作用,在维持正常细胞代谢起重要作用。溶酶体与线粒体功能障碍或相互作用异常与多种疾病相关,包括2型腓骨肌萎缩症[3]、溶酶体贮积症[4]和多种神经退行性病变[5]。
目前,溶酶体与线粒体也被认识到对细胞代谢具有共同的调节作用,并且两者可通过以下方式发生相互作用,例如:细胞通过选择性自噬机制清除受损伤或不需要的线粒体的过程[6],即线粒体自噬,在此过程中,损伤的线粒体通过与溶酶体融合并被溶酶体降解;在线粒体应激时,线粒体包裹线粒体外膜、内膜或者基质的蛋白载体以发芽的方式形成囊泡,其最终与溶酶体结合,使传递至溶酶体的氧化产物得到清除而维持了线粒体以及细胞的稳态[7];通过形成线粒体-溶酶体的膜接触点维持两者的动态平衡[8]。
Rab7是调控早期内体向晚期内体的成熟、晚期内体向溶酶体的转运与融合进程中重要的分子[9]。目前,发现Rab7通过参与线粒体自噬体的形成[10]、线粒体自噬体与溶酶体的融合[10]和调节线粒体-溶酶体的接触与解离[11]等过程进而在调节两者相互作用起重要作用,因此,本文综述了Rab7在线粒体与溶酶体相互交谈中的作用(见图1),为线粒体与溶酶体功能障碍性疾病发生以及防治提供理论依据。
1 Rab7的主要作用和功能
Rab蛋白属于GTP酶家族,主要参与膜的转运过程[9]。Rab7是Rab家族中的一种小G蛋白,哺乳动物有两种Rab7,分别是Rab7a和Rab7b,两者有50%的同源性,在膜转运的不同的阶段起作用,Rab7a(NCBI核酸序列号NM-004637;酵母ypt7p的同源基因)主要位于晚期核内体,调节早期核内体向晚期核内体以及晚期内体向溶酶体的转运,Rab7b则主要负责核内体向高尔基体的转运[9]。本文重点介绍Rab7a亚型,以下简称Rab7。
目前对Rab7在内吞途径的作用研究较为具体[12],Rab7通过替换Rab家族的另一个成员Rab5,参与晚期内体的成熟过程,Rab7与下游效应因子Rab7-溶酶体相互作用蛋白(Rab7-interacting lysosomal protein, RILP)及同型融合及液泡蛋白分选复合物(homotypic fusion and vacuole protein sorting complex, HPOS)相互作用调节内体和溶酶体融合过程。Rab7通过与RILP或FYVE与卷曲螺旋结构域蛋白1(Fab1-YotB-Vac1P-EEA1 and coiled-coil domain containing 1, FYCO1)分别参与内体在微管上的负向和正向运输。显然, Rab7是调控早期内体向晚期内体的成熟、晚期内体向溶酶体的转运与融合进程中重要的分子。
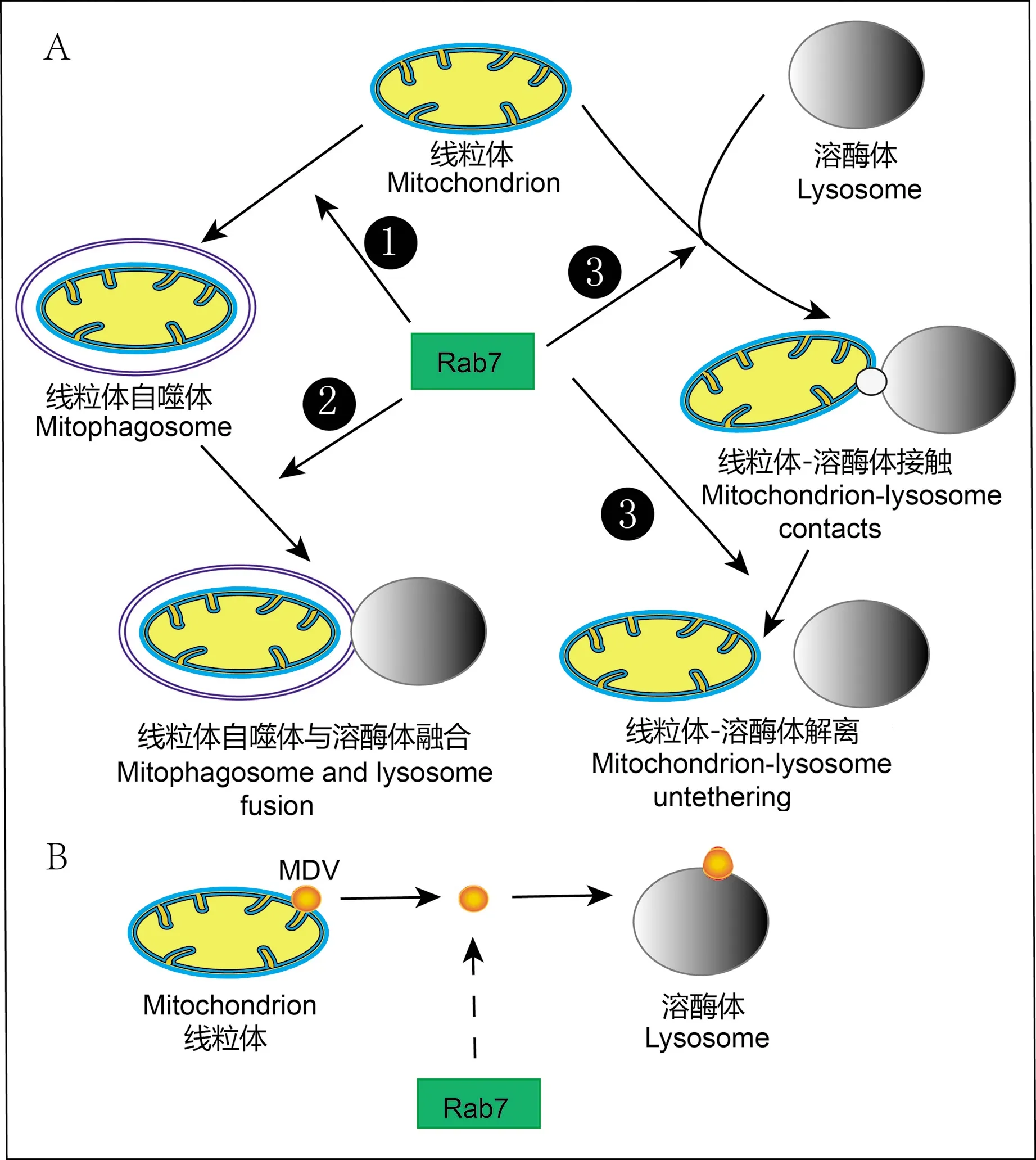
注:A: Rab7蛋白参与了线粒体和溶酶体相互调节过程中的关键环节,包括调控线粒体自噬体形成,促进线粒体自噬体与溶酶体融合以及促进线粒体-溶酶体接触与解离的过程。B: Rab7调节MDV(线粒体衍生的囊泡)的过程有待进一步明确。图1 Rab7在线粒体与溶酶体交互调节中的作用示意图Note. A, Rab7 is involved in a key link in the mutual regulation of mitochondria and lysosomes, including regulating the formation of mitophagosomes, promoting the fusion of mitophagosomes and lysosomes and promoting the process of mitochondria-lysosomes contacts and dissociation.B, The process by which Rab7 regulates MDV (mitochondrial-derived vesicles) needs to be further clarified.Figure 1 Schematic diagram of the role of Rab7 in the interactive regulation of mitochondria and lysosomes
2 线粒体-溶酶体互作
线粒体是细胞进行有氧呼吸与能量代谢的主要场所,通过合成ATP为细胞提供能量,除此以外,也是钙、铁、脂质等物质的储存场所,并且参与细胞信号传导与程序性细胞凋亡的过程[2]。另一方面,溶酶体是真核细胞重要降解与回收的中心,具有单层膜结构并富含60多种酸性水解酶[1]。溶酶体通过降解而回收外源性和细胞内异常的大分子物质,为细胞提供氨基酸、脂质等营养物质,可以存储钙和铁离子,并且参与细胞凋亡,分泌,免疫防御,质膜修复,细胞信号传导和能量代谢等细胞过程[1]。因此,线粒体与溶酶体在维持细胞稳态起重要的作用。
近年来,研究发现在帕金森、阿尔茨海默病和肌萎缩性脊髓侧索硬化症等神经退行性病变中同时出现溶酶体和线粒体功能异常[5],而线粒体功能受损时可促发溶酶体损伤[13],溶酶体功能受损时也可反过来促发线粒体功能异常[14]。这些证据,均提示溶酶体与线粒体可能存在相互作用,事实上,已有研究证实溶酶体与线粒体可通过以下几种方式相互发生交谈。
2.1 线粒体自噬
有核细胞在饥饿及应激状态下,通过双层膜结构包裹待降解物质形成自噬体,并最终与溶酶体结合形成自噬溶酶体,其包裹的内容物在溶酶体酶的作用下被降解的过程,称为自噬[15]。而在细胞应激时,细胞通过选择性自噬机制清除受损伤或不需要的线粒体,这一过程称为线粒体自噬[6]。各种病理因素作用下,线粒体受损出现内膜持续去极化,从而使PTEN诱导的PINK1在线粒体外膜稳定表达。PINK1磷酸化线粒体外膜蛋白Mfn2,反过来可招募Parkin至线粒体外膜并使相关的蛋白发生泛素化,后被泛素化结合蛋白p62标记后形成自噬体,最后与溶酶体结合清除损伤线粒体,这是PINK1/Parkin介导的线粒体自噬途径[6]。除此以外,线粒体相关受体,包括AMBRA1[16],FUNDC1[17]和Nix/BNIP3L也相继被发现,这些线粒体相关受体通过与LC3的相互作用区域(LC3 interacting region, LIR)发生相互作用,使得线粒体逐渐被自噬小泡包裹。而在线粒体自噬终末端,溶酶体与以上途径形成的自噬小体融合,在此过程中溶酶体与线粒体相互作用是保证受损线粒体被降解与清除最关键步骤。
2.2 线粒体衍生的囊泡(mitochondrial-derived vesicles, MDVs)
MDVs是实现线粒体与溶酶体之间进行分子转移及相互作用的另一种非依赖经典自噬通路途径[7]。线粒体应激时,线粒体选择性包裹线粒体外膜、内膜或者基质的蛋白载体以发芽的方式形成囊泡的过程称为MDVs。MDVs的形成与线粒体自噬有相似之处,同样需要PINK1募集并活化线粒体外膜的Parkin[18],但沉默自噬的主要元素Atg5, Beclin-1或Rab9,线粒体仍可形成MDVs,并且MDVs与LC3不发生共定位,说明MDVs的产生不依赖于经典自噬途径[18-19]。MDVs形成后最终通过与溶酶体结合,使传递至溶酶体的氧化产物得到清除而维持了线粒体以及细胞的稳态。
2.3 mTOR/TFEB调控体系
转录因子EB(transcription factor EB, TFEB)与溶酶体基因启动子区域CLEAR(coordinated lysosomal expression and regulation)网络相连,可使溶酶体相关基因表达增高,从而增强溶酶体的生物合成及功能[20]。近年来研究发现,TFEB也可调控线粒体的生成,过表达TFEB可促进调节线粒体生成的转录因子PGC1-α(peroxisome proliferative activated receptor-γ (PPARγ) co-activator 1α)的mRNA水平与蛋白的表达,沉默TFEB抑制了PGC1-α的表达与线粒体蛋白的生成,说明TFEB可通过PGC1-α依赖的途径促进线粒体生成[21]。除此以外,研究发现过表达TFEB的小鼠线粒体生成相关基因NRF1,NRF2和TFAM的表达增加,并且,沉默PGC1-α不影响NRF1,NRF2和TFAM的表达,说明TFEB还可通过非依赖PGC1-α的途径促进线粒体生成与功能[22]。
此外,TFEB主要受哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)磷酸化调节,在细胞营养缺乏时,溶酶体信号复合物Rag GTPase(Rags)失活,哺乳动物雷帕霉素靶蛋白复合物C1(mammalian target of rapamycin complex 1, mTORC1)从溶酶体上解离,从而导致TFEB/14-3-3分离及去磷酸化入核结合CLEAR网络,进而启动溶酶体生成[23]。研究发现,在神经细胞,抑制mTORC1可促进线粒体应激与调节线粒体活性[24]。说明,线粒体与溶酶体有共同的调控体系。
2.4 线粒体-溶酶体接触点
细胞器间的膜接触点是指两个不同的细胞器的膜之间形成的紧密接触,使它们能够在细胞内进行互相交流[25]。内质网与其它细胞器包括:质膜、高尔基体、线粒体、过氧化物酶体、脂滴以及核内体的相互作用早见报道[25],但近年研究发现除外内质网的其它细胞器间,如溶酶体、脂滴和过氧化物酶体等细胞器间也存在接触[26]。
线粒体-溶酶体的膜接触点即是线粒体与溶酶体的膜之间形成的紧密接触,使两者能在细胞内进行信息交流[8]。目前,多项研究利用电子成像技术证实了在健康状态下多种细胞类型线粒体和溶酶体之间形成接触点[11, 27-28],线粒体-溶酶体接触点在线粒体与溶酶体膜之间平均距离约为10 nm[11],大约15%的溶酶体在任意时间可与线粒体形成接触点,两者稳定的平均接触时间约60 s[11],甚至可延长到13 min[29]。在线粒体-溶酶体膜接触点之间,未观察到溶酶体内容物、线粒体基质蛋白或跨膜蛋白转移,并且自噬或线粒体自噬发生的生物标记物ULK1、Atg5、Atg12、LC3不表达[11],沉默自噬相关受体(NDP52、OPTN、NBR1、TAX1BP1和p62)不影响线粒体-溶酶体膜接触点形成[30],显然,线粒体-溶酶体膜接触点形成是区别于线粒体自噬的独立事件。
线粒体-溶酶体的相互作用既确保两者动态平衡,也在维持细胞稳态中具有重要的意义。然而,线粒体-溶酶体的相互作用的机制尚未明确。近年来,研究发现Rab7也在上述线粒体-溶酶体相互作用进程中起关键的作用,Rab7是调节线粒体自噬体与线粒体-溶酶体接触位点形成的重要分子之一。
3 Rab7参与线粒体自噬体的形成
学者们最初在A群链球菌的感染中发现Rab7在早期阶段自噬溶酶体样空泡形成起重要作用[31],A型链球菌通过内吞途径进入细胞,正常状态下,从内体逃逸出来的链球菌被自噬体捕获后与溶酶体融合形成自噬溶酶体[31],沉默Rab7抑制了A型链球菌感染过程中自噬溶酶体空泡形成[32],这提示Rab7参与了自噬体的形成。
线粒体自噬是一种通过选择性地清除受损伤或不需要线粒体的自噬途径。PINK1/Parkin线粒体自噬的主要途径,PINK1和Parkin蛋白是在哺乳动物的线粒体自噬过程中两个重要蛋白,当线粒体损伤,线粒体膜电位下降而引起PINK1蛋白在损伤线粒体积累,进而招募Parkin蛋白使线粒体外膜蛋白发生泛素化,从而介导线粒体自噬的发生[6]。那么,Rab7是否参与PINK1/Parkin介导的线粒体自噬过程呢?首先,有学者发现沉默Rab7a可显著的影响线粒体的清除,而表达Rab7a可恢复对线粒体的清除。继之,Yamano等[33]发现Rab7在线粒体自噬体的早期形成阶段起调节作用。TBC1D15 和TBC1D17均为Rab7的GTP酶活化蛋白(Rab-GAP),TBC1D15既可通过与线粒体分裂蛋白Fis 1结合与线粒体相关联,并可与LC3/GABARAP/Atg8家族蛋白相互作用而与自噬体相关联[34-35]。有趣的是,研究发现在PINK1/Parkin介导的线粒体自噬途径中,沉默TBC1D15或Fis1细胞中大量的自噬泡包绕着损伤的线粒体但是并未与线粒体结合[33],提示Rab7失活可能参与了早期线粒体自噬体形成。而Parkin活化后反作用于下游效应因子TBC1D15,后者通过与线粒体外膜蛋白fission1(FIS1)及Atg8家族成员GABARAP相互作用抑制Rab7a活性,从而调控线粒体自噬过程中自噬泡的生成与线粒体形态[33]。同时,TBC1D15的同源蛋白TBC1D17,也同样被证实通过与TBC1D15形成同源二聚体,进一步与FIS1蛋白结合而参与线粒体自噬过程[33],说明,Rab7a调控了线粒体自噬体生成。
此外,在缬氨霉素诱导的线粒体自噬中发现[36],损伤的线粒体可招募Rab7a与MON1/CCZ1而形成MON1/CCZ1Rab7a GEF复合体,不仅如此,Rab7a上游的两个Rab家族成员Rab5和其鸟嘌呤核苷酸交换分子(guanine nucleotide exchange factor, GEF)RabeX-5也被同时招募至损伤的线粒体。其中,RabeX-5的线粒体招募依赖于Parkin活化。RabeX-5活化Rab5后进而作用于其效应因子MON1/CCZ1,反过来可使Rab7a被招募至损伤线粒体。还有研究表明,Rab7也可通过Rab7的效应器异源五聚体运输复合物(retromer trafficking complex, Retromer)和Rab7a的下游GTP活化蛋白TBC1D5相互作用调控线粒体自噬[37]。针对Retromer 和TBC1D5如何调控线粒体自噬,学者在线粒体自噬进程[38],观察到Rab7a包绕Pakin或线粒体外膜蛋白(translocase of outer membrane 20, TOM20)标记的损伤线粒体结构,而当沉默Retromer的亚基VPS29或VPS35,则未能观察到此现象,说明TBC1D5与Retromer的亚基VPS29或VPS35结合从而反过来抑制Retromer活性而发挥相互作用。说明,Rab7在线粒体自噬体早期形成的阶段具有重要的意义,此过程需要PINK1、 Parkin、 TBC1D15、 TBC1D17和Retromer等蛋白的协同。
4 Rab7参与线粒体自噬体与溶酶体的融合过程
受Rab7在内体转运与融合作用的启发,Rab7调节自噬体与溶酶体的融合也被学者广泛研究。首先,学者们在沉默Rab7的真核细胞中发现自噬泡与溶酶体融合受阻导致出现大量自噬泡堆积[39],随后,Rab7参与自噬体与溶酶体融合的机制也被深入研究。有学者发现,自噬体形成后通过与溶酶体的融合降解其内容物,可溶性N-乙基马来酰亚胺敏感的融合蛋白(N-ethyl-maleimide-sensitive fusion protein, NSF)附着蛋白(soluble NSF attachment protein, SNAP)受体(SNAP receptors, SNARE)可创建膜的开口,并通过与同源融合和蛋白分选(homotypic fusion and protein sorting,HOPS)复合体及Rab7集合,这确保了相邻的自噬体与溶酶体有效的融合[40]。有研究表明,Rab7/Ypt7还可通过Vps41和Vps39与HOPS形成的Rab7/Ypt7-HOPX复合体桥接2个融合膜,促进启动阶段自噬体与溶酶体的融合[41]。此外,Rab7通过与EPG5和R-SNARE VAMP7-VAMP8蛋白相互作用形成STX17-SNAP29复合体而促使自噬体与溶酶体的粘附融合[42]。因此,Rab7参与自噬体与溶酶体融合。
线粒体自噬体-溶酶体的融合进程与自噬体-溶酶体并非完全相同,最早,Yamano等[33,36]学者在线粒体自噬过程中观察到沉默Rab7可使损伤的线粒体不能被自噬体包裹。ATG9A通常存在于细胞浆的囊泡结构中,而我们知道,这些含有ATG9A的囊泡或膜状结构是自噬溶酶体膜形成的主要来源,在线粒体自噬被诱导的过程中,ATG9A会被大量的募集到线粒体[43],然而,有研究发现,沉默Rab7损害了ATG9A在线粒体膜上的组装过程[44]。实际上,Rab7与ATG9a存在一定程度的相互作用,此过程主要受Retromer VPS35的调节。这些研究结果,均提示Rab7活性可能参与线粒体自噬体与溶酶体融合过程。近年还有学者进一步发现PINK1/Parkin依赖的线粒体自噬过程中,Rab7同样介导线粒体自噬体与溶酶体融合,在此过程中TBC1D15即GTPase活性起主要的调节作用[45-46]。因此,Rab7通过促进线粒体自噬体与溶酶体融合而参与线粒体溶酶体相互作用过程。
5 Rab7磷酸化与线粒体自噬的调节
Rab7的活性主要受翻译后修饰调节,例如S72位点丝氨酸-苏氨酸磷酸化修饰,与Y183位点酪氨酸磷酸化修饰[47]。有趣的是,学者们发现,Rab7 S72位点可被PTEN(phosphatase and tensin homolog)去磷酸化,而PTEN对线粒体自噬具有调节作用[48]。相似的,Rab7受TBK1(TRAF family-associated NF-κB activator binding kinase 1)磷酸化调节而促进PINK1/Pakin介导的线粒体自噬途径也被报道[49]。
Rab7 S72位点磷酸化减弱其与GDI以及GGT酶复合物的相互作用,另一方面,增强与FLCN-FNP1(folliculin and the folliculin-ineracting protein 1)蛋白的关联性。我们知道,FLCN-FNP1蛋白可被损伤的线粒体招募并促进PINK1/Parkin依赖的线粒体自噬过程[50-51],当在细胞中敲进Rab7 S72 A使Rab7发生突变不能磷酸化这一过程受到抑制。实际上,Rab7 S72 A不仅影响有效的线粒体自噬,也被证实影响ATG9阳性的自噬体包裹损伤线粒体,这说明了Rab7磷酸化也调节了线粒体自噬体的早期形成过程。
6 Rab7调节线粒体-溶酶体的接触与解离
近年,美国西北大学费恩伯格医学院的研究首次在形态学上发现线粒体与溶酶体存在直接的物理接触,为线粒体-溶酶体的相互交谈提出了新的见解,线粒体与溶酶体接触的形成可调节线粒体的分裂与溶酶体动态平衡,并且与两者间的物质转运有关[11]。此过程涉及多个线粒体与溶酶体膜蛋白的相互作用,而Rab7蛋白在调节线粒体溶酶体接触与解离过程中的作用尤其重要。首先,在线粒体-溶酶体接触阶段,Rab7在调节线粒体与溶酶体的接触与解离中起重要作用,Rab7通过与溶酶体的GTP结合活化促进了其与线粒体接触,并且,当通过高表达Rab7 Q67 L持续活化Rab7 GTP时,可延长线粒体与溶酶体接触。反之,当Rab7与GDP结合处于非活化状态则线粒体与溶酶体解离[11]。
随后出现的线粒体-溶酶体解离过程也受Rab7调节,线粒体外膜蛋白Fis1通过招募胞浆TBC1D15(Rab7 GAP)至线粒体,TBC1D15通过与溶酶体接触点处的Rab7结合并水解 GTP转换为GDP,Rab7-GDP从溶酶体释放出来,从而促使线粒体-溶酶体解离[35, 52]。学者们进一步发现当基因突变或者沉默Fis1和TBC1D15蛋白,可使已形成的线粒体-溶酶体接触位点则不能发生解离或者接触时间延长,然而,这并不影响线粒体-溶酶体接触的形成[35],说明Fis1和TBC1D15蛋白主要通过与Rab7相互作用影响线粒体-溶酶体接触后解离的过程。因此,Rab7对线粒体与溶酶体的接触形成和解离具有重要的作用,此过程涉及Rab7的活化、转换、运输与定位并需要TBC1D15和Fis1的协同作用。
除此以外,Rab7还可以通过线粒体-溶酶体膜接触点对两者进行双向的调控。首先,线粒体-溶酶体接触点为线粒体相关蛋白通过调控Rab7 GTP结合进而调节溶酶体提供了一个平台,学者发现当TBC1D15与线粒体外膜结合使Rab7 GTP酶水解促进线粒体溶酶体解离的同时,也促使了溶酶体膜的Rab7效应蛋白释放,进而调节了溶酶体动态,而TBC1D15突变使GAP活性受抑制则导致溶酶体体积增大[11],说明Rab7不仅通过在调节线粒体-溶酶体接触过程中也调控了溶酶体动态。 其次,Rab7通过线粒体-溶酶体接触点而调控线粒体也得到证实,当抑制Rab7 GTP酶水解而破坏线粒体-溶酶体接触点解离时,线粒体分裂减少,线粒体网状结构被破坏[11]。
7 其它
正如前面所述,Rab7参与线粒体自噬与线粒体溶酶体接触形成,鉴于其在膜结构的形成过程中的重要作用, Rab7即使调节线粒体衍生的囊泡的过程也是不足为奇的,然而,这有待进一步明确。mTOR/TFEB信号通路是调节线粒体与溶酶体的共同通路,Rab7 GAP TBC1D5也被发现可通过与Retromer相互作用在调节mTOR活性的过程起重要的作用[53]。
8 结语
线粒体和溶酶体对细胞的正常代谢都是至关重要的,线粒体为细胞产生能量,溶酶体则主要回收细胞的废弃物。线粒体和溶酶体存在相互交谈,两者的功能也存在关联,两者发生功能障碍与2型腓骨肌萎缩症、溶酶体贮积症和多种神经退行性病变等疾病存在密切关系。线粒体和溶酶体拥有共同的mTOR/TFEB调控体系,并可能通过线粒体自噬、线粒体衍生的囊泡和线粒体-溶酶体接触位点等途径发生相互作用。Rab7蛋白参与了线粒体和溶酶体相互作用过程中的关键环节,包括早期驱动富含Atg9A的膜结构形成吞噬泡包裹损伤的线粒体,介导PINK1/Parkin依赖的线粒体自噬体形成;线粒体自噬体与溶酶体融合;介导线粒体-溶酶体接触与解离的过程,进而双向调控线粒体与溶酶体等等。因此,特异性靶向Rab7的治疗策略为今后有效控制线粒体与溶酶体功能障碍性疾病开辟了新的研究方向。但Rab7与线粒体溶酶体互作之间的关系错综复杂,线粒体溶酶体互作受到多个分子、多种通路的调控,目前尚未完全研究明确。如何特异性靶向Rab7并减少不良反应,无疑是个极大挑战。因此,调控Rab7以维持线粒体溶酶体互作的稳态,在治疗线粒体与溶酶体功能障碍性疾病中具有广阔的应用前景,但仍需大量研究工作。
