同步放化疗治疗局部晚期EGFR野生型NSCLC合并COPD患者的临床疗效观察
2017-11-01杜建飞畅婕崔立春王旋党升强张双燕杨拴盈
杜建飞 畅婕 崔立春 王旋 党升强 张双燕 杨拴盈
·论著·
同步放化疗治疗局部晚期EGFR野生型NSCLC合并COPD患者的临床疗效观察
杜建飞1畅婕1崔立春1王旋1党升强1张双燕1杨拴盈2
目的探讨同步放化疗治疗局部晚期表皮生长因子受体(epidermal growth factor receptor, EGFR)野生型非小细胞肺癌(non-small cell lung cancer, NSCLC)合并慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)和肺不张患者的近期疗效及毒副反应。方法对42例局部晚期EGFR野生型NSCLC合并COPD和肺不张的患者给予低分割大剂量调强放射治疗,Dt:5Gy/次,隔日一次,3次/周,总剂量达到50~60Gy/10~12次,同步EP方案依托泊苷50 mg/m2d1~5,顺铂 d1~5(总量70 mg/m2)化疗,每四周为一周期,共化疗两周期后评估患者疗效。结果治疗结束后复查患者胸部CT评估患者肺部原发肿块及纵膈阳性淋巴结退缩情况完全缓解(complete remission, CR) 6例(14.3%),部分缓解(partial remission, PR) 31例(73.8%),稳定(stable disease, SD) 5例(11.9%),进展(progressive disease, PD)0例;毒副反应情况:毒性反应主要表现为放射性肺炎,其中0级16例(38.1%),Ⅰ~Ⅱ级21例(50%),Ⅲ级5例(12%)。结论对于局部晚期EGFR野生型NSCLC合并COPD和肺不张的患者低分割调强放射治疗同步EP方案化疗安全有效,毒副反应可以耐受。
同步放化疗; EGFR野生型; 局部晚期; 非小细胞肺癌; 肺疾病,慢性阻塞性
肺癌是全球恶性肿瘤死亡的第一位病因,每年超过140万患者因肺癌死亡,占所有癌症死亡的13%以上[1-2]。慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是以不完全阻塞性肺通气功能障碍为临床特征的呼吸系统常见病、高发病,预计2020年COPD为全球第三位死亡病因[3-4]。肺癌与COPD密切相关,是导致COPD患者死亡的主要因素之一,而COPD是影响肺癌发病率和死亡率的独立因素[5]。对于局部晚期非小细胞肺癌(local advanced non-small cell lung cancer, LA-NSCLC)的标准治疗方法为同步放化疗,研究认为,EP方案同步放化疗可使LA-NSCLC患者生存期明显提高,但是该方案用于NSCLC合并COPD的临床研究少之又少[6]。本研究旨在探讨同步放化疗治疗局部晚期表皮生长因子受体(epidermal growth factor receptor, EGFR)野生型NSCLC合并COPD患者的近期疗效与毒副反应。
资料与方法
一、一般资料
选自长安医院2013年1月至2015年6月收治的中心型EGFR野生型LA-NSCLC合并COPD的患者,且所有患者均合并肺不张,符合入选条件的患者42例其中男性39例,女性3例,年龄52~68岁,中位年龄62岁。其中鳞癌29例,腺癌13例。
入选标准:①年龄<70岁;②ECOG 1~2分;③中心型肺癌经支气管镜活检病理学证实为NSCLC,且基因检测EGFR野生型;④临床分期为Ⅲb期经胸外科证实不能手术切除的患者;⑤肝肾功能正常;⑥无放化疗禁忌症的患者,无心功能异常;⑦肺功能检查存在中-重度混合性肺通气功能障碍;⑧CT表现为肺部占位性病变,纵膈内肿大淋巴结,不同程度的肺不张;⑨既往无放化疗病史;⑩有可测量或可评价的病灶;了解病情,知晓同步放化疗的治疗作用及其毒副反应,自愿接受放化疗并签署放化疗知情同意书。
排除标准:①年龄>70岁;②ECOG评分>2分;③EFGR阳性患者;④有远处转移的;⑤严重内科疾病,或肝肾功能异常不能耐受同步放化疗者;⑥不知情或不同意接受同步放化疗者。
三、治疗方法
1. 放疗: 放疗计划制定前所有患者均行胸部增强CT扫描以更清晰鉴别纵膈阳性淋巴结及行核磁共振弥散成像-DWI鉴别肿块与不张肺组织。常规真空垫固定患者,CT扫描胸部,层厚2.5 mm。图像传入三维适形调强放射治疗计划系统,经副主任医师以上放疗人员于肺窗勾画靶区,靶区包括GTV(肺癌原发病灶及纵膈阳性淋巴结),GTV腹背及左右各外放5 mm,头足外放10 mm生成CTV。勾画食管、心脏、肺、脊髓等周围正常组织,通过DVH图(剂量体积直方图)限定正常组织受量,采用低分割大剂量放射治疗,Dt:5 Gy/次,隔日一次,3次/周,行放射治疗40 Gy/8次后复查胸部CT,根据肺复张情况,重新上述方法定位及制定放疗计划,总剂量达到50~60 Gy/10~12次完成放疗计划,等效生物学剂量达到75 Gy~90 Gy。
2. 化疗: 化疗于第一次放疗当天进行,方案为EP方案,依托泊苷50 mg/m2d1~5,顺铂 d1~5(总量70 mg/m2)静脉滴注,每四周为一周期,共化疗两周期后评估患者疗效,治疗期间给予患者止吐、保肝等对症治疗,白细胞降低给予G-CSF药物升白治疗。
三、疗效及不良反应评价
所有患者在治疗过程中每周最少复查一次血常规,两周复查一次肝肾功能,密切观察患者骨髓抑制、放射性食管炎情况。治疗结束后第三周复查胸部CT及肺功能,评价近期疗效(对比治疗前后肿瘤病灶退缩情况及肺功能情况)及放射性肺损伤。肿瘤退缩情况根据WHO实体瘤疗效评价标准分为:完全缓解(CR),部分缓解(PR),稳定(SD),进展(PD)。肺不张疗效评价:有效: 胸部CT显示全肺或肺叶或部分肺叶复张; 无效: 胸部CT显示肺不张无变化。急性放射性损伤按RTOG标准0~4级进行评定,按WHO标准将不良反应分为0~4度。
四、统计学方法
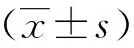
结 果
一、患者胸部CT示肺部肿块退缩情况
所有患者均完成治疗,治疗完成率100%,无治疗相关性死亡。第二周期化疗结束后第三周复查患者胸部CT评估患者肺部原发肿块及纵膈阳性淋巴结退缩情况行近期疗效评价,见表1。
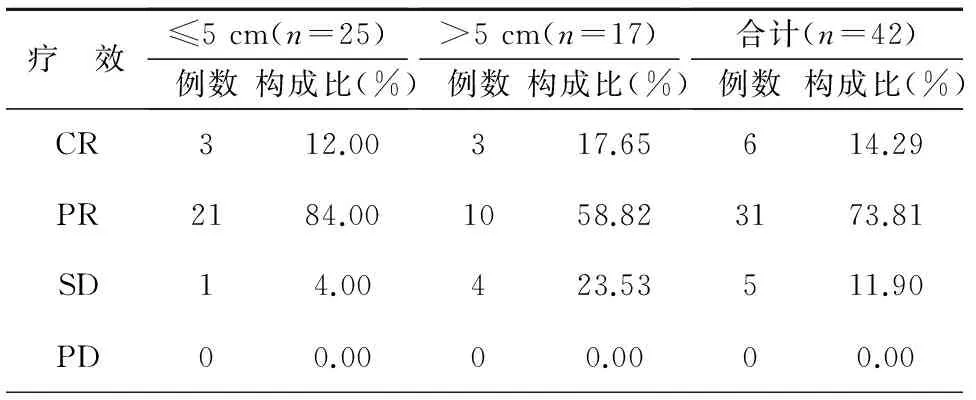
表1 42例肺癌合并COPD患者放化疗的近期疗效
注:CR:完全缓解;PR:部分缓解;SD:稳定;PD:进展
二、患者肺复张情况
评价治疗疗效时同时评价肺复张情况,结果完全复张19例(45.2%),部分复张18例(42.9%),无变化5例(11.9%)
三、患者肺功能改变情况
所有患者治疗前后均接受肺功能检测主要评价指标为FEV1、FEV1/FVC、VC、FVC及DLCO值,治疗后患者肺功能较治疗前明显改善,P<0.05为差异有统计学意义,见表2。

表2 患者治疗前后肺功能比较
注:CLCO:一氧化碳弥散量;VC:肺活量;FEV1:一秒用力呼气容积;FVC:用力肺活量
四、患者毒副反应情况
治疗期间14例患者出现Ⅰ-Ⅱ度白细胞降低经升白治疗后好转,无Ⅲ-Ⅳ度骨髓抑制发生,主要的毒性反应表现为放射性肺炎,见表3。
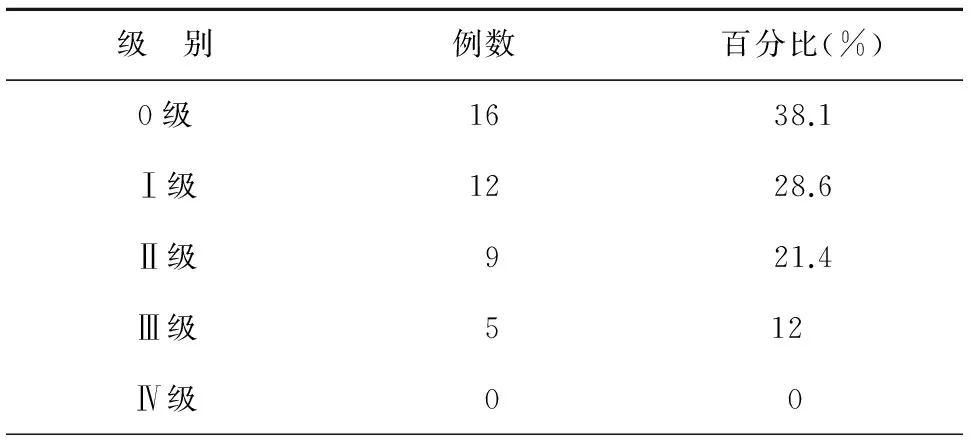
表3 放射性肺炎发生率
讨 论
肺癌已成为我国恶性肿瘤致死的首位病因,2015年我国新诊断肺癌患者733 000例,死亡610 200例,且其发病率及死亡率呈明显上升趋势。CODP为慢性病至死的第一位病因,据统计2013年我国COPD死亡的患者为910 809例,而肺癌为COPD患者的常见死亡病因[7-8]。研究认为吸烟、慢性炎症、环境暴露、遗传因素等为肺癌与COPD共同的发病高危因素,但是只有10%~15%的吸烟人群发展成为肺癌,20%~30%的吸烟人群发展为临床症状明显的COPD[9-11]。有学者认为肺功能的降低为肺癌高危因素之一,因此COPD患者患肺癌的风险为肺功能正常的吸烟者的四至六倍,而这种趋势随着FEV1的降低而有增高趋势,同时COPD为肺癌患者预后不良的主要因素之一[12]。
同步放化疗在局部晚期NSCLC的治疗中占据主导地位,放化疗同步的优势是两种治疗手段作用的双重叠加,以增加局部肿瘤的缩小,以利于肺复张,同时控制已有的微小病灶。中国原发性肺癌诊疗规范专家共识及NCCN指南均推荐以EP方案或CP方案同步放化疗为主的综合治疗,但疗效并不显著,2年生存率不足30%[13-16]。我国中科院肿瘤医院王绿化团队采用EP方案同步常规分割放疗(2 Gy/次,5次/周,总剂量60~66 Gy/30~33次)治疗LA-NSCLC 3年总生存期达到41.1%[17]。常规分割放疗技术成熟,应用广泛,但对于肺癌合并COPD肺不张的患者而言,存在总治疗时间较长,患者依从性下降的缺点。目前认为肿瘤的局部控制率与放射剂量呈正相关,彻底杀灭肿瘤细胞需放射剂量达到80~100 Gy,而常规分割由于周围正常组织受照射量的限制而使肿瘤组织很难达到理想放射剂量,同时由于后程肿瘤细胞的再群体化,放疗超过30 d后每延长治疗一天剂量损失约0.6~1 Gy。因此低分割放疗明显缩短放疗时间,大大增加了患者的依从性,使放疗剂量接近肿瘤的致死剂量,明显提高了对肿瘤的杀伤力。其优势在于采用多野共面照射,使高剂量区分布在肿瘤组织区内,而最大限度减少周围正常组织受量,5 Gy/次隔日照射使肿瘤区等效生物学剂量提高1.5倍,总剂量50~60 Gy/10~12次相当于等效生物学剂量75 Gy~90 Gy接近了理论上的肿瘤组织致死所需剂量。
COPD合并肺癌与单纯肺癌相比,影像学表现为阻塞性肺炎、肺不张、胸腔积液,病理类型以鳞癌的肺癌易并发COPD,临床表现为更严重的咳嗽、咳痰及喘息症状,同时合并咯血、胸闷、呼吸困难、胸痛、声音嘶哑,其主要的病因为COPD反复气道感染或存在慢性炎症,形成瘢痕,间质细胞和上皮细胞过度增生,使上皮细胞癌变,故COPD合并肺癌与单纯肺癌的患者相比心肺功能及放化疗耐受性更差,需要对放疗精准度及放疗时间提出更高要求。而在COPD的基础上因肺癌原发肿块或肿大淋巴结压迫导致阻塞性肺不张的患者,其肺功能比单纯肺癌更差,故治疗十分棘手,对于此类患者治疗的目的为尽可能减轻症状,延长患者生存期及提高患者生活质量[18]。随着放射治疗学技术的进步,低分割大剂量调强放射治疗可在短期内使肿瘤组织接受高剂量照射,且周围正常组织受照射剂量较低,使肿块快速退缩,对支气管的压迫减除,阻塞性病因去除后不张肺组织可以复张而使患者肺功能有所恢复。低分割大剂量放射治疗与EP方案联合应用可以更好的提高LA-NSCLC合并COPD肺不张患者的局部控制率,显著改善患者症状,提高患者生存质量。本研究中患者放化疗后,局部病灶得到较好的控制,解除了对支气管的压迫,使不张肺组织得到迅速复张而改善了肺通气功能,放化疗结束后复查患者肺功能显示VC、FVC、FEV1、FEV1/FVC及DLCO较治疗前均明显改善且具有统计学意义,肺功能得到改善后患者胸闷气短的症状均有不同程度缓解,患者生活质量得到明显提升。
在本次研究中,主要选择了42例肺癌合并COPD导致肺不张的患者作为主要的研究对象,近期不良反应主要为骨髓抑制、放射性肺炎、放射性食管炎等。其中放射性肺炎为LA-NSCLC放射治疗最主要、最严重并发症也是肺癌放射治疗中主要的剂量限制性毒性反应,放射性肺炎的发生主要与照射面积与照射剂量有关,特别与V10、V20关系较大,有文献报道放化疗联合可增加放射性肺炎的发生几率,但也有研究持相反态度,认为同步放化疗与单纯放疗相比并不增加放射性肺炎的发生几率[19-20]。COPD是否影响放射性肺炎的发生几率同样有较大争议,有学者认为合并COPD的患者放射性肺炎发生几率明显增加,COPD为预测≥3级放射性肺炎发生的独立因素,但也有研究认为,COPD与放射性肺炎之间无明显的关系。目前对于COPD合并肺癌临床研究多局限于二者相互关系、发病机制及临床诊断的研究上,对于此类患者治疗方案的选择上各指南均按照肺癌相关指南进行治疗而未行特殊说明[21-24]。本研究中低分割大剂量同步EP方案治疗前所有患者均行胸部增强CT扫描及核磁共振弥散成像-DWI有效的鉴别了纵膈阳性淋巴结及肺不张组织,使放疗靶区既包括病变组织避免遗漏同时又避免靶区过大而损伤周围正常组织,放化疗后38.1%的患者未出现放射性肺炎的症状、体征及影像学表现,而放射性肺炎的发生率近60%,但多为Ⅰ级Ⅱ级放射性肺炎,Ⅲ级放射性肺炎仅仅为12%,无Ⅳ级放射性肺炎的发生,进一步分析Ⅲ级放射性肺炎患者主要症状为咳嗽及气短,可能与治疗前COPD及肺原发肿块巨大关系更为密切。本研究的局限性一方面在于患者的选择上,入选患者虽然均为COPD合并肺癌继发肺不张,但样本量较小,同时患者年龄小于70岁,ECOG评分在1-2分之间,患者总体状况较好,对放化疗耐受性相对较好,故能完成全部治疗计划,而在临床上COPD合并肺癌患者多为70岁以上老年人,心肺功能较差难以接受同步放化疗特别是低分割放射治疗所带来的毒副反应,因此对于此类患者的治疗方案选择上仍然是较为棘手的问题;第二增大单次剂量,缩短时间,可促进早反应组织的损伤,继发骨髓抑制或放射性食管炎;第三本研究中主要观察患者的近期疗效,治疗后患者长期生活质量是否可以得到提高及慢性迟发型放射性肺炎的发生等仍需进一步观察,对于患者疾病控制率、总生存时间、无疾病进展时间均需继续随访。
总之,对于一般状况较好的局部晚期EGFR野生型NSCLC合并COPD导致肺不张的患者低分割调强放射治疗同步EP方案化疗安全有效,毒副反应可以耐受,可以作为此类患者治疗方案中一个有效性的选择。
1 钱桂生. 肺癌不同病理类型发病率的变化情况及原因[J/CD]. 中华肺部疾病杂志(电子版), 2011, 4(1): 1-6.
2 Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386.
3 任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志(电子版), 2009, 2(2): 104-115.
4 Miravitlles M, Soler-Catalua JJ, Calle M, et al. Spanish guideline for COPD (GesEPOC). Update 2014[J]. Arch Bronconeumol, 2014, 50 Suppl 1: 1-16.
5 任成山, 白莉, 钱桂生. 慢性阻塞性肺疾病合并肺癌临床特征及新理念[J/CD]. 中华肺部疾病杂志(电子版), 2015, 8(2): 137-142.
6 Steuer CE, Behera M, Ernani V, et al. Comparison of Concurrent Use of Thoracic Radiation With Either Carboplatin-Paclitaxel or Cisplatin-Etoposide for Patients With Stage Ⅲ Non-Small-Cell Lung Cancer: A Systematic Review[J]. JAMA Oncol, 2017, 3(8): 1120-1129.
7 Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
8 Yin P, Wang H, Vos T, et al. A Subnational analysis of mortality and prevalence of COPD in China from 1990 to 2013[J]. Chest, 2016, 150(6): 1269-1280.
9 Durham AL, Adcock IM. The relationship between COPD and lung cancer [J]. Lung Cancer, 2015, 90(2): 121-127.
10 Hecht SS, Carmella SG, Murphy SE, et al. Tobacco smoke toxicant and carcinogen biomarkers and lung cancer susceptibility in smokers[J] J Thorac Oncol, 2016, 11(2): S7-S8.
11 Kohansal R, Martinez-Camblor P, Agustí A, et al. The natural history of chronic airflow obstruction revisited: an analysis of the Framingham offspring cohort [J]. Am J Respir Crit Care Med, 2009, 180(1): 3-10.
12 Tockman MS, Anthonisen NR, Wright EC, et al. Airways obstruction and the risk for lung cancer[J]. Ann Intern Med, 1987, 106(4): 512-518.
13 Yang P, Allen MS, Aubry MC, et al. Clinical features of 5,628 primary lung cancer patients: experience at Mayo Clinic from 1997 to 2003[J]. Chest, 2005, 128(1): 452-462.
14 石远凯, 孙燕, 于金明, 等. 中国晚期原发性肺癌诊治专家共识 (2016 年版)[J]. 中国肺癌杂志, 2016, 19(1): 1-15.
15 Ettinger DS, Wood DE, Akerley W, et al. NCCN guidelines insights:non-small cell lung cancer, version 4.2016[J]. J Natl Compr Canc Netw, 2016, 14(3): 255-264.
16 Baumann M, Appold S, Petersen C, et al. Dose and fractionation concepts in the primary radiotherapy of non-small cell lung cancer [J]. Lung cancer, 2001, 33 Suppl 1: S35-S45.
17 Liang J, Bi N, Wu S, et al. Etoposide and Cisplatin vs Paclitaxel and Carboplatin With Concurrent Thoracic Radiotherapy in Unresectable Stage Ⅲ Non-Small Cell Lung Cancer: A Multicenter Randomized Phase Ⅲ Trial[J]. Ann Oncol, 2017, 28(4): 777-783.
18 Sekine Y, Hata A, Koh E, et al. Lung carcinogenesis from chronic obstructive pulmonary disease: characteristics of lung cancer from COPD and contribution of signal transducers and lung stem cells in the inflammatory microenvironment[J]. Gen Thorac Cardiovasc Surg, 2014, 62(7): 415-421.
19 Palma DA, Senan S, Tsujino K, et al. Predicting radiation pneumonitis after chemoradiation therapy for lung cancer: an international individual patient data meta-analysis[J]. Int J Radiat Oncol Biol Phys, 2013, 85(2): 444-450.
20 Dang J, Li G, Lu X, et al. Analysis of related factors associated with radiation pneumonitis in patients with locally advanced non-small-cell lung cancer treated with three-dimensional conformal radiotherapy [J]. J Cancer Res Clin Oncol, 2010, 136(8): 1169-1178.
21 Shi A, Zhu G, Wu H, et al. Analysis of clinical and dosimetric factors associated with severe acute radiation pneumonitis in patients with locally advanced non-small cell lung cancer treated with concurrent chemotherapy and intensity-modulated radiotherapy[J]. Radiat Oncol, 2010, 5(1): 35.
22 Warner A, Dahele M, Hu B, et al. Factors associated with early mortality in patients treated with concurrent chemoradiation therapy for locally advanced non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2016, 94(3): 612-620.
23 Kim M, Lee J, Ha B, et al. Factors predicting radiation pneumonitis in locally advanced non-small cell lung cancer [J]. Radiat Oncol J, 2011, 29(3): 181-190.
OutcomesofconcurrentthoracicradiationwithchemotherapyforEGFRwild-typelocaladvancednonsmallcelllungcancerwithCOPD
DuJianfei1,ChangJie1,CuiLichun1,WangXuan1,DangShengqiang1,ZhangShuangyan1,YangShuanying2.
1DepartmentofOncology,ChanganHospital,Xi′an710016,China;2DepartmentofRespiratoryDisease,SecondAffiliatedHospitalofXi′anJiaotongUniversity,Xi′an710004,China
YangShuanying,Email:yangshuanying66@163.com
ObjectiveTo explore the recent therapeutic effect and adverse reactions of chemoradiation for epidermal growth factor receptor(EGFR) wild-type LA-non-small cell lung cancer(NSCLC) patients with chronic obstructive pulmonary disease(COPD) and atelectasis.Methods42 patients receive hypofractionation Intensity-modulated radiotherapy, 5 Gy/ fraction, three times/week, total dose 50-60Gy/10-12fractions, Concurrent chemotherapy with etoposide 50 mg/m2on days1 to 5 and cisplatin on days 1 to 5(total 70 mg/m2)every 4 weeks for two cycles.ResultAfter treatment, 42 patients complete remission(CR) 6 cases(14.3%), partial remission(PR) 31 cases(73.8%), stable disease(SD) 5 cases(11.9%), progressive disease(PD) 0 case; Toxic effects mainly for radioactive pneumonia, of which the 0 level 16 cases (38.1%), Ⅰ-Ⅱ level 21 cases (50%), Ⅲ level 5 cases (12%).Conclusionhypofractionation Intensity-modulated radiotherapy Concurrent EP chemotherapy is effective and well-tolerated for EGFR wild-type LA-NSCLC patients with COPD and atelectasis.
Chemoradiation; EGFR wild-type; Local advanced; Non-small cell lung cancer; Chronic obstructive pulmonary disease
10.3877/cma.j.issn.1674-6902.2017.05.011
国家自然科学基金资助项目(81350032)陕西省科技统筹计划重点项目(2014KTCL03-02)
710016 西安,长安医院肿瘤科1710004 西安,西安交通大学第二附属医院呼吸科2
杨拴盈, Email: yangshuanying66@163.com
R563,R734.2
A
2017-05-02)
(本文编辑:张大春)
杜建飞,畅婕,崔立春,等. 同步放化疗治疗局部晚期EGFR野生型NSCLC合并COPD患者的临床疗效观察[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(5): 559-563.
