临床试验中药物安全性的统计学考虑*
2017-10-26贺佳
贺 佳
(第二军医大学卫生勤务学系卫生统计学教研室 上海 200433)
临床试验中药物安全性的统计学考虑*
贺 佳**
(第二军医大学卫生勤务学系卫生统计学教研室 上海 200433)
药品安全是重大的民生和公共安全问题,贯穿于新药研发的全生命周期。本文主要针对临床试验中药品的安全性评价涉及的统计学方法进行阐述与讨论。以期加强药品的安全性监测,保障公众的用药安全。
临床试验 药品安全 不良反应监测 安全性评价
药物安全性问题是重要的公共健康问题,“安全第一,疗效第二”贯穿于新药研发的全生命周期。目前,由于安全性问题在国家食品药品监督管理总局(China Food and Drug Administration,CFDA)官网被通报的具有不良药物反应的中药/中成药包括:何首乌(肝毒性)[1]、含马兜铃酸的中药材(肾毒性)[2]、雷公藤(肝肾毒性)[3]、复方青黛丸(肝损害)[4]、壮骨关节丸(肝损害)[5]、白蚀丸(肝损害)[6]、生脉注射液(严重过敏反应)[7]、鱼腥草折射液(严重过敏反应)[8]。在美国死亡率排名中,药物不良反应排名第4;而据媒体报道,药品不良反应成为中国第5大死亡原因[9]。
药物上市前需要经过非临床试验和临床试验的I期、II期、III期。非临床试验主要为动物实验,包括了急性毒性实验、慢性毒性实验、致癌作用、致畸作用、致突变作用、毒代动力学和药品的相互作用等。在这一系列实验得出有效结果后,药品即可进入临床试验。临床I期、II期、III期试验均为小样本研究,主要针对的是药物有效性问题。而对于药品安全性问题,由于样本量的限制很难全面地了解与认识药品潜在的不良反应,还需进行大样本的上市后监测。药物上市后监测主要包括主动监测(包括IV期)和被动监测。其中,IV期临床试验为大样本观察性研究,主要进行药品销售后的检测,包括:不良反应的调查、病死率和死亡率研究。本文主要对药物上市前和上市后的安全性评价涉及的统计学方法进行讨论。
1 药物上市前的安全性评价
1.1 统计学相关指导原则中的安全性评价要求
2016年6月1日,CFDA发布了最新制定的《药物临床试验的生物统计学指导原则》,当日起执行。2016年7月29日CFDA发布了《药物临床试验数据管理与统计分析的计划和报告指导原则》,以加强临床试验数据管理,提高统计学专业审评的效率和质量。其中,针对药品安全性的观察指标主要包括:临床不良事件(疾病、体征、症状等)、生命体征、实验室检查结果(包括生化学和血液学指标等)、其他特殊的安全性检验(如心电图、眼科检查)、耐受性指受试者对于明显的不良反应的耐受程度。安全性分析内容主要包括:不良事件(Adverse Event,AE)、不良反应(Adverse Drug Reaction,ADR)、严重不良事件、重要不良事件等等。
1.2 不良事件与不良反应的统计评价
AE是指服用药物的患者或临床试验受试者使用药物后出现的任何不良医学事件。ADR是指在新药或药物新用途的临床试验中,特别是其治疗剂量尚未确定时,与任何剂量的药物使用有因果关系的、非预期的有害反应。AE和ADR评价主要采用因果关系评分法(表1)描述了5级关系,3个“有关”和2个“无关”,与之有关的均为不良反应。

表1 不良事件和不良反应的因果关系评分法
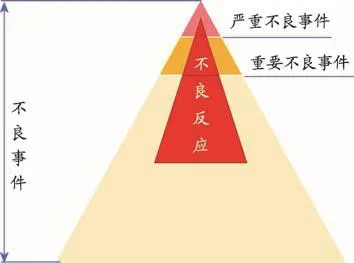
图1 药品不良事件相关术语的相互关系
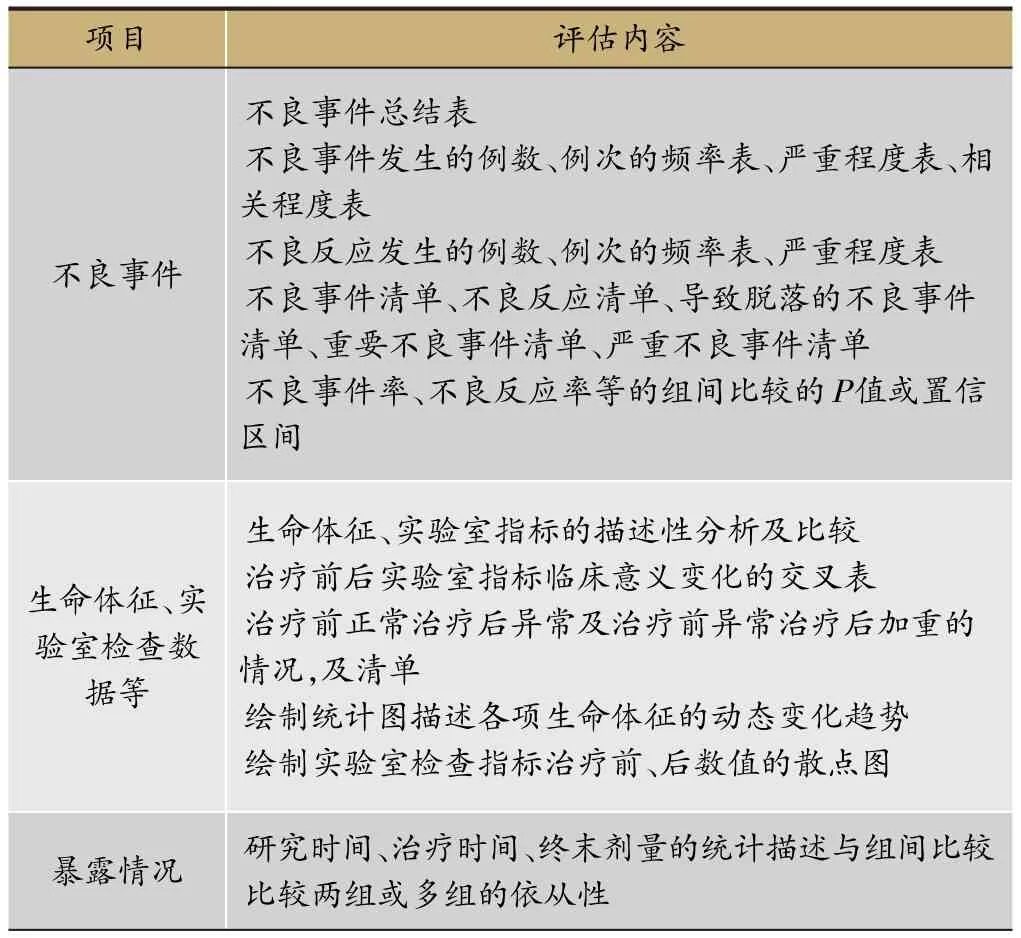
表2 临床试验安全性评价的主要内容
严重不良事件(Serious Adverse Event,SAE)是指在临床试验过程中,在任何剂量时患者或临床试验受试者发生的不可预见的以下临床事件:死亡、危及生命、需要住院治疗或延长目前的住院治疗时间,导致永久性或显著的功能丧失或残废、导致先天性畸形或出生缺陷的重要的医学事件(Important Medical Events)。
重要不良事件(Significant Adverse Event)指的是严重不良事件外,发生的任何导致采用针对性医疗措施(如停药、降低剂量和对症治疗)的不良事件和血液学或其他实验室检查明显异常(图1)。
1.3 统计学相关指导原则中的安全性分析要求
安全性分析数据集(Safety Set,SS)是指至少接受过一次治疗且有安全性评价的受试者。统计学分析是根据事先确定的统计分析计划,采用描述性统计分析方法,必要时辅以P值和置信区间,需要注意的是安全性评价指标需采用统一的不良事件编码词典,如MedDRA等。统计学分析的内容如表2所示。
1.3.1 不良事件的编码
编码就是对特定对象或事物进行分类的过程。即按照标准字典或术语集进行分类,是对事物的多方面性质的解释,根据编码可以方便对不良事件进行统计分析。不良事件编码词典如MedDRA、WHO-ART,药物编码如WHO Drug,疾病编码如ICD-10等。不良事件编码以MedDRA字典为例(图2),不同医生对于肝功能变化有各种描述,为了方便统计,首先将各种肝功能描述用低位语进行编码,可归为肝功能减退、肝功能异常和肝脏功能异常;然后进行首选语和高位语的归类,最后到系统器官类归为肝胆系统疾病。
1.3.2 安全性分析实例
临床试验的题目为“XX中药治疗XX病的安全性和疗效”,采用安慰剂对照,样本量480例,试验组和安慰剂组患者比例为3∶1。首先,将不良事件、不良反应、严重不良事件和反应、重要不良事件等项目列出(表3)。然后,将各种不良事件的MedDRA编码详细内容和关系列出(表4);此外,按照各个系统不良事件、不良反应的发生进行列表,按照MedDRA编码后的SOC和PT名称归类,将对应的例数、例次和发生率列出(表5、表6);导致脱落的不良事件和各系统不同严重程度的不良事件也按照同样方法列出(表7、表8)。另外,不同暴露剂量的不良事件发生情况(表9)和依从性均列出清单。
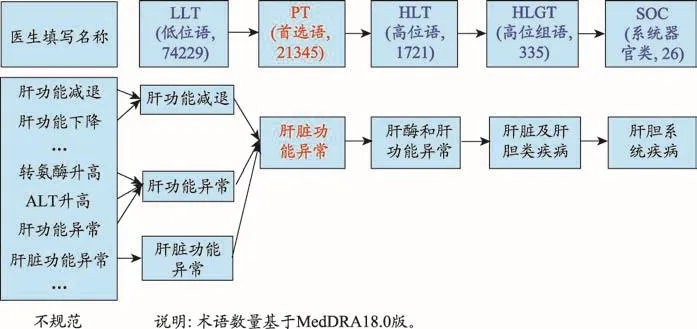
图2 MedDRA字典用于不良事件编码
实验室检查指标的分析,重点关注治疗前后实验室指标临床意义变化的交叉表(表10)。由表10可见,主要关注治疗前正常但治疗后异常这一列数据;其次关注治疗前异常和治疗后异常一列,查看患者在治疗后是否病情更严重。再观察具体指标值,如表11所示,逐例审核数值的变化情况。
采集的实验室指标还可以进行数值的描述性分析,进一步观察治疗前后试验组和安慰剂组ALT是否整体升高,详见表12。此外还可以通过绘制散点图清晰展示每位患者治疗前后ALT的变化情况,如图3所示,试验组有个别病例远离斜线,分布在斜线左上方,提示治疗后ALT升高;而安慰剂组分布较均匀。
1.4 注意事项
安全性研究与有效性研究一样,也需要考虑随机化、对照与盲法、样本量等问题,还要关注安全性事件的破盲问题。
1.4.1 对样本量的考虑
I期、II期、III期临床试验一般不会因为安全性事件而考虑样本量问题。上市前样本量考虑主要参考疗效的样本量和法规。上市后样本量主要根据单组不良事件发生率计算。可以参考表13,如果有5‰的发生率,则需要600例样本量。
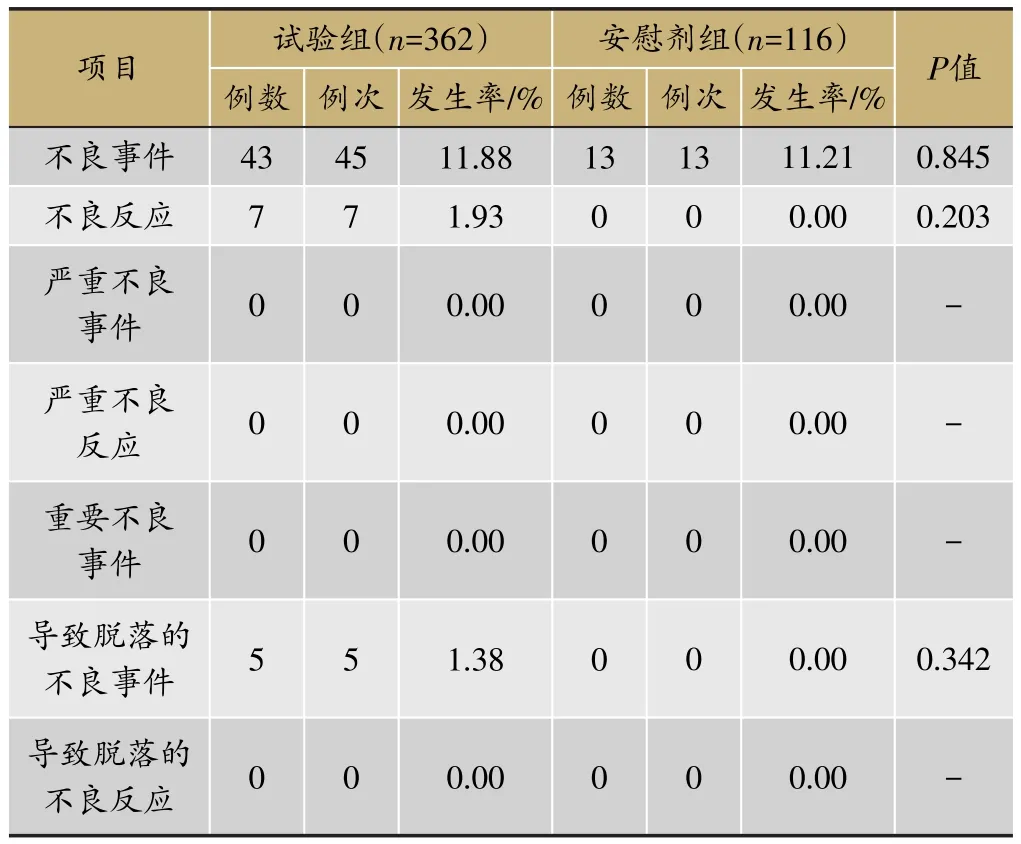
表3 不良事件总结(SS集)
1.4.2 严重不良事件的破盲问题
出现严重不良事件时,无需立即全面破盲。如果破盲结果对受试者将接受的医疗处理没有影响,可以不破盲。除非对试验药和对照药导致的不良反应的处理方法不同,这种情况可以进行个例破盲,切勿全部破盲。应该尽量使分析和解释结果的人员继续保持盲态直到研究结束。

表4 各种不良事件发生情况详细清单(SS集)
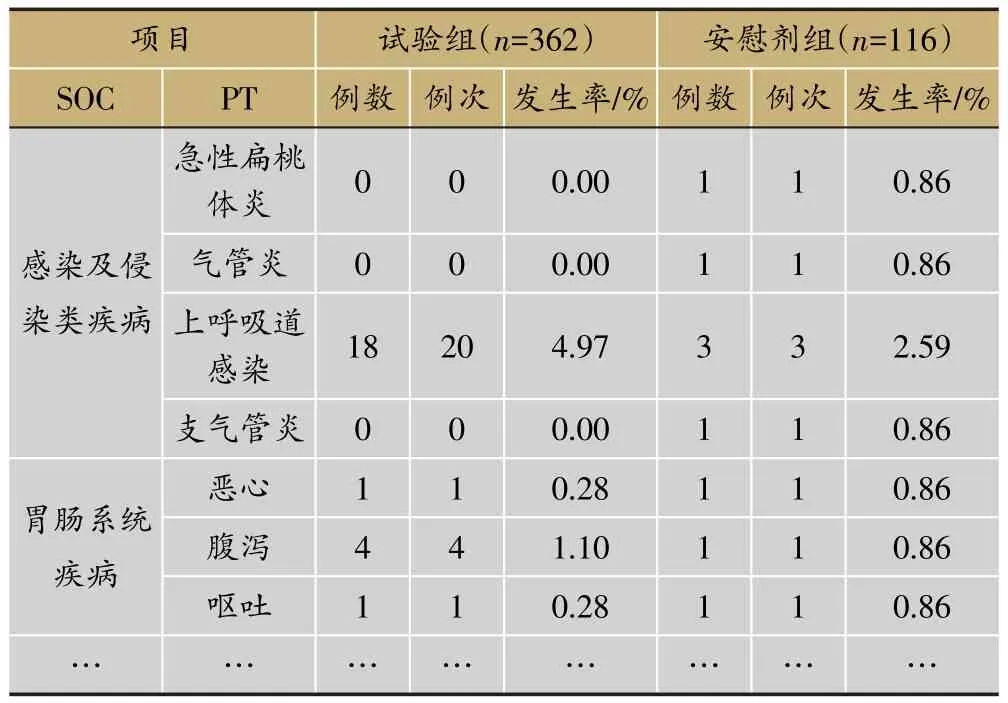
表5 各系统不良事件发生情况(SS集)
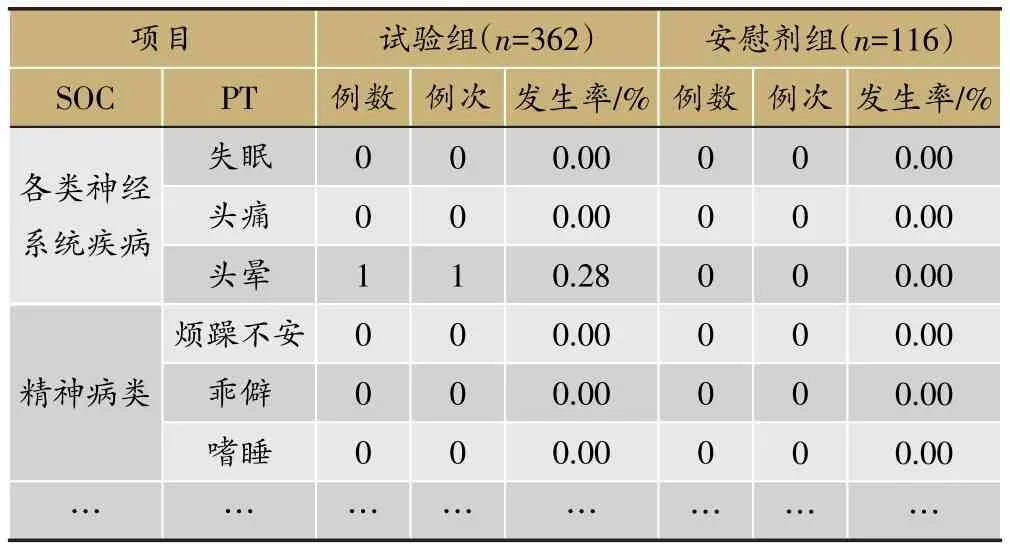
表6 各系统不良反应发生情况(SS集)
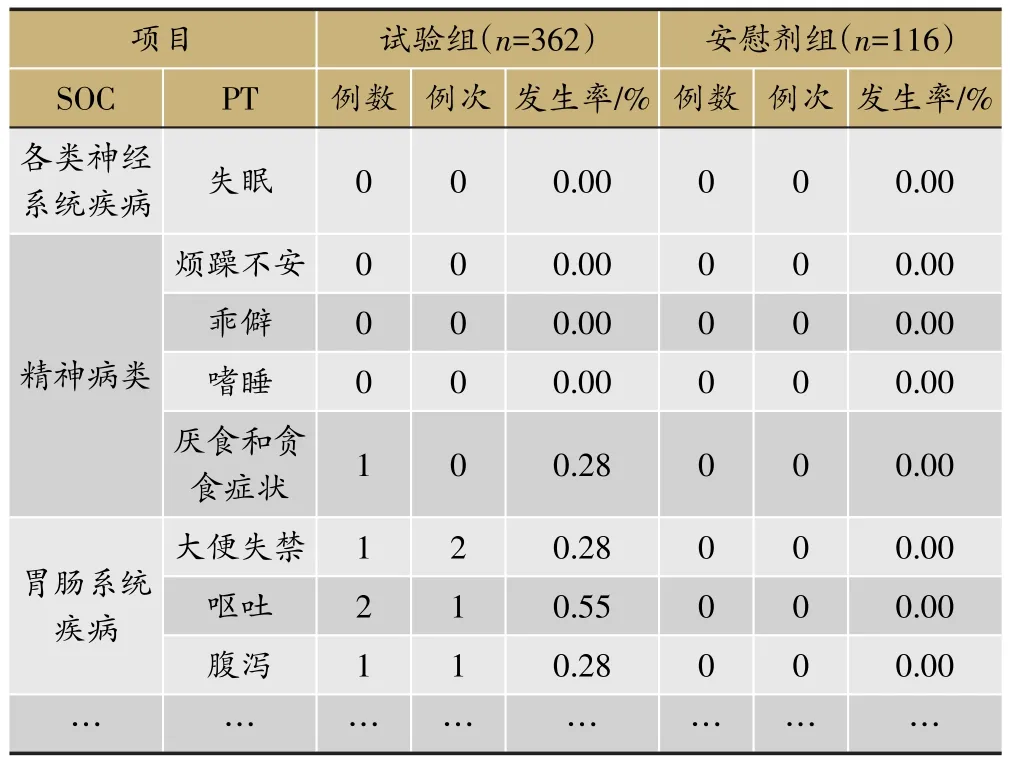
表7 各系统导致脱落的不良事件发生情况(SS集)
2 药品上市后的安全性评价
药品上市后有主动监测和被动监测,Ⅳ期临床试验属于主动监测。上市前的临床试验均为小样本的临床试验,不足以发现更多的不良反应情况;而上市后的大样本临床试验有利于发现一些特殊安全性问题,如:罕见不良反应、迟发性不良反应、长期的不良反应、发生于特殊人群的不良反应、合并用药出现的不良反应。这就要求进行药物安全警戒(Pharmacovigilance,PV),PV是与发现、评价、理解和预防药品不良反应或其他任何可能与药物有关问题的科学研究与活动,包括主动监测和被动监测。
2.1 主动监测
主动监测是指由主体方(政府、药品生产企业等)针对某一药品,为探索某个或某些安全性问题的性质和/或程度等,基于各种适宜科学方法而展开的各种活动、行为和研究。主动监测能获取人口学资料,药物、诊断信息;获取随访过程中发生的所有不良事件;可以计算药品不良反应发生率。主动监测主要是在上市后进行安全性研究、Ⅳ期临床试验;另外还可以进行哨点监测、集中监测计划和处方事件监测。
2.2 被动监测
被动监测是指药品在上市后使用过程中,由医疗卫生专业人员、药品经营、生产者、消费者等将所发现、获知或经历的可能与药品安全有关的信息,上报给药品监管机构、生产企业、医疗卫生专业人员或其他组织的过程。被动监测信息将上报至自发呈报系统(Spontaneous Reporting System,SRS)。该系统目前还存在不能计算药品不良反应发生率和漏报的问题。中国药品不良反应自发呈报系统需要国家中心、省中心授权方可进入。中国药品不良反应自发呈报系统包括69个变量,如:患者基本信息、不良反应/事件信息、药品信息、报告单位/人相关信息。
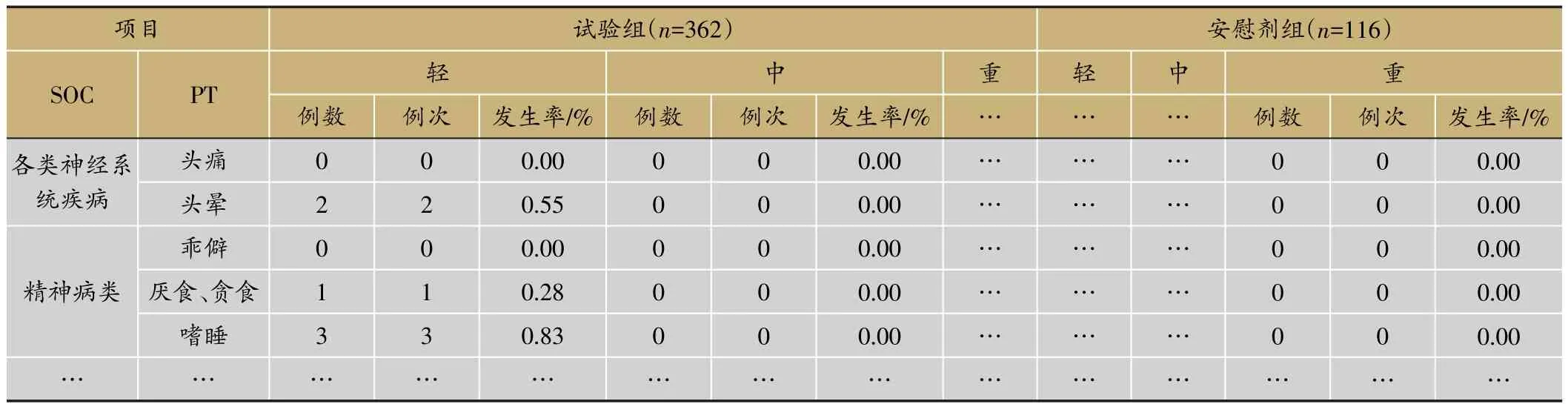
表8 各系统不同严重程度不良事件发生情况(SS集)
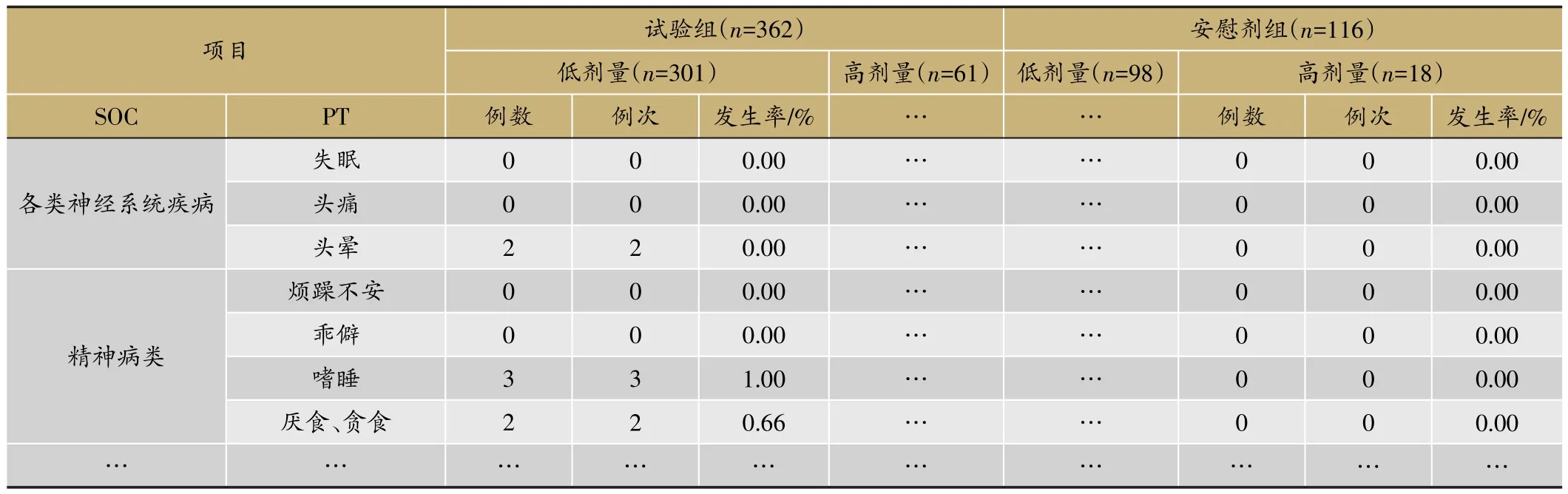
表9 各系统不同暴露量不良事件发生情况(SS集)
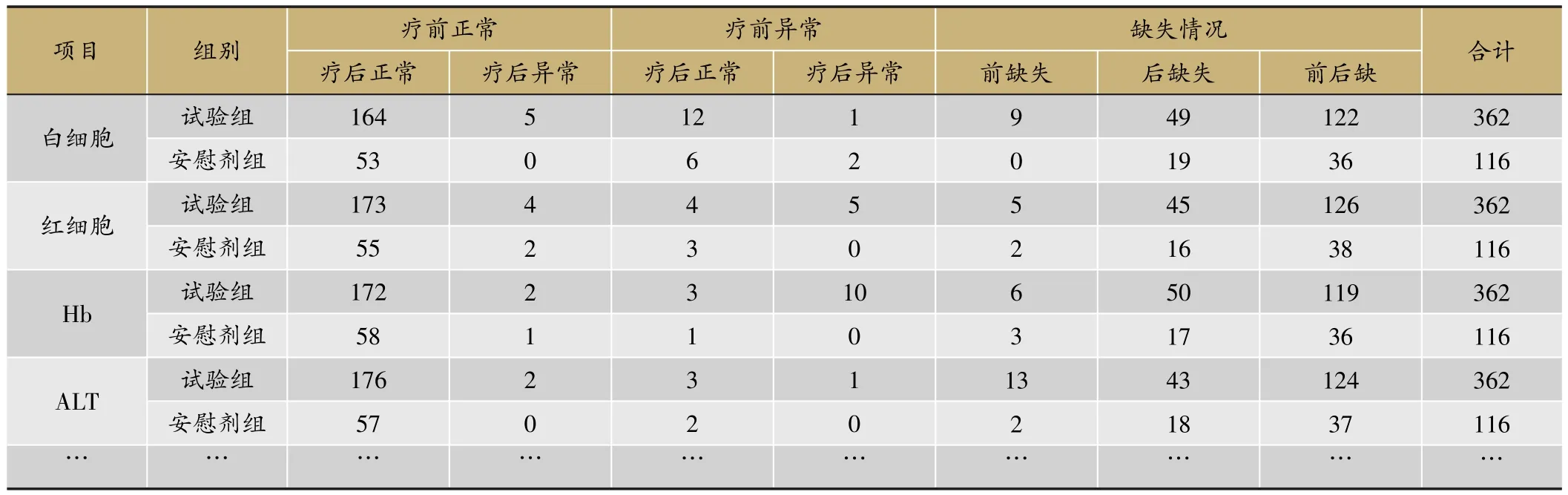
表10 实验室指标治疗前后正常异常情况(SS集)
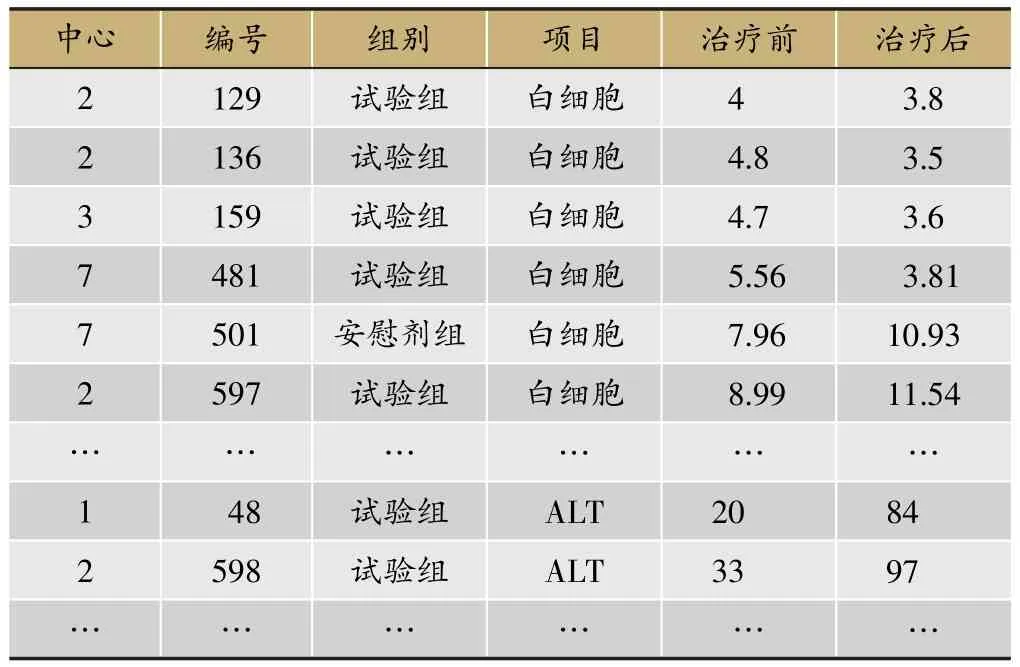
表11 实验室指标治疗前正常治疗后异常病例情况(SS集)
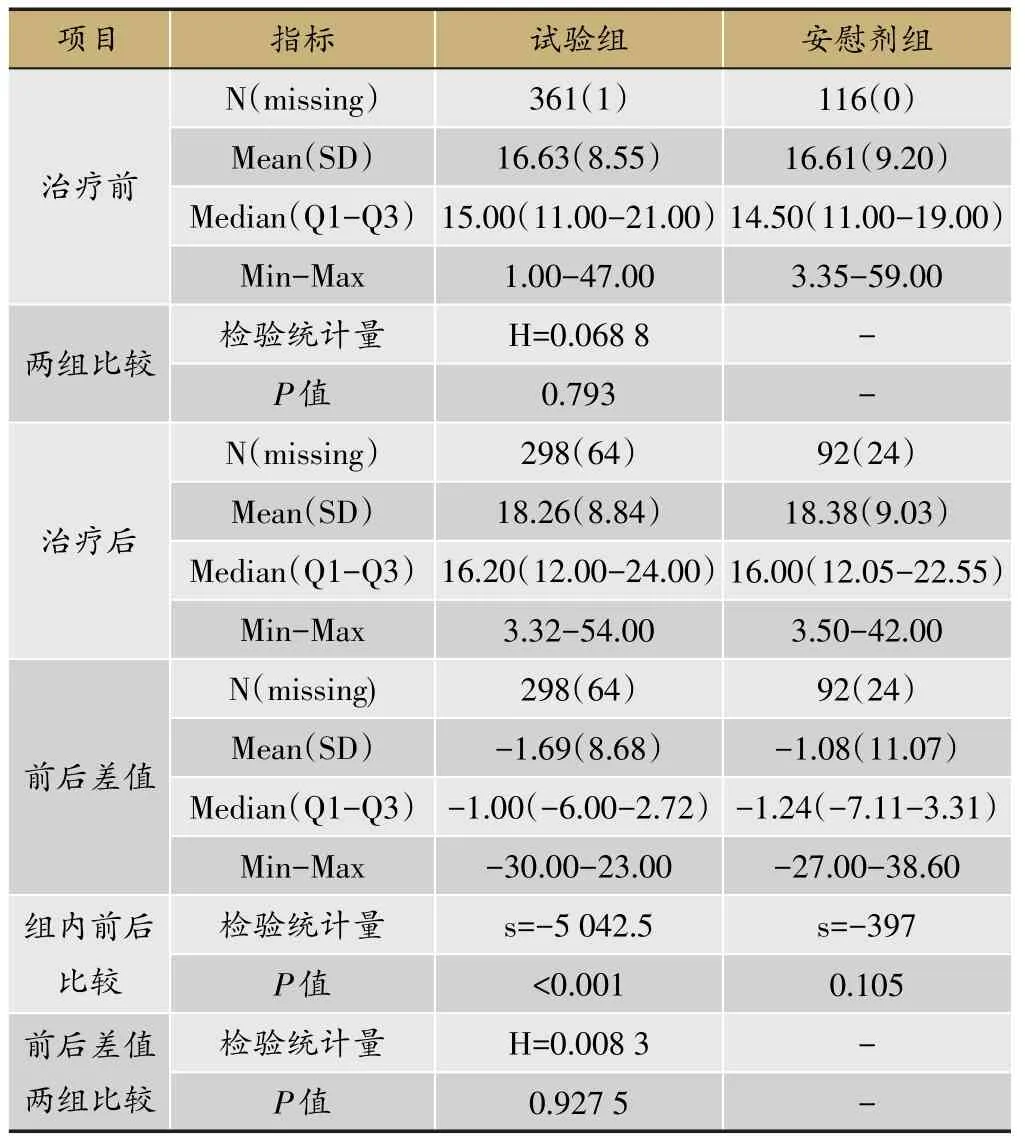
表12 治疗前后二组ALT变化情况(SS集)
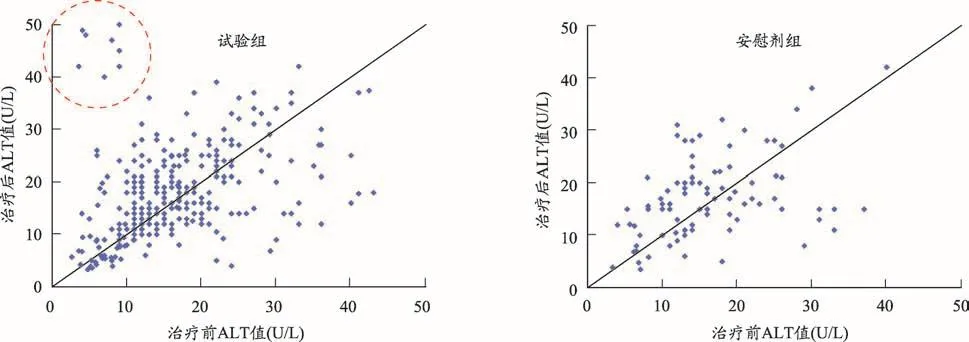
图3 治疗前后两组ALT变化情况(SS集)
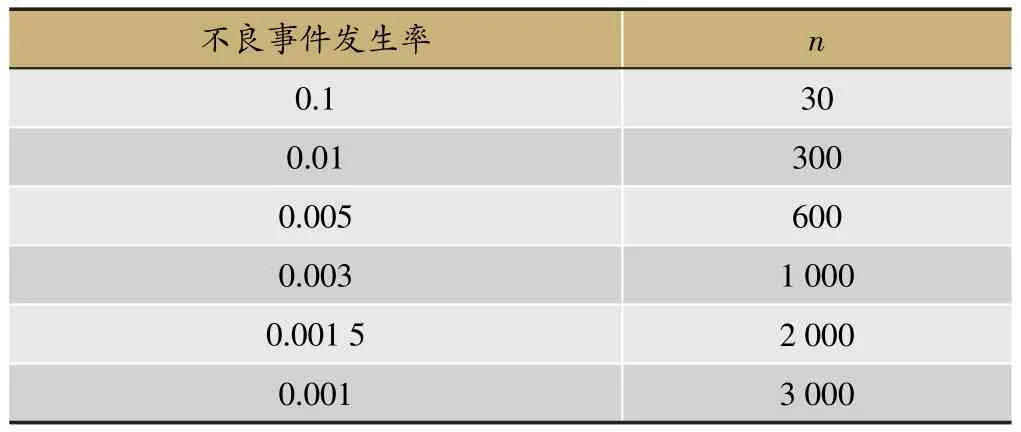
表13 不良事件发生概率和所需的样本量
2.3 统计分析方法
自1998年以来,中国药品不良反应自发呈报系统收集的不良反应报告呈逐年递增趋势,2015年报告数量已达139.8万份。最初自发呈报系统中包含了4种方法,我们在比较这4个方法后发现有些方法存在相似处,目前系统更新后仅保留频数分析和贝叶斯两种方法。频数分析法分为比例报告比值比法(Proportional Reporting Ratio,PRR)[10]、报告比数比法(Reporting Odds Ratio,ROR)[11]、英国MHRA采用的综合标准法[10],贝叶斯方法主要有WHO UMC采用的信息成分法(Information Component,IC)[12]、FDA 采用的多项伽玛泊松缩减法(Multi-item Gamma Poissonshrinker,MGPS)[13]。
2.4 拓展模式
国际针对药品不良事件和不良反应采取了两种新模式,一种是药品不良事件报告ICH E2B格式,另一种是不良事件分析的“三级体系”。
2.4.1 药品不良事件报告ICH E2B格式
ICH E2B格式是电子化的个例安全性报告格式,详细规范了临床安全性数据管理细则,提供了不同结构数据库在不同机构间传递的标准化形式;为了统一标准、整合共享。上市前、上市后的不良反应、不良事件报告均可以使用ICH E2B[14]。格式包括信息的格式和文件的结构。信息的格式:日期格式,性别的代码,专业术语的代码等;文件的结构:xml(Extensible Markup Language),是一种扩展性标识语言。欧美大部分地区、日本均采用ICH E2B报告,用于上市后药品不良反应报告。ICH-E2B主要包括:①管理和身份识别的有关的信息,有个案安全报告的识别(国家-组织-ID号)、信息的原始来源、报告发送者和接受者有关的信息;②报告中的信息,包括患者特性、不良反应/事件、化验结果和程序、药品信息、病例摘要及其他信息。
(1)上市前药品不良事件报告格式
美国FDA采用纸质格式(FDA form 3500A、CIOMS form)和电子版格式(E2B format)。其中,FDA form 3500A共包括7部分信息:患者信息、不良事件信息、产品可及性、产品信息、怀疑医疗设备信息、合并用药信息、报告者信息。纸质格式:WHO format(Intdis);电子格式:E2B format(xml-files)。其中。WHO format共3部分信息:①基本信息,包括报告来源国家、报告编号、年龄、性别;②不良反应信息,包括不良反应术语、不良反应编码;③药物信息,包括药物名称、药物剂量、药物剂量单位、服药开始时间、服药结束时间、服药原因。
(2)国内外不同监管机构要求比较
FDA在临床试验不良事件报告中推荐采用ICH E2B格式。EMA要求从2016年7月1日开始在临床试验不良事件报告中必须采用ICH E2B格式。CFDA尚未要求按照E2B格式上报,无论上市前还是上市后。目前CFDA采用的上报格式:上市前有严重不良事件报告表;上市后有药品不良反应/事件报告表。国内外不同监管机构要求比较(表14)。

图4 不良事件“三级体系”的分析方法
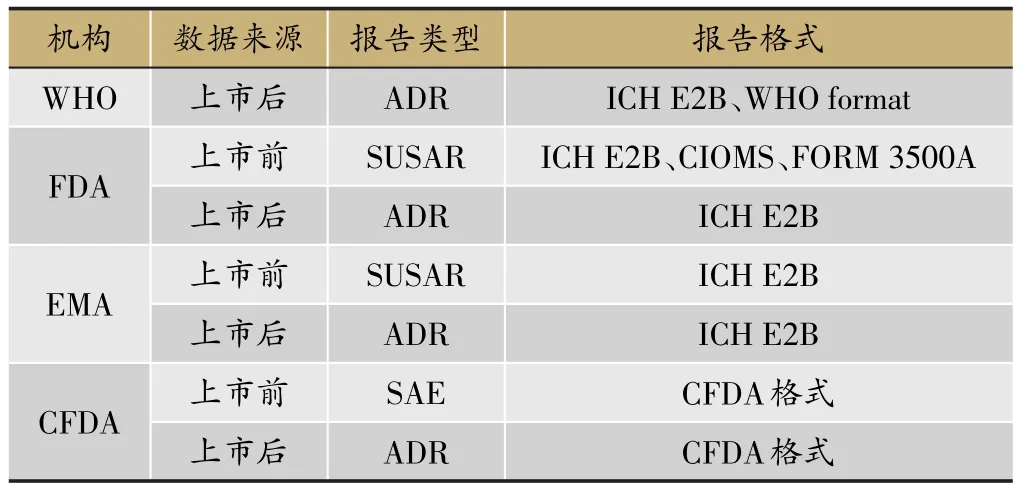
表14 国内外不同监管机构要求比较
2.4.2 不良事件的“三级体系”
根据有无事先设定的不良事件的假设,将不良事件分为有事先设定(1级)和无事先设定(2级和3级)情况。其中,区分2级和3级不良事件,可采用“4例原则”。即小于400例的均衡随机化试验中,任意一组出现MedDRA字典中PT(首选语)层级的不良事件≥4例时,则该不良事件属于2级不良事件,否则就是3级。
在不良事件的“三级体系”原则中,要求报告所有的不良事件,但是应使用不同的方法分析。该原则由美国药品研究与制造商协会(PhRMA)的安全性计划、评价和报告小组(SPERT)在2009年提出,主要用于IIB期及以上的药物、生物制品和疫苗研究。部分外企在申报的材料中采用。关于三级体系的说明应包括在试验方案和项目安全性分析计划中[15](图4)。
3 结语
国家“十二五”规划纲要指出“药品安全是重大的民生和公共安全问题,事关人民群众身体健康和社会和谐稳定”。因此,还要不断加强药品不良反应监测工作,时刻警戒药品风险信号,牢牢把住药品安全生命线。进而维护人民群众健康权益,促进医药产业持续健康发展。
1 国家食品药品监督管理总局.药品不良反应信息通报(第61期)关注口服何首乌及其成方制剂引起的肝损伤风险,2014-07-16.
2 国家食品药品监督管理总局.药品不良反应信息通报(第6期)关注口服何首乌及其成方制剂引起的肝损伤风险,2004-04-15.
3 国家食品药品监督管理总局.药品不良反应信息通报(第46期)关注雷公藤制剂的用药安全,2012-04-01.
4 国家食品药品监督管理总局.药品不良反应信息通报(第54期)关注复方青黛丸(胶丸、胶囊、片)引起的消化系统不良反应,2013-04-12.
5 国家食品药品监督管理总局.药品不良反应信息通报(第16期)警惕壮骨关节丸引起的肝损害,2013-08-09.
6 国家食品药品监督管理总局药品不良反应信息通报(第9期)警惕白蚀丸引起的肝损害、注射用头孢拉定与血尿,2005-09-05.
7 国家食品药品监督管理总局.药品不良反应信息通报(第44期)警惕生脉注射液的严重过敏反应,2012-01-10.
8 国家食品药品监督管理总局.药品不良反应信息通报(第4期)警惕甲氧氯普胺(片剂、注射剂)的锥体外系反应、警惕鱼腥草注射液引起的不良反应、警惕群体服用碘化油胶丸补碘引起的不良事件、卡马西平片的严重不良反应、安痛定注射液的不良反应,2003-09-01.
9 Food and Drug Administration.Preventable Adverse Drug Reactions:A Focus on Drug Interactions,2017-07-23.
10 Hauben M,Madigan D,Gerrits C M,et al.The role of data mining in pharmacovigilance.Expert Opin Drug Saf,2005,4(4):929-948.
11 van Puijenbroek E P,Bate A,Leufkens H G,et al.A comparison of measures of disproportionality for signal detection in spontaneous reporting systems for adverse drug reactions.Pharmacoepidemiol Drug Saf,2002,11(1):3-10.
12 Norén G N,Bate A,Orre R,et al.Extending the methods used to screen the who drug safety database towards analysis of complex associations and improved accuracy for rare events.Stat Med,2006,25(21):3740-3757.
13 Dumouchel W.Bayesian data mining in large frequency tables,with an application to the fda spontaneous reporting system.Am Stat,1999,53(3):177-190.
14叶小飞,郭晓晶,赵璐,等.个例安全性报告规范(ICH E2B)简介及应用.中国药物警戒,2012,9(3):149-151.
15 Crowe B J,Xia H A,Berlin J A,et al.Recommendations for safety planning,data collection,evaluation and reporting during drug,biologic and vaccine development:a report of the safety planning,evaluation,and reporting team.Clin Trials,2009,6(5):430-440.
Statistical Considerations on Drug Safety in Clinical Trials
He Jia
(Department of Health Statistics,Department of Health Service,Second Military Medical University,Shanghai 200433,China)
Drug safety is of paramount importance.It has major effect on people’s livelihood and public safety.The issue of drug safety should be considered throughout the new drug development cycle.This paper mainly introduced and discussed the statistical methods involved in the safety evaluation in clinical trials,in order to strengthen the drug safety surveillance and to guarantee drug safety in public health.
Clinical trial,drug safety,adverse reaction surveillance,safety evaluation
10.11842/wst.2017.07.002
R289
A
2017-03-20
修回日期:2017-07-20
* 国家自然科学基金委面上项目(81373105):贝叶斯倾向性评分方法研究及其在药品不良反应信号检测中的应用,负责人:贺佳。
** 通讯作者:贺佳,教授,主要研究方向:药品不良反应监测、药物流行病学。
(责任编辑:马雅静,责任译审:王 晶)
