低强度脉冲超声对磷酸三钙磨损颗粒诱导的假体周围骨细胞损伤的影响
2017-10-22胡露琦蔡红慧周湶钱朱莉陈启程袁楠毛红娇张云
胡露琦 蔡红慧 周湶钱 朱莉 陈启程 袁楠 毛红娇 张云
绍兴文理学院医学院(浙江绍兴 312000)
低强度脉冲超声(low intensity pulsed ultrasound,LIPUS)是一种非侵袭性物理治疗技术,其穿透能力强,可凭借其生物声学效应的机械波对组织、细胞施加生理剪切应力,促进骨重建和骨修复。Duarte等[1]于上世纪80年代发现LIPUS对兔骨折具有治疗作用,其治愈率可高达70%,目前已被美国FDA批准用于治疗骨折愈合。目前有关LIPUS与骨修复之间的关系研究主要集中在骨折愈合、牵张成骨和牙槽骨修复等领域[2-4],而对于LIPUS对磨损颗粒诱导假体周围骨溶解的影响研究在国内外均处于起步阶段。最近赵翔[5]和Hu[6]等研究表明LIPUS能抑制磨损颗粒诱导的假体周围破骨细胞形成和骨溶解,延缓磨损颗粒诱导的假体周围骨溶解进程,可作为防治假体周围骨溶解和关节松动的一种新方法,但是其作用的靶细胞目前尚不明确。
骨细胞均匀分布于矿化的骨基质中,其数量占骨组织细胞90%~95%。骨细胞能通过其丰富的伪足彼此连接形成骨细胞网络,维持自身生理功能或合成和分泌牙本质基质蛋白(dentin matrix protein 1,DMP-1)及骨硬化蛋白(sclerosis protein,SOST)等分子调控骨表面的成骨细胞和破骨细胞活动而影响骨重建[7-9],是维持成熟骨新陈代谢的主要细胞。最近我们研究显示磷酸三钙(tricalcium phosphate,TCP)磨损颗粒可诱导假体周围骨细胞凋亡,并释放TNF-α、IL-1β、IL-6和RANKL等因子释放,诱导破骨细胞活化,促进破骨细胞生成而调控假体周围骨溶解。由此推测:骨细胞参与调控磨损颗粒诱导的假体周围骨溶解,可能是LIPUS阻止假体周围骨溶解的另一种新的靶细胞。
本研究应用TCP磨损颗粒诱导小鼠颅骨溶解模型,以假体周围骨细胞为研究对象,观察LIPUS对假体周围骨细胞活性和功能的影响,探讨LIPUS对假体周围骨细胞损伤的保护作用及其机制;为研究和防治假体周围骨溶解和关节松动提供一种新的靶细胞、新方法和新的治疗靶点,并为LIPUS的临床应用提供理论和实验依据。
1 材料和方法
1.1 实验动物
6~8周龄ICR雄性小鼠30只,体重 18~22 g,清洁级,购自浙江省医学科学院实验动物中心。实验前将动物置室内适应性饲养3 d,温度22~28°C,相对湿度50%~70%。
1.2 小鼠颅骨溶解模型的构建[10]与实验分组
30只ICR雄性小鼠,随机分为正常组、模型组和LIPUS治疗组,每组10只。模型组和LIPUS治疗组小鼠分别于第1、3、5、7、9和第11周向颅顶注射TCP磨损颗粒0.5 mL(约1010个颗粒)建立小鼠颅骨溶解模型。治疗组小鼠于TCP磨损颗粒注射1周后小鼠颅顶接受LIPUS干预治疗3个月,正常组小鼠颅顶仅接受阴性超声探头按压处理3个月。
1.3 LIPUS参数设定与处理方法
采用超声骨折愈合仪(日本伊藤,Osteoteron-IV)进行治疗。LIPUS治疗参数为强度30 mW/cm2,频率1.5 MHz,频宽 200 μs,重复频率 1.0 kHz。治疗时将超声探头涂抹无菌耦合胶紧贴于小鼠颅骨顶皮肤上,每天治疗1次,每天治疗时间 20 min,每周 6 d,持续3个月。实验结束后处死所有实验动物取颅骨(以正中矢状线为中心的方形区域)。
1.4 测试指标与方法
1.4.1 Micro-CT分析与三位重建
各组小鼠颅骨经4%多聚甲醛固定48 h后,行Mi⁃cro-CT扫描(条件为电压59 kV、电流167 μA、深度16 bit、曝光时间295 ms,分辨率为9.18 μm),选颅骨相同位置的感兴趣区域(region of interest,ROI)进行三维重建。应用ABA专用骨骼分析软件定量分析骨溶解面积变化。
1.4.2 HE染色
颅骨经10%甲醛固定24 h和10%EDTA(pH7.4)脱钙2周后进行石蜡包埋。后经切片机对颅骨矢状面连续切片(5 μm),脱蜡后行HE染色观察假体周围骨细胞数量和活性,应用Image Pro-Plus 6.0(美国Media Cy⁃bernetics公司)软件分析骨细胞和死亡骨细胞数/mm2。
1.4.3 骨细胞的获取
参照[10,11]方法分离骨细胞。颅骨去除软组织和骨膜后,小鼠颅骨与0.2%IV型胶原酶溶液(用含70 mM NaCl,10 mM NaHCO3,60 mM sorbitol,30 mM KCl,3 mM K2HPO4,1 mM CaCl2,0.1%bovine serum albumin,0.5%glucose 和 25 mM HEPES)在37 °C培养箱中孵育20 min。去除上清液,颅骨碎片在37°C与含5 mM EDTA和0.1%BSA消化液中消化20 min,中间吹打1次。PBS冲洗后,重复以上消化步骤4次,收集最后2步消化后的上清液含有大量的骨细胞。
1.4.4 流式细胞术检测骨细胞凋亡
各组骨细胞与5 μL Annexin V-FITC/10 μL碘化丙啶(PI)轻轻混匀后,避光室温温育15 min。然后加入200 μL PBS并混匀,上流式细胞仪检测细胞凋亡情况。FITC的激发波长为488 nm,检测发射波长575 nm(Ex:488nm,Em:575nm)。
1.4.5 Western blotting ting检测蛋白表达[12]
各组骨细胞加入RIPA(100 μL)裂解液置于冰上裂解30 min。经12000 r/min离心15 min收集上清液即为总蛋白,通过BCA™试剂盒检测各组颅骨总蛋白浓度。各组颅骨蛋白提取液加入上样缓冲液后煮沸10 min,冷却后每孔上样30 μg蛋白,行12%SDS-PAGE分离蛋白,电泳完成后将蛋白转移到PVDF膜上,经5%脱脂牛奶常温封闭2 h后,分别加入兔源性一抗DMP-1(1︰500)、SOST(1︰500)、GRP78(1︰1000)、IRE1α(1︰1000)、XBP1s(1︰1000)、JNK(1︰1000)、p-JNK(1︰1000)和β-actin(1︰1000)置于4 °C孵育过夜。次日用TBST洗涤3次后加入HRP标记的二抗室温孵育2 h,TBST清洗3次加入ECL显色液;通过凝胶成像系统扫描分析各蛋白变化。
1.5 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(±s)表示,多组间比较采用单因素方差分析(one way ANOVA),组间两两比较采用Bonferroni矫正的配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 TCP磨损颗粒粒径分析结果
TCP磨损颗粒经电镜扫描显示TCP磨损颗粒平均粒径为1.997 μm(90%<3.2 μm),颗粒容易发生聚集(图1)。

图1 TCP磨损颗粒扫描电镜(A,×6000)和粒径分布(B)
2.2 各组小鼠颅骨溶解情况观察
我们前期已经成功建立了小鼠颅骨溶解模型,并通过抗酒石酸酸性磷酸酶(TRAP)染色验证了该模型,表明该模型可用于研究假体周围骨细胞损伤。本研究Micro-CT分析结果(图2)也显示:与正常组比较,模型组小鼠颅骨正中矢状缝发生明显骨溶解,而LIPUS干预组假体周围骨溶解程度明显减轻(P<0.05)。
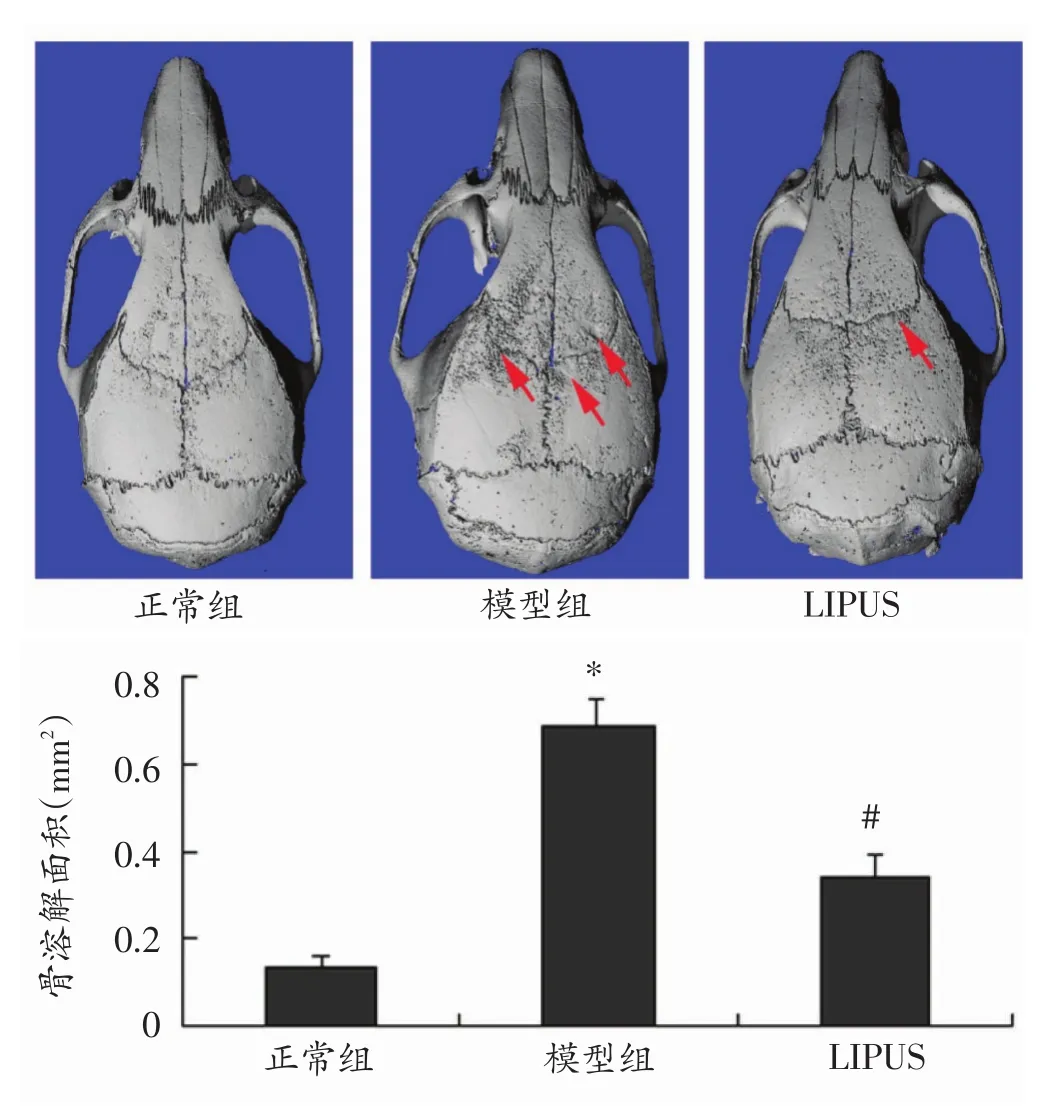
图2 Micro-CT分析各组小鼠颅骨溶解情况(n=3)
2.3 各组小鼠颅骨假体周围骨细胞特征蛋白表达比较
与正常组比较,模型组假体周围骨细胞特征蛋白DMP-1明显下调而SOST显著上调,造成DMP-1/SOST显著减少,即TCP磨损颗粒诱导假体周围骨细胞功能损伤;与正常组比较,差异具有统计学意义(P<0.05);而LIPUS治疗组假体周围骨细胞功能损伤减弱,表现为假体周围骨细胞DMP-1显著上调,SOST显著下调,DMP-1/SOST明显增加,增加为模型组的3.13倍;与模型组比较,差异具有统计学意义(P<0.05)。见图3。
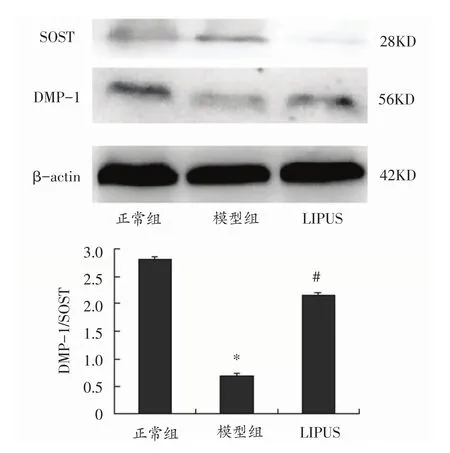
图3 免疫印迹技术检测各组骨细胞特征蛋白SOST和DMP-1表达的变化(n=3)
2.4 各组小鼠假体周围骨细胞损伤结果
与正常组比较,模型组假体周围骨细胞损伤严重(图4),表现为假体周围骨细胞活性降低,死亡骨细胞增加;与正常组比较,差异具有统计学意义(P<0.05);而LIPUS治疗组假体周围骨细胞活性明显升高,死亡骨细胞数减少,与模型组比较,差异具有统计学意义(P<0.05)。
2.5 各组小鼠颅骨假体周围骨细胞凋亡比较
流式细胞术定量分析结果显示,模型组凋亡的骨细胞数量较多,而正常组很少,提示TCP磨损颗粒能诱导假体周围骨细胞凋亡(图5);LIPUS干预可明显抑制TCP磨损颗粒诱导的骨细胞凋亡,阻止其凋亡和坏死,使细胞凋亡率和坏死率分别减少为11.35%和2.78%;与模型组比较,差异具有统计学意义(图5、表1,P<0.05)。
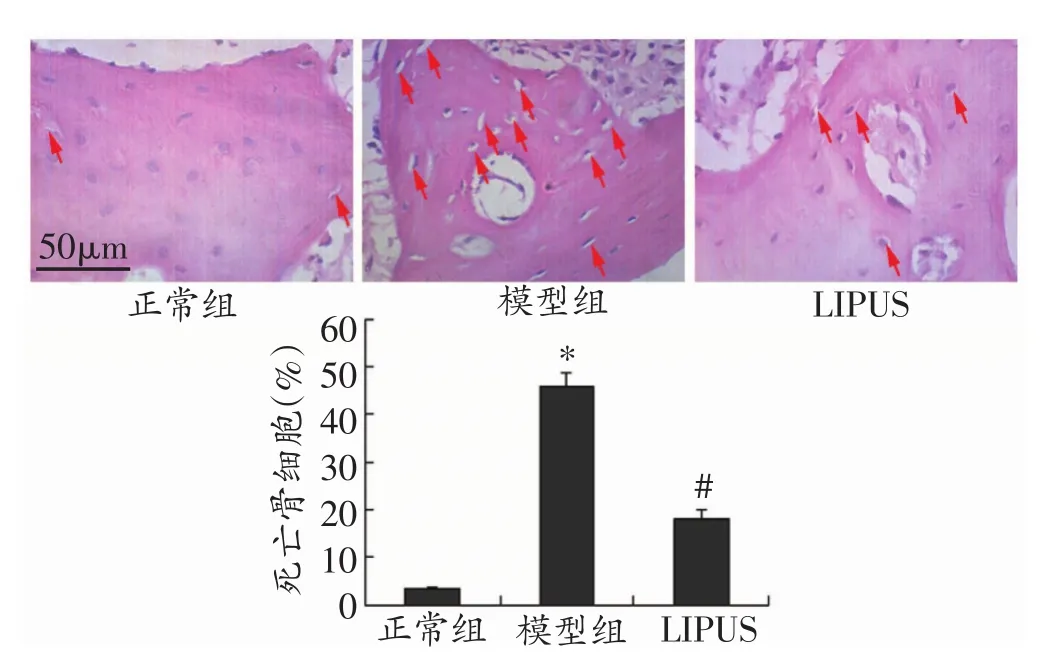
图4 HE染色检测各组假体周围骨细胞损伤情况(n=3)
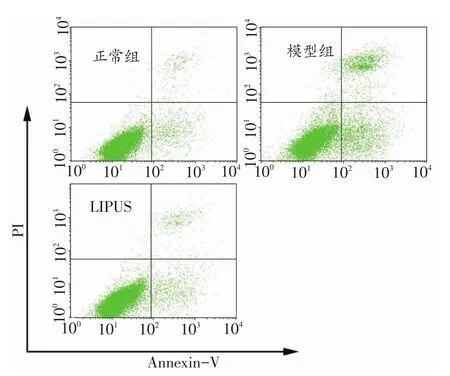
图5 流式细胞术定量分析TCP磨损颗粒诱导假体周围骨细胞凋亡
2.6 各组小鼠颅骨假体周围骨细胞内质网应激相关蛋白表达
与正常组比较,模型组假体周围骨细胞发生内质网应激反应,并激活IRE1α-XBP1-JNK信号通路,表现为内质网应激通路蛋白GRP78、IRE1α、XBP1s及p-JNK等表达均增加(图6),与正常组比较,差异具有统计学意义(P<0.05)。而LIPUS治疗组假体周围骨细胞内质网应激关键蛋白GRP78和IRE1α-XBP1-JNK通路蛋白表达均明显减少,与模型组比较,差异具有统计学意义(图6,P<0.05)。
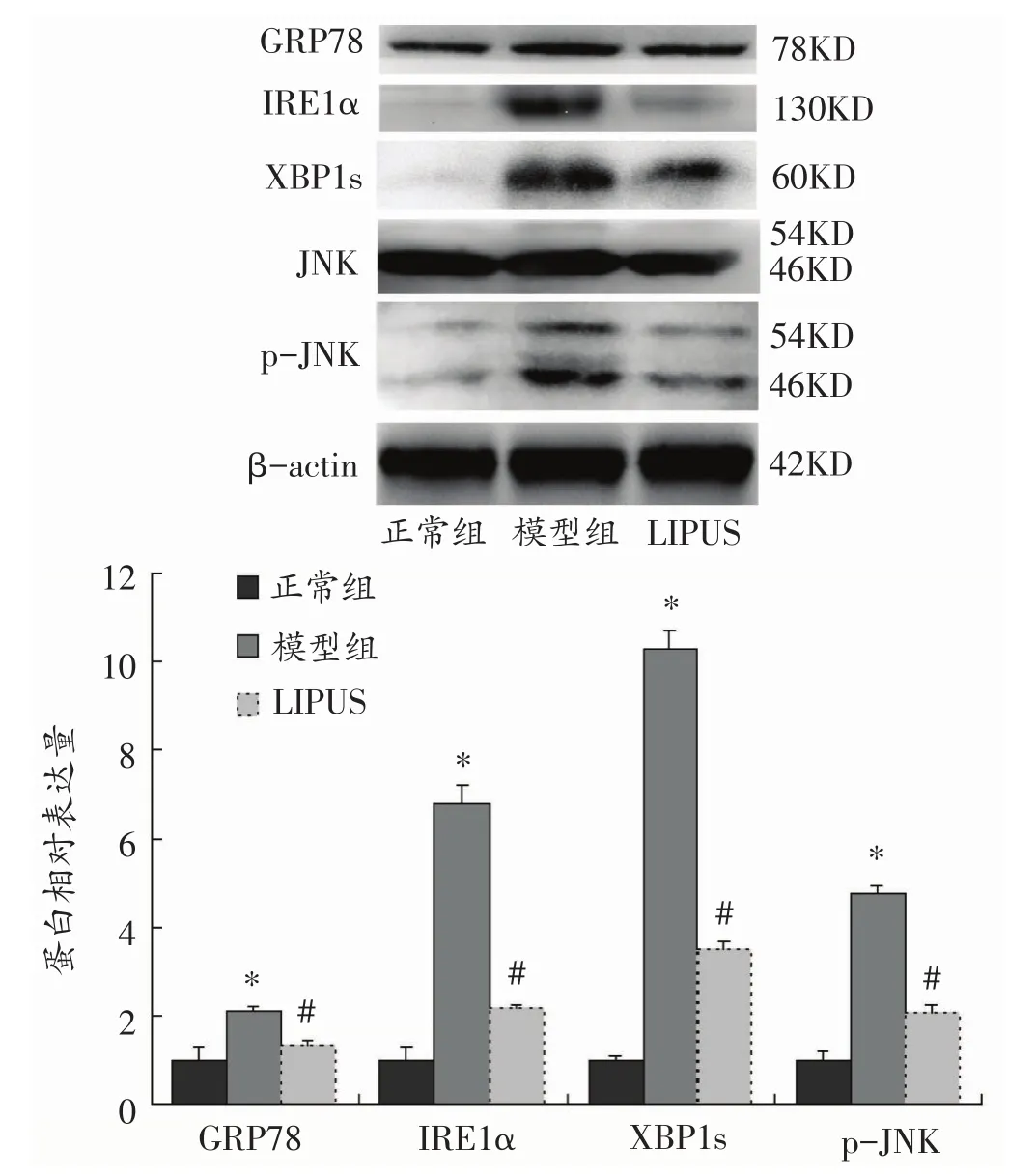
图6 免疫印迹法检测假体周围骨细胞内质网应激反应(n=3)
3 讨论
本研究首先通过Micro-CT分析证实了LIPUS可抑制TCP磨损颗粒诱导的假体周围骨溶解,与以往报道结果基本一致[7,8],表明LIPUS可作为治疗假体周围骨溶解和关节松动的一种新方法,但是其作用的靶细胞及其调控机制目前还未见报道。在此基础上,本研究以假体周围含量丰富的力学敏感细胞——骨细胞为研究对象,探讨频率为1.5 MHz、强度为30 mW/cm2的LI⁃PUS作用于假体周围骨细胞后的应答反应。实验结果显示LIPUS可明显抑制TCP磨损颗粒诱导的假体周围骨细胞活性降低、功能损伤及骨细胞凋亡,增加假体周围骨细胞活性、数量并恢复其功能。2014年Fung等[15]也报道该频率和强度的LIPUS能促进体外培养的骨细胞MLO-Y4释放力学信号分子PGE2和NO,促进成骨细胞MC3T3-E1的分化和新骨形成。上述结果提示,LI⁃PUS能对假体周围的骨细胞施加生理剪切应力,促进骨细胞释放力学信号分子,从而促进成骨细胞分化、抑制破骨细胞功能,最终阻止假体周围骨溶解和关节松动,但是其作用机制目前还不清楚。
LIPUS产生的剪切应力在细胞内部物理传递到内质网膜后会影响内质网功能[16,17],而内质网是细胞内蛋白合成、翻译后修饰、折叠组装的场所。多种病理刺激可引起未折叠蛋白或错误折叠蛋白在内质网腔内大量堆积,引发内质网应激。内质网应激的调控包含PERK、1型内质网转膜蛋白激酶1α(inositol-requiring enzyme,IRE1α)和活化转录因子6(activating transcrip⁃tion factor 6,ATF6)三条信号通路[18-21]。其中IRE1α是ER膜上I型跨膜蛋白,在内质网应激状态下可剪切细胞质中 XBP1,形成剪切型 XBP1(XBP1s),后者进入细胞核与内质网应激元件及未折叠反应元件结合,增强内质网应激相关蛋白GRP78等的表达[22]。然而严重或长期内质网应激时,IRE1α可结合肿瘤坏死因子受体相关因子(tumor necrosis factor associated factor 2,TRAF2),并与凋亡信号调节激酶(ASK1)形成TRAF2-ASK1-JNK复合体,激活JNK通路而调节凋亡相关基因Bcl-2和Bax,促进细胞凋亡[23]。我们前期研究已经证实内质网应激参与调控TCP磨损颗粒诱导的假体周围骨细胞损伤,表现为TCP磨损颗粒组小鼠假体周围骨细胞活性较低、骨细胞凋亡显著,内质网应激通路相关蛋白GRP78、IRE1α、XBP1s和p-JNK等表达也明显增加,且骨细胞损伤程度与上述内质网应激通路蛋白表达呈正相关。但是内质网应激在LIPUS阻止假体周围骨细胞损伤中的作用目前还未见报道。
本研究Western blotting结果显示LIPUS可明显减弱TCP磨损颗粒诱导的假体周围骨细胞内质网应激反应;LIPUS干预还能显著减少假体周围骨细胞中GRP78、IRE1α、XBP1s和 p-JNK 等蛋白表达,抑制IRE1α-XBP1-JNK信号通路的活化。以上研究结果表明LIPUS可阻止TCP磨损颗粒诱导假体周围骨细胞损伤,其作用机制可能与抑制IRE1α-XBP1-JNK通路的活化密切相关。
综上,LIPUS可通过缓解假体周围骨细胞中IRE1α-XBP1-JNK通路介导的内质网应激反应,阻止TCP磨损颗粒诱导的假体周围骨细胞损伤,进而减少假体周围骨溶解。因此,骨细胞可能是LIPUS防治假体周围骨溶解和关节松动的一种新的靶细胞,而IRE1α-XBP1-JNK通路可能是LIPUS阻止假体周围骨细胞损伤的一个新靶点。
