不同加工方法对白萝卜中异硫氰酸酯的影响
2017-10-19,
,
(河南科技学院食品学院,河南新乡 453003)
不同加工方法对白萝卜中异硫氰酸酯的影响
赵功玲,郭延成
(河南科技学院食品学院,河南新乡 453003)
目的:研究常见加工烹调方法对白萝卜中异硫氰酸酯(MTBITC)的影响。方法:以白萝卜为原料,经适当处理后,采用干燥、盐腌、榨制、微波及不同加热烹调方法进行加工,然后破碎,用正己烷提取其中的MTBITC,气相色谱法测定MTBITC的含量。结果:冷冻干燥的白萝卜中MTBITC的保存率可达85.46%,60 ℃常压干燥只有15.0%;榨制和腌制降低白萝卜中MTBITC的保存率,10%食盐腌制3 d、榨制2 min,保存率分别为72.05%、67.26%。高温长时加热对MTBITC的破坏较大,微波比电磁炉加热的方法要好。结论:加工烹调降低了白萝卜中MTBITC的保存率,温度越高,时间越长,切块越小,影响越大。
白萝卜,MTBITC,加工烹调,保存率
白萝卜属于十字花科植物,营养丰富,风味独特,价格低廉,有“冬令萝卜小人参”之美誉。萝卜味甘辛,具有下气宽中,消积导滞,止咳化痰等功能[1]。现代研究认为,萝卜含硫苷、淀粉酶和粗纤维,具有促进消化,增强食欲,加快胃肠蠕动和止咳化痰的作用[2]。近年研究表明:主要存在于萝卜中的异硫氰酸酯[3-4]—MTBITC(4-甲硫基-3-丁烯基异硫氰酸酯)对啮齿动物肝癌、乳腺癌、肠道癌、前胃癌有明显的阻断作用,并具有很好的降低小鼠血脂的作用[5-6]。
十字花科植物中含有大量硫苷,当植物细胞壁受到损伤后,在内源或外源性黑芥子硫苷酶的作用下,其中的硫苷经水解、分子重排(洛森重排)生成相应的异硫氰酸酯[7-8],在这一过程中,温度、压力、渗透压等可能会影响黑芥子硫苷酶活性及异硫氰酸酯的稳定性[9-10]。我们以白萝卜为原料研究了几种常用的加工方法(干燥、腌制、榨制)及烹调方法(炒、煮、蒸、炸、微波)对萝卜中MTBITC的影响,为人们合理加工烹调萝卜及其产品的开发提供一些理论依据。
1 材料与方法
1.1材料与仪器
白萝卜 购于本市农贸市场,要求新鲜干净,完好无破损;花生油 鲁花牌;Erucin 美国Sigma公司;正己烷 分析纯。
HR287粉碎机 珠海经济特区飞利浦电器有限公司;ST2118电磁炉 美的;WG900G型微波炉 顺德市格兰氏微波炉电器有限公司;KYYB-IA真空恒温干燥箱 北京中西科仪科技有限责任公司;DHG-9013C电热鼓风干燥箱 杭州蓝天化验仪器厂;FD-1系冷冻干燥机 北京科创百方科技发展有限公司;Trace DSQ气相色谱-质谱联用仪 美国Finnigan公司;Thermo TR-35MS石英毛细管色谱柱 美国热电公司。
1.2实验方法
1.2.1 样品的准备 用自来水清洗白萝卜,去蒂,按不同的加工烹调要求切分萝卜,然后立即进行加工烹调。
1.2.2 加工烹调方法对白萝卜中MTBITC的影响
1.2.2.1 干燥对白萝卜中MTBITC的影响 白萝卜切成大小为1 cm×1 cm×1 cm的块,称取50 g为一份,准备若干份,分别采用不同的方法干燥样品水分含量约为10%。冷冻干燥:压力控制在0.36 Pa,温度为-50 ℃,干燥期间,每间隔12 h取样1小份,检测水分含量。真空干燥:真空度设置为0.07 MPa,温度分别设置为30、35、40、45、50 ℃,干燥期间,每间隔1 h,取样1小份,检测水分含量。常压加热干燥:设置烘箱干燥温度分别为30、35、40、45、50、55、60、65、70 ℃,其余操作同真空干燥。大自然空气晒干:连续3 d,有太阳,微风,温度20~30 ℃,日照12 h,空气湿度50%~60%,其余操作同真空干燥。每个实验重复3次。
1.2.2.2 腌制对白萝卜中MTBITC的影响 切块大小对腌制白萝卜中MTBITC的影响:白萝卜分别切成0.5 cm×0.5 cm×0.5 cm、1 cm×1 cm×1 cm、1.5 cm×1.5 cm×1.5 cm、2 cm×2 cm×2 cm的块,称取250 g为一份,准备若干份。按10%的比例加食盐腌制萝卜3 d,期间搅拌一次。腌制过程中要避光密闭,室温18~20 ℃。腌制好的萝卜取出,用水冲去过多的盐,吸水纸轻轻去除多余的水分,备用。每个实验重复3次。为了减少微生物的影响,样品处理在无菌室进行操作。
食盐浓度对白萝卜中MTBITC的影响:白萝卜切成1 cm×1 cm×1 cm的块状,准备若干份,每份为250 g。分别按0%、5%、10%、15%、20%、25%的比例加食盐腌制萝卜3 d,其余操作同上。
腌制时间对白萝卜中MTBITC的影响:白萝卜切成1 cm×1 cm×1 cm的块状,准备若干份,每份为250 g。按10%的比例加食盐腌制萝卜0~15 d,每2 d搅拌一次。其余操作同上。
1.2.2.3 炒制对白萝卜中MTBITC的影响 切块大小对白萝卜中MTBITC的影响:白萝卜分别切成0.5 cm×0.5 cm×0.5 cm、1 cm×1 cm×1 cm、1.5 cm×1.5 cm×1.5 cm、2 cm×2 cm×2 cm的块,称取250 g为一份,准备若干份。将炒锅置于电磁炉上,倒入4 mL花生油,200 ℃档位加热至油温200 ℃,取一份样品放入锅中翻炒1 min,后加入20 mL蒸馏水,继续翻炒2 min。一个切块大小为一个处理。炒好的萝卜取出,迅速用0 ℃水冲去过多的油脂,吸水纸轻轻去除多余的水分,0 ℃冰箱密闭保存备用。每个实验重复3次。
炒制时间对白萝卜中MTBITC的影响:白萝卜切成1 cm×1 cm×1 cm大小,其余操作同上,只是将继续翻炒时间分别控制为1、2、3、4 min。一个翻炒时间独立为一个处理。
炒制温度对白萝卜中MTBITC的影响:白萝卜切成1 cm×1 cm×1 cm的块,250 g为一份,准备若干份。将炒锅置于电磁炉上,倒入4 mL花生油,200 ℃档位加热,温度分别控制在180~240 ℃,取一份样品放入锅中翻炒1 min,后加入20 mL蒸馏水,继续翻炒2 min。一个翻炒温度独立为一个处理。其余操作同上。
1.2.2.4 炸制对白萝卜中MTBITC的影响 炸制时间对白萝卜中MTBITC的影响:白萝卜切成1 cm×1 cm×1 cm大小,250 g为一份,准备若干份。铁锅置于电磁炉上,添加1000 g花生油,200 ℃档位加热至油温200 ℃,分别取四份样品放入锅中炸制2、3、4、5 min,期间每1 min搅动一次。其余操作同上。
炸制温度对白萝卜中MTBITC的影响:白萝卜切成1 cm×1 cm×1 cm大小,250 g为一份,准备若干份。铁锅置于电磁炉上,添加1000 g花生油,200 ℃档位加热油脂分别至180、200、220、240 ℃,取一份样品放入锅中炸制3 min。其余操作同上。
1.2.2.5 煮、蒸对白萝卜中MTBITC的影响 白萝卜切成1 cm×1 cm×1 cm大小,250 g为一份,准备若干份。电磁炉煮制:取四份样品,分别放入4倍量的沸腾的蒸馏水中,加盖,电磁炉200 ℃档分别煮制2、4、6、8 min。微波煮制:取四份样品,分别置于2000 mL微波炉专业的塑料盆中,加入1000 mL沸腾的蒸馏水中,加盖,放入微波炉中,调节功率为1800 W,分别煮制1、2、3、4 min。蒸:取四份样品,分别置于电磁炉上水已经沸腾的蒸锅中,200 ℃档分别蒸制2、4、6、8 min。烹调好的萝卜取出,迅速用0 ℃水冲一下,吸水纸轻轻去除多余的水分,0 ℃冰箱密闭保存备用。每个实验重复3次。
不同的煮制、蒸制时间独立为一个处理。每个实验重复3次。
1.2.2.6 榨制对白萝卜中MTBITC的影响 白萝卜切成1 cm×1 cm×1 cm大小。准确称量4份250 g萝卜块,用豆浆机分别搅打2、4、6、8 min,榨成萝卜泥,0 ℃冰箱密闭保存备用。一个搅打时间为一个处理。每个实验重复3次。
1.3MTBITC的提取及测定
原样或烹调加工后的样品加250 mL蒸馏水,捣碎机中搅打30 s,准确称取白萝卜汁50 mL于碘量瓶中,加入等量正己烷[11],振荡3 min,静置,取出正己烷层,-20 ℃保存。用GC-MS联用仪鉴定、测定MTBITC。气化室温度250 ℃,载气流速(He)1.0 mL/min,程序升温:80 ℃保持5 min,以20 ℃/min升到280 ℃,保持5 min。接口温度280 ℃,EI+源:70 eV,200 ℃,检测器电压350 V,扫描频率2次/s,质量范围:35~500 u;分流比:1∶20;进样量1 μL。以Erucin做标品[12]外标法定量。按下公式计算MTBITC保存率。
保存率(%)=烹调加工后含量/原料中的含量(平均值)×100
式(1)
1.4腌制白萝卜中水分含量的测定
常压干燥法测定白萝卜中水分含量[13],按下公式计算水分含量。
水分含量(%)=(腌制后的萝卜重量-干燥后的萝卜重量)/加工后的萝卜重量×100
式(2)

表1 干燥方法对白萝卜中MTBITC保存率的影响(%)Table 1 Effect of drying methods on preserving rate of MTBITC(%)

表3 切块大小对腌制白萝卜中MTBITC和水分的影响Table 3 Effect of size level on MTBITC and water content from salted white radish
1.5数据分析方法
实验结果采用Original 8.0进行统计分析。
2 结果与分析
2.1干燥对白萝卜中MTBITC的影响
四种方法干燥萝卜中水分至10%时,对MTBITC的影响及所需要的时间见表1和表2。很明显,不同干燥方法对MTBITC的影响很大,随加热温度的提高,保存率越低,且差异显著(p<0.05)。四种干燥方法中,冷冻干燥对MTBITC的影响最低,保存率可以达85%,其次是真空干燥,30 ℃保存率达80.26%,50 ℃还可达55.62%,常压干燥对MTBITC的破坏很大,30 ℃保存率为65.33%,50 ℃为26.42%,60 ℃只有15%,而自然干燥的MTBITC的保存率为38.46%。一般来说干燥温度越低,MTBITC的保存率越高,但自然干燥的保存率明显低于同温度下的其它方法,可能与白天紫外线的照射降低了MTBITC的保存率有关[14]。相同温度下,真空干燥比常压干燥的保存率高,并且随温度的升高,两种加热方式下的保存率之差越大(15%~29%),说明真空干燥的优势越明显。

表2 干燥白萝卜所需要的时间(h)Table 2 Time of complete drying ofdifferent drying methods(h)
真空干燥与常压干燥相比,因为真空降低了水的沸点,加快了干燥速度,相同温度下干燥至约10%的含水量的时间缩短17~24 h,也很好解释了真空干燥的保存率高的原因。这些结果验证了MTBITC的热稳定性差[15-16],以及容易被氧化的性质[17]。虽然冷冻干燥的时间较长(48 h),但由于温度很低(-50 ℃),MTBITC的保存率很高。与30 ℃常压加热相比,自然干燥的时间短5 h,可能与大自然更好的空气流通,水分蒸发快有关。
2.2腌制对白萝卜中MTBITC的影响
2.2.1 切块大小对腌制白萝卜中MTBITC的影响 由表3看出,腌制降低了萝卜中MTBITC的含量、保存率和水分,并随萝卜切块的减小,MTBITC的含量、保存率由最大块的4.49 mg/100 g、76.59%,降为最小块的2.77 mg/100 g、47.27%。其中的原因与萝卜切块体积增大,其内部的MTBITC避免了与氧气接触,从而免遭氧化有关;另外可能还与切块体积增大,在3 d的腌制时间内食盐不能完全渗透其中,水分及MTBITC都受到了保护有关。
2.2.2 食盐浓度对白萝卜中MTBITC的影响 从表4看出,随食盐浓度从0%增大到25%,腌制的萝卜中MTBITC的含量、保存率从4.94 mg/100 g、84.23%降到2.66 mg/100 g、45.41%,水分的含量从95.11%减少到43.31%。保存率的降低可能与MTBITC不耐受高的渗透压而分解及随水分的流失有关。0%的食盐浓度,MTBITC的保存率只有84.23%而非100%,应该与切块表面的MTBITC在3 d的放置过程中被氧化有关。本实验与Coogan的研究结果相似[18]。

表4 食盐浓度对白萝卜中MTBITC和水分的影响Table 4 Effect of salt level on MTBITC and water content
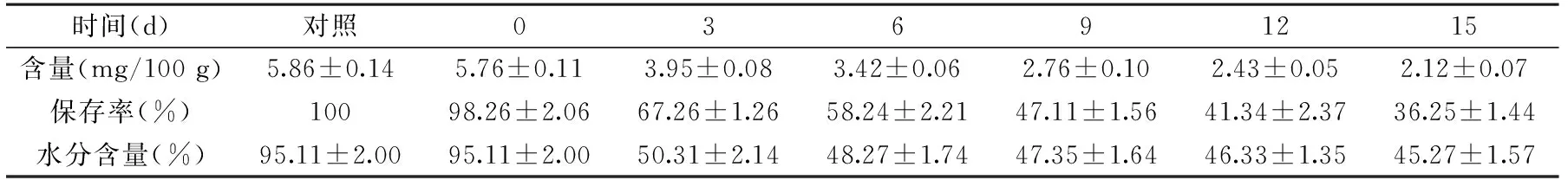
表5 腌制时间对白萝卜中MTBITC和水分的影响Table 5 Effect of salting time on MTBITC and water content

表6 切块大小对炒制白萝卜中MTBITC的影响Table 6 Effect of size level on MTBITC from pickled white radish

表7 炒制时间对白萝卜中MTBITC的影响Table 7 Effect of pickling time on MTBITC

表8 炒制温度对白萝卜中MTBITC的影响Table 8 Effect of pickling temperature on MTBITC

表9 炸制时间对白萝卜中MTBITC的影响Table 9 Effect of frying time on MTBITC
2.2.3 腌制时间对白萝卜中MTBITC的影响 从表5看出,随腌制时间的延长,白萝卜中MTBITC的含量、保存率从0 d的5.76 mg/100 g、98.26%降到15 d的2.12 mg/100 g、36.25%,再一次说明MTBITC在高渗溶液中的不稳定性;0~3 d,萝卜中水分的含量从95.11%减少到50.31%,但3~15 d,萝卜中的水分含量仅从50.31%降到45.27%,说明1 cm×1 cm×1 cm大小的萝卜块,10%的食盐浓度腌制3 d几乎可使萝卜内外的食盐浓度相同,完成腌制过程,其中3 d的MTBITC的保存率为67.26%。0 d的萝卜中MTBITC的保存率为98.26%而非100%,应该与萝卜块表面和10%的食盐相混合的瞬间,造成MTBITC的流失或氧化有关[10]。
2.3炒制对白萝卜中MTBITC的影响
由表6看出:随萝卜切块体积的增大,MTBITC的含量、保存率随之增大,由最小块的0.60 mg/100 g、10.24%增大到1.23 mg/100 g、20.9%,其中的原因与切块体积大、内部的MTBITC被保护而免遭氧化有关;经品尝,1 cm×1 cm×1 cm的块3 min炒制可达完全成熟,较大的块只能达到八或六成熟,所以随萝卜切块体积的增大,在3 min炒制时间内,萝卜中心部位受到的热能冲击越小,MTBITC的保存率越高。通过计算发现,MTBITC保存率的变化与切块大小无线性关系。
如表7所示:随炒制时间的延长,MTBITC的含量、保存率随之降低,并且降低的幅度由2 min的1.15 mg/100 g、19.52%到5 min的0.38 mg/100 g、6.46%,相比于切块大小的4个处理,高温度(200 ℃)下,加热时间比切块大小对MTBITC的影响大。
由表8知,随炒制温度的提高,MTBITC的含量、保存率随之降低,并且温度超过180 ℃,MTBITC的含量、保存率下降速度非常快,由0.94 mg/100 g、15.94%(200 ℃)降低为0.20 mg/100 g、3.46%(240 ℃)。建议炒菜的温度最好不超过200 ℃。
2.4炸制对白萝卜中MTBITC的影响

表10 炸制温度对白萝卜中MTBITC的影响Table 10 Effect of Frying temperature on MTBITC

表11 微波煮对白萝卜中MTBITC的影响Table 11 Effect of boiling by Induction Cooker on MTBITC

表12 电磁炉煮、蒸对白萝卜中MTBITC的影响Table 12 Effect of boiling and steaming by microwave on MTBITC

表13 榨制对白萝卜中MTBITC的影响Table 13 Effect of pressing on MTBITC
由表9、表10看出,随炸制时间的延长,MTBITC的含量、保存率随之降低,由2 min的0.49 mg/100 g、8.34%降为5 min的0.19 mg/100 g、3.36%;炸制温度对MTBITC影响的变化规律同炸制时间,MTBITC的含量、保存率由180 ℃的0.54 mg/100 g、9.27%降为240 ℃下不含MTBITC。对比表5、表6数据,发现相同温度和时间下,炒制处理的萝卜中MTBITC的保存率比炸制高,其中的原因应该与炸制所用的油脂多,温度始终能保持较高的水平有关[19]。
2.5煮、蒸对白萝卜中MTBITC的影响
从表11、表12看出:电磁炉煮制、微波煮制与电磁炉蒸制三种加热方式,延长加热时间,MTBITC保存率随之降低;电磁炉煮制与电磁炉蒸制方法相比,尽管加热温度相同,但相同时间下,蒸制的MTBITC保存率要稍高于煮制,其中的原因应该与煮制过程中,水的沸腾造成萝卜的振动翻滚较大[20],MTBITC被氧化的程度增大有关。
微波与电磁炉加热相比,食物熟制速度快,加热时间短[21]。在本文实验条件下,微波2 min,萝卜已经成熟,MTBITC保存率还保持在32.25%,而电磁炉加热最高的保存率为2 min的13.98%,但萝卜只达到八成熟,所以微波比电磁炉加热具有明显的优势。由表7和表12知,在相同的加热时间下,炒制的MTBITC保存率比蒸制、煮制高,其中的原因可能与介质的保护作用有关[19]。
2.6榨制对白萝卜中MTBITC的影响
榨制过程虽然温度低,但萝卜颗粒较小,接触氧气的机会多,会增大性质不稳定的物质的损失[9,22]。榨制时间越长,样品颗粒度越小,造成活性成分的损失越大。正如表13结果所示,MTBITC的含量、保存率随榨制时间的延长而降低,由2 min的4.23 mg/100 g、72.05%降为8 min的2.65 mg/100 g、45.26%。相对于高温加热和腌制方法,榨制对MTBITC的影响较小。
3 结论
存在于十字花科植物中的异硫氰酸酯一般都具有很好的抗氧化、抗癌等生物活性,但性质可能很不稳定,如研究较多的源于西兰花中的莱菔硫烷,已经被证实具有很强的抗癌作用,但对温度很敏感、容易被氧气,对光不敏感[23]。在我们的研究中表明,高温长时间加热、有氧气、食盐可加速白萝卜中MTBITC的破坏,光照可能会破坏MTBITC。由于MTBITC也具有很强的抑制多种癌症的作用,如何在加工以及烹调过程中保护MTBITC,防止其遭到破坏显得很重要。低温短时加热、减少氧气作用时间、低盐短时腌制或采取上浆、挂糊等方法,可以最大限度地保护萝卜中的MTBITC。
[1]Kuang P,Song D,Yuan Q,et al. Separation and purification of sulforaphene from radish seeds using macroporous resin and preparative high-performance liquid chromatography[J]. Food Chem,2013,136(2):342-347.
[2]Navarro S L,Schwarz Y,Song X,et al. Cruciferous vegetables have variable effects on biomarkers of systemic inflammation in a randomized controlled trial in healthy young adults.[J]. Journal of Nutrition,2014,144(11):1850-1857.
[3]Suh S J,Moon SKKim C H. Raphanus sativus and its isothiocyanates inhibit vascular smooth muscle cells proliferation and induce G1 cell cycle arrest[J]. International Immunopharmacology,2006,6(5):854-861.
[4]Reyes L F,Villarreal J E,Cisneroszevallos L. The increase in antioxidant capacity after wounding depends on the type of fruit or vege
Table tissue[J]. Food Chemistry,2007,101(3):1254-1262.
[5]Barillari J,Iori R,Papi A,et al. Kaiware Daikon(Raphanus sativus L.)Extract:A Naturally Multipotent Chemopreventive Agent[J]. Journal of Agricultural and Food Chemistry,2008,56(17):7823-7830.
[6]Castro-Torres I G,De la O-Arciniega M,Gallegos-Estudillo J,et al. Raphanus sativus L. var niger as a source of phytochemicals for the prevention of cholesterol gallstones[J]. Phytother Res,2014,28(2):167-171.
[7]Zhang Y,Kensler T W,Cho C G,et al. Anticarcinogenic activities of sulforaphane and structurally related synthetic norbornyl isothiocyanates[J]. Proc Natl Acad Sci U S A,1994,91(8):3147-3150.
[8]Beevi S S,Mangamoori L N,Subathra M,et al. Hexane Extract of Raphanus sativus L. Roots Inhibits Cell Proliferation and Induces Apoptosis in Human Cancer Cells by Modulating Genes Related to Apoptotic Pathway[J]. Plant Foods for Human Nutrition,2010,65(3):200-209.
[9]Song L,Thornalley P J. Effect of storage,processing and cooking on glucosinolate content of Brassica vegetables[J]. Food and Chemical Toxicology,2007,45(2):216-224.
[10]Murcia M A A,Jiménez A M A,Martínez-Tomé M. Vegetables antioxidant losses during industrial processing and refrigerated storage[J]. Food Research International,2009,42(8):1046-1052.
[11]Nakamura Y,Iwahashi T,Tanaka A,et al. 4-(Methylthio)-3-butenyl Isothiocyanate,a Principal Antimutagen in Daikon(Raphanus sativus;Japanese White Radish)[J]. Journal of Agricultural and Food Chemistry,2001,49(12):5755-5760.
[12]Hanlon P R,Webber D M,Barnes D M. Aqueous Extract from Spanish Black Radish(Raphanus sativus L. Var.niger)Induces Detoxification Enzymes in the HepG2 Human Hepatoma Cell Line[J]. Journal of Agricultural and Food Chemistry,2007,55(16):6439-6446.
[13]GB5009.3—2016 食品中水分的测定方法[S]. 北京:中国标准出版社,2016.
[14]Syed S B S. Antioxidant,antimicrobial and chemopreventive efficacy of Raphanus sativus[J]. Kukatpally,2010.
[15]Amarowicz R,Estrella I,Hern Ndez T,et al. Free radical-scavenging capacity,antioxidant activity,and phenolic composition of green lentil(Lens culinaris)[J]. Food Chemistry,2010,121(3):705-711.
[16]Yuan G F,Wang X P,Guo R F,et al. Effect of salt stress on phenolic compounds,glucosinolates,myrosinase and antioxidant activity in radish sprouts.[J]. Food Chemistry,2010,121(4):1014-1019.
[17]Martinez-Villaluenga C,Pe As E,Ciska E,et al. Time dependence of bioactive compounds and antioxidant capacity during germination of different cultivars of broccoli and radish seeds[J]. Food Chemistry,2010,120(3):710-716.
[18]Coogan R C,Wills R B H. Effect of drying and salting on the flavour compound of Asian white radish[J]. Food Chemistry,2002,77(3):305-307.
[19]孟天真,闫永芳,赵春江,等. 中式烹饪对马铃薯中抗性淀粉及主要营养物质的影响[J]. 食品工业科技,2012(11):86-89.
[20]Burgos G,Amoros W,Muoa L,et al. Total phenolic,total anthocyanin and phenolic acid concentrations and antioxidant activity of purple-fleshed potatoes as affected by boiling[J]. Journal of Food Composition & Analysis,2013,30(1):6-12.
[21]Mejíagaribay B,Palou E,Lópezmalo A. Composition,diffusion,and antifungal activity of black mustard(Brassica nigra)essential oil when applied by direct addition or vapor phase contact.[J]. J Food Prot,2015,78(4):843-848.
[22]马婧,袁春龙,杨丽,等.不同粉碎条件对葡萄籽超微粉破壁率的影响[J].食品工业科技,2015(4):247-250.
[23]李雷,邹翔,季宇彬. 十字花科植物中异硫氰酸盐的性质及活性研究[J].哈尔滨商业大学学报:自然科学版,2007,23(4):385-389(399).
Effectofdifferentprocessingmethodsonisothiocyanateofwhiteradish
ZHAOGong-ling,GUOYan-cheng
(College of Food,Henan Institute of Science and Technology,Xinxiang 453003,China)
Objective:To study the effect of common processing and cooking methods on isothiocyanate(MTBITC)in white radish. Methods:The white vadish as raw material,after appropriate treatment,were treated with different processing cooking methods:dried,salted,pressed,microwave and different cooking methods,and then broken. The MTBITC was extracted with n-hexane and the content of MTBITC was determined by gas chromatography. Results:The preservation rate of MTBITC was 85.46% after freeze-dried,but only 15.0% after ambient pressure dried at 60 ℃. The preservation rate of MTBITC in white radish was reduced by pressing and pickling method. The preserving rate was 72.05% and 67.26% respectively when the white radish was cured with 10% sodium chloride for 3 days and pressed for 2 min. The higher and longer the temperature and time was,the larger the MTBITC was damaged. The microwave was better than the induction cooker heating method. Conclusion:The processing and cooking reduced the preservation rate of MTBITC in white radish. Higher temperature,smaller cut and longer time resulted in greater loss of MTBITC
white radish;MTBITC;processing and cooking methods;conservative rate
TS255.1
B
1002-0306(2017)19-0166-06
10.13386/j.issn1002-0306.2017.19.031
2017-04-14
赵功玲(1968-),女,硕士研究生,副教授,研究方向:植物生物活性,E-mail:hnzgl@163.com。
河南省科技厅项目(152300410096);河南省教育厅项目(16A550014)。
