超声波辅助离子液体提取石榴籽中原花青素的工艺及其动力学与热力学分析
2017-10-19,,,,,
,,,, ,
(1.枣庄学院生命科学学院,山东枣庄 277160;2.中国人民解放军空军总医院药学部,北京 100142)
超声波辅助离子液体提取石榴籽中原花青素的工艺及其动力学与热力学分析
王占一1,郑丹丹1,张立华1,王玉海1,戴博2,李卓瓦1
(1.枣庄学院生命科学学院,山东枣庄 277160;2.中国人民解放军空军总医院药学部,北京 100142)
探讨了超声波辅助离子液体提取石榴籽中原花青素的工艺条件,以原花青素得率为考察指标,提取时间、提取温度、超声功率和离子液体浓度为实验因子,在单因素实验基础上,通过Box-Behnken实验设计优化最佳提取工艺条件,并对提取过程的动力学和热力学性质进行了分析。结果显示:原花青素的最佳提取工艺条件为:提取时间32 min、提取温度52 ℃、超声功率300 W、离子液体浓度1.15 mol/L,此条件下的原花青素得率达到1.718%;在该工艺参数下,提取速率常数k值为0.313 min-1,表面扩散系数DS值为7.936×10-5cm2/min,而相同提取条件下,无水乙醇空白对照组的k值仅为0.063 min-1,表面扩散系数DS值为1.597×10-5cm2/min,提取速率明显提高;提取过程的热力学参数,熵ΔH为248.51 kJ/mol,焓ΔS为813.69 J/(mol·K),数值均大于零,说明离子液体提取过程为吸热熵增加过程,自由能ΔG为-18.254 kJ/mol,小于零,为自发过程。离子液体提取的工艺参数及动力学与热力学分析,均可用于石榴籽中原花青素提取过程的工程放大和优化控制。
石榴籽,原花青素,超声波,离子液体,动力学,热力学
石榴(PunicagranatumL.)是亚热带地区常见树种,在我国分布区域广泛[1]。石榴的果实类型为浆果,可食用部分为其肉质多汁的外种皮,而内种皮及以内的部分,即所谓的“石榴籽”经常作为废物被丢弃。近年来,大量研究证明石榴籽中具有多种活性成分,且普遍具有较好的生物活性。杨丽娜等[2]研究发现,石榴籽提取物中多糖及多酚类成分,具有较强的清除自由基能力,对四氯化碳诱导小鼠肝损伤保护作用效果明显。张立华等[3]研究发现,石榴籽提取物中酚酸类成分,对大肠杆菌和金黄色葡萄球菌均有较好的抑制作用。原花青素作为酚酸性成分广泛存在于植物浆果种子中,目前,研究较多的为葡萄籽[4]、沙棘籽[5]、爬山虎籽[6]等,而对石榴籽中原花青素的研究鲜见文献报道。王新红等[7]研究发现,以离子液体1-乙基咪唑四氟硼酸盐([EIM]BF4)提取山楂中酚酸性成分,具有蒸汽压低、挥发性小、溶解能力强、萃取能力好等诸多优点。章凯等[8]研究发现,以离子液体1-丁基-3-甲基咪唑氯盐([BMIM]Cl)提取柠檬皮中果胶类成分,方法快速高效、操作简单、环境友好。虽然离子液体在食品领域中的安全性问题不可忽视,但是其诸多的优点和广阔的发展前景,使其已经成为一种新型的绿色溶剂,近几年在食品领域中越来越广泛的应用[9]。超声波辅助溶剂法,通过产生高效的空化效应,使提取过程能够在短时间内完成,有效避免了活性成分被氧化而使功效丧失,该技术已经广泛应用于中药有效成分提取领域[10-11]。但是,采用超声波辅助离子液体提取石榴籽中原花青素类成分的研究,国内外还未见文献报道。因此,本研究以石榴籽为材料,1-丁基-3-甲基咪唑溴盐([BMIM]Br)离子液体为溶剂,采用超声波辅助提取石榴籽中原花青素,并对提取过程的动力学和热力学性质进行了分析,以期为该生产工艺的工程放大提供技术参考。
1 材料与方法
1.1材料与试剂
野生石榴采自鲁南地区峄城“万亩石榴园”主产区,经枣庄学院闫志佩教授鉴定为正品石榴科石榴(PunicagranatumL.),石榴籽经过手工搓洗,在50 ℃条件下干燥72 h,粉碎,过24目筛(颗粒半径R约为0.05 cm),备用。原花青素对照品(纯度>98%) 合肥博美生物科技有限责任公司;1-乙基-3-甲基咪唑溴盐([EMIM]Br)、1-丙基-3-甲基咪唑溴盐([PMIM]Br)、1-丁基-3-甲基咪唑溴盐([BMIM]Br)、1-己基-3-甲基咪唑溴盐([HMIM]Br)、1-辛基-3-甲基咪唑溴盐([OMIM]Br)、1-丁基-3-甲基咪唑氯盐([BMIM]Cl)、1-丁基-3-甲基咪唑碘盐([BMIM]I) 阿拉丁试剂(上海)有限公司(纯度>99%);无水乙醇、香草醛、硫酸(均为分析纯) 天津市东丽区天大化学试剂厂;蒸馏水 枣庄学院生物学省级教学示范中心提供。
1.2仪器与设备
TU-1800SPC型紫外-可见光分光光度计 北京普析通用仪器有限公司;DGH-9240型电热恒温鼓风干燥箱 上海一恒科技有限公司;FW135型多功能粉碎机 天津泰斯特仪器有限公司;EB-280-12型电子分析天平 日本岛津公司;HN-CQY型低温超声波萃取仪 上海汗诺仪器有限公司;DK-80型数显恒温水浴锅 金坛市医疗仪器厂;RE-2000A型旋转蒸发仪 河南巩义予化仪器仪器有限公司;SH2-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;标准检验筛 浙江上虞华美仪器纱筛厂。
1.3实验方法
1.3.1 原花青素含量测定 采用香草醛-浓硫酸法[12-13]。精密称取干燥至恒重的原花青素对照品2.5 mg,用无水乙醇溶解并定容至25 mL,即得0.1 mg/mL的原花青素对照品溶液。精确吸取原花青素对照品溶液0.0、1.0、2.0、3.0、4.0、5.0 mL分别用无水乙醇定容至10 mL,分别吸取1 mL置于10 mL具塞比色管中,先后依次加入3%香草醛-乙醇溶液2.5 mL和体积分数30%的浓硫酸-乙醇溶液2.5 mL,充分摇匀后,于30 ℃恒温水浴锅中保温20 min,用无水乙醇定容后,于500 nm波长处测定吸光度(A值),并以A值为纵坐标,原花青素系列浓度为横坐标,绘制原花青素标准曲线,求得回归方程为:A=3.76C+0.0013,R2=0.9992,原花青素含量在0~0.005 mg/mL范围内与A值之间线性关系良好。
1.3.2 样品处理方法 准确称取粉碎至规定粒度的石榴籽粉末5.0 g,置于250 mL干燥锥形瓶中,加入不同浓度离子液体的乙醇溶液至设定料液比例,用保鲜膜封住瓶口,设置超声波输出功率,在超声波萃取仪上提取到设定时间[14]。反应结束后,提取液在3000 r/min转速下离心15 min,取上清液用0.45μm微孔滤膜过滤,适当浓缩后定容,作为供试品溶液。准确量取1 mL于10 mL具塞比色管中,按照“1.3.1”项下实验方法测定A值,计算样品中原花青素含量及得率[15]。
式(1)
1.3.3 提取工艺优化设计 单因素实验中,固定不变条件为:选择离子液体[BMIM]Br、提取时间30 min、料液比1∶25、提取温度50 ℃、超声功率250 W、离子液体浓度1.0 mol/L。考察离子液体种类、提取时间(15、20、25、30、35、40 min)、料液比(1∶10、1∶15、1∶20、、1∶30、1∶35)、提取温度(20、30、40、50、60、70 ℃)、超声功率(100、150、200、250、300、350 W)和离子液体浓度(0.6、0.8、1.0、1.2、1.4、1.6 mol/L)6个因素对石榴籽中原花青素得率的影响。在单因素实验基础上,采用Box-Behnken实验设计,以石榴籽中原花青素得率(Y)为响应值,通过响应面分析优化提取工艺条件。表1为响应面实验因素水平表。

表1 响应面实验因素水平表Table 1 Levels and factors Table ofresponse surface experiment
1.3.4 提取过程动力学分析 精密称取5.0 g石榴籽干燥粉末(颗粒半径R约为0.05 cm),共计15份,分别置于15支250 mL锥形瓶中,将15支锥形瓶随机分为5组,每组3支作平行实验。再以小组为单位,分别加入1.15 mol/L的[BMIM]Br离子液体125 mL,超声波功率设置为300 W,在不同温度条件下(315、320、325、330、335 K)进行超声波辅助提取。同时,在相同工艺参数下,以无水乙醇空白溶剂作对照实验。反应11 min后,每隔3 min取样0.1 mL,直至32 min提取完全为止,分别进行石榴籽中原花青素的质量浓度测定,根据测得的实验数据进行动力学与热力学分析。
中药有效成分的提取过程中,当有效成分从植物颗粒内部向介质中扩散时,是一种非稳态的扩散过程,当传质过程的外部阻力可以忽略不计,并假设样品粉末为球形颗粒时,浓度差异只与传质径向相关,扩散速率可以采用Fick扩散公式来计算,用如下方程进行动力学参数拟合[16-17],为了方便表达,假设Y=ln[C∞/(C∞-C)]。
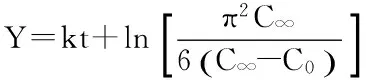
式(2)
式中:C∞为提取平衡时刻,介质中原花青素的质量浓度,mg/mL;C为t时刻,介质中原花青素的质量浓度,mg/mL;C0为介质中原花青素的初始质量浓度,mg/mL;k为提取速率常数,min-1;DS为表面扩散系数,cm2/min;r为假设石榴籽粉末颗粒为球形的半径,cm。
1.3.5 提取过程热力学分析 在一定温度下,当达到提取平衡时,石榴籽中原花青素提取过程的热力学参数ΔG、ΔH和ΔS可以通过Van’t Hoff方程计算[18],公式如下:
式(3)
式中:ΔG为提取过程的自由能,kJ/mol;ΔH为提取过程的熵,kJ/mol;ΔS为提取过程的焓,J/(mol·K);R为摩尔气体常数,数值为8.314J/(mol·K);T为提取温度,K。
1.4数据分析
BBD实验设计采用Design-Expert8.0.5统计分析软件,图形制作采用Excel数据处理软件。
2 结果与分析
2.1原花青素的提取工艺参数优化
2.1.1 单因素实验结果与分析
2.1.1.1 离子液体种类对原花青素得率的影响 如图1所示,前5种离子液体的阴离子均为[Br-],在无水乙醇中均有很好的溶解度,但是它们对原花青素的提取效果不同,随着阳离子烷基链由1-乙基-3-甲基咪唑到1-丁基-3-甲丁基咪唑的加长,原花青素得率逐渐增大,当从1-丁基咪唑再增大到1-辛基咪唑时,原花青素得率反而下降。说明阳离子为1-丁基-3-甲基咪唑的离子液体,比较适合原花青素的提取,烷基链太短,离子液体与细胞壁纤维素形成氢键后,纤维素微纤丝网状结构空隙太小,不利于活性成分的溶出[19];烷基链太长,突出的位阻效应减弱了咪唑环与原花青素结构上芳香环之间的色散力,其次,烷基链加长,导致离子液体粘度相对增大,不利于活性成分的溶出[7]。后2种离子液体的阳离子均为1-丁基-3-甲基咪唑,在实验中也比较常见,但是,其对原花青素的提取能力不如阴离子为[Br-]的离子液体,原因是阴离子主要控制离子液体的溶解性,其对活性成分的多重交互作用如π-π键、溶剂效应等不同,对原花青素的提取能力不同。因此本实验选择[BMIM]Br作为提取溶剂。

图1 离子液体种类对原花青素得率的影响Fig.1 Effects of ionic liquid typeon the extraction yield of proanthocyanidins
2.1.1.2 提取时间对原花青素得率的影响 如图2所示,原花青素得率随着提取时间的增加而增大,30 min后降低。原因是原花青素从固相向液相传递是一个复杂过程,故而延长提取时间,原花青素得率升高。但是,提取时间太长,部分产物被分解,或者是原料中杂质不断溶入而影响了提取效果,从而使得原花青素得率升高趋势缓慢。因此,提取时间初步确定为30 min。

图2 提取时间对原花青素得率的影响Fig.2 Effects of extraction timeon the extraction yield of proanthocyanidins
2.1.1.3 料液比对原花青素得率的影响 如图3所示,原花青素得率随着溶剂用量的增加而提高,当料液比超过1∶25后,产物得率随料液比变化幅度不大。原因是原料质量一定,增大溶剂用量,会提高原花青素得率,但是,当料液比达到一定值后,材料中的原花青素基本提取完全,故再增加料液比,原花青素得率不再提高,基于经济方面考虑,料液比1∶25为宜。

图3 料液比对原花青素得率的影响Fig.3 Effects of solid-liquid ratioon the extraction yield of proanthocyanidins
2.1.1.4 提取温度对原花青素得率的影响 如图4所示,随着提取温度的提高,原花青素得率升高趋势明显,温度超过50 ℃后,原花青素得率升高趋势非常缓慢。原因是超声波产生的空化效应、机械效应和热效应能够破坏植物组织细胞壁,增大溶剂的运动频率和速度,提高提取效率[20]。但是,如果温度过高,这些效应及其协同作用贡献不大,因此对原花青素得率的贡献不明显,从节约能源角度考虑,确定提取温度为50 ℃。
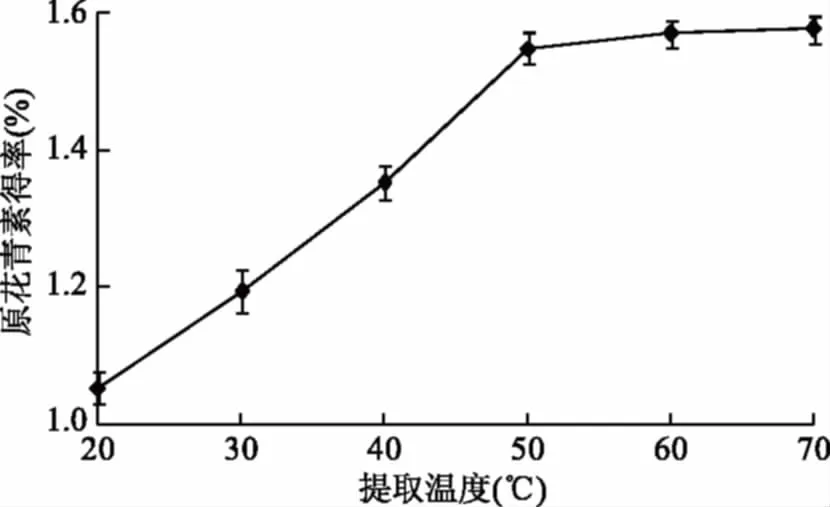
图4 提取温度对原花青素得率的影响Fig.4 Effects of extraction temperatureon the extraction yield of proanthocyanidins
2.1.1.5 超声功率对原花青素得率的影响 如图5所示,随着超声功率的增大,原花青素得率也随之增大,当超声功率超过250 W后,原花青素得率随超声功率增加变化并不明显,从节约能源角度考虑,确定超声功率为250 W。
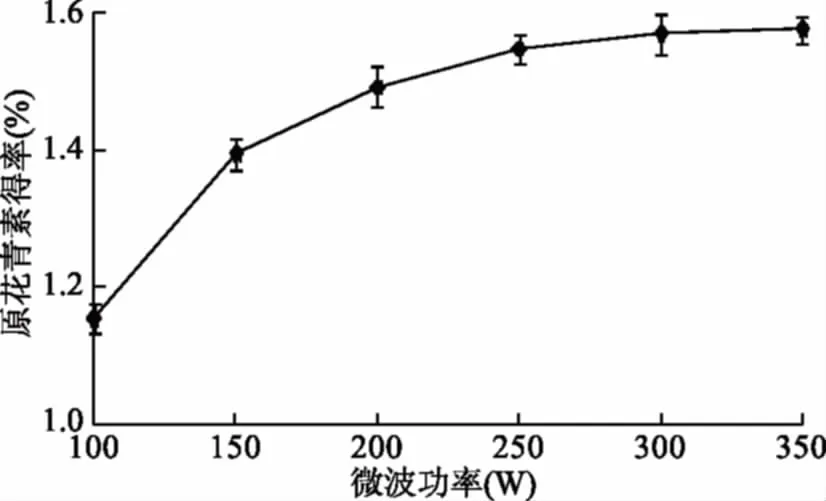
图5 超声功率对原花青素得率的影响Fig.5 Effects of ultrasonic poweron the extraction yield of proanthocyanidins
2.1.1.6 离子液体浓度对原花青素得率的影响 如图6所示,离子液体浓度对原花青素得率的影响相对较大,随着离子液体浓度的增加,原花青素得率随之增加,当离子液体浓度达到1.0 mol/L时,原花青素得率达到最大值,此后,随着离子液体浓度的增加,产物得率呈下降趋势。原因是离子液体浓度太低,无法起到增溶作用,而浓度太高,溶液粘度也会随之增大,有效成分的扩散能力下降,从而影响得率,因此选择离子液体浓度为1.0 mol/L。

图6 离子液体浓度对原花青素得率的影响Fig.6 Effects of ionic liquid concentrationon the extraction yield of proanthocyanidins
2.1.2 Box-Behnken实验设计及显著性分析 参照单因素实验结果,根据Design-Expert8.0.5软件中所提供的实验方案,确定提取时间、提取温度、超声功率和离子液体浓度4个因素为影响原花青素得率比较显著的因素,依次编码为X1、X2、X3、X4,以3次平行实验中原花青素得率(Y)的平均值作为响应值进行实验。响应面实验方案与实验结果见表2。
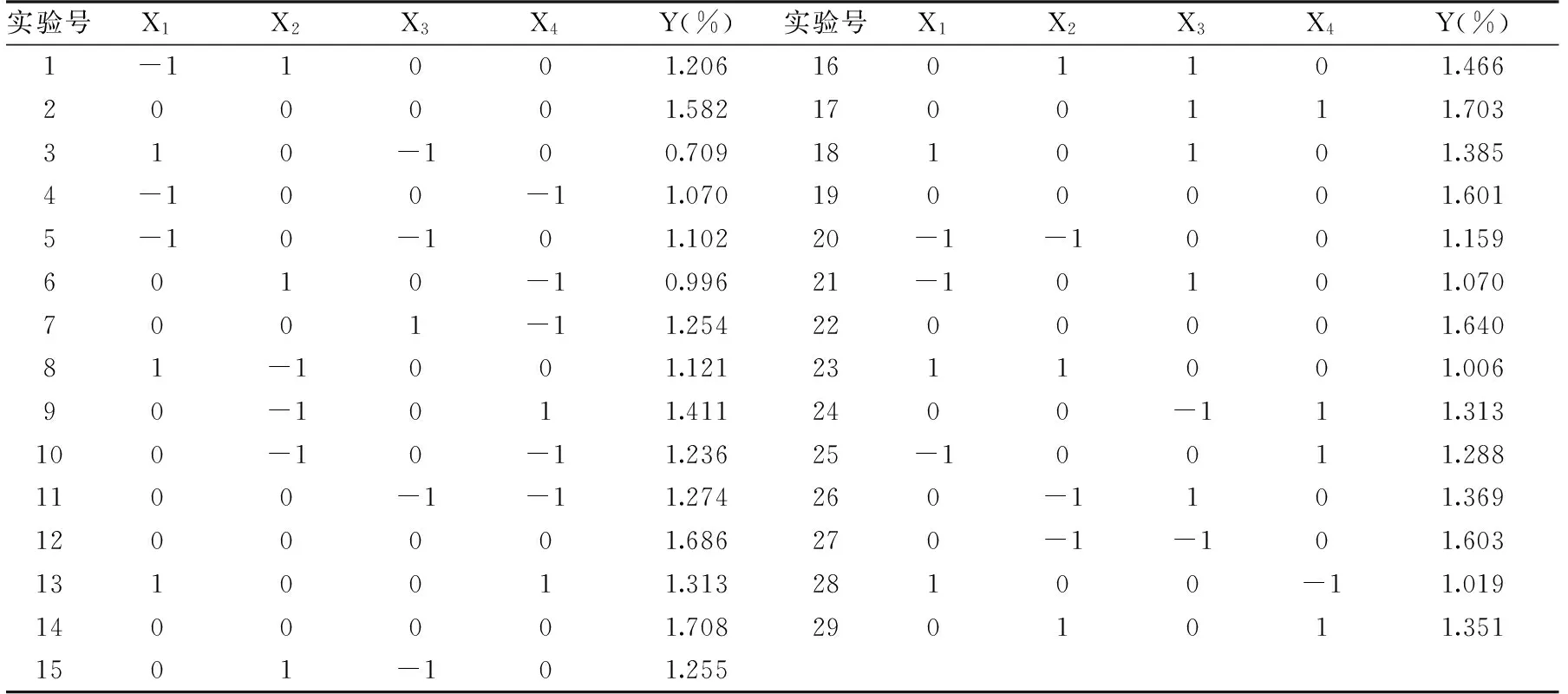
表2 响应面实验方案与实验结果Table 2 Arrangement and corresponding results of Box-Behnken experimental design

表3 回归方程方差分析结果Table 3 Analysis of variance of regression equation
注:**.差异极显著(p<0.01);*.差异显著(p<0.05)。 应用Design-Expert8.0.5软件对表2数据进行回归拟合,得到石榴籽中原花青素得率(Y)对响应变量X1、X2、X3、X4的二次回归方程为:
Y=1.64-0.029X1-0.052X2+0.083X3+0.13X4-0.04X1X2+0.18X1X3+0.019X1X4+0.11X2X3+0.045X2X4+0.1X3X4-0.38X12-0.16X22-0.12X32-0.15X42
式(4)
由表3可知,回归模型的决定系数R2=0.9051,p<0.0001,达到极显著水平,失拟项p=0.0615>0.05,影响不显著,说明该方程对实验数据的拟合情况良好,误差小。可以应用该回归方程代替实验真实点对实验结果进行分析和预测。超声功率(X3)和离子液体浓度(X4)的p值小于0.05,表明其对原花青素得率的影响显著。4个影响因素中,对原花青素得率影响最大的为离子液体浓度,其次为超声功率和提取温度,影响最小的为提取时间。
2.1.3 两两因素交互效应分析 图7为两两因素之间交互影响的响应面图[21-22],由图可知,响应面为开口向下的平滑曲面,说明曲面上存在最大响应值,且能够在各因素水平范围内找到最佳提取工艺条件。影响因素之间,X1与X3交互作用极其显著(p<0.01),表现为曲线比较陡峭,说明提取时间和超声功率的交互作用对原花青素的得率影响较大,其它各因素间交互作用的影响较小。各因素间交互作用对石榴籽中原花青素得率的影响大小依次为X1X3>X2X3>X3X4>X2X4>X1X2>X1X4。

图7 提取时间与超声功率交互作用对原花青素得率的影响Fig.7 Interactive effects of extraction timeand ultrasonic power on the yield of proanthocyanidins
2.1.4 最佳工艺条件的确定及验证 根据回归模型,预测得到超声波辅助离子液体提取石榴籽中原花青素的最佳工艺条件:提取时间31.8 min,提取温度52.4 ℃,超声功率295.5 W,离子液体浓度1.152 mol/L,原花青素得率的模型预测值为1.721%。考虑到实际操作的可行性,将工艺参数修正为:提取时间32 min,提取温度52 ℃,超声功率300 W,离子液体浓度1.15 mol/L。采用该工艺条件,进行3次平行验证实验,测得原花青素平均得率为1.718%,基本与预测值相符,说明应用Box-Behnken实验设计所得的最佳工艺参数可靠,具有实际应用价值。
2.2原花青素提取过程的动力学分析
在不同提取温度(315、320、325、330、335 K)下,分别应用[BMIM]Br离子液体和无水乙醇为试剂,功率为300 W超声波辅助提取,得到石榴籽中原花青素得率随超声时间(t)的变化规律如图8所示。

图8 原花青素得率与提取时间的关系Fig.8 Relationship between the yield ofproanthocyanidins and extraction time
由图8可以看出,在不同提取溶剂下,原花青素得率均随时间的延长而逐渐提高。离子液体提取组,原花青素得率明显较高,最高值接近1.72%,高于无水乙醇对照组原花青素得率1.31%,两者间存在显著性差异,p<0.05。同时,离子溶液提取组达到提取平衡所需要的时间缩短,当提取温度高于52 ℃(325 K),提取时间到达20 min时,材料中的原花青素已经接近提取完全。国内有学者,应用咪唑类离子液体提取肉桂中原花青素和挥发油类成分,微波辅助提取时间为10 min,产物得率提高接近40%[23]。本研究,采用[BMIM]Br离子液体为溶剂提取石榴籽中原花青素,产物得率提高31.3%,研究结果相近。说明以离子液体作为提取溶剂,既可以提高原花青素得率,又可以提高提取效率,缩短提取时间。不同溶剂提取的动力学方程及动力学参数见表4。
由表4可以看出:不同提取试剂在不同的提取温度下,相关系数R2均大于0.911,说明方程拟合精度较高,离子液体提取与传统提取方法相似,为简单的一级传质动力学过程。离子液体提取组,在提取温度较低时,提取速率常数k值增加明显:315 K,k值为0.126 min-1,325 K时,k值0.313 min-1;但是,提取温度从325 K提高到335 K时,提取速率常数k变化幅度不大。这充分证实提取工艺参数中,提取温度确定为52 ℃(325 K),既能有很好的提取效果,又达到了节能环保的目的,可操作性更强。同时,离子液体提取组的提取速率常数,均大于相同提取条件下的无水乙醇对照组,提取温度为325 K时,无水乙醇对照组的k值仅为0.063 min-1,仅为离子液体提取组的1/5左右。表面扩散系数(DS),离子液体提取组在数值上也均大于相同提取条件下的无水乙醇对照组,从微观角度证实了有效成分分子运动速度明显加快。以上数据充分证明,以离子液体作为提取试剂,在提取速率上具有明显优势。

表4 不同溶剂提取的动力学方程及参数Table 4 Kinetic equations and parameters of different solvent extraction
2.3原花青素提取过程的热力学分析
在离子液体为溶剂提取条件下,假设提取温度为335 K,提取时间在32 min时,系统达到提取平衡,此时,C=C∞,且该数值为实验条件下,材料中原花青素固有得率。根据公式(3),将ln[C∞/(C∞-C)]和1/T进行线性拟合可得:ln[C∞/(C∞-C)]=-29.89/T+97.87,R2=0.963。直线的斜率和截距分别为-ΔH/R和ΔS/R,由此可以计算热力学参数熵ΔH值、焓ΔS值和自由能ΔG值[24]。提取温度在315、320、325、330 K下的动力学参数值可以计算,但是,温度为335 K时热力学参数无法计算,结果见表5。
由表5可以看出:在不同提取温度下,ΔH值和ΔS值均大于零,表明离子液体提取过程为吸热熵增加的过程[24]。ΔG数值小于零,表明提取过程为自发过程,且随着提取温度的提高,ΔG值逐渐减小,提示提取过程越容易进行[25]。但是,当提取温度超过325 K后,ΔG值变化较小,进一步证实提取工艺参数中,提取温度确定为52 ℃(325 K)是可靠的。

表5 不同提取温度下的热力学参数Table 5 Thermodynamic parameters ofdifferent extraction temperatures
3 结论
本实验以[BMIM]Br离子液体作为提取试剂,在单因素实验基础上,选取提取时间、提取温度、超声功率和离子液体浓度4个因素进行响应面分析,通过回归模型的方差分析结果可知,各因素对于原花青素得率影响的主次顺序为:离子液体浓度>超声功率>提取温度>提取时间。超声波辅助离子液体提取石榴籽中原花青素的最优工艺条件为:提取时间32 min,提取温度52 ℃,超声功率300 W,离子液体浓度1.15 mol/L,原花青素得率的实测值为1.718%,接近原花青素得率的预测值。提取过程的动力学和热力学分析表明,以离子液体为溶剂,对原花青素提取速率常数k值和表面扩散系数DS值明显增大;离子液体提取过程为吸热熵增加过程,ΔG值小于零,为自发过程。该研究为离子液体在食品工业中的深入研究和实际应用提供了理论参考。离子液体与目标物质分离较为困难,这也使得离子液体的应用目前只停留在食品功能分子的提取与分析阶段,尚未在食品工业中大规模应用。
[1]汪小飞,周耘峰,黄埔,等. 石榴品种数量分类研究[J]. 中国农业科学,2010,43(5):1093-1098.
[2]杨丽娜,付中喜,李明志,等. 石榴籽提取物对四氯化碳诱导小鼠肝损伤的保护作用[J]. 吉林大学学报:医学版,2011,37(5):817-820.
[3]张立华,张元湖,杨雪梅. 石榴不同部位提取物抗油脂氧化及抑菌活性的比较研究[J]. 中国粮油学报,2010,26(4):38-42.
[4]王艳菊,马建伟,王曦茁,等. 葡萄籽原花青素对秀丽隐杆线虫抗衰老的影响[J]. 食品工业科技,2014,35(20):369-373.
[5]张佳婵,王昌涛,孙宝国,等. 沙棘籽粕原花青素制备、体外抗氧化及细胞活力评价[J]. 食品工业科技,2016,37(23):103-108.
[6]董爱文,于华忠,冯英英. 爬山虎籽中原花青素提取纯化工艺优化及其含量测定[J]. 食品科学,2010,31(4):88-92.
[7]王新红,李雪梅,蔡晨,等. 离子液体提取山楂绿原酸的工艺优化[J]. 农业工程学报,2014,30(10):270-276.
[8]李永祥,张玲玲,刘雁红,等. 离子液体在食品领域中的应用研究进展[J]. 食品工业科技,2016,37(5):394-398.
[9]章凯,黄国林,陈中胜,等. 微波辅助萃取柠檬皮中果胶动力学及热力学研究[J]. 食品科学,2010,31(15):107-111.
[10]李爱民,姚元枝,郭瑛,等. 超声波提取接骨草叶中绿原酸的工艺优化[J]. 食品工业科技,2013,34(17):232-235.
[11]WANG Guihua,SU Ping,ZHANG Fan,et al. Comparison of microwave-assisted extraction of aloe-emodin in aloe with Soxhlet extraction and ultrasound-assisted extraction[J]. Science China(Chemistry),2011,54(1):230-235.
[12]陈晨,刘怀秀,赵晓辉,等. 黑果枸杞色素中原花青素含量测定[J]. 光谱实验室,2011,28(4):1767-1769..
[13]周玮婧,孙智达,谢笔钧,等. 荔枝皮原花青素提取、纯化及抗氧化活性研究[J]. 食品科学,2009,30(8):68-71.
[14]赉永光,苏健裕,杨鼎隆. 基于离子液体超声辅助提取菊花绿原酸的实验研究[J]. 中国食品学报,2014,14(10):164-170.
[15]PAN Guangyan,YU Guoyang,ZHU Chuanhe,et al. Optimization of ultrasound-assisted extraction(UAE)of flavonoids compounds(FC)from hawthorn seed(HS)[J]. Ultrasonics Sonochemistry,2012,19(3):486-490.
[16]储茂泉,古宏晨,刘国杰,等. 中草药浸提过程的动力学模型[J]. 中草药,2000,37(7):504-506.
[17]陈震鸣,陶文沂,许泓瑜. 乙醇提取樟芝菌粉三萜类化合物的动力学研究[J]. 食品科学,2009,30(3):21-24.
[18]郭庆启,张娜,孙瑶,等. 超声波辅助提取落叶松树皮多酚的动力学和热力学研究[J]. 北京林业大学学报,2014,36(3):115-120.
[19]李明英. 离子液体在天然药物活性成分物质提取中的应用研究进展[J]. 药学进展,2015,39(6):437-443.
[20]史丽娟,彭胜,郑阳,等. 离子液体超声波辅助法提取杜仲皮总木脂素的工艺研究[J]. 应用化工,2015,44(12):2249-2254,2259.
[21]SUN Yi,WU Wenqing,ZHANG Wenqing,et al. Optimizing the extraction of phenolic antioxidants from Kudingcha made from Ilex kudingcha C.J. Tseng by using response surface methodology[J]. Separation and Purification Technology,2011,78(3):311-320.
[22]LIU Qidi,QIN Kunming,SHEN Baojia,et al. Optimization of the processing technology of Fructus Arctii by response surface methodology[J]. Chinese Journal of Natural Medicines,2015,13(3):222-231.
[23]柳叶. 肉桂中原花青素和肉桂油的提取及提取剩余物的微波磷酸法热解[D]. 哈尔滨:东北林业大学,2013.
[24]张艳丽,符华林,卢朝成,等. 内部沸腾法提取槐米中的芦丁及其动力学和热力学研究[J]. 中成药,2015,37(4):895-898.
[25]陈晓光,韦藤幼,彭梦微,等.丹参酚酸B减压内部沸腾法提取的动力学及相关热力学研究[J].高校化学工程学报,2011,25(6):961-965.
Optimizationandkinetic/thermodynamicsanalysisofionicliquidbasedultrasonic-assistedextractionofproanthocyanidinsfrompomegranateseeds
WANGZhan-yi1,ZHENGDan-dan1,ZHANGLi-hua1,WANGYu-hai1,DAIBo2,LIZhuo-wa1
(1.College of Life Sciences,Zaozhuang University,Zaozhuang 277160,China;2.Department of Pharmacology,General Hospital of Air Force,People’s Liberation Army of China,Beijing 100142,China)
The ionic liquid based ultrasonic-assisted extraction conditions of proanthocyanidins from pomegranate seeds were studied. Single factor test and Box-Behnken experimental design were used to optimize the extraction process employing proanthocyanidins yield as the response,and extraction time,extraction temperature,ultrasonic power and concentration of ionic liquid were used as independent variables. The kinetics and thermodynamics of extraction process was studied basing the optimized extraction conditions. Results showed that the optimal extraction conditions for proanthocyanidins were determined as follows:extraction time of 32 min,extraction temperature of 52 ℃,ultrasonic power of 300 W,and concentration of ionic liquid of 1.15 mol/L. Under these conditions,the yield of proanthocyanidins was 1.718%. Kinetic parameters showed that extraction rate constant k value was 0.313 min-1,surface diffusion coefficient DSvalue was 7.936×10-5cm2/min while those of ethanol control group were 0.063 min-1and 1.597×10-5cm2/min,respectively,and the extraction rate was significantly improved. Thermodynamics parameters showed that entropy ΔH was 248.51 kJ/mol,enthalpy ΔS was 813.69 J/(mol·K),the values were all greater than zero,indicating that the ionic liquid extraction process was an endothermic process of increasing entropy,at the same time,the free energy ΔG was-18.254 kJ/mol,less than zero,indicating that the ionic liquid extraction process was a spontaneous process. Both the optimized ionic liquid extraction technique and dynamics/thermodynamics analysis can be used for industrial scale-up and optimal control of proanthocyanidins extraction from pomegranate seeds.
pomegranate seed;proanthocyanidins;ultrasonic;ionic liquid;kinetic analysis;thermodynamics analysis
TS255.1
B
1002-0306(2017)19-0154-07
10.13386/j.issn1002-0306.2017.19.029
2017-04-14
王占一(1980-),男,硕士,讲师,主要从事天然药物活性成分提取与分离研究,E-mail:zhyiwang@126.com。
2015年度国家星火计划项目(2015GA740027);山东省自然科学基金项目(ZR2013BL018);山东省重点研发计划项目(2016GSF202010)。
