桑葚汁多菌种发酵过程主要成分及抗氧化性的变化
2017-10-19,,,,,*,
,, ,,,*,
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.华南协同创新研究院,广东东莞 523808)
桑葚汁多菌种发酵过程主要成分及抗氧化性的变化
刘涛1,韦仕静1,任杰2,杨继国1,2,*,宁正祥1
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.华南协同创新研究院,广东东莞 523808)
桑椹酵素是以桑椹汁为原料再加入有益菌发酵而来。本文研究了桑椹酵素在发酵过程中生理活性的变化,采用高效液相色谱法和比色法测定发酵过程中的葡萄糖、果糖、乙醇、有机酸、花青素、原花青素和总酚的含量,并通过羟自由基清除实验和DPPH·清除实验探究发酵过程中桑椹酵素抗氧化活力变化。结果显示:发酵30 d后,体系中葡萄糖和果糖总量下降到66.58 mg/mL,而乙醇、乳酸和醋酸含量明显增加,最后分别为27.19、4.03、4.69 mg/mL;活性成分测定实验结果显示,在发酵30 d后,桑椹酵素中花青素和原花青素含量降低,而总酚含量增加了5.0%,且抗氧化活性也增强;10倍的发酵稀释液对羟自由基清除率和DPPH·自由基清除率最大分别可达48.12% 和98.16%。结论表明:桑椹酵素的抗氧化能力在发酵过程得到提升,且其变化与总酚变化存在正相关性。
桑椹酵素,发酵,生理活性,抗氧化活性
桑椹又名桑果、桑泡儿,富含糖、蛋白质、有机酸、维生素及微量元素等[1],味甜汁多,是人们喜爱的水果之一,素有“中国果皇”的美誉。桑椹具有一定的药用价值,性味甘寒,具有补肝益肾、生津润燥、乌发明目等功效[2],是中医中常用的药材之一。中国药典《本草纲目》中记载:“捣汁饮,解酒中毒;酿酒服,利水气,消肿”[2]。现代医学研究表明,桑椹可以调节机体免疫、清除机体自由基,并有养颜美容、预防心血管疾病的功效[3]。
果蔬酵素是植物酵素的一种,是把水果、蔬菜等植物原料混合均匀后,添加有益菌种发酵制得的酵素制品。酵素是一种纯天然保健产品,具有消炎抗菌、激活细胞、净化血液、修复机体损伤等功能。2007年,酵素引入中国,经过数年的发展,逐渐成为极具竞争力和市场的保健品[4]。国内已有酵素的相关报道,主要研究了木瓜酵素和火龙果酵素。不同水果发酵制得的酵素,一般都具有助消化、防治疾病等功效。本文研究的桑椹酵素是以桑椹汁为主料、蔗糖为辅料,添加有益菌发酵而来。由于桑葚汁在发酵过程中成分变化比较复杂,且常见的生理活性成分和抗氧化性是保健效果的重要体现,因此本文将系统研究桑椹汁在发酵过程中的生理活性成分和抗氧化性变化,为桑椹酵素产品的形成提供理论基础,为进一步阐述酵素的保健功能提供了可靠依据。
1 材料与方法
1.1材料与仪器
桑椹汁 广东省农业科学院蚕业与农产品加工研究所;蔗糖 市购;梅山酵母 河北马利食品有限公司;干酪乳杆菌、嗜酸乳杆菌 仙农生物科技(上海)有限公司;沪酿1.01醋酸菌 广东省微生物菌种保藏中心;葡萄糖、果糖、乳酸、乙醇、乙酸 色谱纯;α,α-二苯基-β-苦苯肼(DPPH)、无水乙醇、邻二氮菲、双氧水、FeSO4、EDTA等 分析纯。
Thermo U3000高效液相色谱仪 Dionex softrom GmbH;PHS-3C型pH计 上海仪电科学仪器股份有限公司;JM-A5002型电子天平 上海菁海仪器有限公司;XMTD-4000型恒温水浴锅 广州市芊荟化玻仪器有限公司;GZX-9070MBE型数显鼓风干燥箱、SPX-100B-Z型生化培养箱 上海博迅实业有限公司医疗设备厂;WH-90A型微型旋涡混合器 上海振荣科学仪器有限公司;YX-280A+型手提式压力蒸汽灭菌锅 合肥华泰医疗设备有限公司;SW-CJ-10型单人净化工作台 苏州净化设备有限公司。
1.2实验方法
1.2.1 桑椹酵素的制备 将经过紫外灭菌的800 g桑椹汁(糖含量:34.58 mg/mL、固形物含量:10%)和200 g蔗糖加入无菌玻璃坛中振荡混匀,再分别添加质量比0.1‰酵母菌菌粉,0.5‰嗜酸乳杆菌菌粉和0.5‰干酪乳杆菌菌粉,混合均匀后密封,放在暗处(30.0±1.0 ℃)发酵7 d,每天在无菌条件下搅拌一次,每次持续约2 min;第8 d再加入5% 的醋酸菌菌液(约109cfu/mL),每2 d搅拌一次,每次搅拌时间约2 min,30 d后终止发酵。分别于0、1、2、3、5、7、9、12、15、20和30 d取样5 mL测定发酵液菌落总数和pH;同时在0、1、2、3、5、10、20和30 d分别取样50 mL测定还原糖、乙酸、乳酸,花青素、原花青素、多酚、羟自由基和DPPH·清除率。以上实验均重复三次。
1.2.2 发酵过程中总菌落数生长变化 菌落总数测定参照GB4789.2-2010进行检测[5]。
1.2.3 pH的测定 用酸度计进行测定。
1.2.4 发酵过程中葡萄糖、果糖、乙醇和有机酸含量变化
1.2.4.1 标准曲线的制作样品预处理 标准曲线的制作:取葡萄糖、果糖、乙醇配制成0、20、40、60、80、100、120 mg/mL溶液,0.22 μm膜过滤后用高效液相色谱示差折光检测器进行测定,绘制标准曲线。取乳酸、乙酸配制成0、1.0、2.0、3.0、4.0、5.0、6.0 mg/mL溶液,0.22 μm膜过滤后用高效液相色谱紫外检测器进行测定,绘制标准曲线。
样品预处理:采用高效液相色谱法测定发酵过程葡萄糖、果糖、乙醇、乙酸和乳酸的变化。精确称取葡萄糖、果糖、乙醇、乳酸和乙酸标准品,分别稀释不同浓度,使用0.22 μm膜过滤,备用。取样品经10000 r/min离心5 min后取上清液1 mL,稀释后经0.22 μm膜过滤,备用。
1.2.4.2 色谱检测条件 参照文献[6]方法测定:
色谱柱:Aminex HPX-87H有机酸分析柱(300 mm×7.8 mm:Bio-Rad. Hercules)。
流动相:0.005 mol/L H2SO4溶液,流速0.6 mL/min,进样量20/10 μL,柱温50 ℃。
检测器参数:紫外检测器波长210 nm,示差折光检测器、温度50 ℃。
1.2.5 发酵过程中生理活性成分的变化
1.2.5.1 花青素含量测定 标准曲线的制作:取矢车菊素-3-O-葡萄糖苷配制成14.1、5.64、2.82、1.41、0 μg/mL的标准溶液。空白对照在定容前加入0.5 mL的10%亚硫酸钠溶液。在最大吸收波长518 nm测定吸光值,以吸光度为纵坐标(y),以矢车菊素-3-O-葡萄糖苷浓度为横坐标(x,μg/mL),绘制标准曲线。
花青素含量测定[7]:取5 mL样品滤液于试管,用0.1 mol/L柠檬酸水溶液定容至10 mL。对照空白管取5 mL样品液,用0.5 mL 10% Na2SO3溶液定容至10 mL,都加塞混匀,静置5 min后分别于比色皿中,在波长518 nm处测定其吸光度A。按下式计算花青素含量。
式中:A为所为518 nm处测定的吸光值,20为本方法中的稀释倍数,0.0199、0.0367为标准曲线参数。
1.2.5.2 原花青素的测定 标准曲线的制作:用原花青素标准品分别配制成0、25、50、100、200、300、400 μg/mL的溶液,分别取1 mL上述溶液于10 mL具塞比色管中,加入9 mL混合液(正丁醇、浓盐酸和20% 硫酸高铁铵按体积比85∶5∶0.4配制而成),沸水浴40 min后,立即取出,用冷水快速冷却至室温,用正丁醇定容至刻度线摇匀,在550 nm处测吸光值。以吸光值为纵坐标(y),以原花青素浓度为横坐标(x,μg/mL),绘制标准曲线。
式中:c是查标准曲线样品液吸光值对应的原花青素的含量,(μg/mL);V1是吸取样品体积,(mL);V2是样品稀释后体积,(mL)。
1.2.5.3 总酚含量测定 标准曲线的制作:用没食子酸标准品配制成0.1 mg/mL的溶液,分别取0、0.2、0.4、0.6、0.8、1.0 mL于6个10 mL比色管中,加入2.5 mL 0.1 mol/mL福林酚试剂混匀,静置5 min后加入2 mL 15% 的 Na2CO3溶液,定容至10 mL,室温反应2 h,在760 nm处测吸光值。以吸光值为纵坐标(y),以没食子浓度为横坐标(x,mg/L),绘制标准曲线。
总酚含量测定[8]:取1 mL样品于10 mL具塞比色管中,按上述反应条件处理,以纯水为空白对照,在760 nm处测吸光值,代入标准曲线方程,计算总酚含量。用以下公式计算样品中总酚含量。
式中:A是查标准曲线样品液吸光值对应的原花青素的含量(mg/L),0.0537、0.0899是标准曲线参数。
1.2.6 发酵过程中抗氧化性的变化
以二维空间中6个样本点(包含3个继承点)为例,对继承拉丁超立方采样过程进行具体描述,如图1所示。首先,将设计空间的每一维度划分为6个区间,移除继承点(黑色圆点)占据的空白网格,形成新采样空间(缩减的设计空间)。将新采样空间的每一维度划分为3个区间,并用拉丁超立方采样选取3个样本(如图1b)。最后,将此3个拉丁超立方样本映射到图1a中的阴影区域,最终生成的样本集既包含了3个继承点,又具备拉丁超立方采样的均匀性。
1.2.6.1 羟自由基清除实验 参照文献[9]方法:取1.2 mL 5 mmol/L邻二氮菲溶液加入到0.8 mL 0.2 mol/L的磷酸盐缓冲液中,混合均匀后加入1.2 mL 5 mmol/L硫酸亚铁溶液、1.2 mL 15 mmol/L EDTA溶液、1.2 mL样品(稀释10倍的发酵液)、1.6 mL 0.1% H2O2的,混合均匀,37 ℃保温1 h,在536 nm处测定吸光值,以抗坏血酸代替样品作阳性对照。
羟自由基清除率(%)=[(A样品-A损伤)/(A空白-A损伤)]×100
式中:A样品是样品测定管的吸光值;A空白是空白测定管的吸光值,空白测定管中用蒸馏水代替样品和H2O2;A损伤是损伤测定管的吸光值,损伤测定管中将样品用蒸馏水代替。
1.2.6.2 DPPH自由基清除实验 参照文献方法[10]:取样品2 mL(稀释10倍的发酵液)加入到2 mL 0.02 mg/mL的DPPH·溶液(无水乙醇配制),混合均匀,25 ℃恒温水浴室30 min,在517 nm处测定吸光度值,空白组以2 mL无水乙醇代替样品。
DPPH·清除率(%)=[1-(A1-A2)/A0]×100
式中:A1为样品溶液的吸光值;A2为用无水乙醇代替DPPH·时测得对应浓度的吸光值;A0为空白组的吸光值。
1.3数据统计分析
本文实验均重复3次,采用Excel 2003对基础数据进行整理,采用Origin 9.0和SPSS 19.0对实验结果进行常规处理和分析。
2 结果与分析
2.1桑椹酵素发酵过程中菌落总数的变化
从图1可知,菌落总数总体呈先上升后下降的趋势,并在第2 d达到峰值,为3.02×107cfu/mL。在桑椹酵素发酵初期加入的酵母菌和乳酸菌,经过前2 d的对数期生长,在第2 d开始进入菌种的稳定期。第3 d开始,菌落总数下降并逐渐趋于平稳,是由于体系中糖原和生长空间的限制。为强化产酸而在第8 d加入的醋酸菌,使得菌落总数在第10 d又达到一个高峰。随后,酵素菌落总数趋于下降,符合微生物生长曲线。

图1 发酵过程菌落总数的变化Fig.1 Changes in total number of colonies during fermentation
2.2桑椹酵素发酵过程中生化指标的变化
2.2.1 桑椹酵素发酵过程中pH的变化 从图2可知,体系pH在发酵前12 d保持下降趋势,主要有两个原因:其一,发酵前期碳源充足乳酸菌生长旺盛,产酸量随时间增加[11];其二,酵母菌在无氧条件发酵产生CO2部分溶于水,从而使得发酵液的pH下降。第9 d到第12 d pH下降较快,是由于在第8 d加入醋酸杆菌,强化了产酸。之后pH变化趋于平缓。pH小幅度升高可能由于发酵过程微生物利用了氨基酸或者水解蛋白质导致的;小幅度降低可能是由于发酵过程中有机酸浓度增加导致的[12]。

图2 发酵过程pH的变化Fig.2 Changes of pH during fermentation
2.2.2 桑椹酵素发酵过程中葡萄糖、果糖、乙醇的变化 桑椹酵素发酵过程中葡萄糖、果糖、乙醇的变化采用HPLC中示差折光检测器进行检测,其保留时间、线性关系如表1。

表1 葡萄糖、果糖、乙醇的保留时间及线性关系Table 1 Retention time and linear relationship ofglucose,fructose and ethanol
由图3知,葡萄糖、果糖含量在发酵中一直处于降低趋势,而乙醇含量先升高后降低。发酵前期酵母菌和乳酸菌利用葡萄糖和果糖作为碳源,进行生长,导致两种糖含量下降迅速;发酵中后期酵母菌在无氧条件下产生乙醇,乙醇逐渐积累;发酵后期主要是醋酸杆菌利用乙醇产酸,乙醇含量降低。
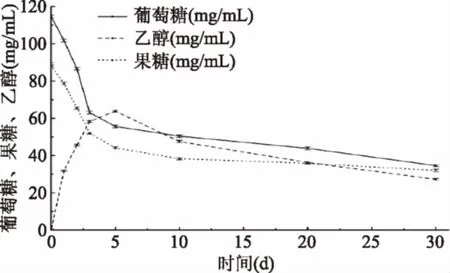
图3 发酵过程葡萄糖、果糖、乙醇含量的变化Fig.3 Changes of glucose,fructoseand ethanol during fermentation
2.2.3 桑椹酵素在发酵过程中乳酸、乙酸的变化 桑椹酵素在发酵过程中的乳酸、乙酸的变化采用HPLC中紫外检测器检测,其保留时间、线性关系如表2。

表2 乳酸、乙酸的保留时间及线性关系Table 2 Retention time and linear relationship oflactic acid and acetic acid
从图4可知,乳酸和乙酸含量在发酵过程中一直在增加,发酵结束后分别达到4.03 mg/mL和4.69 mg/mL。乳酸是嗜酸乳杆菌和干酪乳杆菌的代谢产物,乙酸是沪酿醋酸菌的代谢产物。桑椹酵素在发酵过程中不仅仅产生了乳酸和乙酸,还产生了一些其他短链脂肪酸,如琥珀酸、苹果酸、柠檬酸等有机酸,不仅可以提高桑椹酵素的风味,更提升了其保健价值。
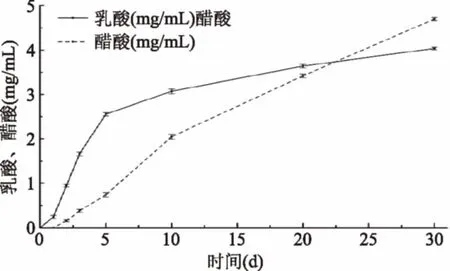
图4 发酵过程乳酸、乙酸的变化Fig.4 Changes of lactic acidand acetic acid during fermentation
2.3桑椹酵素发酵过程中生理活性成分的变化
2.3.1 花青素的变化 桑椹中所含有的花青素主要是矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香苷[13]。本文采用的发酵液中矢车菊素-3-O-葡萄糖苷的变化代替花青素含量化。从图5可以看出,发酵过程中花青素一直在降低,从178.05 mg/L降到了80.73 mg/L。可能是矢车菊素-3-葡萄糖苷含有的四个酚羟基,与酵母发酵过程中产生的活性氧发生反应,从而导致溶液中花青素含量降低。还有研究表明,酵母产生的代谢产物可以与花青素反应产生一些大分子物质,从而导致溶液中花青素含量降低[14]。
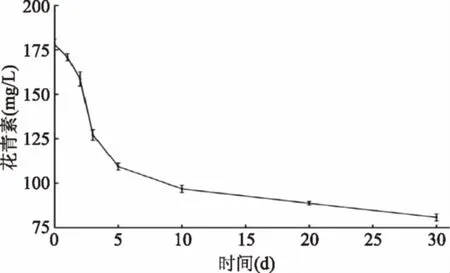
图5 发酵过程花青素的变化Fig.5 Changes of anthocyanin during fermentation
2.3.2 原花青素的变化 原花青素在发酵初期处于上升趋势,在第3 d达到高峰296.62 mg/L,随后逐渐下降。原花青素主要有低聚原花青素和高聚原花青素两类,其中高聚原花青素在酸性条件下可以水解成低聚原花青素,从而大大提高体系的抗氧化活性[15-16]。发酵过程中酸度的增加使花青素的聚合度降低,多聚体的原花青素转化为单聚体和二聚体,从而原花青素含量升高。导致后期原花青素含量下降的原因可能是发酵过程产生某些酶,与原花青素发生酶促反应。
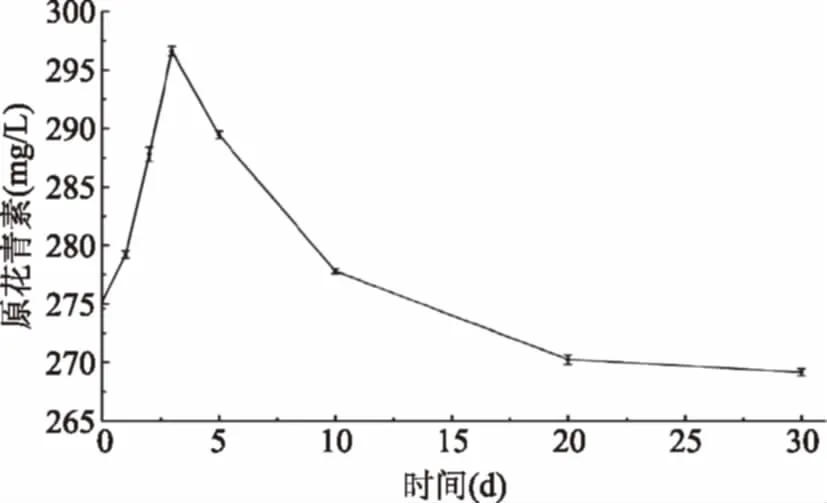
图6 发酵过程原花青素的变化Fig.6 Changes of procyanidin during fermentation
2.3.3 总酚含量的变化 图7可知桑葚酵素在发酵过程中总酚总体上呈上升趋势,发酵第5 d达到最大值657.23 mg/L,发酵30 d比未发酵增加了5.0%。Chu S C[17]指出总酚在发酵过程含量升高,可能由于微生物将大分子的酚类物质转化成了小分子的酚类物质。酚类物质含量的变化,会影响酵素的抗氧化活性。
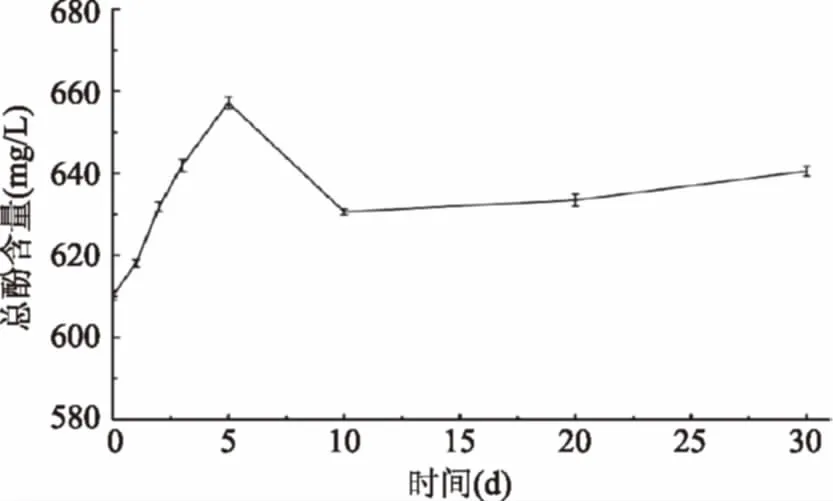
图7 发酵过程总酚含量的变化Fig.7 Changes of total phenols content during fermentation

图8 发酵过程羟自由基清除率的变化Fig.8 Changes in hydroxyl radicalscavenging ability during fermentation
2.4桑椹酵素发酵过程中抗氧化性的变化
2.4.1 羟自由基清除能力的变化 羟自由基是一种高活性反应自由基,具有极强的氧化能力,可以破坏细胞膜结构,从而引发一些疾病。桑椹酵素在发酵过程中羟自由基清除率的变化见图8。
图8是10倍发酵稀释液的羟自由基清除率变化,桑椹酵素羟自由基清除能力在第5 d达到最大,之后略有波动,发酵30 d后经过10倍稀释的发酵液清除率仍达到47.72%,比未发酵之前增加了3.37%。其原因可能是发酵菌产生了可以清除活性氧的抗氧化酶类[18],还有一种可能是发酵菌本身就具备抗氧化能力,有研究报道酵母菌的细胞壁多糖能够清除羟自由基,起到抗氧化作用[19]。
2.4.2 DPPH·清除能力的变化 DPPH·是一个以氮原子为中心的非常稳定的脂溶性自由基。DPPH·清除能力反映物质在短时间内的抗氧化能力。DPPH·在517 nm处有最大吸收峰,当溶液有自由基清除剂与DPPH·结合时,其在最大吸收波长处的吸光值变小。桑椹酵素发酵过程中DPPH·的变化见图9。
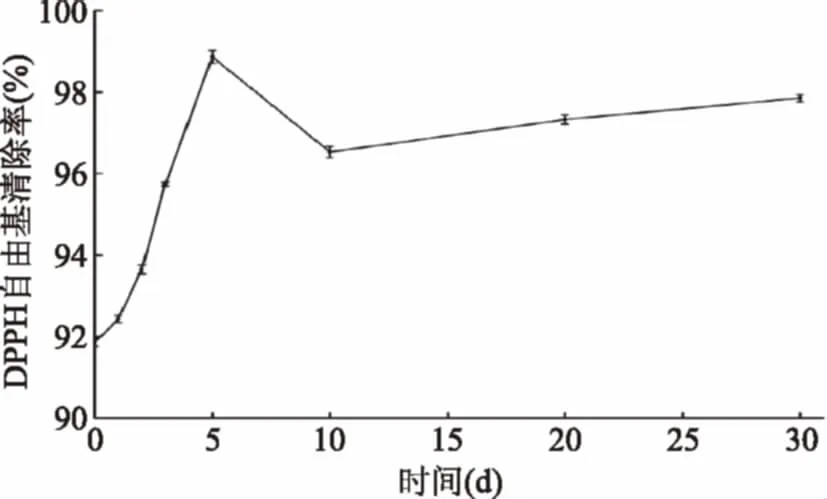
图9 发酵过程DPPH·清除率的变化Fig.9 Changes in DPPH· scavengingability during fermentation
图9是稀释了10倍发酵液的DPPH·清除率,桑椹酵素在第5 d时DPPH·清除能力为98.61%,此时达到了桑葚酵素对DPPH·清除能力的最大,较未发酵的桑葚汁提高了7.01%;发酵后期,DPPH·清除率有波动,但总体是高于未发酵状态。桑椹酵素DPPH·清除能力远远高于羟自由基清除能力。
李飞[20]等研究了苹果酵素的抗氧化活性,其结果显示羟自由基与DPPH·清除率总体上都是呈上升趋势,这与本文研究结果一致,其还研究了羟自由基与DPPH·清除率与多酚有一定的线性关系。由图7~图9可知羟自由基、DPPH·清除率的变化与总酚的变化有一定的相关性。
3 结论
本文主要探究了桑椹酵素发酵过程中的生理活性成分和抗氧化活性的变化。研究发现在发酵过程中,发酵液的pH处于下降趋势;在发酵前期酵母菌和乳酸菌利用葡萄糖和果糖作为碳源,产生乙醇和乳酸,葡萄糖和果糖含量降低,乙醇和乳酸含量升高;在发酵后期醋酸菌利用乙醇产生醋酸,从而使醋酸积累,乙醇含量降低;发酵30 d,发酵液中的花青素和原花青素含量下降,而总酚含量提高了5%,且羟自由基与DPPH·清除能力总体上呈现上升趋势,10倍稀释的桑椹酵素发酵液对DPPH·清除能力和羟自由基清除能力分别提高了3.37%和7.01%。酵素的总酚含量变化与自由基清除能力呈现相同的变化趋势,具有一定的线性相关性。
[1]李奕华.桑椹的价值及开发利用[J].中国林副特产,2000,55(4):50-51.
[2]杨小兰.桑椹籽油的降脂作用研究[J].中国粮油学报,2001,16(4):8-10.
[3]王萍,张云霞,刘敦华.桑葚的营养保健功能及功能性研究进展[J].中国食物与营养,2008(8):57-60.
[4]潘宣如,毛旸昊.果蔬酵素新兴产业现状分析及对策[J].北方经贸2015,11(2):113-115.
[5]GB 4789.2-2010,食品安全国家标准食品微生物学检验.菌落总数测定[S].
[6]马瑞,欧阳嘉,李鑫,等.高效液相色谱法同时测定生物质乳酸发酵液中有机酸及糖类化合物[J].色谱,2012,30(1):62-66.
[7]白鸿.保健食品功效成分检测方法[M].北京:中国中医药出版社,2011.
[8]Singleton V L,Orthofer R,Lamuela-Raventos R M. Analysis of total polyphenols and other oxidationsubstrates and antioxidants by means of Folin-Ciocalteau reagent[J]. Methods in Enzymology,1999,299:152-178.
[9]Kitta DD,Wijewickreme AN,Hu C. Antioxidant Activity of North American Ginseng Extract[J]. Mol Cell Biochem,2000,203:1-10.
[10]彭长连,陈可薇,林植芳,等.用清除有机自由基DPPH法评价植物抗氧化能力[J]. 生物化学与生物物理进展,2000,27(6):658-661.
[11]Jayabalan R,Subathradevi P,Marimuthu S,et al. Changes in Free-radical Scavenging Ability of Kombucha Teaduring Fermentation[J]. Food Chemistry,2008,109(1):227-234.
[12]Cho K M,Hong S Y,Math R K,et al. Biotransformation ofPhenolics(Isoflavones,Flavanols and Phenolic Acids)During the Fermentation of Cheonggukjang by Bacillus Pumilus HY1[J]. Food Chemistry,2009,114(2):413-419.
[13]Suh H J,Noh D O,Kang C S,et al. Thermal Kinetics of Color Degradation of Mulberry Fruit Extract[J]. Nahrung Food,2003,47(2):132-135.
[14]Morata A,Gomez-Cordoves MC,Colomo B,et al. PyruvicAcid and Acetaldehyde Production by Different Strains of Saccharomyces Cerevisae:Relationship with Vitisin A and B Formation in Red Wines[J]. Agri Food Chem,2003,51:7402-7409.
[15]赵平,张月萍.原花青素高聚体水解[J].中国食品添加剂,2012(5):124-129.
[16]Vanech,Dragetc,Snapece,et al,Decay of Cultivated Apricot Wood(Prunus Armeniaca)by the Ascomycete Hypocrea Sulphurea,Using Solid State 13 Cnmr and Off-line TMHA Thermochemolysis with GC-MS[J]. Int Biodeterrior Biodegrad,2005,55(3):175-185.
[17]Chu S C,Chen C. Effect of origins and fermentation time on the antioxidant activities of kombucha[J]. Food Chemistry,2006,98(3):502-507.
[18]ZyrackaE,ZadragR,KoziolS,et al. Yeast as a Biosensor for Antioxidants:Simple Growth Tests Employing a Sacchromyces Cerevisiae Mutant Defective in Superoxide Dismutase[J]. ActaBiochim Pol,2005,52(3):679-684.
[19]张丽霞,袁红梅,尤凤丽,等.微波辅助提取啤酒酵母多糖及其抗氧化作用研究[J].安徽农业科学,2011,39(11):6521-6523.
[20]李飞,王凤舞,潘越,等.苹果酵素抗氧化活性初步研究[J].青岛农业大学学报,2016,33(1):40-44.
Thechangeofindexandantioxidantactivityinmulberryjuicefermentationprocess
LIUTao1,WEIShi-jing1,RENJie2,YANGJi-guo1,2,*,NINGZheng-xiang1
(1.College of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China;2.South China Institute of Collaborative Innovation,Dongguan 523808,China)
The mulberry jiaosu is a fermentation product which is made from mulberry juice adding probiotics for fermentation. The changes of mulberry jiaosu’ physiological activity in its fermentation process was studied. The changes of the content of glucose,fructose,ethanol,organic acids,anthocyanins,procyanidins and the total phenol were determined by HPLC and colorimetric methods. To explore the effect of fermentation on the antioxidant activity of mulberry jiaosu by hydroxyl radical scavenging experiments and DPPH· scavenging experiments. The results indicated that the total content of glucose and fructose decreased to 66.58 mg/mL after 30 days fermentation,but the ethanol,lactic acid and acetic acid content was greatly improved to 27.19,4.03 and 4.69 mg/mL respectively in the end. The results of the active constituent experiment showed that the content of anthocyanins and procyanidinsc reduced,but the total phenol content increased by 5.0% and the antioxidant activity was also enhanced after 30 days of fermentation. The scavenging rate of hydroxyl radicals and DPPH· were 48.12% and 98.16%,respectively. Therefore,the antioxidant activity of mulberry jiaosu has been improved in the fermentation process and its change was relevant to the change of total phenolics.
mulberry jiaosu;fermentation;physiological activity;antioxidant activity
TS255.1
A
1002-0306(2017)19-0131-06
10.13386/j.issn1002-0306.2017.19.025
2017-04-11
刘涛(1991-),男,硕士研究生,研究方向:食品科学,E-mail:liu13609647598@163.com。
*通讯作者:杨继国(1977-),男,博士,副研究员,研究方向:食品生物化学,E-mail:36381970@qq.com。
十二五科技支撑计划子课题(2012BAD33B11)。
