预热处理对乳清分离蛋白水包油乳状液特性和物理稳定性的影响
2017-10-19,,,,,,*
,, ,,,,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.北京三元食品股份有限公司,北京 100163)
预热处理对乳清分离蛋白水包油乳状液特性和物理稳定性的影响
王超1,蔡浚泽2,刘骞1,曹传爱1,孔保华1,夏秀芳1,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.北京三元食品股份有限公司,北京 100163)
本实验主要研究了加热预处理(90 ℃,5 min)对乳清分离蛋白作为稳定剂所制备的菜籽油水包油型乳状液的特性和物理稳定性的影响。测定了乳状液在储藏期间的ζ-电势、粒径、絮凝指数、分层指数、流变特性和乳状液中蛋白质分配系数的变化趋势。研究结果表明,与天然乳清分离蛋白相比,经过预热处理的乳清分离蛋白能够显著降低乳状液在整个储藏期间(0~14 d)的物理稳定性(p<0.05),具体表现为较低的ζ-电势(p<0.05),以及较高的粒径、絮凝指数、分层指数和粘度(p<0.05)。与此同时,加热处理导致的乳清分离蛋白变性和聚集,能够显著增加其在乳状液界面蛋白膜表面的分布(p<0.05),从而验证了上述乳状液物理稳定性的结果。上述结果表明,加热预处理显著降低了整个乳状液在储藏期间的物理稳定性,为乳清分离蛋白在乳状液中的合理应用奠定了理论基础。
乳清分离蛋白,预热处理,水包油型乳状液,物理稳定性,分配系数
乳化体系是由互不相容的两相(一般为油和水),其中一种以液滴的形式分散于另一相中,并且加入了小分子的表面活性剂(例如吐温-20)或大分子(蛋白质)作为稳定剂的一种复杂的混合体系,其中含有大量的乳状液滴。根据热力学第二定律,乳状液滴是非自发形成的,因此,乳化体系通常是热力学不稳定体系,它们常常会发生絮凝、聚结或乳状液的分层[1]。温度、pH、离子强度、蛋白质浓度、蛋白质/油、油相的体积分数等是影响乳状液物理稳定性的主要因素。最常用的提高稳定性的办法是使用具有表面活性的乳化剂。乳化剂能够吸附在油水界面,可以促进液滴形成且通过降低界面张力使其稳定,同时还能够在液滴之间产生排斥力而防止其聚集[2]。目前在食品工业中,常用的乳化剂有单甘酯、大豆磷脂及其衍生物、蔗糖酯、山梨醇酯及丙二醇这五大类[3]。而蛋白质具有两亲性(同时具有极性和非极性基团),不仅能够产生乳化作用,迅速吸附到油滴表面上且在油滴周围形成保护膜防止油滴的结合[4],稳定新形成的O/W(水包油)乳状液,还能在一定程度上稳定和改善乳化性能,因此作为食品乳化剂应用日益广泛。而蛋白质与界面之间的疏水作用是使蛋白质能够吸附于界面的主要作用,因此,具有较高疏水性的蛋白质分子有更好的乳化作用[5]。已有的研究包括大豆分离蛋白[6-7]、酪蛋白[8-9]、麦醇溶蛋白[10-11]、乳清蛋白[12-13]等。
乳清蛋白作为乳酪等乳制品的副产物,来源广泛,价格低廉,具有很高的营养价值及诸多功能特性,比如溶解性、搅打起泡性、成膜性、凝胶性等[14-15]。此外,还具有突出的乳化特性。乳清分离蛋白是通过选择性离子交换技术或膜分离处理产生的一种市场上出售的主要的乳清蛋白产品,与乳清浓缩蛋白(30%~70%)相比含有较高的蛋白含量(90%~95%)[16]。热处理是食品加工过程中最常用的处理手段之一,会对球蛋白质的结构及功能特性产生影响。热处理会诱导蛋白质界面疏水性和灵活性的改变,不仅会对蛋白质的聚集产生影响,还会影响蛋白质在油水界面的界面活性。而乳清蛋白在热处理过程中极易变性从而导致部分蛋白变性聚集,而影响其功能特性[17],乳清分离蛋白的热不稳定性限制了其在食品加工过程中的应用。乳清蛋白的热敏感性与其结构有着密切的关系。乳清蛋白包括β-乳球蛋白(β-Lg)、α-乳清蛋白(α-La)、牛血清蛋白(BSA)及免疫球蛋白[18],这几种蛋白均为紧密的球状蛋白,具有由二硫键结合在一起的明确的三维结构,其中,β-Lg和α-La含量较高[8]。β-Lg在乳清蛋白的聚集中起到重要的作用。Mulvihill[19]等人的研究表明,在聚集过程中,β-Lg发生了球状结构的展开及蛋白分子不可逆的形成蛋白复合物的两个阶段的变化。而α-La的分子内部不含游离巯基,因此对热处理相对稳定。牛血清蛋白(BSA)分子内部含有一个游离-SH基团和17个二硫键,是乳清蛋白中对热最敏感的蛋白质[20]。关于预热处理蛋白质对乳状液稳定性的影响已经进行了诸多研究,但蛋白质预热处理对乳液稳定性的影响在文献中经常是矛盾的。Cui[21]等人对高浓度的大豆蛋白预热处理后,制备的乳状液有较小的粒径和较高的表面载荷。而Millqvist-Fureby[16]等人的研究结果显示乳清浓缩蛋白(WPC)稳定的乳液的液滴大小随着预热条件(在60~90 ℃下热处理达1000 s)而增加,并且导致乳液失稳。
本实验主要研究加热预处理(90 ℃,5 min)是否对乳清分离蛋白作为稳定剂所制备的菜籽油水包油型乳状液的特性和物理稳定性产生影响,分析探讨整个乳状液在储藏期间的ζ-电势、粒径、絮凝指数、分层指数、流变特性和乳状液中蛋白质分配系数的变化趋势,为乳清分离蛋白在复杂的乳状液体系中的应用奠定理论基础。
1 材料与方法
1.1材料与试剂
乳清分离蛋白(WPI,蛋白含量95%) 北京银河路商贸有限责任公司;菜籽油 当地超市;叠氮钠、十二烷基磺酸钠硫酸(SDS)等均为分析纯;实验用水均为去离子水。
1.2仪器与设备
AL-104型精密电子天平、FE20K型pH计 上海梅特勒-托利多仪器设备有限公司;AM-1磁力搅拌器 北京鼎昊源实验仪器有限公司;DK-8B 型电热恒温水浴锅 上海精宏实验设备有限公司;T18匀浆机 德国IKA公司;FPG12805型高压均质机 英国斯坦斯特德流体动力有限公司;Malvern Nano ZS型动态光散射仪、Malvern 2000型激光粒度仪 英国马尔文公司;Allegra 64R型台式高速冷冻离心机 美国贝克曼库尔特有限公司;DHR-1动态剪切流变仪 美国TA公司。
1.3实验方法
乳状液的制备:称取一定量的乳清分离蛋白(Whey protein isolate,WPI)粉末分散于去离子水中,于室温下用磁力搅拌器至少搅拌1 h使其充分溶解,配制成4%的蛋白分散液,同时加入0.01%的叠氮钠作为抑菌剂。将该WPI分散液等体积分成两份,其中一份于90 ℃水浴中加热5 min,拿出后迅速冷却到室温,表示为预加热乳清分离蛋白(Pre-heated whey protein isolate,H-WPI)。取这两种处理的蛋白分散液90 mL分别与10 mL的菜籽油混合,用匀浆机于13500 r/min匀浆2 min,得到粗乳状液。将得到的粗乳状液在40 MPa下进行高压均质,制备稳定的乳状液。用HCl或NaOH调节乳状液的pH到7.0。将制备的乳状液在4 ℃分别储藏0(新鲜乳状液)、1、4、7、10、14 d,进行测量。
1.4乳状液测定指标
1.4.1 ζ-电势 乳状液的ζ-电位是通过测量粒子在电场中移动的方向和速度得到的。为了避免多重散射效应,将均质后的乳状液用去离子水稀释到油相体积的0.001%(v/v),将稀释后的乳状液置于折叠的毛细管中,用激光粒度仪进行测量。
1.4.2 粒径 新鲜乳状液滴和储藏一定时间的乳状液滴的粒径大小用粒度分布仪来测量,样品用去离子水或1%(w/v)SDS溶液进行稀释。将样品的遮蔽度稀释到10%和20%之间。液滴大小用体积分数平均粒径(d4,3)表示。
1.4.3 分层指数(CI) 取25 mL乳状液置于带刻度的具塞玻璃管中,在室温条件下储藏0、1、4、7、10、14 d(垂直状态),乳状液在储藏期间会发生分层现象,上层为不透明的乳化层,下层为血清层。记录不同储藏时间血清层的高度(HS)和乳状液的总高度(Ht)。乳状液的分层指数计算公式如下:

分层指数为乳状液中粒子聚集的非直接指标,粒子聚集越多,粒径越大,乳状液发生分层越快,分层指数越大。
1.4.4 絮凝指数(FI)新鲜或储藏一定时间乳状液滴的絮凝指数用以下公式进行计算:
FI=[(d4,3-water)/(d4,3-1% SDS)-1.0]×100
式中:d4,3-water表示水作为分散剂的乳状液滴的d4,3,d4,3-water表示1% SDS作为分散剂的乳状液滴的d4,3。
在1.4.2中分别用去离子水和1%(w/v)SDS溶液稀释乳状液滴并对其平均粒径(d4,3)进行测量。SDS是一种阴离子表面活性剂,能够吸附在液滴表面,通常,在衍射分析期间,如存在SDS,SDS分子会置换吸附于油/水界面蛋白质并且诱导其与液滴之间的静电排斥作用,从而破坏原始的液滴聚集体[22]。因此,SDS能够降低桥接油滴的程度,但如果液滴聚结,则不会破坏聚集。当不存在SDS分子时,尽管稀释和搅拌可能破坏任何弱絮凝的液滴,但不会破坏强絮凝的液滴,因此该方法能够用来评价由于桥接机制形成的絮状物的稳定性[23]。
1.4.5 流变特性 本实验采用具有平行板的DHR-1 动态剪切流变仪测定新鲜乳状液和储藏14 d的乳状液的流变特性,测量温度为25 ℃,平板直径为40 mm,间隙为0.5 mm。剪切流动实验中剪切速率由0.01 s-1到10 s-1。
1.4.6 乳化剂在水相及界面的分布 为了测定新鲜乳状液和储藏14 d的乳状液中蛋白含量在各相的分布情况,取1 mL乳状液置于1.5 mL的离心管中,于25 ℃ 15000×g条件下离心45 min,用注射器小心吸取下层清液在相同条件下再次离心,小心吸取下层清液,并合并多个离心中的清液,合并后的清液过0.22 μm滤膜,使用Lowry’s[24]的方法测定滤液的蛋白含量。
参考Hunag[25]等人的方法计算蛋白在两相中的分配系数,公式如下:
式中:Vw表示水的体积(mL);Vl表示油的体积(mL);Wt表示总蛋白含量(mg/mL);Ww表示水相中的蛋白含量(mg/mL);计算时所用油的密度(g/mL)为0.922;水相中的蛋白含量占总蛋白含量的比例为(Ww/Wt);界面上吸附的蛋白含量所占的比例等于总的蛋白含量与水相中蛋白含量之差。
1.5数据统计分析
每个实验重复三次,结果表示为平均数±SD。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(p<0.05)分析使用Tukey HSD程序。采用sigmaplot11.0 软件作图。
2 结果与分析
2.1ζ-电势的变化
食品中许多具有表面活性的物质一般都具有带电性,例如一些蛋白质分子、磷脂分子以及表面活性剂等物质。当这些具有表面活性的物质附着在水包油型乳状液的油-水界面膜上的时候,使得油滴表面的界面膜也具有一定的带电性。水包油乳状液通常通过带相似电荷油滴之间的静电排斥来稳定,带相似电荷的乳状液滴之间的排斥性静电相互作用阻止了液滴的彼此靠近。Yi[26]等人的研究表明ζ-电势的绝对值越高,乳状液物理稳定性越高,即乳状液在贮藏期间可以抵抗聚集和絮凝的能力越强,因此ζ-电势可以用作静电排斥力的量度,可以作为一个重要的指标来评价乳状液的稳定程度。
WPI及H-WPI稳定的乳状液的ζ-电势随储藏时间的变化如图1所示。由图可知,在中性条件下,两种乳状液的电势为负值,说明乳液上的静电电荷为负,表明带负电荷(阴离子)的蛋白质分子吸附到油滴表面上,而且ζ-电势的绝对值均随着储藏时间的延长而降低,WPI涂覆的液滴和H-WPI稳定的液滴的电位分别从第0 d的-40.6 mV、-36.0 mV变为第14 d的-30.2 mV和-25.3 mV(p<0.05),这一结果表明,随着储藏时间的增加,乳状液的稳定性呈逐渐下降的趋势。而且在同一储藏时间H-WPI所制备的乳状液相对于WPI稳定的体系有较小的ζ-电势,说明H-WPI稳定的乳状液的稳定性较差。可能的原因是均质后蛋白质产生的液滴间的排斥相互作用(例如空间位阻和静电相互作用)对于稳定乳状液发挥重要的作用[27]。本实验中对WPI蛋白分散液进行90 ℃预处理,这个温度高于β-Lg的变性温度,暴露球状蛋白内部的疏水性氨基酸残基,导致其表面疏水性和吸附的β-Lg分子的灵活性增加,同时,暴露的非极性基团或巯基基团通过疏水吸引和硫醇-二硫化物交换反应增加蛋白分子间相互作用,从而产生聚集,降低了乳状液的稳定性,表现为ζ-电势有所下降[28]。
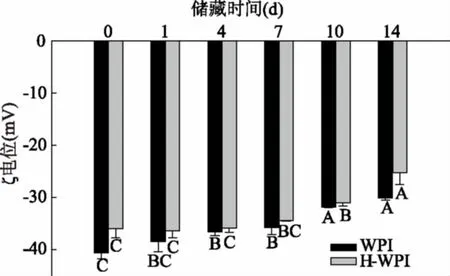
图1 储藏时间对乳状液粒子ζ-电位的影响Fig.1 Effect of storage time on zeta potential of emulsion注:不同字母表示同种处理不同时间的数据有显著性差异(p<0.05),图2~图4同。
2.2粒径的变化
图2表示乳状液的粒径随储藏时间的变化情况,从图中可以看出,乳状液的粒径随着储藏时间的延长显著增加(p<0.05)。WPI经加热处理后,乳状液液滴粒径增大。这是由于加热导致了大多数球蛋白,如β-Lg结构和功能特性的变化。变性能够影响蛋白质的三维结构特别是与蛋白质的打开及聚集有关。热诱导的变性程度取决于加热持续时间和加热温度[29]。β-Lg的变性温度约为70 ℃,而α-La的约为60 ℃[30]。Ruffin[29]等人探究了不同的预热温度和时间对于WPI变性程度的影响,结果表明,70 ℃预热5 min仅有12.2%变性。而80 ℃预热30 min蛋白完全变性。
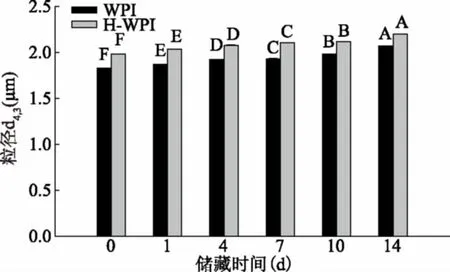
图2 储藏时间对乳状液粒子粒径的影响Fig.2 Effect of storage time on droplet size of emulsion
Ruffin[29]等人在对WPI进行80 ℃预热3 min条件下制备的乳状液与天然乳清蛋白制备的乳状液的液滴粒径要小。这与蛋白质的成分及变性条件相关。在强预热条件(即80 ℃,30 min)下,WPI完全变性,因此乳清蛋白完全展开。Vassilios[18]等人研究称展开的乳清蛋白能够在油相周围重新排列,形成更紧密的界面膜从而减少液滴絮凝。此外,更多的蛋白展开增加了分子的灵活性,从而影响界面吸附蛋白质层的行为及液滴之间的空间相互作用,从而增强了乳状液的稳定性。
而本实验中蛋白经过加热预处理后制备的乳状液粒径增大可能是因为在该处理条件下(90 ℃,5 min),暴露了先前隐藏的疏水性基团从而形成大分子量的聚集,不能够有效的覆盖到油滴表面,使粒径增大,从而使乳状液的稳定性降低。此外,存在于血清相中的非吸附的蛋白质与吸附在界面上的蛋白之间的相互作用也会引起脂肪滴的聚集,增大粒径[18]。
2.3分层指数(CI)的变化
由于乳状液中分散相和连续相之间存在质量密度差,而且O/W乳状液中油相的密度低于水相的密度,因此油滴往往向上移动,乳状液发生分层现象。而CI表示乳状液滴在一段时间内其对抗重力分离的稳定性[31]。此外,CI能够提供关于乳状液滴聚集程度的间接信息[32],CI值越小,乳状液越稳定。储藏期间乳状液在0~14 d的分层情况变化如图3所示。由图可以观察到:新鲜制备的乳状液未发生分层现象,所有样品在储藏期间在视觉上没有观察到明显的分层现象,但是乳状液样品的分层指数随着储藏时间的延长而逐渐增大,WPI制备的乳状液,CI从0增大到6%,相同储藏时间,经过加热预处理后制备的乳状液分层指数更大,在第14 d达到最大7%,说明高温度的预热处理会对乳状液的物理稳定性产生不利的影响。

图3 储藏时间对乳状液粒子分层指数的影响Fig.3 Effect of storage time on creaming index of emulsion
Shao[33]等人的研究表明乳状液滴的分层现象不仅与乳状液滴的絮凝状态有关,而且取决于分离或絮凝的液滴间的相互吸引作用。由于加热导致蛋白质的变性,增加了其表面疏水性。结合上文分析,分散相的液滴粒径大小对分层指数具有显着影响;随着液滴粒径增大,乳状液分层变慢,乳状液更不稳定,反之亦然。此外,乳状液的分层行为与界面膜的厚度有关,如果蛋白质在表面上的吸附快于打开,则会形成更厚的界面膜。然而,由于此时WPI(90 ℃,5 min)已经大部分变性,所以吸附比打开慢,因此会形成更薄的膜,从而降低了乳状液的物理稳定性。
2.4絮凝指数(FI)的变化
絮凝会导致液滴粒径的增大从而产生分层现象,此外,由于液滴彼此靠近而导致聚结,因此,絮凝会对乳状液的物理稳定性产生有害的影响[34]。絮凝指数也是用来衡量乳状液稳定性的一个重要参数。可以通过测量液滴粒径来确定乳状液中是否存在絮凝。1% SDS可能破坏油滴的絮凝。因此用1% SDS作为分散剂得到d4,3反映了单个油滴的大小。当乳状液没有发生絮凝时,液滴使用双蒸水和1.0%(w/v)SDS分别作为分散剂所测得液滴粒径大小不会发生改变;但是如果乳状液中存在絮凝,液滴分散于1.0%(w/v)SDS中所得的粒径相比于分散于双蒸水中的将会减小[35]。Shao[33]等人的研究表明,对大豆蛋白进行热预处理(95 ℃,15 min)测得的d4,3(分散于1% SDS中)值与未加热的蛋白质相比显著降低(p<0.05)。
储藏期间乳状液在0~14 d的絮凝情况变化如图4所示,在本实验中WPI制备的乳状液絮凝指数随着储藏时间的延长呈增大趋势,在第0 d絮凝指数较低,说明新鲜乳状液未有絮凝形成,及此时液滴间的静电排斥力对于稳定乳状液起到了关键作用。在第14 d达到了最大值,说明两种乳状液在储藏期间均发生絮凝且絮凝程度逐渐增大。而H-WPI制备的乳状液絮凝指数与WPI制备的乳状液比显著升高,这是由于与热处理导致WPI变性、聚集,有利于液滴间的相互吸引作用,从而反应了乳状液稳定性的降低。热诱导引起絮凝的程度取决于诸多因素,如热处理时间及温度和未吸附的蛋白质浓度。形成的絮凝物通过吸附到不同液滴表面的蛋白质之间的疏水相互作用和共价二硫键结合在一起,WPI经过高温加热后暴露了更多的疏水作用基团,从而加剧了絮凝的形成。
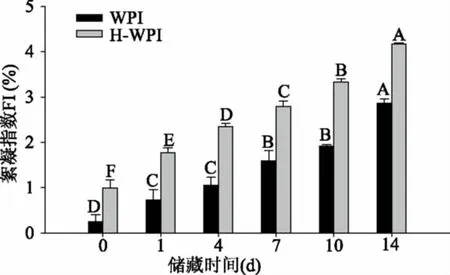
图4 储藏时间对乳状液粒子絮凝指数的影响Fig.4 Effect of storage time on flocculation index of emulsion
2.5乳状液流变学特性
通过对乳状液的流变特性的测量可以得到有关于乳状液物理稳定性,液滴粒径大小及分布的信息。乳状液的流变行为主要由几个因素控制,如连续相的流变学性质、平均粒度及粒度分布、内部粘度、液滴浓度和粒子-粒子相互作用的性质[36]。图5表示乳状液的流变特性在第0 d和第14 d的变化情况,在剪切速率为0.01~1 s-1的变化范围内,所有样品的粘度均随着剪切速率的增大而减小,最后趋于0,这是由于增加的剪切速率破坏了聚集的液滴从而导致了粘度的降低。WPI经加热处理后,乳状液的粘度显著增大,WPI稳定的乳状液,第14 d的粘度值相对于第0 d的有所增大,但差异并不显著;而H-WPI稳定的乳状液也表现出类似的现象,其稳定的乳状液在储藏14 d后,两组样品的粘度达到了最大值。这说明随着储藏时间的增加,乳状液滴粘度增大,这也与前文所述的乳状液滴在储藏期间粒径增大,表面电荷减小,液滴发生聚集、絮凝,稳定性降低一致。Taherian[37]等人的研究也表明,乳状液在储藏期间粘度的增加与液滴的絮凝有关,Peng[38]等人通过对豌豆蛋白进行热预处理(90 ℃,30 min),也得到了类似的结论。
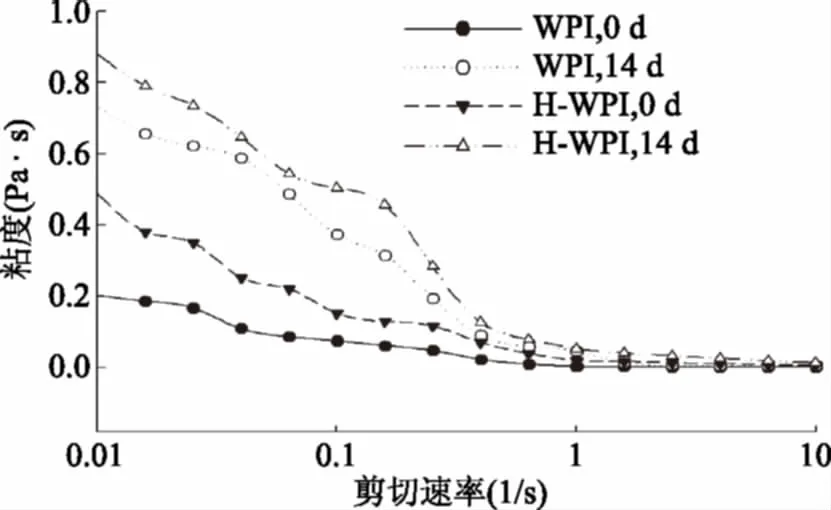
图5 剪切速率对乳状液粒子粘度的影响Fig.5 Effect of shear rate on the viscosity of emulsion
2.6乳化剂在油水界面的分布
表1为乳状液在储藏14 d后WPI及H-WPI在水相及与油水界面的分布情况。由表1可知,WPI在水相中的含量较H-WPI高,两者差异显著(p<0.05)。H-WPI在油水界面的分配系数为3.17,高于WPI的分配系,这说明加热处理WPI有利于乳化剂在油相的分布。这是由于加热预处理导致蛋白质发生变性或聚集,能够使原本位于球蛋白内部的疏水性基团暴露出来,增加WPI蛋白的界面疏水性,因此,水相中蛋白含量减少,从而有利于蛋白质吸附到界面上。Peng[38]等人对用热预处理(90 ℃,30 min)的豌豆蛋白稳定的乳状液进行,表明在相同的浓度,经过加热预处理的乳状液的蛋白吸附量要高于加热的乳状液,这也与Li[39]等人关于预加热的大豆蛋白乳状液吸附蛋白的百分比高于未加热的蛋白乳状液这一结果一致。此外,蛋白质在油水界面的吸附特性还与蛋白的灵活性和疏水性有关。H-WPI相对于WPI增加了蛋白分子的灵活性和界面疏水性,因此H-WPI比WPI更易吸附在界面上,从而使分配系数增大[39]。
表1 不同处理条件下乳化剂在水相中的分布情况
Table 1 Partitioning of emulsifier in the aqueoussolution under different treatment conditions

处理条件水相中蛋白质(%)分配系数(油相/水相)WPI80.90±1.31A2.13H-WPI73.96±1.04B3.17
注:大写字母不同表示同列中差异显著(p<0.05),数值表示为均值±标准偏差(n=3)。
3 结论
本实验主要针对加热预处理(90 ℃,5 min)是否能够对乳清分离蛋白作为稳定剂所制备的菜籽油水包油型乳状液的特性和物理稳定性产生影响进行了深入探讨。通过乳状液在储藏期间(0~14 d)的ζ-电势、粒径、絮凝指数、分层指数、流变特性的测定结果发现,经过预热处理的乳清分离蛋白能够显著降低乳状液在整个储藏期间的物理稳定性。另外,乳清分离蛋白在油水界面中的分布情况直接验证了预加热处理不利于促进乳状液物理稳定性的结果。因此,本实验为乳清分离蛋白在乳状液中的合理应用奠定了理论基础。
[1]Zhao J,Xiong Y L. Interfacial peptide partitioning and undiminished antioxidative and emulsifying activity of oxidatively stressed soy protein hydrolysate in an O/W emulsion[J]. LWT-Food Science and Technology,2015,61(2):322-329.
[2]Wang B,Wang L J,Li D,et al. Effect of gum Arabic on stability of oil-in-water emulsion stabilized by flaxseed and soybean protein[J]. Carbohydrate Polymers,2011,86(1):343-351.
[3]孙向东,李硕. 蛋白质乳化作用与置换吸附探讨[J].食品工业科技.2012,33(16):405-408.
[4]Wilde P,Mackie A,Husband F,et al. Proteins and emulsifiers at liquid interfaces[J]. Advances in Colloid and Interface Science,2004,108-109(10):63-71.
[5]Friberg S E,Larsson K. Food Emulsions[M]. New York:Marcel Dekker,1997:57-109.
[6]Zhang Y,Tan C,Abbas S,et al. Modified SPI improves the emulsion properties and oxidative stability of fish oil microcapsules[J]. Food Hydrocolloids,2015(51):108-117.
[7]Wang Y,Li D,Wang L J,et al. The effect of addition of flaxseed gum on the emulsion properties of soybean protein isolate(SPI)[J]. Journal of Food Engineering,2011,104(1):56-62.
[8]Li M,Auty M A E,O’Mahony J A,et al. Covalent labelling ofβ-casein and its effect on the microstructure and physico-chemical properties of emulsions stabilized byβ-casein and whey protein isolate[J]. Food Hydrocolloids,2016(61):504-513.
[9]Ma J Z,Gan C F,Xu Q N,et al. Amphiphilic copolymer stabilized core-shell structural casein-based emulsion[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2015(471):65-72.
[10]Hu Y Q,Yin S W,Zhu J H,et al. Fabrication and characterization of novel Pickering emulsions and Pickering high internal emulsions stabilized by gliadin colloidal particles[J]. Food Hydrocolloids,2016(61):300-310.
[11]Qiu C Y,Zhao M M,Decker E A,et al. Influence of protein type on oxidation and digestibility of fish oil-in-water emulsions:Gliadin,caseinate,and whey protein[J]. Food Chemistry,2015(175):249-257.
[12]Zhang R J,Zhang Z P,Zhang H,et al. Influence of lipid type on gastrointestinal fate of oil-in-water emulsions:Invitrodigestion study[J]. Food Research International,2015(75):75-78.
[13]Ruttarattanamongkol K,Afizah M. N,Rizvi S S H. Stability and rheological properties of corn oil and butter oil emulsions stabilized with texturized whey proteins by supercritical fluid extrusion[J]. Journal of Food Engineering,2015(166):139-147.
[14]耿浩,刘悦,梁新婷,等. 热诱导对乳清浓缩蛋白和分离蛋白乳化性及稳定性的影响[J]. 中国食品学报,2016,16(8):71-77.
[15]杨赫鸿,刘骞,孔保华,等. 美拉德反应中乳清分离蛋白特性的变化[J]. 食品科学,2012,33(23):98-102.
[16]Millqvist-Fureby A,Elofsson U,Bergenståhl B. Surface composition of spray-dried milk protein-stabilised emulsions in relation to pre-heat treatment of proteins[J]. Colloids & Surfaces B Biointerfaces,2001,21(1-3):47-58.
[17]Setiowatia A D,Vermeira L,Martinsb J,et al. Improved heat stability of protein solutions and O/W emulsions upon dry heat treatment of whey protein isolate in the presence of low-methoxyl pectin[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2016(510):93-103.
[18]Vassilios R. Effect of heat treatment on milk protein functionality at emulsion interfaces. A review[J]. Food Hydrocolloids,2010(24):259-265.
[19]Mulvihill D M,Donovan M. Whey proteins and their thermal denaturation-a review[J]. Irish Journal Food Science Technology,1987,11(1):43-75.
[20]赵新淮,徐红华,等. 食品蛋白质:结构,性质与功能[M].北京:科学出版社,2009.
[21]Cui Z,Chen Y,Kong X,et al. Emulsifying Properties and Oil/Water(O/W)Interface Adsorption Behavior of Heated Soy Proteins:Effects of Heating Concentration,Homogenizer Rotating Speed,and Salt Addition Level[J]. Journal of Agricultural & Food Chemistry,2014,62(7):1634-42.
[22]Smulders P E A,Caessens P W J R,Walstra P. Emulsifying properties ofβ-casein and its hydrolysates in relation to their molecular properties[J]. Food Emulsions & Foams Cambridge,1999:61-69.
[23]Thanasukarn P,Pongsawatmanit R,Mcclements D J. Influence of emulsifier type on freeze-thaw stability of hydrogenated palm oil-in-water emulsions[J]. Food Hydrocolloids,2004,18(6):1033-1043.
[24]Lowry O H,Rosebrough N J,Farr A I,et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1):265-275.
[25]Huang S W,Frankel E N,Aeschbach R,et al. Partition of selected antioxidant in corn oil-water model system[J]. Journal of Agricultural & Food Chemistry,1997,45(6):1991-1994.
[26]Yi J H,Zhu Z B,Mcclements D J,Et Al. Influence of aqueous phase emulsifiers on lipid oxidation in water-in-walnut oil emulsions[J]. Journal of Agriculture & Food Chemistry,2014,62(9):2104-2111.
[27]Dickinson E. Adsorbed protein layers at fluid interfaces:interactions,structure and surface rheology[J]. Colloids and Surfaces B:Biointerfaces,1999(15):161-176.
[28]Kim H J,Decker E A,Mcclements D J. Role of Postadsorption Conformation Changes ofβ-Lactoglobulin on Its Ability To Stabilize Oil Droplets against Flocculation during Heating at Neutral pH[J]. Langmuir,2002(18):7577-7583.
[29]Ruffin E,Schmit T,Lafitte G,et al. The impact of whey protein preheating on the properties of emulsion gel bead[J]. Food Chemistry,2014,151(15):324-332.
[30]Fitzsimons S M,Mulvihill D M,Morris E R. Denaturation and aggregation processes in thermal gelation of whey proteins resolved by differential scanning calorimetry[J]. Food Hydrocolloids,2007(21):638-644.
[31]Gómez-Mascaraque L G,López-Rubio A. Protein-based emulsion electrosprayed micro-and submicroparticles for the encapsulation and stabilization of thermosensitive hydrophobic bioactives[J]. Journal of Colloid and Interface Science,2016,465(1):259-270.
[32]Seta L,Baldino N,Gabriele D,et al. The influence of carrageenan on interfacial properties and short-term stability of milk whey proteins emulsions[J]. Food Hydrocolloids,2013,32(2):373-382.
[33]Shao Y,Tang C H. Characteristics and oxidative stability of soy protein-stabilized oil-in water emulsions:Influence of ionic strength and heat pretreatment[J]. Food Hydrocolloids,2014(37):149-158.
[34]Dickinson E,Elverson D J,Murray B S. On the film-forming and emulsion-stabilizing properties of gum arabic:dilution and flocculation aspects[J]. Food Hydrocolloids,1989,2(3):101-114.
[35]Thaiphanit S,Anprung P. Physicochemical and emulsion properties of edible protein concentrate from coconut(CocosnuciferaL.)processing by-products and the influence of heat treatment[J]. Food Hydrocolloids,2016,52(4):756-765.
[36]Barnes H A. Rheology of emulsions-A review[J]. Colloids & Surfaces A-Physicochemical & Engineering Aspects,1994(91):89-95.
[37]Taherian A R,Britten M,Sabik H,et al. Ability of whey protein isolate and/or fish gelatin to inhibit physical separation and lipid oxidation in fish oil-in-water beverage emulsion[J]. Food Hydrocolloids,2011,25(5):868-878.
[38]Peng W W,Kong X Z,Chen Y M,et al. Effects of heat treatment on the emulsifying properties of pea protein[J]. Food Hydrocolloids,2016(52):301-310.
[39]Li F,Kong X Z,Zhang C M,et al. Effect of heat treatment on the properties of soy protein-stabilised emulsions[J]. International Journal of Food Science & Technology,2011(46):1554-1560.
Influenceofheatpretreatmentonthecharacteristicsandphysicalstabilityofwheyproteinisolate-stabilizedrapeseedoil-in-wateremulsions
WANGChao1,CAIJun-ze2,LIUQian1,CAOChuan-ai1,KONGBao-hua1,XIAXiu-fang1,*
(1.College of Food Science,Northeast Agricultural University,Harbin 150030,China;2.Beijing Sanyuan Foods Co.,Ltd.,Beijing 100163,China)
The effect of thermal pretreatment(90 ℃,5 min)on the properties and physical stability of rapeseed oil-in-water emulsion of prepared by using whey protein isolate as stabilizer were investigated. The changes trend of ζ-potential,particle size,flocculation index,creaming index,rheological property and the partition coefficient of protein in the emulsion during storage were measured. The results showed that the heat pretreatment whey protein isolate could significantly reduce the physical stability of the emulsion during storage(0~14 days)compared with the natural whey protein isolate(p<0.05),and the specific performance of lower ζ-potential(p<0.05),and higher particle size,flocculation index,creaming index and viscosity(p<0.05). At the same time,the denaturation and aggregation of whey protein isolate caused by preheating treatment could significantly increase the distribution of the protein on the surface of the emulsion membrane(p<0.05),thus confirming the physical stability of the emulsions. The results indicated that the thermal pretreatment significantly reduced the physical stability of the whole emulsion during storage and laid a theoretical foundation for the rational application of whey protein isolate in the emulsion.
whey protein isolate;heat pretreatment;oil-in-water emulsion;physical stability;percentage of adsorbed proteins
TS201.1
A
1002-0306(2017)19-0021-07
10.13386/j.issn1002-0306.2017.19.004
2017-04-14
王超(1993-),女,硕士研究生,研究方向:畜产品加工,E-mail:WJMwangjiamuWJM@163.com。
*通讯作者:夏秀芳(1973-),女,博士,教授,研究方向:畜产品加工,E-mail:xxfang524@163.com。
国家自然科学基金项目 (31671788);东北农业大学“学术骨干”项目(16XG18)。
