大米谷蛋白热聚集的盐效应及机制
2017-10-16,,,
,,,
(湖北工业大学生物工程与食品学院,湖北武汉 430068)
大米谷蛋白热聚集的盐效应及机制
袁江兰,黄亚明,李传雯,康旭
(湖北工业大学生物工程与食品学院,湖北武汉430068)
大米谷蛋白易发生热聚集,离子强度对大米谷蛋白热聚集有明显影响,研究揭示NaCl对大米谷蛋白的热聚集的影响规律及机制。当NaCl浓度从0增加至0.15 mol·L-1时,热处理大米谷蛋白溶解度由13.78%降至12.49%,减小趋势不明显,浓度达到0.30 mol·L-1时,溶解度降至10.62%,并且出现了肉眼可见的浑浊。当NaCl浓度从0 mol·L-1增加至0.30 mol·L-1时,热处理大米谷蛋白的浊度由0.052显著增加至0.191,平均粒径由168 nm增至273 nm,并出现明显的聚集峰,Zeta电位由-14.4减小至-5.61,疏水性由329.16增加至535.80,谷蛋白荧光发射光谱发生微小蓝移,荧光强度增加。NaCl影响了谷蛋白分子的表面电荷和疏水性,当浓度大于0.15 mol·L-1时明显促进了大米谷蛋白分子热聚集。
大米,谷蛋白,热聚集,氯化钠,疏水性
Abstract:Rice glutelin was prone to thermal aggregation,and ionic strength had obvious effect on its thermal aggregation. Here,the effect laws and mechanisms of rice glutelin thermal aggregation by NaCl were revealed. When NaCl concentration increased from 0~0.15 mol·L-1,solubility of rice glutelin treated by heat decreased from 13.78% to 12.49%,which seemed not to be obvious,but the solubility was 10.62% when NaCl concentration was 0.30 mol·L-1,and it appeared to be turbid. The turbidity of rice glutelin by heat treatment increased significantly from 0.052 to 0.191 when NaCl concentration increased from 0~0.30 mol·L-1,average particle size increased from 168 nm to 273 nm,and an aggregation peak rised,Zeta potential changed from -14.4 to -5.61,and hydrophobicity increased from 329.16 to 535.80,there was a slight blue shift for fluorescence emission spectrum of rice glutelin by heat treatment,and fluorescence intensity increased. NaCl affected surface charge and hydrophobicity of rice glutelin by heat treatment,and promoted its thermal aggregation when concentration of NaCl was more than 0.15 mol·L-1.
Keywords:rice;glutelin;thermal aggregation;sodium chloride;hydrophobicity
热处理是食品工业中常用的操作单元,常常造成食品蛋白质发生变性聚集,蛋白质热聚集对食品质构、营养和功能等均有一定影响。蛋白质遇热后结构发生改变,分子内部的疏水基团暴露于分子表面,使分子之间的表面吸引力大于排斥力,而导致蛋白质分子聚集[1]。聚集会引起蛋白质性质和功能发生变化,如溶解性降低、生物活性丧失等[2]。球蛋白遇热变性后,还可以形成可溶性聚集体,如果蛋白浓度超过临界值则聚集体可交联形成凝胶网状结构[3]。
探究食品蛋白质热聚集过程可以更好地控制加工操作参数从而控制食品品质。离子强度是影响蛋白质热聚集的重要因素,NaCl是常用的食品添加剂,影响着食品中共存成分的微环境,从而影响蛋白质的结构和功能特性。如大豆蛋白中增加适当的盐分可以有效降低蛋白的静电斥力,使蛋白结构发生改变,进一步促进改善大豆蛋白的乳化性和持油性等功能特性,同时产生了蛋白质-盐相互作用,因此利用盐离子可以从分子水平上控制蛋白质溶液的结构以及热力学性质[4]。热处理过程中,单价或二价的盐离子对带电蛋白质产生的电荷屏蔽作用会增大蛋白质之间的相互作用[5],使蛋白质发生聚集。β-乳球蛋白在pH7.0、低离子强度的条件下,有细长型聚集体形成,在较高离子强度的环境下,这些小的聚集体会发生相互缠结形成更大的聚集体[6]。
大米谷蛋白的热聚集是大米类食品加工和生产过程中常见的现象,NaCl也是大米类产品中常用的食品成分,与大米谷蛋白共存于食品中参与构成食品的化学体系。NaCl对其他蛋白质聚集的影响已有文献报道,而它在大米谷蛋白聚集中的作用尚无人论及,本文探究NaCl对大米谷蛋白热聚集的影响及机制,为大米谷蛋白理论研究和应用推广提供依据。
1 材料与方法
1.1 材料与仪器
大米 为市售粳米(OryzasativaL.);1-苯氨基萘-8-磺酸(ANS)、牛血清白蛋白 为biosharp产品;氯化钠等 均为国产分析纯。
UV-2100紫外-可见分光光度计 尤尼柯仪器有限公司;Zeta-Sizer 2000电位仪 英国Malvern公司;日立F-7000荧光分光光度计 日立高新技术公司;ZNC-410超微粉粹机 北京兴时利和科技发展有限公司
1.2 实验方法
1.2.1 大米谷蛋白制备 采用碱溶酸沉法[7-8]。将大米超微粉碎得大米粉,将大米粉和0.05 mol·L-1NaOH溶液按固液比1∶10 (m∶v)混合,室温磁力搅拌4 h,然后5000 r/min离心30 min,取上清液,再用0.05 mol·L-1的盐酸调等电点到4.8,静置12 h后,将样品调到pH7.0。离心取沉淀,再用去离子水洗沉淀三次除去可溶性物质。将沉淀用5% NaCl(w∶v/1∶8)提取3.5 h后,除去少量的清蛋白和球蛋白,再次离心取沉淀,沉淀采用75%乙醇(w∶v/1∶8)提取3.5 h后离心除去醇溶蛋白。最后冷冻干燥得到谷蛋白冻干粉。
1.2.2 不同NaCl浓度的谷蛋白样品制备 大米谷蛋白冻干粉按照1/15 (w/v)加入至pH11.0磷酸盐缓冲液中,制成分散液,室温下磁力搅拌2 h,10000 r/min离心30 min取上清液,再经0.45 μm醋酸纤维素膜过滤。将滤过液与不同浓度的NaCl溶液按照1∶2 (V∶V)混合均匀制成NaCl浓度分别为0、0.05、0.10、0.15、0.30 mol·L-1的谷蛋白溶液,再加至具塞试管中90 ℃加热30 min,冷却至室温,得五组样品,分别测定其溶解度、浊度、粒径分布、Zeta电位、表面疏水性指数和荧光光谱。
1.2.3 蛋白质溶解度测定 采用Bradford法[9]。将1.2.2中样品10000 r/min离心30 min,取上清液,测定上清液蛋白质含量,以牛血清蛋白为标准蛋白制作标准曲线。并按下式计算溶解度:
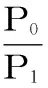
式中,S:溶解度(%);P0:上清液中蛋白质的总量(mg);P1:冻干样品中蛋白质的总量(mg)。
1.2.4 浊度测定 测定样品在600 nm处的吸光值,以表征其浊度。
1.2.5 粒径分布 采用Malvern纳米粒度分布仪,散射角度为173°,室温测定。
1.2.6 Zeta电位 采用Malvern Zeta电位仪,一对0.45 cm2铂电极,间距为0.4 cm,测定温度25 ℃。
1.2.7 表面疏水性指数 采用ANS荧光探针法[10]。将1.2.2制备的样品溶于pH7.0的PBS缓冲液中,每组样品均制成0.02、0.04、0.06、0.08、0.1 mg/mL的系列浓度溶液。测前加入8 mmol·L-1ANS储液20 μL,振荡均匀后测定其荧光强度(FI),激发波长为390 nm,发射波长为480 nm。均以谷蛋白浓度为0.02 mg/mL的样品为基准,作相对荧光强度-谷蛋白浓度的直线,该直线的斜率作为蛋白质的表面疏水性指数(H0)。
1.2.8 荧光光谱分析 采用F-7000荧光分光光度计测定[11]。激发波长为290 nm,在300~400 nm扫描发射光谱,激发和发射狭缝宽均为5 nm。
1.3 统计分析方法
每个样品均做三个平行,每个平行测定重复3次,结果取平均值。采用Origin 8.0处理和分析数据。
2 结果与分析
2.1 溶解度变化
蛋白质的溶解度受离子强度的影响[12]。由图1可以看出,即使低浓度的NaCl共存,也会导致热处理大米谷蛋白溶解度的下降,随着NaCl浓度的增大,热处理大米谷蛋白溶解度呈下降趋势,当NaCl浓度达到0.30 mol·L-1时,溶解度降至10.62%,溶液呈现明显的浑浊,这与不加NaCl处理的对照组形成明显区别,表明NaCl对谷蛋白的热聚集具有明显促进作用,特别是NaCl浓度较高时,聚集程度明显增加。当离子强度较低时,盐离子中和蛋白质表面的电荷,从而产生电荷屏蔽效应,若蛋白质含有较高的非极性区域,则屏蔽效应可降低其溶解度[5,13];当NaCl浓度较高时,盐离子与蛋白质分子表面带相反电荷的基团结合,中和了生物分子表面的电荷,降低了蛋白质分子与水分子之间的相互作用,蛋白质表面水化层逐渐被破坏,排斥力减小而发生聚集,另外,大量的盐离子存在时,盐离子自身的水合作用降低了自由水的浓度,使蛋白质水化层脱去,疏水区域暴露而发生相互聚集[14]。表明谷蛋白分子表面的疏水性很强且电荷数很小,即使在远高于其PI的碱性环境中也是如此,进一步说明了这一结构特点。
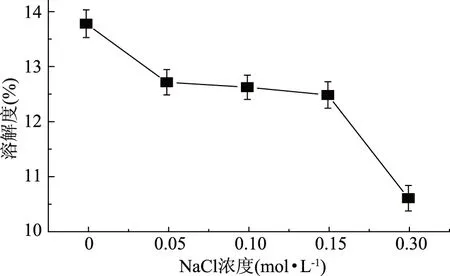
图1 NaCl对热处理大米谷蛋白溶解度的影响Fig.1 Effect of NaCl on solubility of rice glutelin by heat treatment
2.2 浊度变化
对NaCl处理的样品进行观察,很明显,在NaCl浓度低于0.15 mol·L-1时,溶液澄清透明,当浓度为0.30 mol·L-1时,溶液变成乳状浑浊液。由图2可知,随着NaCl浓度增加,大米谷蛋白在600 nm处的吸光值逐渐增大,即溶液浊度逐渐增加,当NaCl浓度低于0.15 mol·L-1时,溶液浊度变化并不明显,但是当NaCl达到0.30 mol·L-1时,浊度显著增加(p<0.05),并且肉眼可见透明溶液变成乳浊液,逐渐有沉淀析出。NaCl浓度从0~0.30 mol·L-1时,浊度值由0.052显著增加至0.191。大豆分离蛋白在低离子强度下加热,浊度不会明显增加,而离子强度增大后,溶液变浊[4,15]。大豆球蛋白的聚集对离子强度也具有依赖性,对低离子强度下的热处理敏感,易发生聚集[15]。NaCl在溶液中产生的静电屏蔽作用促进了蛋白质-蛋白质作用力,使得蛋白质聚集,样品的浊度增大[15-16]。热处理的乳清分离蛋白和β-乳球蛋白在NaCl浓度大于0.054 mol·L-1时,随着NaCl浓度增加,浊度急剧增加[17]。大米谷蛋白在NaCl共存时的浊度变化特点与大豆分离蛋白相似,在低盐浓度下浊度变化不明显,而盐浓度为0.30 mol·L-1时,变浊变化明显,反映出大米谷蛋白分子表面结构上的疏水性和低电荷特点。

图2 NaCl对大米谷蛋白浊度的影响Fig.2 Effect of NaCl on turbidity of rice glutelin
2.3 粒径变化
由图3可知,随着NaCl浓度增加,谷蛋白粒径有增大趋势,当NaCl浓度从0增加至0.30 mol·L-1时,平均粒径由168 nm增至273 nm,还出现了明显的聚集峰。但NaCl浓度低于0.15 mol·L-1时,NaCl对谷蛋白粒度影响并不明显,说明较低离子浓度不会明显促进谷蛋白聚集,当NaCl浓度进一步增加,谷蛋白粒径有明显增加趋势,并且形成聚集峰。其它蛋白质在离子的作用下,也存在聚集的趋势。在低离子强度下加热,卵白蛋白会形成线性聚集物,随着离子强度增加,线性聚集向多胶束型聚集转化,其中,疏水作用力均是聚集的重要诱导力[18]。
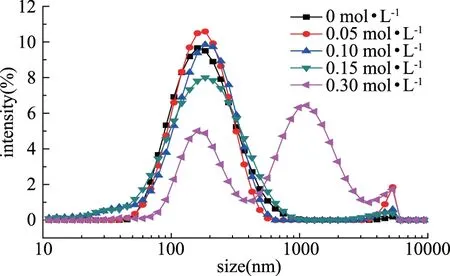
图3 NaCl对大米谷蛋白粒径的影响Fig.3 Effect of NaCl on size of rice glutelin
2.4 Zeta电位变化
Zeta电位是对胶体粒子之间相互排斥或吸引力的强度的度量,与胶态分散的稳定性相关,Zeta电位绝对值越高,体系越稳定,溶液中蛋白质溶解和分散状态良好,而Zeta电位绝对值越低,体系蛋白质则趋于聚集[4]。蛋白质溶液是一种典型的胶态分散体系,Zeta电位是蛋白质溶液稳定性的有效度量参数。由图4可知,未经任何处理的大米谷蛋白溶液Zeta电位值较低,是一个不稳定体系,有明显的聚集趋势,而NaCl的存在进一步降低了其Zeta电位值,进一步加剧了其聚集趋势,显然这种趋势还与NaCl浓度具有明显的相关性,相同条件下,NaCl浓度越高,聚集趋势越明显。NaCl对大米谷蛋白聚集的影响是通过改变谷蛋白Zeta电位值而实现的。NaCl浓度由0 mol·L-1递增至0.30 mol·L-1,Zeta电位由-14.4变为-5.61,表明离子在大米谷蛋白静电相互作用中产生了电荷屏蔽效应[19],使蛋白质分子之间的吸引力大于排斥力,稳定的分散体系被破坏,谷蛋白聚集发生。
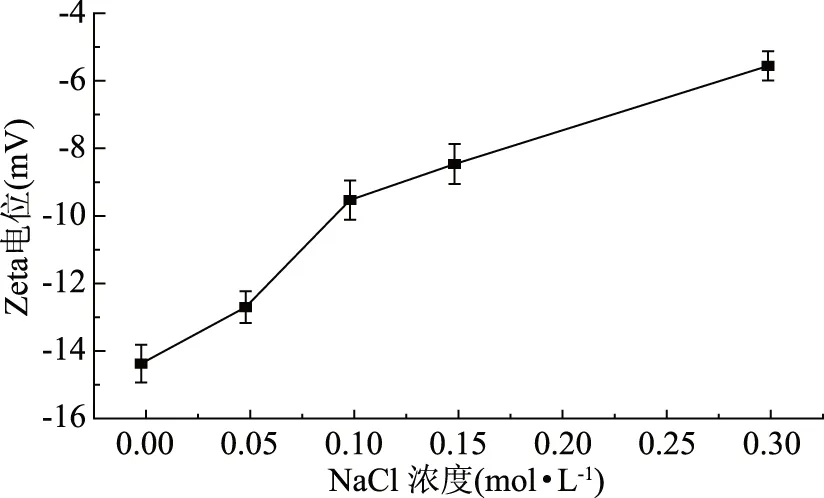
图4 NaCl对大米谷蛋白Zeta电位的影响Fig.4 Effect of NaCl on Zeta potentional of rice glutelin
2.5 表面疏水性变化
蛋白质表面疏水性的大小取决于疏水基团在蛋白质表面的暴露程度,表面疏水性对蛋白质的溶解特性有很大影响[20],从而直接影响蛋白质聚集。图5表明,对照组谷蛋白的表面疏水指数H0为329.15,而经过不同浓度NaCl处理后,谷蛋白的疏水性呈现逐渐增大的趋势。当NaCl为0.30 mol·L-1时,谷蛋白疏水性显著增加至535.80。大米谷蛋白疏水性与溶解性变化趋势相反,原因在于蛋白质的溶解性与蛋白质的亲水性/疏水性的平衡有关[12]。Na+可通过静电屏蔽效应,使得大米谷蛋白表面电势降低,疏水性增强,从而使这种平衡关系被打破,导致蛋白质聚集析出。随着盐离子浓度增加,特别是盐离子浓度较高时,明显扰乱了水分子的组织结构以及水分子和蛋白质之间的相互作用,导致蛋白质表面疏水性增强,蛋白质之间通过疏水相互作用而聚集。NaCl对乳清分离蛋白和β-乳球蛋白表面疏水性的影响不同于大米谷蛋白,无论热处理与否或盐浓度高低,乳清分离蛋白和β-乳球蛋白表面疏水性均无明显变化[17]。
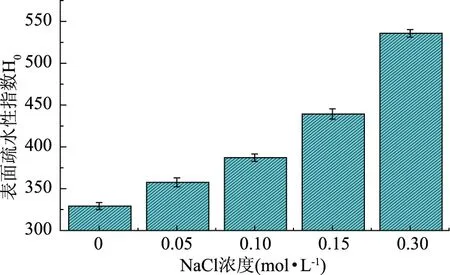
图5 NaCl处理的大米谷蛋白表面疏水性Fig.5 Surface hydrohobicity of rice glutelin after NaCl treatment
2.6 内源荧光变化
蛋白质的内源荧光主要来自色氨酸和酪氨酸残基,其中色氨酸内源荧光光谱对微环境的变化很敏感,其峰位一般在325~350 nm之间波动,蛋白质分子和周围溶剂或其它分子相互作用会导致其荧光发射光谱发生红移或蓝移,常用来探究蛋白质在溶液中的构象变化。当生色基团周围的微环境或结构发生改变时也会导致荧光增强或猝灭。由图6可知,与对照相比,NaCl共存时使谷蛋白荧光强度增加,表明相同条件下NaCl的存在可增加发色团的量子产率[21],其它金属离子也有类似现象,如Zn2+对血红蛋白有较强的荧光增强作用,Cu2+对血红蛋白具有较强的荧光淬灭作用[22]。但当NaCl浓度达到0.30 mol·L-1时,荧光强度明显下降,这与该浓度下热处理的谷蛋白发生聚集有关,谷蛋白聚集引起蛋白质浓度下降,因此荧光强度降低。另外,NaCl共存还使大米谷蛋白荧光光谱发生了蓝移,说明在NaCl作用下,大米谷蛋白色氨酸周围微环境的疏水性有所增强。NaCl趋向于其周围的水分子,使蛋白质表面自由水分子降低,使蛋白质的水化层发生重排,疏水基团暴露程度增加,从而使蛋白质表面疏水性增加[23]。各实验结果相互印证,共同说明了大米谷蛋白分子表面的结构特点及其在NaCl共存时的变化规律。
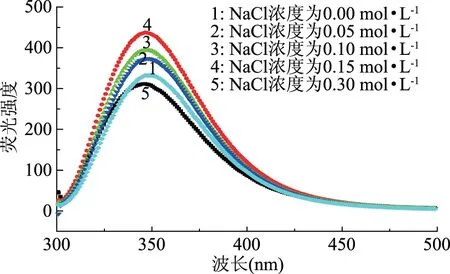
图6 NaCl处理的大米谷蛋白内源荧光光谱Fig.6 Endogenous fluorescence spectra of rice glutein treated by NaCl
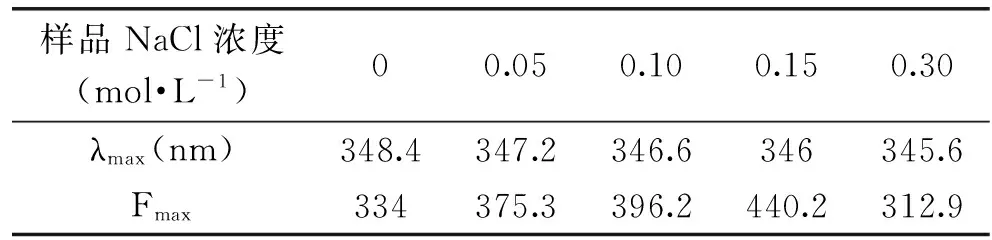
样品NaCl浓度(mol·L-1)00.050.100.150.30λmax(nm)348.4347.2346.6346345.6Fmax334375.3396.2440.2312.9
3 结论
在pH11.0的碱性水溶液环境中,大米谷蛋白依然是一个不稳定体系,低盐浓度即可促进其热聚集。随着盐离子浓度的增加,热处理的大米谷蛋白溶解度降低,浊度增大,尤其是盐离子浓度较高时,这种现象尤为明显,更易形成大分子聚集体。NaCl浓度高于0.15 mol·L-1时即可对大米谷蛋白微环境中的电荷产生屏蔽作用,对蛋白质微环境的水化层形成破坏作用,蛋白质表面疏水作用增强,分子间斥力减小,发生聚集。通过盐离子效应综合分析,大米谷蛋白分子表面具有极强的疏水性,并且表面电荷数较少,因此在低盐离子共存时,即可发生静电屏蔽作用,导致的蛋白质疏水作用增强,从而使大米谷蛋白聚集。
[1]李云. 大豆蛋白聚集及共凝胶性质研究[D]. 无锡:江南大学,2007:3-5.
[2]Morris Aimee M,Watzky Murielle A,Finke Richard G. Protein aggregation kinetics,mechanism,and curve-fitting:A review of the literature[J]. Biochimica et Biophysica Acta,2009,1794(3):375-379.
[3]Liu Jing,Tang Chuan-He. Heat-induced fibril assembly of vicilin at pH 2.0:Reaction kinetics,influence of ionic strength and protein concentration,and molecular mechanism[J]. Food Research Internatioonal,2013,51(2):621-632.
[4]李向红,华欲飞,刘展,等. 不同离子强度大豆分离蛋白热诱导聚集体的研究[J]. 中国食品学报,2010,10(2):104-109.
[5]Bryant C M,McClements D J. Influence of NaCl and CaCl2on cold-set gelation of heat-denatured whey protein[J]. Journal of Food Science,2000,65(5):801-804.
[6]Durand Dominique,Gimel Jean Christophe,Nicolai Taco. Aggregation,gelation and phase separation of heat denatured globular proteins[J]. Physica A:Statistical Mechanics and its Applications,2002,304(1-2):253-265.
[7]Agboola Samson,Ng Darren,Mills Dominic. Characterisation and functional properties of Australian rice protein isolates[J]. Journal of Cereal Science,2005,41(3):283-290.
[8]李亦蔚. 大米蛋白提取与分离纯化技术的研究[D]. 长沙:长沙理工大学,2012:5-6.
[9]Bradford Marion M. A rapid and sensitive method for the quantitation of microgram of protein utilizing the principle of protein dye binding[J]. Analytical Biochemistry,1976,72(1-2):248-254.
[10]Kato Akio,Nakai Shuryo. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta(BBA)-Protein Structure,1980,624(1):13-20.
[11]夏宁. 喷射蒸煮制备米糠、碎米蛋白及其功能性研究[D].广州:华南理工大学,2012:29.
[12]许凤. 米糠蛋白的提取及pH、离子强度对理化特性和结构的影响[D]. 大庆:黑龙江八一农垦大学,2015:23-25,44-45.
[13]刘凤茹. 麦胚蛋白聚集行为及其钙离子螯合肽的制备与评价[D]. 无锡:江南大学,2014:1.
[14]王镜岩,沈同,朱圣庚,等. 生物化学[M].第四版.北京:高等教育出版社,2017:193-194.
[15]袁德保,李芬芳,杨晓泉. 大豆蛋白的热处理改性及热聚集行为研究进展[J],现代食品科技,2012,28(12):1829-1833.
[16]Guo Jian,Yang Xiao-Quan,He Xiu-Ting,et al. Yuan-Yuan Zhang. Limited Aggregation Behavior ofβ-Conglycinin and Its Terminating Effect on Glycinin Aggregation during Heating at pH 7.0[J]. Journal of Agricultural and Food Chemistry,2012,60(14):3782-3791.
[17]Ryan K N,Vardhanabhuti B. Stability and mechanism of whey protein soluble aggregates thermally treated with salts[J]. Food Hydrocolloids,2012,27(2):411-420.
[18]迟玉杰,鲍志杰,程缘. 蛋清蛋白热处理改性及其热聚集行为的研究进展[J]. 食品安全质量检测学报,2014(12):3951-3954.
[19]Li Xianghong,Cheng Yunhui,Yi Cuiping,et al. Effect of ionic strength on the heat-induced soy protein aggregation and the phase separation of soy protein aggregate/dextran mixtures[J]. Food Hydrocolloids. 2009,23(3):1015-1023.
[20]Sheard P R,Fellows A,Ledward D A,et al. Macromolecular changes associated with the heat treatment of soya isolate[J]. International Journal of Food Science & Technology,1986,21(1):55-60.
[21]Vivian James T,Callis Patrik R. Mechanisms of tryptophan fluorescence shifts in proteins[J]. Biophysical Journal,2001,80(5):2093-2109.
[22]杨培慧,郑志雯,刘凌波,等. 金属离子协同效应对血红蛋白分子荧光光谱的影响[J]. 分析科学学报,2005,3:268-270.
[23]余晶梅. 荧光探针法和疏水相互作用层析法分析蛋白表面疏水性[D]. 杭州:浙江大学,2014:30-32.
Salteffectandmechanismsofthermalaggregationofriceglutelin
YUANJiang-lan,HUANGYa-ming,LIChuan-wen,KANGXu
(Academy of Bioengineering and Food,Hubei University of Technology,Wuhan 430068,China)
TS210.1
A
1002-0306(2017)18-0069-05
2017-02-28
袁江兰(1970-),女,博士研究生,副教授,研究方向:蛋白质化学与工程,E-mail:jlyuan1229@163.com。
国家自然科学基金资助项目(31371741)。
10.13386/j.issn1002-0306.2017.18.014
