生物联接体用作疫苗佐剂-传递系统
2017-10-13王雪婷甄媛媛
王雪婷,李 宁,甄媛媛,王 汀*
生物联接体用作疫苗佐剂-传递系统
王雪婷1,李 宁2,甄媛媛3,王 汀1*
(安徽医科大学药学院,安徽合肥230032)
生物联接体是生物分子与功能材料通过共价联接形成的结合物。基于抗原和佐剂的生物联接体,具有独特的理化及生物学性质,能将疫苗有效传递至免疫细胞,甚至靶向于特定的胞内途径。有些生物联接体具有类似天然病原体的免疫原性,能够有效诱导机体产生强大的免疫应答。而不同生物联接体功能多样,应用广泛,在当前疫苗领域越来越受到重视。本文介绍生物联接体用作疫苗佐剂-传递系统的最新研究进展,着重阐明生物联接体分子结构与功能之间的关系,为设计安全、高效的疫苗提供一定的参考。
药剂学;疫苗佐剂-传递系统;生物联接体;免疫应答;细胞免疫
目前,使用疫苗治疗、预防疾病已经成为最有效的公共卫生干预措施。接种疫苗诱导的免疫应答包括细胞免疫应答与体液免疫应答,过程复杂、步骤繁多,涉及各种信号分子及其与免疫细胞间相互作用。概括而言,疫苗诱导细胞免疫应答过程大致包括以下环节:在接种部位或淋巴结,疫苗抗原被抗原呈递细胞(antigen presenting cells,APCs)捕获后,内化并形成抗原性多肽片段,后者与主要组织相容复合分子(major histocompatibility complex molecules,MHC)结合[1-2],被呈递至细胞表面,随后被CD8+或CD4+T细胞表面受体识别。二者结合后,CD8+或CD4+T细胞被激活,经过增殖、分化,形成抗原特异性CD8+T细胞(又称“杀伤”T细胞,即Tc细胞)或CD4+T细胞(又称“辅助”T细胞,即Th细胞)。抗原特异性CD8+T细胞分泌穿孔素等物质直接杀死被感染的靶细胞,而CD4+T细胞则分泌淋巴因子,协助CD8+T及其他免疫细胞清除病原体。而疫苗诱导的体液免疫过程是在B细胞识别结合抗原后,在Th细胞释放的“辅助”信号刺激下,被迅速激活,并增殖分化为浆细胞,浆细胞分泌大量抗原特异性抗体,病原体与抗体结合后被清除。一般来说,个体接种疫苗后会迅速产生免疫应答。而初次免疫应答后,约90%抗原特异性CD8+T、CD4+T细胞及B细胞在早期效应阶段会相继凋亡,只有少量记忆性T细胞和B细胞存留在体内。这些记忆细胞再次接触相同抗原时,能够迅速增殖、分化,成为效应细胞,产生有效免疫。此类记忆细胞可在体内存留数年之久,在某些情况下,甚至能维持终身免疫。上述免疫应答机制是进行疫苗接种预防疾病的生理基础。从疫苗发展来看,首批用于临床的疫苗是减毒或灭活微生物,但是其适用范围窄,且安全性不够理想。进而研究者发展了亚单位疫苗,此类疫苗具有明确的分子结构、且自身不具有潜在感染性和毒性,相对于具有蛋白质或多糖结构的全微生物疫苗[3],此类疫苗更安全。但一般来说,亚单位疫苗免疫原性较低,往往需要免疫佐剂的作用,才能有效地诱导免疫应答。而免疫佐剂(adjuvant)则是一种非特异性免疫增强物,与抗原一起使用时,能够非特异地增强抗原的免疫原性,提高机体的特异性免疫应答甚至改变免疫应答类型,但佐剂本身并无抗原性。免疫佐剂可分为三类:免疫调节分子类佐剂、抗原递送系统类佐剂以及前两类佐剂的联合体。研究发现,许多物质能够用作免疫佐剂,例如,病原体衍生物、合成的细胞因子、纳米颗粒、油/水型乳剂和脂质体等。本文介绍的生物联接体通过生物结合形成生物联接体(bioconjugate, BC)将功能分子通过共价键联接到抗原分子,形成具有明确分子结构的生物结合体。BC能够增强疫苗效力,相关机制多种多样,例如:将抗原或佐剂与配体结合,能够实现对特定组织或细胞的靶向作用;疫苗与聚合物结合,不仅能产生多价性,还能实现缓释或控释效果;而疫苗与纳米粒结合,甚至能够改变APC处理及呈递抗原的处理过程。本文主要介绍各种生物联接体的最新研究进展,讨论其在疫苗—佐剂传递系统中的作用。
1 BC靶向淋巴系统
一般而言,疫苗主要通过刺激次级淋巴器官(淋巴结或脾)中未成熟的T细胞和B细胞产生免疫应答。若抗原不能到达此类淋巴器官,则会被免疫系统忽略,从而不能诱导有效的免疫应答[4]。研究表明疫苗可能通过两种途径传递至淋巴结:1)疫苗直接从接种部位(如肌肉、皮肤或黏膜表面)通过淋巴管转移至淋巴结;2)APCs在接种部位直摄取疫苗,随即将其转运至淋巴结。由于只有很少的APCs能从接种部位迁移到淋巴结,相对来说第一途径效率较高。由此,可通过制备BC,通过其运载作用,将疫苗从接种部位通过淋巴管转移至淋巴结,从而提高淋巴系统摄取、捕获疫苗的效率。
1.1 靶向免疫细胞特异性受体BC
疫苗靶向免疫细胞的方法多样,可通过对BC表面进行配体或抗体修饰,从而实现主动靶向。修饰后的BC通过与APC表面的特异性受体(如Fc受体、C型凝集素受体和甘露糖受体等)结合,实现疫苗对免疫细胞及淋巴结的靶向定位。例如,Yu等以生物联接方法构建的抗DEC-205单克隆抗体-HBV抗原特异性DNA疫苗,是一种基于靶向BC的疫苗,相比于非靶向DNA疫苗,即便在大型动物体内,此类疫苗也能更有效地诱导免疫应答[5]。Laura等将由蛋白抗原-抗DEC-205抗体-卵清蛋白(ovalbumin,OVA)组成的BC注入小鼠体内,相比于非靶向卵清蛋白(OVA),此类疫苗能够诱导较强的CD8+T、CD4+T细胞应答[6]。也有研究发现,相比于非靶向HIVtop4蛋白(HIV-1 tat/env/pol/gag)疫苗,由HIVtop4蛋白-抗DEC-205单克隆抗体组成的BC能够诱导更强的免疫应答。此外,将CpG与DEC-205结合制成的BC,也能够有效地促进抗原的交叉呈递,从而激活CD8+T细胞免疫应答,产生IFN-和IL-2,实现细胞免疫[7]。疫苗诱导免疫应答过程示意图见图1。
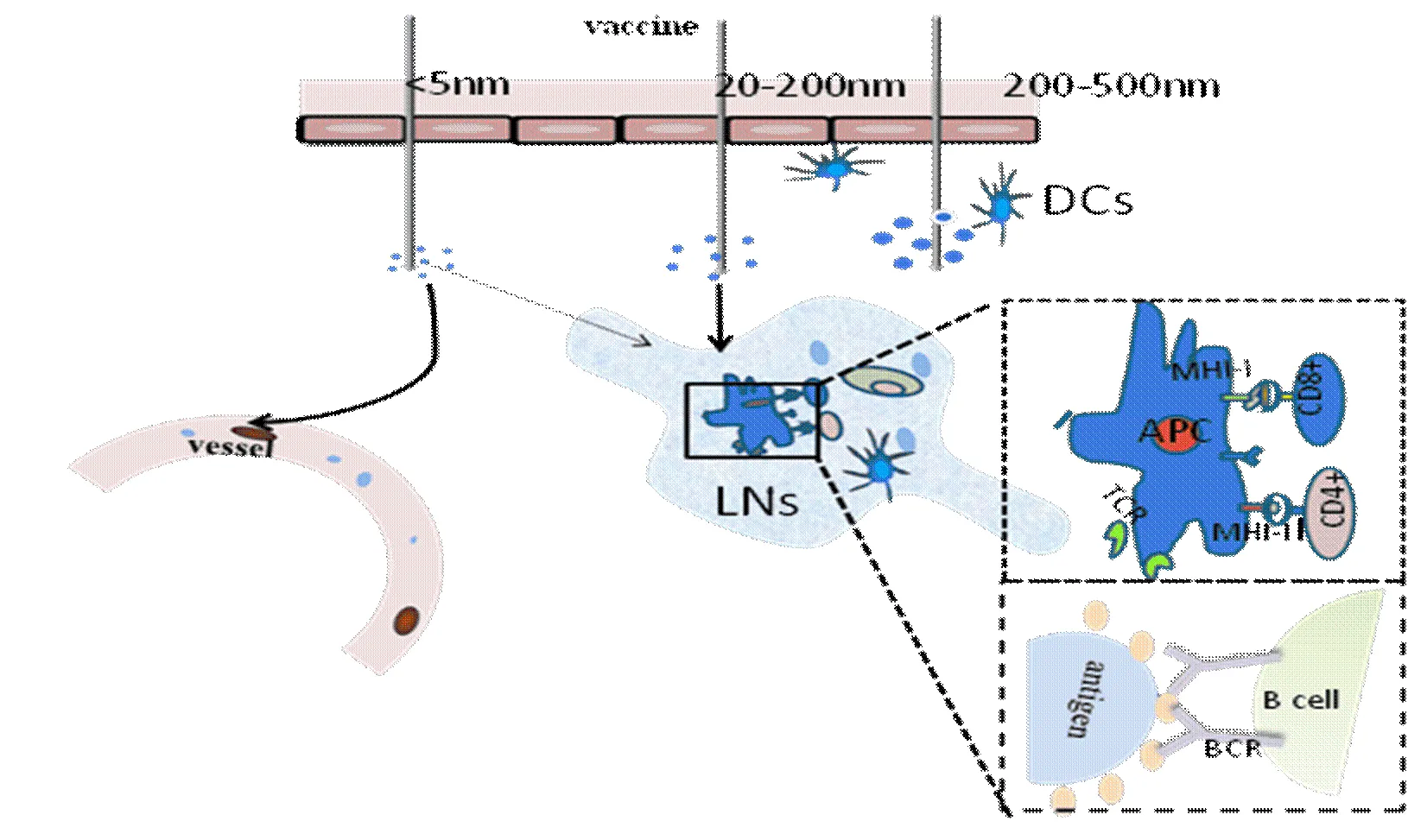
Different particle sizes of vaccinehavedifferenttransport pathways. The vaccine with 200-500 nm is mainly captured by dendritic cells at the injection site, and the vaccine with20-200 nm is mainly transferred by the tissue fluid to the lymph nodes (LNs), while less than 5 nm vaccine is easily transferred to the blood
图1疫苗诱导免疫应答过程示意图
研究证实,甘露糖基化的MUC-1能根据甘露糖的氧化状态,诱导较强的Th1或Th2免疫应答。例如,以生物联接方法构建的氧化甘露聚糖-MUC-1疫苗,能够有效诱导体及细胞免疫应答,不但能够防止早期乳腺癌复发,而且未出现严重不良反应[8]。鉴于其较高的安全性,此类BC具有广泛的临床应用价值。
1.2 控制BC粒径靶向定位淋巴组织
一般而言,经非肠道途径给药,药物的粒径会对淋巴引流产生较大影响。当微粒粒径大于3~5 nm时难以通过血管进行扩散,来源于组织的小分子或微粒主要在血液中被清除。粒径在20~100 nm的纳米粒,可经淋巴管引流至淋巴结且不蓄积在注射部位。因此,可通过控制疫苗粒径,使小分子质量的疫苗直接进入淋巴结以提高靶向效率。且引流至淋巴结的纳米颗粒,粒径在200~500 nm的大颗粒主要被注射部位的DCs捕获摄取,粒径在20~200 nm的小颗粒能自由地进入淋巴结(LNs),被积聚在LNs的DCs和巨噬细胞捕获,此发现可以为制备最佳粒径的纳米粒提供参考[9](图1)。以BC方式构建的抗OX40抗体/抗AFP 抗体纳米微粒疫苗,可显著刺激细胞毒性T细胞与 CTL/AFP158-166细胞的增殖、活化,产生 IL-2、IFN-,增强对肝癌细胞的杀伤作用。此外,也有研究发现小粒径的聚丙烯硫化物能够高效地进入淋巴结,被淋巴结中的DCs捕获,若将亚单位抗原或佐剂连接至此纳米粒,能显著增强机体的体液和特异性CD8+T细胞免疫应答。以上研究均表明,以BC方式构建的抗原/佐剂的纳米微粒疫苗,能够显著增强机体的体液和细胞免疫应答。
1.3 改变BC表面性质靶向定位淋巴组织
除载体微粒的大小、形状能影响淋巴结的转运效率外,如表面电荷、疏水性等表面性质也会对分子转运效率产生影响。因此,可通过改变疫苗的表面性质,靶向定位APCs,以促进抗原的吸收,或促进疫苗组分直接转运至淋巴结的固有免疫细胞。带正电荷的物质与带负电荷的间质基质间,因强烈的静电相互作用,可避免被淋巴管引流。相比于阳离子聚合物,中性或阴离子聚合物能更有效地积聚于引流淋巴结。由此可知,或许带负电荷或呈中性的分子能够成为制备靶向分子的优选。Kaminskas等人发现,对干扰素α2表面进行聚乙二醇化修饰后,经皮下或静脉注射,此BC在增加溶解度的同时,也会降低蛋白质的免疫原性,使其抗肿瘤活性增强,更有效地对抗乳腺癌患者的淋巴结转移[10]。另外,Linda等对曲妥珠单抗Fab′表面进行聚乙二醇化修饰后,发现此种BC在保留体外生物活性的同时,能够显著提高淋巴系统的免疫功效[11]。此外,若增加化合物的疏水性,与APCs间的相互作用也会增加,进而增加在淋巴结的蓄积。不仅如此,化合物的疏水性也可以影响载体的溶解度。若增加化合物的疏水性,可以使疫苗蓄积在注射部位,降低在淋巴管的引流。上述研究结果均表明,高分子载体的疏水性会对淋巴管的吸收产生显著影响,此因素成为控制疫苗在注射部位引流与淋巴结蓄积的关键。处于最佳粒径范围,同时又结合紧密的聚合物,虽可避免从组织转运至血管,但仍会通过细胞外基质进行扩散。输送至淋巴管并蓄积在淋巴结的聚合物,当表面电性与疏水性得到修饰后,此现象会愈加明显。因此,具有合适粒径(直径约5~100 nm)、表面电性(呈负性或中性)及疏水性的化合物更能有效地定位至淋巴结。
1.4 BC与血清蛋白结合靶向淋巴组织
聚合物与血清蛋白也能以非共价键的方式结合,靶向定位淋巴结。例如,低聚核苷酸佐剂或肽抗原的脂质尾部与内源性蛋白结合制成的BC,可以增加在淋巴结的吸收[12]。低分子质量的疫苗与白蛋白结合,可阻止疫苗扩散入血,从而高效转运至淋巴管。相比于未结合白蛋白的可溶性抗原或佐剂,此类疫苗能增加在淋巴结的蓄积,从而增强疫苗的免疫原性。近期研发的“搭白蛋白便车”疫苗,就是将抗原或分子佐剂共价联接至亲脂性白蛋白的结构域,此BC可以提高对机体的免疫应答。若设计合理,此类两亲性疫苗,能够大幅度减少插入自然细胞的细胞膜现象,从而提高疫苗的安全性。大量研究数据表明,疫苗的初始淋巴吸收和淋巴结靶向定位,在很大程度上受物质大小的影响。若结合白蛋白的疫苗粒径合适,即能显示出从组织转运至淋巴结,从血液转运至淋巴的主要单向通路,能够有效地控制疫苗的淋巴结引流,减少全身播散,提高分子佐剂的安全性。鉴于间质液和淋巴含有多种物质(如血浆蛋白、白蛋白、球蛋白、纤维蛋白原、脂蛋白,补体等),“搭便车”疫苗是否同样能够利用其他淋巴组分到达淋巴结还有待进一步研究。
2 BC促进抗原的加工与提呈
在诱导适应性免疫应答过程中,APCs起着关键作用。抗原被APCs捕获后,内化并形成抗原性多肽片段,后者与MHC分子结合,被呈递至细胞表面,随后被T细胞表面受体识别,诱导机体产生免疫应答。依据以上结果,是否能够进一步优化BC,从而影响呈递至APCs胞质内的抗原,以提高机体的免疫应答,还有待进一步研究。
2.1 BC促进抗原的交叉呈递
近年来,人们致力于研究能够促进MHC-I类分子呈递抗原的方法,以促进CD8+T细胞对抗原的免疫应答。通常,MHC-I-抗原复合体激活CD8+T细胞,MHC-II-抗原复合体激活CD4+T细胞。对机体来说,疫苗中的抗原是一种外源性物质,理论上是通过 MHC-Ⅱ类分子激活 CD4+T细胞。纳米材料被DCs摄取后,将抗原释放到胞质,发生溶酶体逃逸,则能通过内源性途径,使MHC-Ⅰ类分子呈递抗原,进而激活CD8+T细胞。这种由MHC-Ⅱ类分子转变为MHC-Ⅰ类分子呈递外源性抗原的方式称作抗原的交叉呈递(cross-presentation)。研究发现,经功能化修饰的纳米材料通过多种方式产生的抗原交叉呈递,是应用亚单位疫苗治疗癌症和某些传染性疾病的关键[13]。
在溶酶体内,共聚物的羧酸盐与氨基质子化后,通过质子海绵效应破坏溶酶体膜,释放抗原到胞质产生交叉呈递[13]。若共聚物结合上磷酸胞苷酰鸟苷(cytidylyl phosphate guanosine, CpG)疫苗功效会得到进一步提高[14]。例如,Molino等模拟病毒的特征,利用一种仿生蛋白纳米粒制成BC,此BC在溶酶体的酸性环境中被水解,释放出CpG后,可以诱导 DCs成熟,增强抗原的交叉呈递[15]。另一种实现胞质转运抗原的方法,是将抗原与细胞穿透肽(cell-penetrating peptides ,CPPs)结合。短的CPPs序列(约10~20个氨基酸)与抗原结合构建的疫苗注入机体后,一定量的CPPs被溶酶体裂解释放,促进抗原的摄取、胞质定位和交叉呈递,有效诱导CD8+T细胞应答[16]。总之,通过合理设计BCs,提高抗原的摄取和呈递,从而以低的剂量产生高的免疫效率。
2.2 BC促进耐受性抗原呈递
BC除可刺激免疫应答外,还能够促进耐受性抗原呈递,以抑制有害的免疫应答。用以治疗变态反应、器官移植排斥反应以及自身免疫性疾病等,产生无免疫抑制的特异性免疫耐受。早期研究主要用凋亡细胞诱导免疫耐受,通常是用化学方法将自身抗原多肽联接至凋亡细胞,此类结合物能够有效地预防和治疗多种自身免疫性疾病。例如,1型糖尿病[17]、实验性复发自身免疫性脑脊髓炎(EAE)[18]和移植排斥反应[19]等。但相关的具体作用机制目前还尚不清楚。近期临床研究结果表明,可以用纳米粒子与疾病相关抗原肽结合制成的BC代替供体细胞应用于临床,制备此类疫苗的操作较简单,成本较低廉,为治疗某些自身免疫性疾病提供更多的可能[20]。此外,在免疫细胞识别抗原的过程中,若能阻滞抗原与免疫细胞间的黏附,也能够抑制自身免疫性疾病的炎性免疫应答。将联接有多肽的纳米粒BC注入机体,能够抑制DCs和T细胞间免疫突触的形成,从而抑制免疫应答[21]。有研究发现,在机体清除衰老红细胞过程中,若将抗原联接至红细胞的结构域,可使自身靶向抗原产生免疫耐受[22]。经静脉注射后,此类红细胞-抗原BC可以和血液中的红细胞有效结合,以抗原特异性方式诱导外周免疫耐受。采用类似结合纳米粒或微粒的方法,用BC代替细胞可实现对原位红细胞的靶向定位,提高疫苗的有效性与安全性。
3 BC激活APCs
亚单位抗原通常需要佐剂的辅助,来增强或调节机体的免疫应答。考虑到佐剂的安全性问题,至今只有少数佐剂可被批准用于临床。佐剂的主要作用是刺激APCs和其他免疫细胞的活化,激活适应性免疫应答。微生物的脂多糖、双链RNA、环状二核苷酸等分子均可作为佐剂激活APCs[23]。联接佐剂的方法有多种,其中最简单的方法是将佐剂直接联接至抗原,再暴露给免疫细胞。若使用更复杂的化学方法调节佐剂的形态与功能,那么佐剂化合物可能会产生新的功能。APCs和其他免疫细胞表面几乎都表达“Toll样受体”(toll-like receptor ,TLR),与TLR激动剂结合的疫苗,能够对免疫细胞产生靶向定位,显著提高免疫效力[24]。例如由脱氧寡核苷酸和聚肌胞苷酸-聚胞嘧啶核苷酸(poly I:C)(配体分别为TLR21和TLR9)制成的BC注入机体后,可以提供“危险信号”给APCs,激活机体的免疫应答[25]。此外,TLR激动剂的多聚化对疫苗的功效也会产生一定影响,这种BC可以使细胞受体聚集,有效激活T 细胞。近年研究发现,自组装DNA纳米结构,具有可塑性高、结构精确、可抵抗核酸酶降解、稳定性高和毒性低等优点,也能作为佐剂,激活APCs提高疫苗的免疫效率。
4 多价免疫原性BC
病毒、细菌等许多病原体表面高度表达有序排列的抗原序列,此类序列能够与B细胞受体有效结合。与具有相同抗原的可溶性蛋白相比,此类病原体能刺激机体产生更多的抗体[26]。因此,可通过模拟病毒颗粒表面刚性、有序的抗原序列,增强亚单位疫苗的免疫原性,以多价抗原的形式呈递、识别和内化免疫细胞,发现提高体液和细胞免疫应答的新方法。
4.1 多价抗原BC
早期研究发现,将约20个半抗原结合至水溶性聚合物的高分子链(间距在10 nm左右),此类结合物在体内只能诱导非T细胞依赖性免疫应答[26]。而多价抗原可以提高亚单位抗原的免疫原性,将多价抗原肽(multiple antigenic peptides, MAPs)联接至树突状寡聚赖氨酸组成的BC,能够增强机体的免疫应答。研究发现,混合免疫佐剂或T细胞辅助表位掺入MAPs系统制成的BC,能够显著提高疫苗的功效。已经有研究证明,固相多肽合成的MAPs用于疫苗,可提高对机体的免疫效力。
现今,多价抗原的树突状聚合物已被广泛用于疫苗。有研究发现,相比于可溶性疫苗卵清蛋白(OVA),以化学方式将聚酰胺(PAMAM)树突状聚合物联接至OVA制成的BC,可诱导机体产生更多的抗OVA CD8+T细胞和特异性IgG抗体。此外,近期研发的一种星形聚合物肽BC,即便不需佐剂辅助,也能提高细胞免疫应答。只需经过单次免疫,这些BC就可以根治小鼠的TC-1肿瘤(HPV诱发宫颈癌的模型)。另有研究发现,由丙烯酰修饰的多肽,也可以增强疫苗的免疫原性,提高机体的免疫应答。上述研究均表明,多价抗原BC在新型疫苗的制备中会继续发挥着重要作用。
4.2 自组装免疫原BC
不只是多价抗原,自组装抗原也能产生呈递多价免疫原的效果。自组装抗原具有多价性、生物相容性、多功能性和分子特异性等优点,可将全合成多肽制成的自组装免疫原应用于疫苗。例如全合成脂肽(包括联接多肽抗原的类脂分子)能通过疏水作用,自组装成均质的纳米粒子或柱状微乳,促进机体的免疫应答[27]。除与脂类结合外,抗原表位也可通过分子间的相互作用(包括范德华力、离子键、氢键、疏水力)联接至多肽序列,形成有序排列的结构应用于疫苗[28]。经研究证明,利用多肽分子间的相互作用,合成的多肽纳米粒或纳米纤维可表达重复抗原表位,促进细胞和体液免疫应答。且此类病毒样多肽纳米粒,不需额外的佐剂辅助,即可提高疫苗功效。此外,自组装的纳米结构还具有除呈递抗原外的其他功能。如通过二硫键连接的抗原微粒,可通过还原性溶酶体途径,促进APCs对环境敏感性抗原的加工、呈递,此类蛋白抗原可阻断细胞内嵌段共聚物胶束中的抗原释放,而促进对T细胞的交叉呈递。上述实例均表明,基于自组装合成的纳米疫苗,在疫苗的大规模生产中具有广阔的应用前景。
5 结语
新型疫苗的合理设计不仅涉及到多学科知识的交叉应用,也依赖相关学科的快速发展,如基础免疫学、工程学、化学、材料科学等。BCs能够实现疫苗功能的多样性,有效调节对机体的免疫应答或耐受,甚至能够操纵免疫细胞的分化,以增强机体免疫应答;或模拟病原体的抗原表位,为治疗疾病提供良好的解决方案。BCs的研发任重而道远,需要更深入的了解免疫系统的调节功能,提出新的方法,设计出优质的BCs,为治疗特定的疾病提供有力的理论依据。总而言之,BCs将在改善疫苗功效,对抗病原体和相关疾病中继续发挥着重要作用。
[1] PULENDRAN B, AHMED R.Immunological mechanisms of vaccination[J]. Nature Immunology, 2011, 12(6): 509-517.
[2] MELLMAN I, COUKOS G, DRANOFF G. Cancer immunotherapy comes of age[J]. Nature, 2011, 480(7378): 480-489.
[3] FERREIRA S A, GAMA F M, VILANOVA M. Polymeric nanogels as vaccine delivery systems[J]. Nanomed- Nanotechnol, 2013, 9(2): 159-173.
[4] ZINKERNAGEL R M, EHL S, AICHELE P, et al. Antigen localisation regulates immune responses in a dose- and time-dependent fashion: a geographical view of immune reactivity[J]. Immunological Reviews, 1997, 156: 199-209.
[5] YU D B, LIU H, SHI S, et al. A novel dendritic-cell-targeting DNA vaccine for hepatitis B induces T cell and humoral immune responses and potentiates the antivirus activity in HBV transgenic mice[J]. Immunol Lett, 2015, 168(2): 293-299.
[6] RAHIMI R, EBTEKAR M, MOAZZENI S M, et al. Optimization of multi-epitopic HIV-1 recombinant protein expression in prokaryote system and conjugation to mouse DEC-205 monoclonal antibody: implication fortargeted delivery of dendritic cells[J]. Iran J Basic Med Sci, 2015, 18(2): 145-152.
[7] WENGERTER B C, KATAKOWSKI J A, ROSENBERG J M, et al. Aptamer-targeted antigen delivery[J]. Mol Ther, 2014,22(7):1375-1387.
[8] VASSILAROS S, TSIBANIS A, TSIKKINIS A, et al. Up to 15-year clinical follow-up of a pilot phase III immunotherapy study in stage II breast cancer patients using oxidized mannan-MUC1[J]. Immunotherapy-Uk, 2013, 5(11): 1177-1182.
[9] REDDY S T, VAN DER VLIES A J, SIMEONI E, et al. Exploiting lymphatic transport and complement activation in nanoparticle vaccines[J]. Nature Biotechnology, 2007, 25(10): 1159-1164.
[10] KAMINSKAS L M, ASCHER D B, MCLEOD V M, et al. PEGylation of interferon alpha2 improves lymphatic exposure after subcutaneous and intravenous administration and improves antitumour efficacy against lymphatic breast cancer metastases[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2013, 168(2): 200-208.
[11] CHAN L J, ASCHER D B, YADAV R, et al. Conjugation of 10 kDa linear PEG onto Trastuzumab Fab' is sufficient to significantly enhance lymphatic exposure while preservingbiological activity[J]. Molecular Pharmaceutics, 2016, 13(4): 1229-1241.
[12] LIU H P, MOYNIHAN K D, ZHENG Y R, et al. Structure-based programming of lymph-node targeting in molecular vaccines[J]. Nature, 2014, 507(7493): 519-522.
[13] KELLER S, WILSON J T, PATILEA G I, et al. Neutral polymer micelle carriers with pH-responsive, endosome- releasing activity modulate antigen trafficking to enhance CD8(+) T cell responses[j]. Journal of Controlled Release, 2014, 191 :24-33.
[14] WILSON J T, KELLER S, MANGANIELLO M J, et al. pH-Responsive nanoparticle vaccines for dual-delivery of antigens and immunostimulatory oligonucleotides[J]. Acs Nano, 2013, 7(5): 3912-3925.
[15] TIERNEY H L, WEISS P S. ACS Nano Lecture Award winners for 2013[J]. Acs Nano, 2013, 7(8): 6411-6412.
[16] Wilson J T, Postma A, Keller S, et al. Enhancement of MHC-I antigen presentation via architectural control of pH-responsive, endosomolytic polymer nanoparticles[J]. The AAPS Journal, 2015, 17(2): 358-369.
[17] MALEK ABRAHIMIANS E, VANDER ELST L, CARLIER V A, et al. Thioreductase-containing epitopes inhibit the development of type 1 diabetes in the NOD mouse model[J]. Frontiers in Immunology, 2016, 7: 67.
[18] LIU H, IRVINE D J. Guiding principles in the design of molecular bioconjugates for vaccine applications[J]. Bioconjug Chem, 2015, 26(5): 791-801.
[19] LIN C M, GILL R G. Direct and indirect allograft recognition: pathways dictating graft rejection mechanisms[J]. Current Opinion in Organ Transplantation, 2016, 21(1): 40-44.
[20] VERBEKE C S, MOONEY D J. Injectable, pore-forming hydrogels forenrichment of immature dendritic cells[J]. Advanced Healthcare Materials, 2015, 4(17): 2677-2687.
[21] CHITTASUPHO C, SHANNON L, SIAHAAN TJ, et al. Nanoparticles targeting dendritic cell surface molecules effectively block T cell conjugation and shift response[J]. Acs Nano, 2011, 5(3): 1693-1702.
[22] KONTOS S, KOURTIS I C, DANE K Y, et al. Engineering antigens for in situ erythrocyte binding induces T-cell deletion[J]. Proc Natl Acad Sci U S A, 2013, 110(1): E60-68.
[23] DUNNE A, MARSHALL N A, MILLS K H. TLR based therapeutics[J]. Current Opinion in Pharmacology, 2011, 11(4): 404-411.
[24] SHATZ M, MENENDEZ D, RESNICK M A. The human TLR innate immune gene family is differentially influenced by DNA stress and p53 status in cancer cells[J]. Cancer Res, 2012, 72(16): 3948-3957.
[25] ARSENAULT R J, KOGUT M H, HE H Q. Combined CpG and poly I:C stimulation of monocytes results in unique signaling activation not observed with the individual ligands[J]. Cell Signal, 2013, 25(11): 2246-2254.
[26] MOYER T J, ZMOLEK A C, IRVINE D J. Beyond antigens and adjuvants: formulating future vaccines[J]. J Clin Invest, 2016, 126(3): 799-808.
[27] BLACK M, TRENT A, KOSTENKO Y, et al. Self-assembled peptide amphiphile micelles containing a cytotoxic T-cell epitope promote a protective immune response[J]. Adv Mater, 2012, 24(28): 3845-3849.
[28] HUDALLA G A, SUN T, GASIOROWSKI J Z, et al. Gradated assembly of multiple proteins into supramolecular nanomaterials[J]. Nat Mater, 2014, 13(8): 829-836.
Using molecular bioconjugates as vaccine adjuvant-delivery systems
WANG Xueting, LI Ning, ZHEN Yuanyuan, WANG Ting*
(230032,)
Bioconjugates(BCs) are the biomolecules that have been covalently conjugated with functional materials. The antigen-based and adjuvant-based BCs have unique physicochemical and biological properties, enabling vaccines to be delivered to key immune cells, even to target specific intracellular pathways. Some BCs even have mimic immunogenic properties of natural pathogens, so that they can vigorously stimulate the immune systems to generate strong immunity. The different BC shave diversefunctionand arewidely used in vaccine adjuvantdelivery systems. In this review, recent advances in the BCs used as vaccine adjuvant delivery systems are introduced. And the structure- function relationships of BCs are emphasized that may providea reference for rational design of safe and effective vaccines.
pharmaceutics; vaccine adjuvant-delivery system; bioconjugate; immunoresponse; cellular immunity
(本篇责任编辑:赵桂芝)
(2017)04–0092–09
10.14146/j.cnki.cjp.2017.04.003
R94
A
2017–02–26
王雪婷(1992-), 女(汉族), 安徽合肥人, 硕士研究生, E-mail wangxueting@stu.ahmu.edu.cn; 王汀(1972-), 男(汉族), 安徽泗县人, 教授, 博士, 硕士生导师, 主要从事药物脂质载体传递系统, Tel. 0551-65161115, E–mailtwangcn@163.com。
