奥美拉唑钠镁咀嚼片的制备与稳定性研究
2017-08-12牛华英宋晓雯姬海红丁平田
王 宇,牛华英,咸 磊,宋晓雯,陈 晓,姬海红,丁平田*
奥美拉唑钠镁咀嚼片的制备与稳定性研究
王 宇1,牛华英2,咸 磊1,宋晓雯1,陈 晓1,姬海红3,丁平田1*
(1. 沈阳药科大学药学院,辽宁沈阳 110016;2. 济南大成医药发展有限公司,山东济南250100;3. 成都大学研究生处,四川成都 610106)
目的制备稳定的奥美拉唑钠镁咀嚼片。方法采用综合分析法进行初步处方筛选,通过正交试验根据口感确定最佳处方,并进行影响因素及加速稳定性考察。结果奥美拉唑钠镁咀嚼片最佳配比的质量分数为7%羟丙基纤维素、0.25%薄荷脑和0.50%三氯蔗糖;小试3批样品质量检查符合规定,重现性好;影响因素试验表明,咀嚼片在强光下不稳定;在温度(25±2) ℃、相对湿度(60±10)%加速条件下放置6个月,各项指标未见明显变化,样品符合规定。结论该制备工艺稳定且重现性好,可进行奥美拉唑钠镁咀嚼片的中试研究。
药剂学;咀嚼片;正交试验;奥美拉唑钠镁;稳定性研究
奥美拉唑为脂溶性弱碱性药物,口服后可特异性地分布于胃黏膜壁细胞的分泌小管中,并在此高酸环境下转化为亚磺酞胺的活性形式,然后通过二硫键与壁细胞分泌膜中H+/K+-ATP酶的巯基呈不可逆性的结合,生成亚磺酞胺与质子泵的复合物,从而抑制该酶活性阻断胃酸分泌[1]。碳酸氢钠和氢氧化镁为临床常用抗酸剂,口服后能直接中和胃酸,迅速升高胃内pH值,从而保护奥美拉唑不被酸降解,还可减轻或解除胃酸对溃疡面的刺激和腐蚀作用,具有价格低廉、制酸迅速的特点。复方奥美拉唑-碳酸氢钠-氢氧化镁咀嚼片(奥美拉唑钠镁咀嚼片)已由美国FDA批准上市,桑塔鲁斯(Santarus)公司生产,商品名为Zegerid Chewable Tablets。目前国内市场主要有奥美拉唑的肠溶片、肠溶胶囊和注射剂,奥美拉唑与碳酸氢钠及氢氧化镁的常释制剂还没有上市,随着市场的发展,奥美拉唑复方常释制剂将成为新的亮点。本试验通过正交法筛选最优处方,确定制备工艺,并进行了质量检查与稳定性研究。
1 仪器与材料
LC-20AT高效液相色谱仪、UV-1800紫外分光光度计(日本岛津公司),Agilent 1200高效液相色谱仪(安捷伦科技公司),ZRS-8G药物溶出仪、FT-2000A脆碎度检查仪、YD-35片剂硬度仪(天大天发科技有限公司),BSA124S电子天平(德国赛多利斯公司),ZS-515漩涡振荡筛、ZP-35D旋转式压片机(辽宁天亿机械有限公司),VBK V混合器(重庆精工制药机械有限责任公司),KJX-100A快速制粒机、YK-160摇摆制粒机(北京国药龙立科技有限公司),热风循环烘箱(天津泰斯特有限公司),PA100双头自动数片机(上海纳丰机械设备有限公司)。
奥美拉唑(含量质量分数为99.7%,寿光富康制药有限公司,批号210908005),奥美拉唑对照品、奥美拉唑磺酰化物(中国药品生物制品检定所),碳酸氢钠(含量质量分数为100.1%,河北华晨药业有限公司,批号090906),氢氧化镁(江苏鹏鹞药业有限公司),木糖醇(山东福田药业有限公司),羟丙基纤维素、交联羧甲基纤维素钠、硬脂酸镁(安徽山河药用辅料股份有限公司),三氯蔗糖(河北甜伴侣科技有限公司),薄荷脑(安徽丰乐香料有限责任公司)。
2 方法
2.1 原料药稳定性的分析与考察
查阅《中华人共和国药典》2015年版四部中奥美拉唑贮存条件为遮光、密封干燥冷处保存,因此将奥美拉唑考察方法定为:取奥美拉唑0.50 g,分别于40 ℃恒温容器、相对湿度为(75±5)%(氯化钠饱和水溶液)的恒湿密闭容器及照度为(4 500±500) lx的光照箱内放置10 d,分别于第5、10天后取样检测,将结果分别与0天数据进行比较。
由于碳酸氢钠50 ℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,在潮湿空气中即缓缓分解,因此将奥美拉唑混合物(奥美拉唑-碳酸氢钠-氢氧化镁质量比为20∶600∶700)考察方法定为:取奥美拉唑混合物适量,分别于40 ℃恒温容器、相对湿度(75±5)%(氯化钠饱和水溶液)的恒湿密闭容器及照度为(4 500±500) lx的光照箱内放置10 d,分别于第5、10天后取样检测,将结果分别与0天数据进行比较。
2.2 奥美拉唑钠镁咀嚼片的制备
2.2.1 辅料的筛选
咀嚼片与普通片剂最大的区别在于,咀嚼片必须有良好的口感,因此,其制备过程中最主要的筛选指标为口感[2]。
参考上市的处方,选用几种较常用的辅料,即:填充剂甘露醇、木糖醇、微晶纤维素;崩解剂交联羧甲基纤维素钠;黏合剂羟丙基纤维素、聚乙烯吡咯烷酮;润滑剂硬脂酸镁、滑石粉;矫味剂三氯蔗糖、薄荷脑及色素赤藓红铝色淀等,综合评价制粒难易、压片难易、片面外观、片质量差异、硬度、口感、崩解时限、溶出度八项指标,以筛选较为合适的辅料;通过正交试验优化辅料处方量。
2.2.2 制备工艺
2.2.2.1 制粒压片工艺
将过147 μm筛的奥美拉唑、氢氧化镁、碳酸氢钠、木糖醇、羟丙基纤维素、1/2交联羧甲基纤维素钠混合均匀。用100 g∙L-1的PVP乙醇溶液作润湿剂制湿粒,于40 ℃左右干燥,干颗粒水分的质量分数控制在2.0%~3.0%内。干颗粒过880 μm筛整粒后,加三氯蔗糖、薄荷脑、1/2交联羧甲基纤维素钠混匀,再加硬脂酸镁总混,混合均匀后,压片,包装即得。
2.2.2.2 粉末直压工艺
将过147 μm筛的奥美拉唑、氢氧化镁、碳酸氢钠、木糖醇、羟丙基纤维素、1/2交联羧甲基纤维素钠混合均匀;加三氯蔗糖、薄荷脑、1/2交联羧甲基纤维素钠混匀,再加硬脂酸镁总混,混合均匀后,压片,包装即得。压片前物料水分的质量分数控制在2.0%~3.0%内。
2.3 溶出度检查
取本品,照《中华人共和国药典》2015年版四部通则0931第一法测定溶出度,以盐酸溶液(0.9 → 1 000)900 mL为溶出介质,转速为100 r∙min-1,依法操作,经45 min时,取溶液10 mL滤过,精密量取续滤液7 mL置于10 mL量瓶中,加0.1 mol∙L-1氢氧化钠溶液稀释至刻度,摇匀,作为供试溶液;另精密称取奥美拉唑对照品约30 mg,置于100 mL量瓶中,加0.1 mol∙L-1氢氧化钠溶液溶解并稀释至刻度,精密量取5 mL置于100 mL量瓶中,加0.1 mol∙L-1氢氧化钠溶液稀释至刻度,摇匀,作为对照溶液。分别取供试溶液与对照溶液,照《中华人共和国药典》2015年版四部通则0401的紫外-可见分光光度法,在波长305 nm处测定吸光度,计算每片的溶出量,限度为标示量的75%。
2.4 有关物质的测定
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂,以10 mmol∙L-1磷酸氢二钠溶液(用磷酸调节pH值至7.6)-乙腈(体积比75∶25)为流动相,检测波长为280 nm。理论板数按奥美拉唑峰计算不低于2 000,奥美拉唑峰与奥美拉唑磺酰化物峰的分离度应大于2.0。
取本品细粉适量(约相当于奥美拉唑10 mg),置于50 mL量瓶中,加流动相适量,振摇使奥美拉唑溶解,用流动相稀释至刻度,摇匀,滤过,取续滤液作为供试溶液;精密量取上述溶液1 mL置于100 mL量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液;另取奥美拉唑对照品1 mg与奥美拉唑磺酰化物(5-甲氧基-2-〔〔(4-甲氧基-3,5-二甲基-2-吡啶基)-甲基〕-磺酰基〕-1H苯并咪唑)对照品1 mg,加流动相溶解至10 mL,摇匀,取20 μL注入液相色谱仪,奥美拉唑峰与奥美拉唑磺酰化物峰的分离度应大于2.0。另取对照溶液20 μL注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的15%,再精密量取供试溶液和对照溶液各20 μL,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。供试溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积1倍,各杂质峰面积的和不得大于对照溶液主峰面积的2倍。
2.5 含量测定
2.5.1 奥美拉唑的含量测定
取本品10片,精密称定,研细,精密称取适量(约相当于奥美拉唑20 mg),置于l00 mL量瓶中,加乙醇20 mL与pH值11.0的磷酸盐缓冲液约60 mL,超声处理使奥美拉唑溶解,用pH值11.0的磷酸盐缓冲液稀释至刻度,摇匀,滤过。精密量取续滤液5 mL,置于50 mL量瓶中,用水稀释至刻度,摇匀,精密量取20 μL注入液相色谱仪,记录色谱图;另取奥美拉唑对照品约20 mg,精密称定,同法操作。按外标法以峰面积计算,即得。
2.5.2 氢氧化镁的含量测定
用络合滴定法测定本品中氢氧化镁的含量。取本品,研细,精密称取适量(约相当于氢氧化镁75 mg),精密称定,加3 mol∙L-1盐酸溶液2 mL,振摇使氢氧化镁溶解,加水100 mL,用1 mol∙L-1的氢氧化钠溶液调节pH值至7.0,加pH值为10.0的氨-氯化铵缓冲液5 mL与铬黑T指示剂少许,用50 mmol∙L-1乙二胺四醋酸二钠滴定液滴定至溶液由紫色变为纯蓝色。每1 mL乙二胺四醋酸二钠滴定液相当于2.916 mg的氢氧化镁。
2.5.3 碳酸氢钠的含量测定
用剩余滴定法测定本品中碳酸氢钠的含量。取本品,研细,精密称取适量(约相当于碳酸氢钠0.25 g),精密称定,精密加0.5 mol∙L-1盐酸滴定液50 mL,超声使溶解,加酚酞指示液5滴,用0.5 mol∙L-1氢氧化钠滴定液滴定至显红色,并将滴定的结果用空白试验校正。再自所消耗的0.5 mol∙L-1氢氧化钠滴定液的毫升数中减去供试液中所含氢氧化镁相当的0.5 mol∙L-1氢氧化钠滴定液的毫升数,计算,即得。
2.6 含量均匀度试验
取本品10片,分别置于50 mL量瓶中,加pH值11.0的磷酸盐缓冲液(取0.25 mol∙L-1磷酸钠溶液110 mL和0.5 mol∙L-1磷酸氢二钠溶液220 mL,用水稀释至1 000 mL,摇匀)适量,超声使崩解,加乙醇10 mL,超声处理15 min,放冷,加pH值11.0的磷酸盐缓冲液稀释至刻度,摇匀,滤过,精密量取续滤液5 mL,置于100 mL量瓶中,加水稀释至刻度,摇匀,按“2.5”条方法测定含量,结果应符合《中华人民共和国药典》2015年版四部通则0941的规定。
2.7 稳定性研究
2.7.1 影响因素试验
高温试验:取本品适量,于40 ℃条件下放置10 d,于第5天和第10天取样,按稳定性重点考察项目检测。
高湿试验:取本品适量,于相对湿度为(75±5)%的条件下放置10 d,于第5天和第10天取样,按稳定性重点考察项目检测。
强光照射试验:取本品适量,于(4 500±500) lx的条件下放置10 d,于第5天和第10天取样,按稳定性重点考察项目检测。
2.7.2 加速试验
因奥美拉唑稳定性较差,故直接采用(30±2) ℃、相对湿度为(65±5)%条件进行考察。取本品3批(批号为1091207、1091208、1091209),按上市包装,在温度为(30±2) ℃、相对湿度为(65±5)%的条件下放置6个月,在试验期间第1、2、3和6个月末分别取样1次,按稳定性重点考察项目检测。测定结果与0个月比较。
2.7.3 长期试验
取本品3批(批号为1091207、1091208、1091209),按上市包装,置温度(25±2) ℃、相对湿度为(60±10)%条件下放置,每3个月取样1次,分别于0个月、3和6个月取样,按稳定性重点考察项目检测。测定结果与0个月比较。
3 结果与讨论
3.1 原料药的稳定性
奥美拉唑及混合物在不同条件下的稳定性见表1、2。表中数据表明,奥美拉唑在40 ℃恒温容器中、相对湿度75%条件下放置10 d后,奥美拉唑原料的各项指标均无明显变化。照度为4500 lx的强光下该产品变色,其他各项指标均无明显变化,因此原料比较稳定,为处方研究提供了数据支持。奥美拉唑混合物在40 ℃恒温容器中、相对湿度75%及照度为4500 lx的强光下放置10 d后,奥美拉唑原料的各项指标均无明显变化。表明奥美拉唑混合物在上述条件下较稳定,碳酸氢钠和氢氧化镁对奥美拉唑各项指标影响不大。为奥美拉唑-碳酸氢钠-氢氧化镁制成复方制剂提供了数据支持。
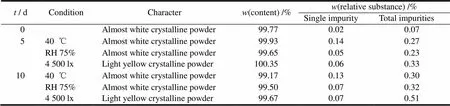
Table 1 The results of omeprazole kept for 10 days in three different conditions
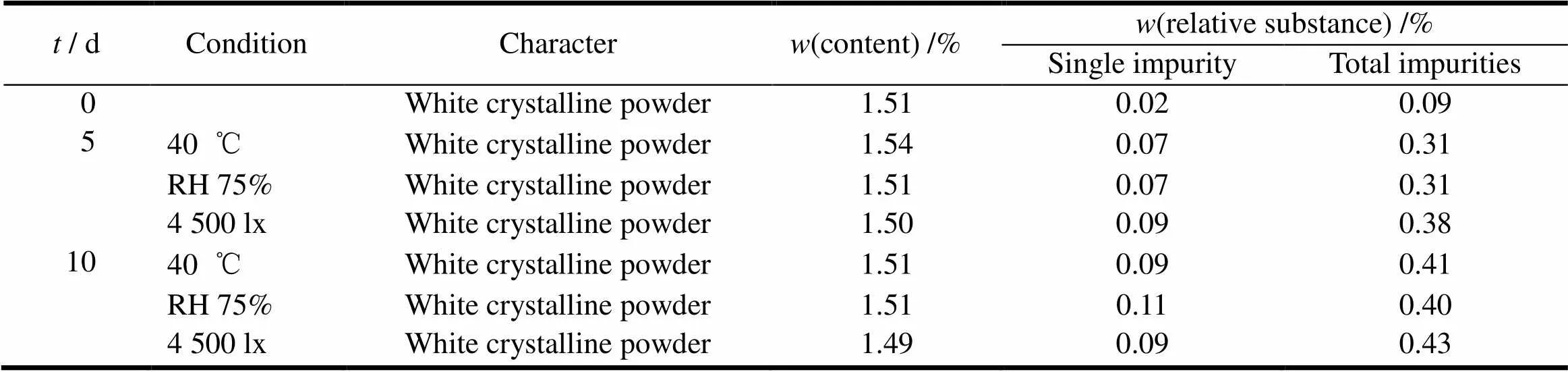
Table 2 The results of omeprazole / sodium bicarbonate/magnesium hydroxide mixture kept for 10 day in three different conditions
3.2 处方工艺优化
根据文献资料[3]及预实验结果设计处方方案,将主药和辅料分别过147 μm筛,根据处方分别直接压片和制粒后压片,因影响片剂质量的因素较多,故采用综合分析法,将制粒难易、压片难易、片面外观、片重差异、硬度、口感、崩解时限、溶出度八项指标综合测定得分后优选,根据八项指标的重要性将评分标准定为:硬度和口感各占20分,其他项各占10分,总分100分,具体处方与结果见表3、4。
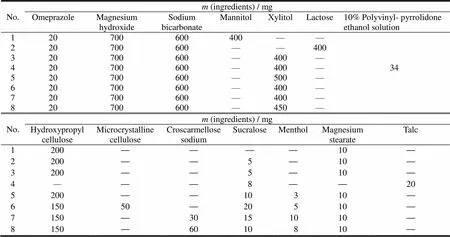
Table 3 Prescription screening programme of omeprazole sodium magnesium chewable tablet
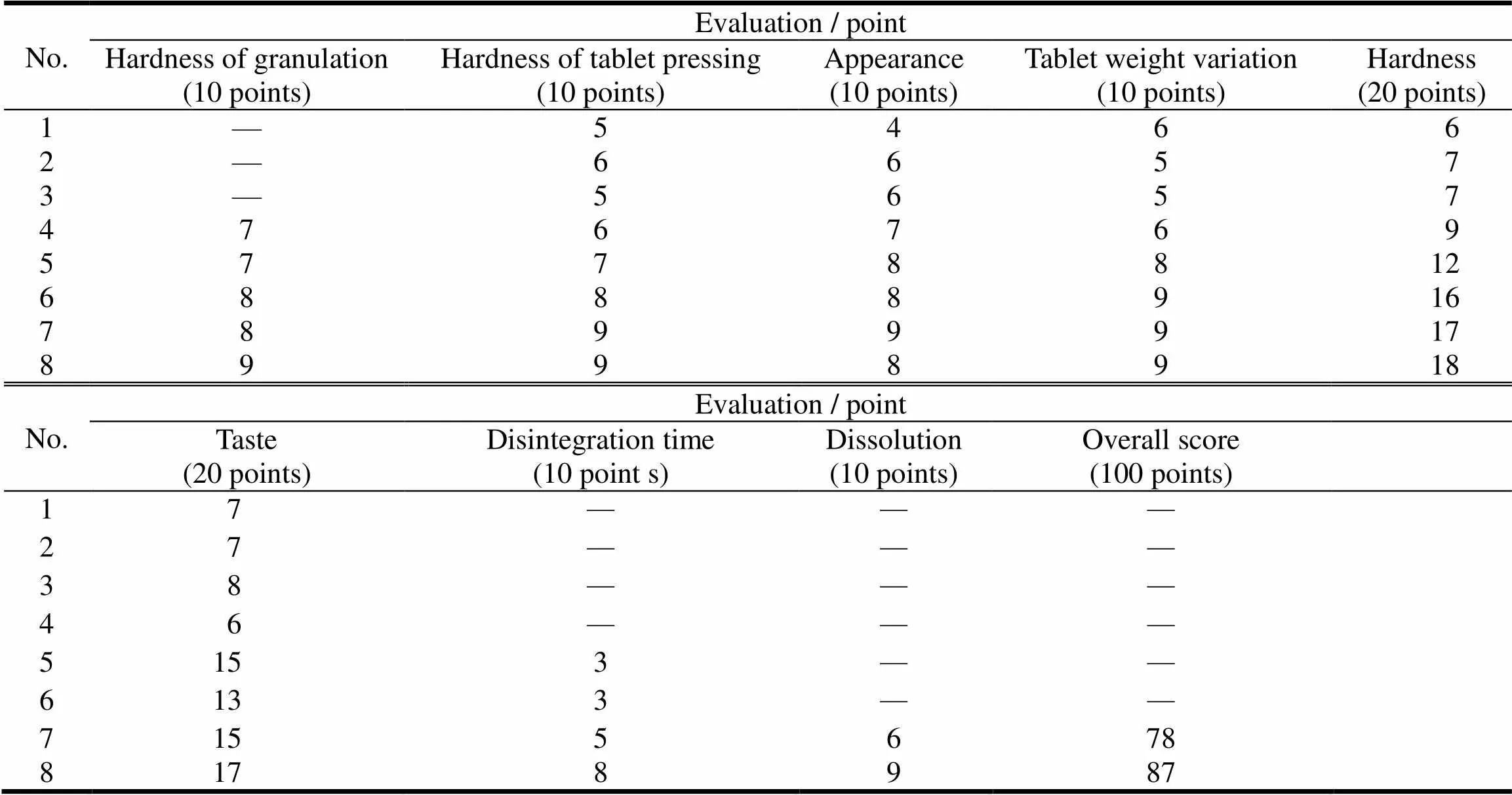
Table 4 The prescription screeningevaluation result of omeprazole sodium magnesium chewable tablets
根据处方初步筛选结果,确定影响奥美拉唑钠镁咀嚼片口感主要因素为羟丙基纤维素用量()、薄荷脑用量()和三氯蔗糖用量()。参考相关文献[4]对这3个因素进行考察,每因素分设3水平,以正交表L9(34)安排9个处方进行试验,以口感对9个处方的片剂进行评分,试验因素水平的划分及试验结果见表5、6。

Table 5 Orthogonal experiment table of factors and levels
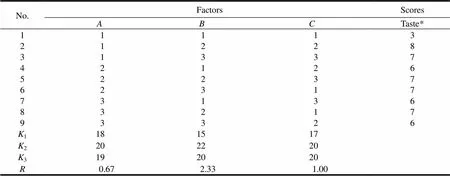
Table 6 Results of orthogonal test
Notes:10 points, taste soft and hard moderate, cool and delicious; 6 points, soft or hard, bitter or more astringent; 2 points , very hard or very soft, bitter or astringent.
根据正交试验结果直观判断,对奥美拉唑钠镁咀嚼片质量的影响因素大小为>>,根据实际生产成本可知处方222是最佳配比,即处方中羟丙基纤维素的质量分数为7%,薄荷脑的质量分数为0.25%,三氯蔗糖的质量分数为0.50%。
3.3 处方及工艺的重现性研究
依据上述处方及工艺分别连续制备3批小样见表7,批号分别为1091207、1091208、1091209,根据其制备过程及样品的检测结果进行考察,以确定处方及工艺的可行性。
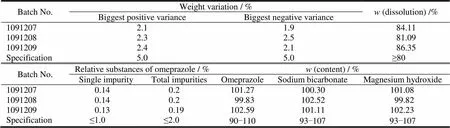
Table 7 The data and test results ofthree batches of samples (200 pieces)
由表7结果可知,所选处方及工艺连续制备的3批小样,经质量检验均符合质量标准之规定,且批与批之间结果较为一致,重现性较好,说明所选处方及工艺符合本品的制备要求。对制备的3批样品进行体外溶出度和含量测定,结果见表8与图1,各批样品的溶出曲线相似,重现性良好,溶出度及含量测定均符合规定。
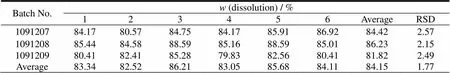
Table 8 Results of dissolution tests for each batch of samples
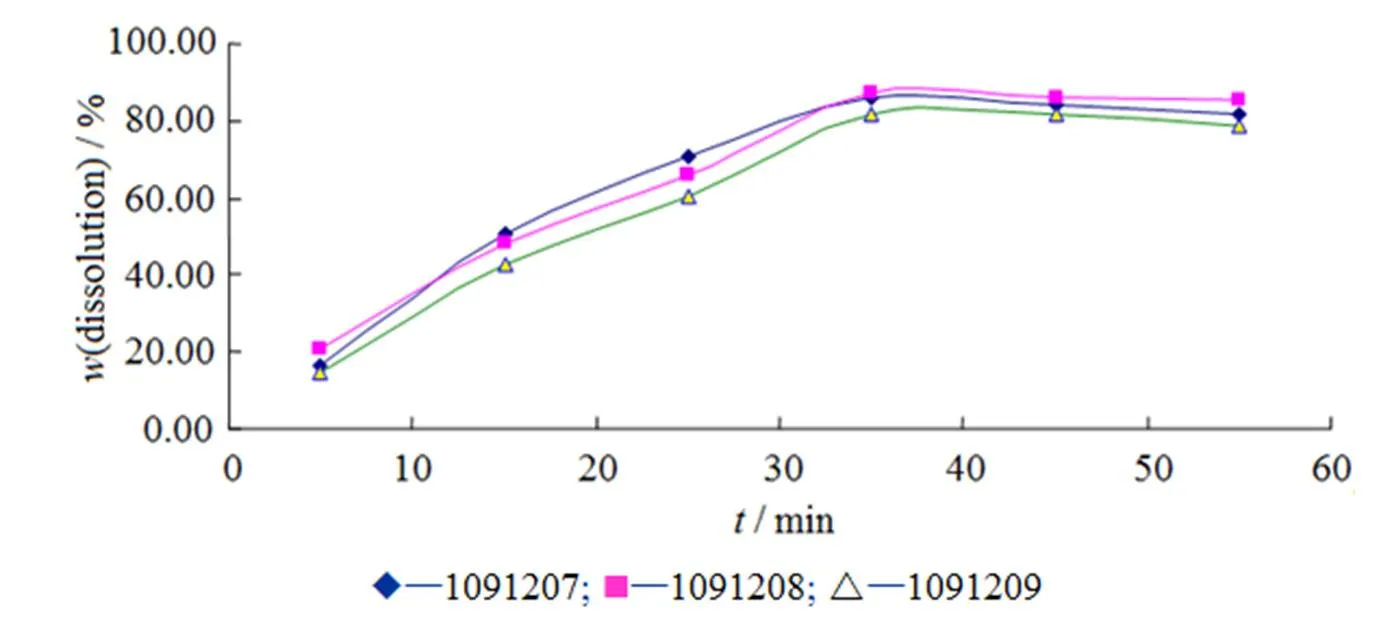
Fig. 1 Dissolution curves of each batch of samples
3.4 制剂稳定性
3.4.1 影响因素试验
如表9、表10所示,本品在高温(40℃)、高湿(相对湿度75%±5%)和强光(4500±500) lx条件下放置10 d,有关物质略有增加,强光照射使片子外观发生变化,其他各项指标未见明显变化,样品仍符合规定。
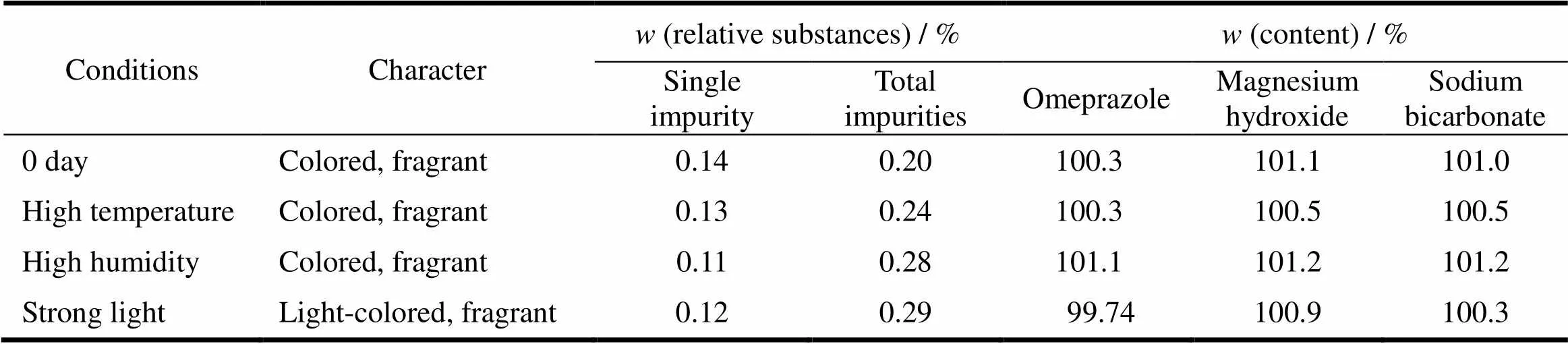
Table 9 Effect factors test results of omeprazole sodium magnesium chewable tablets (5 d)
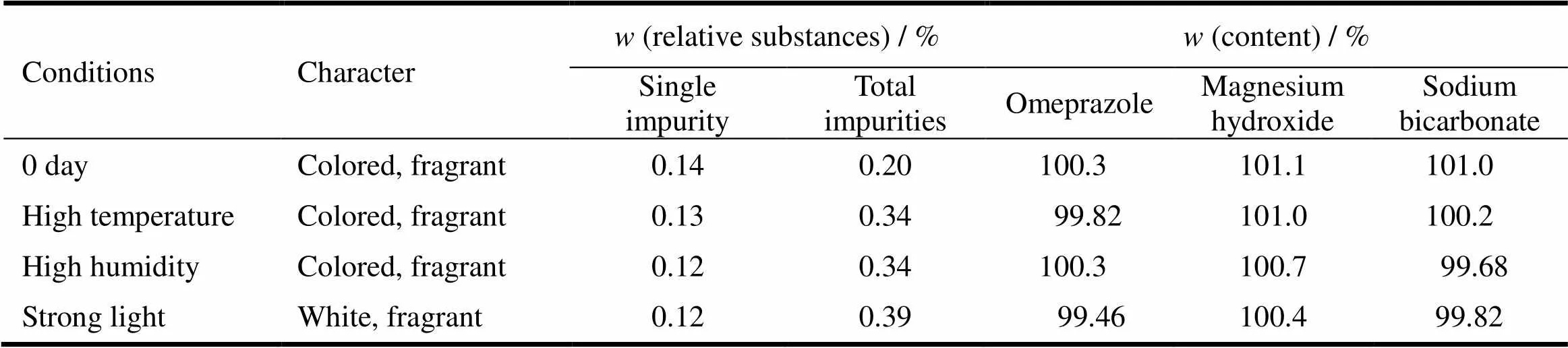
Table 10 Effect factors test results of omeprazole sodium magnesium chewable tablets (10 d)
3.4.2 加速试验
本品按上市包装,经温度(30±2) ℃、相对湿度(65±5)%条件下放置6个月试验,如表11所示,有关物质略有增加,其他各项指标未见明显变化,样品仍符合规定。
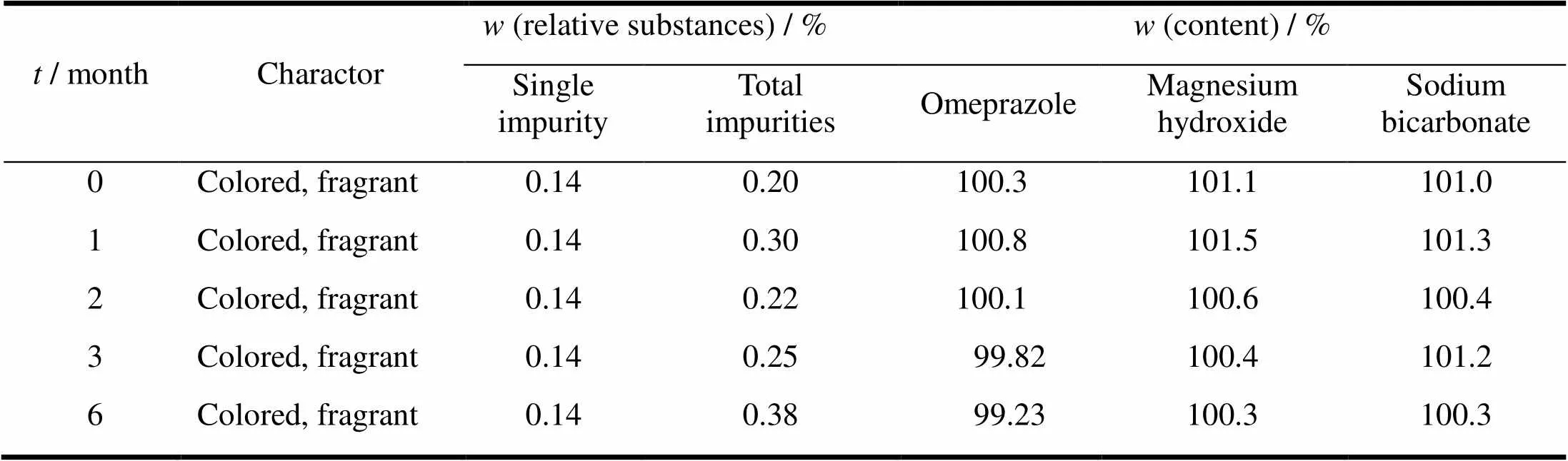
Table 11 Accelerated test results of omeprazole sodium magnesium chewable tablets
3.4.3 长期试验
本品按上市包装,经温度(25±2) ℃、相对湿度(60±10)%条件下放置6个月,如表12所示,各项指标未见明显变化,样品仍符合规定。
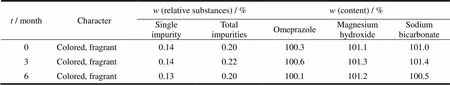
Table 12 Long-term test results of omeprazole sodium magnesium chewable tablets
4 结论
影响奥美拉唑钠镁咀嚼片质量的因素排列为:薄荷脑>三氯蔗糖>羟丙基纤维素,且质量分数为7%羟丙基纤维素、0.25%薄荷脑和0.50%三氯蔗糖为最佳配比;批号分别为1091207、1091108、1091109的3批小试样品的性状、重量差异、溶出度、有关物质、含量均符合规定,重现性较好;影响因素试验表明强光导致片子外观发生变化,本品按上市包装,经温度(25±2) ℃、相对湿度(60±10)%条件下放置6个月,各项指标未见明显变化,样品仍符合规定。该制备工艺稳定且重现性好,可用于奥美拉唑钠镁咀嚼片的工业生产。
[1]迟云峰, 张明晶. 复方奥美拉唑咀嚼片含量测定方法的研究[J]. 中国医药指南,2012,31:98-99.
[2]施昕磊,黄绳武. 咀嚼片的研究进展[J]. 中国药业,2008,14:17-19.
[3]王薇, 刘祖雄, 陶志强, 等. 铝碳酸镁咀嚼片的制备方法改进及其质量控制[J]. 中国药房,2015,13:1824-1826.
[4]张茁. 加校正因子的主成分自身对照法测定复方奥美拉唑咀嚼片相关物质含量的分析[J]. 中国医药指南,2016,06:38-39.
Study on preparation and stability of omeprazole-sodium bicarbonate-magnesium hydroxide chewable tablets
WANG Yu1, NIU Huaying2, XIAN Lei1, SONG Xiaowen1, CHEN Xiao1, JI Haihong3, DING Pingtian1*
(1,,110016,; 2.,250100,; 3.610106,)
Objective To prepare stable omeprazole-sodium bicarbonate-magnesium hydroxide chewable tablets. Methods The formulation of chewable tablets was screened by comprehensive analysis method and the best formulation was determined based on the mouthfeel via the orthogonal test. The influencing factors and accelerated stability were also investigated.Result The optimal formulation for the omeprazole-sodium bicarbonate-magnesium hydroxide chewable tablets composed of 7% hydroxypropyl cellulose, 0.25% menthol and 0.50% sucralose. The quality of three batches all complied with the provisions, and the reproducibility between three batches were good; the results of influencing factor test showed that strong light caused the change of appearance of chewable tablets. When the packaged samples were placed under the following conditions for 6 months: the temperature of (25±2) ℃, relative humidity of (60±10)% , the physical or chemical property of the tablets exhibited no obvious changes, the samples all complied with the provisions. Conclusion This preparation technique is stable and reproducible, which can be used for the industrial production of omeprazole-sodium bicarbonate-magnesium hydroxide chewable tablets.
Pharmaceutics; chewable tablets; orthogonal test; omeprazole-sodium bicarbonate-magnesium hydroxide chewable tablets; stability analysis
(本篇责任编辑:赵桂芝)
(2017)04–0075–10
10.14146/j.cnki.cjp.2017.04.001
R94
A
2016-03-28
王宇(1994-), 男(汉族), 山东省济南人, 本科生, E-mail 624658672@qq.com;
丁平田(1969-), 男( 汉族), 山东临朐人, 教授, 博士, 博士生导师, 主要从事药物新剂型和新技术研究, Tel.024-23986305, E-mail dingpingtian@qq.com。
