溶剂分散法制备咪达那新片
2017-10-13杨如意孙英华
杨如意,孙英华
溶剂分散法制备咪达那新片
杨如意,孙英华*
(沈阳药科大学 无涯学院,辽宁 沈阳110016)
目的 应用溶剂分散法制备溶出度及含量均匀度符合要求的咪达那新片。方法 依据崩解时限及溶出度结果筛选出黏合剂羟丙甲纤维素E5、崩解剂交联聚维酮K30的用量及包衣材料欧巴代的增质量范围,计算自制与市售咪达那新片相似因子(2)及自制咪达那新片的含量均匀度。结果 羟丙甲纤维素E5及聚维酮K30的用量质量分数分别为1%,8%;欧巴代增质量为2.0%~3.0%。自制与市售咪达那新片在不同pH值介质中2值>50,小试3批自制咪达那新片+1.8值分别为6.09、4.83和8.43。结论 应用溶剂分散法制备的自制咪达那新片与市售片溶出相似,含量均匀度合格。
药剂学;小剂量片剂;溶剂分散法;咪达纳新;包衣增质量;相似因子;含量均匀度
咪达那新为一种新型高效抗胆碱药物,用于膀胱过度活动症的治疗。咪达那新具有二苯基丁酰胺结构,它选择性作用于M3 和M1 受体[1],阻断胆碱能神经对逼尿肌的收缩作用,使逼尿肌松弛。每日2次,每次服用0.1 mg 咪达那新,可显著改善膀胱过度活动症所引起的尿急、尿频、尿失禁等症状。咪达那新具有抑制膀胱平滑肌收缩和抑制乙酰胆碱游离双重作用, 而且对膀胱的选择性强于唾液腺,对于脑组织中但碱受体亲和力较低,因此中枢和外周不良反应较少[2]。
咪达那新片由日本小野药品工业株式会社与杏林制药联合开发,于2007年6月在日本上市,商品名(ウリトス锭),规格为0.1 mg。本文以日本小野药品工业株式会社生产的咪达那新片作为参比制剂,研发与其溶出相似的自制制剂。小剂量制剂常见的制备工艺有等量递加法、溶剂分散法、流化床造粒、沸腾制粒和喷雾干燥等[3]。作者应用溶剂分散法制备自制咪达那新片。
1 仪器与材料
HITACHI Chromaster高效液相色谱仪(日本株式会社日立制作所),pHs-2C酸度计(上海理达仪器厂),Adventurer电子分析天平AR1140(上海奥豪斯国际贸易有限公司),TG328A分析天平(上海仪器制造厂),KQ-100超声波清洗器(昆山超声仪器有限公司),ZRS-8G智能溶出仪(天津大学无线电厂),HH-2数显恒温水浴锅(国华电器有限公司),ZB-lE智能崩解仪(天津天大天发科技有限公司),ACCHROM Unitary C18色谱柱(150 mm×4.6 mm,5 μm)。
咪达那新片(日本小野药品工业株式会社),咪达那新对照品(自制),咪达那新原料药(宁夏康亚药业有限公司),羟丙基甲基纤维素(E5)、欧巴代(295A640001)(上海卡乐康包衣技术有限公司),微晶纤维素(PH102)、预胶化淀粉(PC-10)(日本旭化成株式会社),交联聚维酮(美国国际特品公司),硬脂酸镁(安徽山河药用辅料有限公司),无水乙醇(吉林天龙化工),甲醇(色谱纯)、乙腈(色谱纯)(天津康科德科技有限公司),辛烷磺酸钠(分析纯,山东禹城中美色谱产品厂),磷酸(分析纯,天津科密欧化学试剂有限公司),盐酸(分析纯,天津凯信化学工业有限公司)。
2 方法与结果
2.1 色谱条件
用十八烷基硅烷键合硅胶为填充剂,以1.08 g∙L-1辛烷磺酸钠磷酸溶液(1→1 000)-乙腈(体积比67∶33)为流动相,检测波长为205 nm,柱温35 ℃。理论板数按咪达那新峰计算应不低于2 000。
2.2 溶出度测定
按《中华人民共和国药典》2010年版附录XC第三法溶出度检查法测定。分别以水、0.1 mol∙L-1盐酸水溶液、pH值4.5醋酸盐缓冲液、pH值6.8磷酸盐缓冲液和pH值7.4磷酸盐缓冲液100 mL为溶出介质,转速为50 r∙min-1,分别于5、10、15、20、30、45和60 min取样5 mL,滤过,取续滤液作为供试溶液,同时补充同温度同体积的介质。另精密称取咪达那新对照品10 mg,置于100 mL量瓶中,加甲醇溶解,稀释至刻度,摇匀,取1 mL置于100 mL量瓶中,加水稀释至刻度,摇匀,作为对照溶液。按“2.1”条色谱条件,精密量取供试溶液和对照溶液各20 μL,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算每片的溶出量。
2.3 含量均匀度试验
测定方法:用《中华人民共和国药典》2010年版二部附录ⅤD中的高效液相色谱法测定。取本品1片,置于10 mL量瓶中,加水2 mL振摇使崩解,加入适量甲醇,超声使溶解,用甲醇定容至刻度,摇匀,滤过,取续滤液作为供试溶液。另取咪达那新对照品适量,精密称定,加甲醇溶解并定量稀释制成每1 mL中约含咪达那新10 μg的溶液,作为对照溶液。精密量取供试溶液和对照溶液各20 µL,按“2.1”条色谱条件测定含量,应符合《中华人民共和国药典》2010年版二部附录ⅩE之规定。
检查方法:《中华人民共和国药典》规定检查含量均匀度的片剂无需再做质量差异检查。随机取样品10片,测定每片以标示量为100的相对含量质量分数(),求其平均值和标准差以及标示量与均值之差的绝对值,计算+1.80≤15.0即符合规定。
2.4 相似因子2计算方法
溶出曲线的绘制是评价制剂质量的重要依据[4],本试验中溶出情况采用累积法计算溶出,然后采用FDA推荐的相似因子(2)法[5]与市售制剂进行比较评价处方,公式如下:
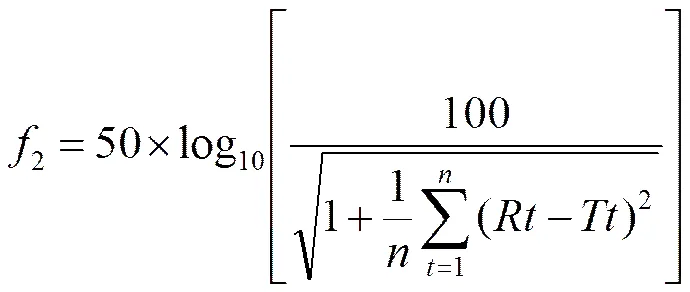
其中,和分别为两制剂在时间的累积溶出百分率,为取样点总数。
2.5 处方组成
在处方组成中,以咪达那新为主药,微晶纤维素和预胶化淀粉为填充剂,羟丙甲纤维素、体积分数50%乙醇为黏合剂,交联聚维酮为崩解剂,硬脂酸镁为润滑剂,Opadry®xy(295A640001)为包衣材料。
2.6 制备工艺
将辅料分别过150 μm筛,备用;将处方量的咪达那新溶解于5 mL 无水乙醇溶液中,加入处方量的羟丙基甲基纤维素,搅拌使完全分散,补加水至10 mL,搅拌均匀,作为黏合剂1;再配制适量的体积分数50%乙醇溶液10 mL作为黏合剂2。将过筛后的微晶纤维素、预胶化淀粉、2/3处方量的交联聚维酮混合均匀,以黏合剂1制软材,再取适量黏合剂2适量继续制软材,用380 μm筛网进行制粒。将湿颗粒在40 ℃条件下干燥;干燥后的颗粒以550 μm筛网进行整粒。将1/3处方量的交联聚维酮以及处方量的硬脂酸镁加入上述干颗粒中,混合均匀,以7号冲压片即得。取素片,清除粉末后放入包衣锅内,40 ℃,10 r∙min-1进行包衣。
2.7 黏合剂用量的确定
由表1可知:随着黏合剂羟丙基甲基纤维素E5的用量降低,片剂的崩解加快(崩解剂交联聚维酮用量的质量分数为4%)。按“2.2”条下的规定,考察质量分数1%的羟丙甲纤维素E5自制片在水中的溶出情况,结果见图1。

Table 1 Influence of the amount of HPMC E5 on disintegration time
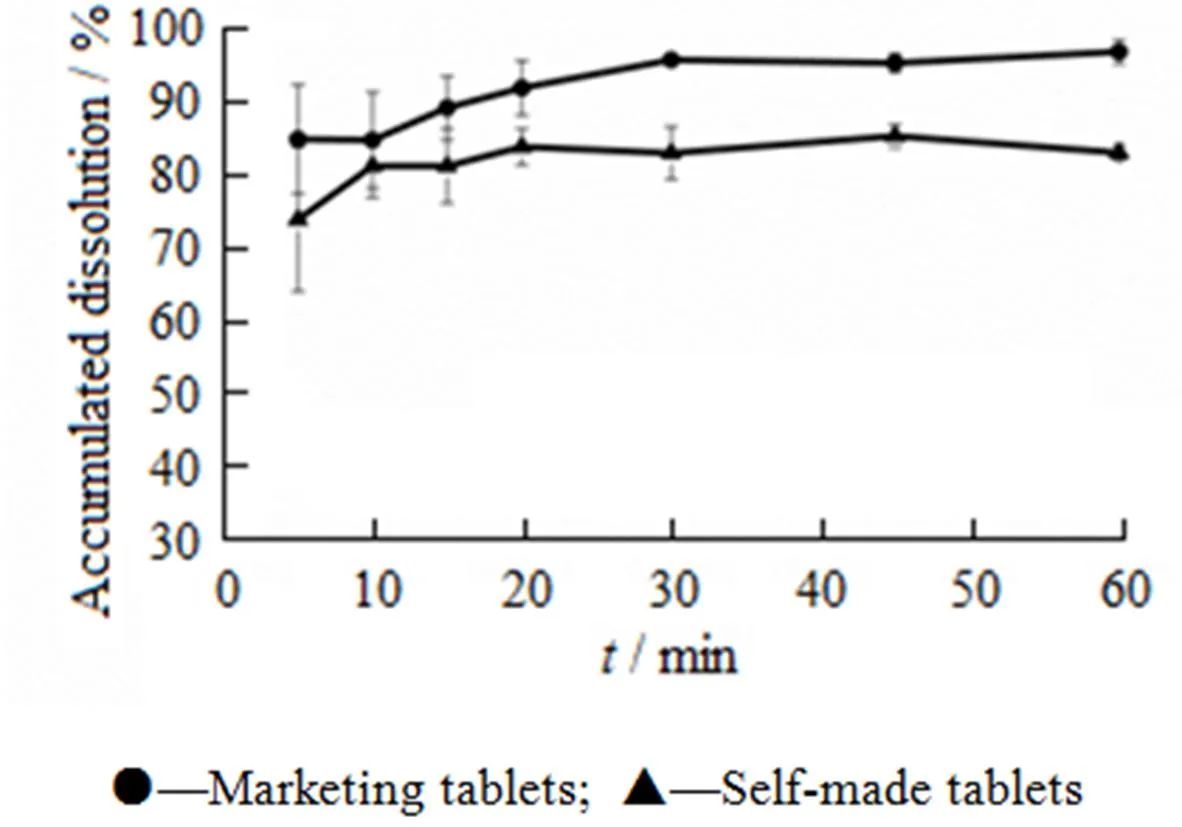
Fig. 1 Dissolution profiles of marketing tablets and self-made tablets with HPMC E5(1%) in water
由图1可知:市售片与1%羟丙甲纤维素E5自制片片芯在水中溶出相似。
2.8 崩解剂用量的确定
确定黏合剂羟丙甲纤维素E5的用量质量分数为1%后,由表2可知:随着崩解剂交联聚维酮用量的增大,片剂的崩解加快,在3 min内可以完全崩解,而且加入质量分数8%的交联聚维酮自制片与市售片的崩解时间相似。按“2.2”条下的规定,考察该自制片在水中的溶出度,结果见图2。

Table 2 Influence of the amount of PVPP on disintegration time
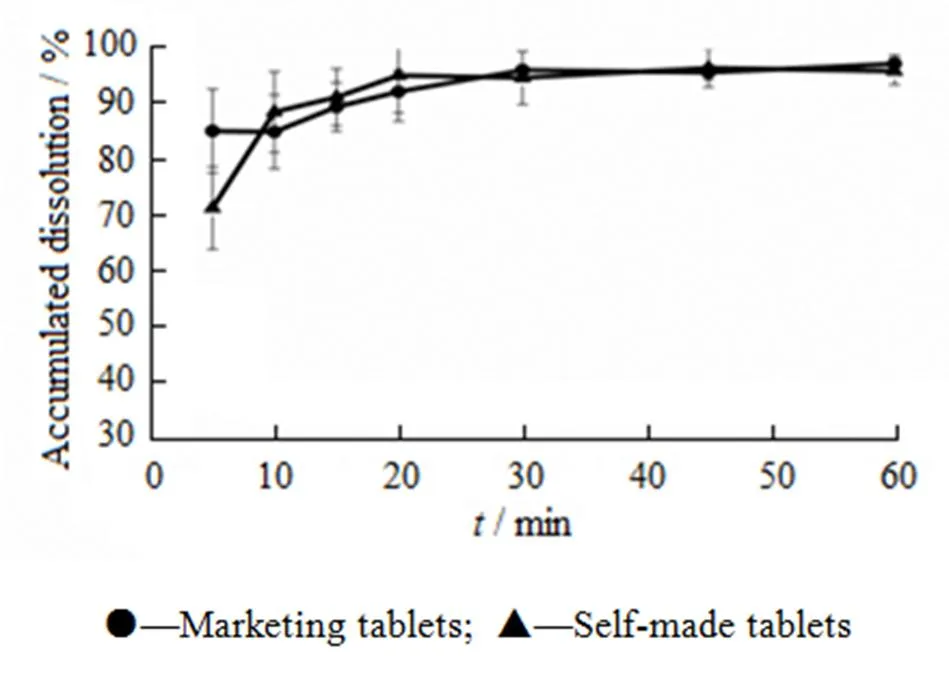
Fig. 2 Dissolution profiles of marketing tablets and self-made tablets with PVPP(8%) in water
由图2可知:市售片与8%交联聚维酮自制片片芯在水中溶出相似。
2.9 包衣增质量范围的确定
根据片芯处方筛选结果,在片芯处方基础上选择欧巴代(295A640001)为包衣剂,以体积分数50%乙醇为包衣溶剂,以溶出曲线为依据进行包衣处方筛选,同时考察不同包衣增质量对片剂溶出的影响,结果见图3。
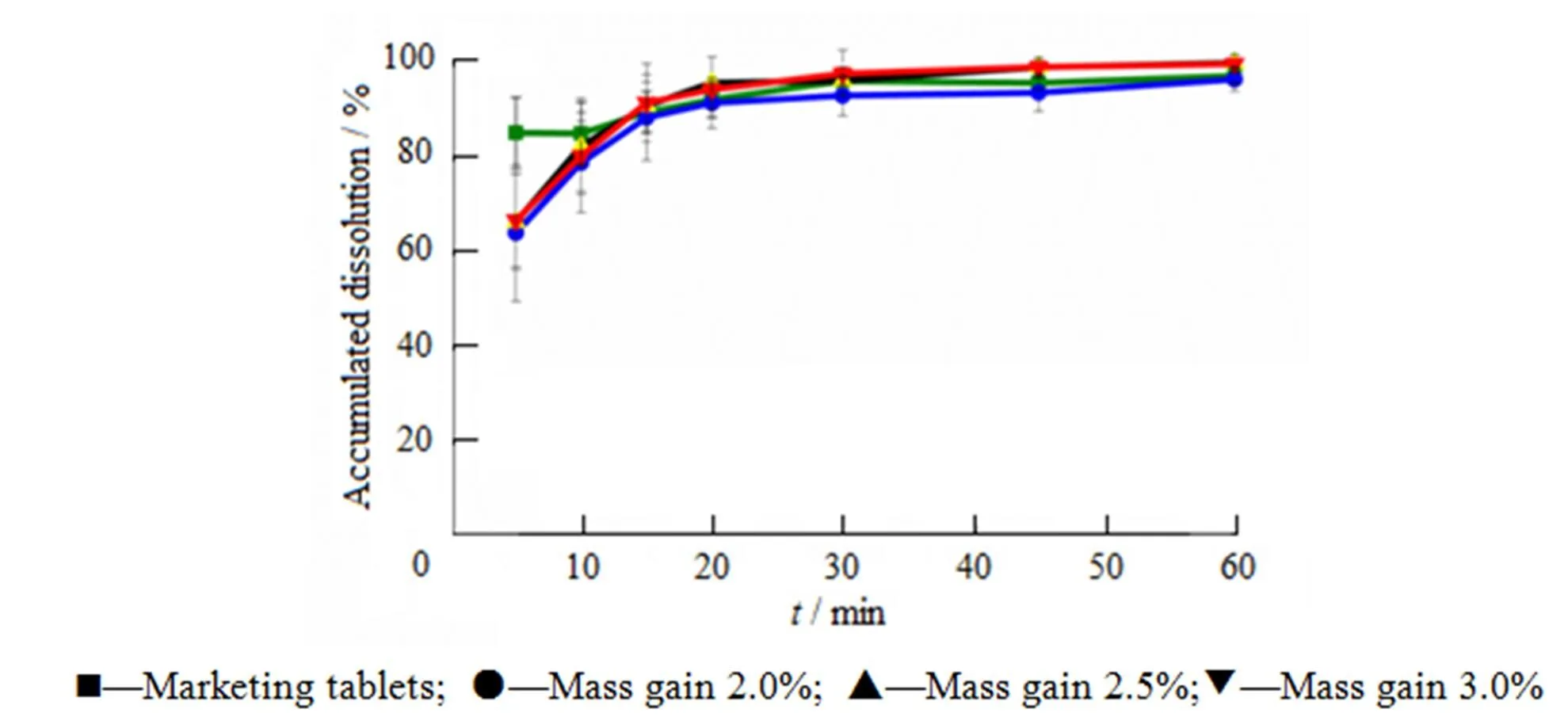
Fig. 3 Influence of weight gain on dissolution profiles in water
由图3可知,当包衣增质量在2.0%~3.0%内,自制片与市售片溶出相似。因此包衣增质量控制在2.0%~3.0%内。
2.10 小试样品与市售品在不同溶出介质溶出曲线对比
取市售片与自制片,分别以水、0.1 mol∙L-1盐酸水溶液、pH值4.5醋酸盐缓冲液、pH值6.8磷酸盐缓冲液和pH值7.4磷酸盐缓冲液100 mL为溶出介质,其余按“2.2”条方法进行操作。溶出结果见图4:
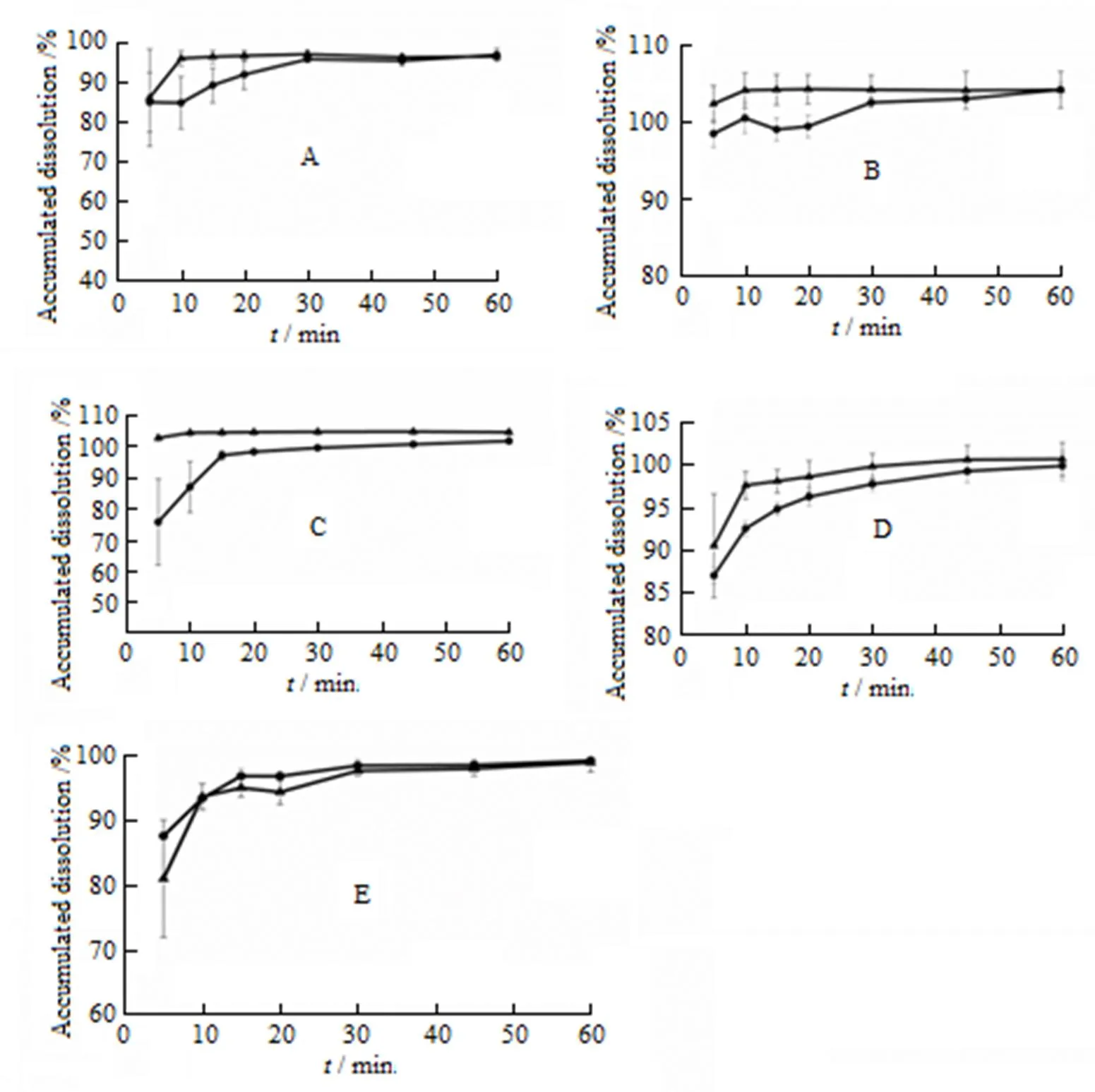
●—Marketing tablets; ▲—Self-made tablets
2.11 自制片与市售片在不同溶出介质的溶出曲线相似因子
通过对自制片与市售片在水、0.1 mol∙L-1盐酸水溶液、pH值4.5醋酸盐缓冲液、pH值6.8磷酸盐缓冲液和pH值7.4磷酸盐缓冲液不同溶出介质中的累计溶出度结果考察比较表明,咪达那新自制片与市售片的溶出曲线基本一致(表3)。

Table 3 The f2 value of marketing tablets and self-made tablets
2.12 小试3批自制咪达那新片含量均匀度检查
依据“2.3”条检查方法,对3批自制咪达那新片的含量均匀度进行了检查,结果见表4。结果表明:小试3批自制咪达那新片+1.8均<15,含量均匀度合格。
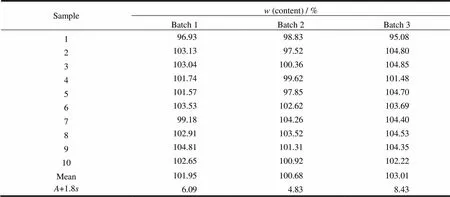
Table 4 Content uniformity tests of three batches of self-madeimidafenacin tablets
3 讨论
溶剂分散法是指将剂量较小的药物溶于适宜溶剂中,再与稀释剂等混合均匀后除去溶剂的分散方法。咪达那新规格较小,只有0.1 mg,若采用普通的混料方法,易造成与稀释剂混合不均匀,含量均匀度不合格等问题。因此,作者将咪达那新溶解于体积分数50%乙醇中,与羟丙基甲基纤维素混匀作为黏合剂1,再加入各辅料混合均匀制软材,使咪达那新以溶液状态与各辅料混合,比以固体状态与辅料混合得更均匀,有助于提高片剂含量均匀度。咪达那新易溶于氯仿,略溶于乙醇,在水中极微溶解。乙醇沸点低,采用乙醇为溶剂,最终可完全除去。
4 结论
作者采用溶剂分散法,将咪达那新溶解于体积分数50%乙醇中与羟丙甲纤维素混合作为黏合剂1,再制备体积分数50%乙醇作为黏合剂2,通过加入两种黏合剂制备出的咪达那新片与市售片在不同pH介质中溶出均相似,含量均匀度合格。该方法既改善了小规格药物制备成片剂含量均匀度不合格的问题,又具有简便易行,无需复杂仪器等优点,更易于实现产业化。
[1]HUANG W, ZONG H, ZHOU X, et al. Efficacy and safety of imidafenacin for overactive bladder in adult: a systematic review and meta-analysis[J]. Int Urol Nephrol, 2015, 47(3): 457-464.
[2]YOSHIDA A, MARUYAMA S, FUKUMOTO D, et al. Noninvasive evaluation of brain muscarinic receptor occupancy of oxybutynin, darifenacin and imidafenacin in rats by positron emission tomography[J]. Life Sci, 2010, 87(5/6): 175-180.
[3]KIM Y H, KIM I K, KIM T G, et al. Sustained drug release system using porous structured poly-lactic acid) fabricated by solvent dispersion method[J]. Journal of Porous Materials, 2013, 20(1): 303-308.
[4]谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志, 2009, 40(4): 308-311.
[5]STEVENS R E, GRAY V, DORANTES A, et al. Scientific and regulatory standards for assessing product performance using the similarity factor,2[J]. Aaps Journal, 2015, 17(2): 301-306.
Application of solvent dispersion method to prepare imidafenacin tablets
YANG Ruyi, SUN Yinghua*
(,,110016,)
Objective To prepare imidafenacin tablets by solvent dispersion method to achieve satisfied dissolution rate and content uniformity. Methods The feeding amount of hydroxypropyl methyl cellulose E5 (HPMCE5) as the adhesive, crosslinking polyvinylpyrrolidone K30 (PVPP K30) as the disintegration agent, and weight gain range of Opadry as the coating material were determined by the disintegration time and dissolution rate. The similarity factor (2) of the homemade and marketing imidafenacin tablets as well as the content uniformity of self-made tablets were calculated. Results The weight percentage of HPMC E5 and PVP K30 were 1% and 8%, and the weight gain range of Opadry was 2.0% to 3.0%.The2of homemade and marketing imidafenacin tablets were above 50 in different pH medium. The values of+1.8of three small batches of homemade imidafenacin tablets were 6.09, 4.83 and 8.43, respectively. Conclusions Thedissolution rate of self-made imidafenacin tablets prepared by solvent dispersion method was similar to that of commercial tablets, and the content uniformity was qualified.
pharmaceutics; low dosage tablets; solvent dispersion method; imidafenacin; coating weight gain; similarity factor; content uniformity
(本篇责任编辑:赵桂芝)
(2017)04–0085–07
10.14146/j.cnki.cjp.2017.04.002
R 94
A
2016-10-27
辽宁省教育厅科学技术研究资助项目(L2013390)
杨如意((1992-), 女(汉族), 江西上饶人, 硕士研究生, E-mailyryphar@163.com;
孙英华(1973-), 女(汉族), 辽宁盖县人, 高级工程师, 博士, 主要从事药剂学研究, Tel. 024-23986325, E-mailsunyinghua77@aliyun.com。
