黄芩素抑制白血病细胞增殖的分子机制研究
2017-10-12钱燕
钱燕
(武汉理工大学医院 公共卫生科,湖北 武汉 430070)
黄芩素抑制白血病细胞增殖的分子机制研究
钱燕
(武汉理工大学医院 公共卫生科,湖北 武汉 430070)
目的 探讨黄芩素抑制白血病细胞增殖的分子机制。方法 用不同终浓度的黄芩素处理多种白血病细胞,通过细胞计数获得不同时间的活细胞数,绘制细胞的生长曲线。采用对黄芩素处理最敏感的6133/MPL W515L细胞,探讨黄芩素抑制白血病细胞增殖的分子机制、细胞周期分布及凋亡情况。结果 黄芩素能抑制实验中所有白血病细胞的增殖,但对来自小鼠胚胎干细胞非恶变的G1ME细胞却无效果,提示黄芩素可能特异性抑制恶变白血病细胞增殖。细胞周期分析显示,不同浓度的黄芩素对6133/MPL W515L细胞凋亡的作用不同(P<0.05),提示可能导致6133/MPL W515L细胞凋亡和将细胞周期阻滞于G1期。另外,黄芩素可能通过抑制MAPK/Erk通路,激活Caspase-3的方式诱导细胞凋亡。单独Z-VAD不影响细胞增殖,但也不能拯救黄芩素导致的细胞增殖抑制,提示Caspase活化可能不是黄芩素抑制细胞增殖的关键通路。结论 黄芩素能诱导白血病细胞凋亡和细胞周期阻滞,从而抑制其增殖,可能是有效的抗白血病候选药物。
白血病;黄芩素;增殖;凋亡;细胞周期
Abstract:Objective To investigate the molecular mechanism of baicalein inhibiting proliferation of leukemic cells.Methods A variety of leukemia cells were treated with different concentrations of baicalein,and the number of viable cells was obtained by cell counting.6133/MPL W515L cells were used to study the molecular mechanism of baicalein inhibition of cell proliferation,cell cycle distribution and apoptosis.Results Baicalein could inhibit the proliferation of all the tested leukemia cells,except for the non malignant G1ME cells from mouse embryonic stem cells,suggesting that baicalein might specifically inhibit the proliferation of malignant leukemia cells.Cell cycle analysis showed that the different concentrations of baicalein had different effect on apoptosis of 6133/MPL W515L cells (P<0.05),suggesting that may lead to the apoptosis of 6133/MPL W515L cells and cell cycle arrest in G1phase.In addition,baicalein may induce apoptosis by inhibiting MAPK/Erk pathway and activating caspase-3.Z-VAD alone did not affect cell proliferation,but it could not save the cell proliferation inhibition induced by baicalein,suggesting that caspase activation may not be the key pathway of baicalein inhibiting cell proliferation.Conclusions Baicalein can induce apoptosis and cell cycle arrest and inhibit the proliferation of leukemia cells.It may be an effective candidate for anti-leukemia drugs.
Keywords:leukemia;baicalein;proliferation;apoptosis;cell cycle
白血病是威胁人类健康的重大疾病,白血病致病的分子机制和治疗一直是生物医学研究的热点[1-4]。从天然物质中寻找毒副作用小,安全有效的治疗白血病的药物,已经成为近些年的研究热点[5-7]。黄芩素是黄芩的主要有效成分,具有多种药理作用,如抗氧化、抗肿瘤、抑制醛糖还原酶及抗病毒等,其抗肿瘤作用一直是国内外研究的热点。本文主要探讨黄芩素抑制白血病细胞增殖的分子机制。
1 材料与方法
1.1 材料
1.1.1 细 胞 系 6133、6133/MPLW515L、K562、CMK(原始巨核细胞白血病细胞系)、HL-60、HEL、Jurkat(人外周血白血病T细胞)、Raji(人淋巴瘤)、U937(人巨噬细胞系)、G1ME等细胞系为武汉理工大学医学院实验室所保藏,培养于含10%胎牛血清的无血清细胞冻存培养基(roswell park memorial institute 1640,RPMI 1640)中。
1.1.2 试剂 黄芩素为美国Sigma公司产品,纯度为99.00%,其他化学试剂均为分析纯。
1.1.3 仪器设备 恒温水浴锅(上海精宏试验设备有限公司),细胞培养箱、小型离心机及高速冷冻离心机购自香港Healforce公司,生物安全柜(苏州安泰空气技术有限公司),基因扩增仪(美国Thermo公司),流式细胞仪(美国Beck-man&Coulter公司生产Epics XL流式细胞仪),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪(美国ABI7500定量PCR仪),琼脂糖凝胶电泳仪(北京君意东方设备有限公司),液氮罐(成都市洪达化工责任有限公司),-80℃、-20℃和4℃冰箱均购自青岛海尔集团,XFS-280A高压灭菌锅 (长沙科怡仪器设备有限公司),DGG-9023AD电热恒温烘箱(济南恒旭试验机技术有限公司),凝胶成像分析系统(北京六一生物科技有限公司),磁力搅拌器(德国IKA公司),XS-205电子天平、pH计购自瑞士Mettler Toledo公司。
1.1.4 试剂及溶液 胎牛血清(美国Hyclone公司),诱导剂TPA(美国Sigma公司),人源CD61-FITC抗体(美国Bdbioscience公司),焦碳酸二乙酯水(日本TaKaRa公司),Trizol(美国Invitrogen公司),盐酸HCl(美国Sigma公司),氯仿,异丙醇,乙醇。磷酸盐缓冲溶液(phosphate buffer saline,PBS)的配置:称取 0.2 g氯化钾 KCl、8 g 氯化钠 NaCl、0.24 g 磷酸二氢钾KH2PO4及1.44 g磷酸氢二钠Na2HPO4溶于800 ml蒸馏水中,充分搅拌混匀,溶解后用HCl调节溶液pH值至7.4,最后加蒸馏水定容至1 L。在103.4 kPa高压下湿热灭菌20 min,保存于室温或4℃冰箱中。RPMI 1640培养基的复制:将1 L RPMI 1640粉末溶于800 ml去离子水中,4℃搅拌2 h,加2.5g碳酸氢钠NaHCO3,继续搅拌30 min。2.5 mol/L HCl调节pH值至7.0。0.22 μm无菌滤膜过滤,分装2瓶,500 ml/瓶,每瓶取4 ml于小青瓶,置于细胞培养箱中培养48 h,溶液若清澈透明即可使用。RPMI 1640细胞培养液的配制:将500 ml RPMI 1640培养基移出50 ml,加入胎牛血清50 ml,并加入5 ml青霉素-链霉素双抗母液,相同方向摇匀,置于4℃冰箱冷藏备用。
1.2 方法
1.2.1 黄芩素溶液的制备 称取适量黄芩素溶于二甲基亚砜(dimethyl sulfoxide,DMSO)中制备成100 mmol/L储存母液,用0.22μm的一次性针头过滤器过滤,置入-20℃避光保存备用,根据需要将母液稀释。
1.2.2 白血病肿瘤细胞的培养 细胞在含10%胎牛血清、100 IU/L青霉素-链霉素的RPMI 1640培养基中,将其置于37℃、5%二氧化碳C02的培养箱中培养。
1.2.3 白血病肿瘤细胞的生长曲线 将对数生长的6133、6133/MPL W515L、6133、K562、CMK、HEL、HL-60、U937、Raji、Jurkat等白血病细胞,以及 G1ME 细胞制成单细胞悬液,0.5×106个细胞/孔接种于12孔板中,1 ml/孔;在37℃、5%CO2培养箱中孵育1 h;加入终浓度为0、10、20和40 μmol/L黄芩素溶液,每个浓度设3个复孔,以不含黄芩素培养基的细胞作为阴性对照,继续培养24、48和72h,进行细胞计数。
1.2.4 BrdU渗入法 细胞生长至指数期时,向培养液中加入BrdU,使最终浓度为10 μg/ml。44 h加秋水仙素0.1μg/ml。48 h后常规消化细胞至离心管中,注意培养上清的漂浮细胞也要收集到离心管中。常规染色体制片。染色体玻片置56℃水浴锅盖上,铺上2×SSC液,距紫外灯管6 cm处紫外照射30 min。弃去2×SSC液,流水冲洗。Giemsa液染色10 min,流水冲洗,晾干。镜检100个分裂相,记录第1~4细胞期分裂指数。细胞周期=48/[(M1+2M2+3M3+4M4)/100]。
1.2.5 Annexin-V 和碘化丙啶(propidium iodide,PI)染色 将6133/MPLW 515L细胞1 500 r/min离心5 min。用PBS将细胞洗涤2次,1 500 r/min离心5 min,收集2×106个细胞,加入500 μl Binding Buffer重悬细胞,加入5 μl Annexin V-FITC混匀后再加入5 μl PI充分混匀。于室温、避光条件下反应5~15 min。在1 h内于激发波长488 nm,发射波长530 nm条件下用流式细胞仪检测细胞凋亡率。
1.2.6 PI染色 将6133/MPL W515L细胞1500r/min离心5 min,预冷PBS洗涤细胞2次,1 500 r/min离心5 min,收集2×106个细胞,加入预冷的70%乙醇,4℃固定过夜,或置入-20℃长期固定。细胞染色,离心收集细胞,用1ml PBS洗涤细胞1次,加入500 μl PBS(含 50μg/ml PI、100μg/ml Rnase A、0.2%Triton X-100),4℃避光条件下孵育30 min。在标准程序条件下用流式细胞仪进行检测,一般计数2~3104个细胞,用Flowjo软件分析细胞周期。
1.2.7 Western blot检测 ①蛋白质样品获得:每个样品收集10×106个细胞,1 500 r/min离心,去上清液,用PBS重悬洗2次,加1 ml放射免疫分析裂解液Buffer(含有1/1 000的蛋白酶抑制剂苯甲基磺酰氟),裂解30 min。为使细胞充分裂解,培养瓶要经常来回摇动。4℃、13 000 r/min离心15 min,取上清液作为样品;②电泳:根据目的蛋白大小选择适当浓度的分离胶来制备电泳凝胶,并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。将胶片进行扫描或拍照,用凝胶图象处理系统分析目标带的分子量和净光密度值,根据净光密度值分析数据。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,两组比较用t检验,多组间比较用方差分析,P<0.05为差异统计学意义。
2 结果
2.1 黄芩素对白血病细胞增殖的影响
用终浓度为40 μmol/L的黄芩素处理6133/MPL W515L、6133、CMK、K562、HL-60、HEL、Jurkat、U937及Raji细胞48h后,发现其细胞增殖率分别为0.100%、0.150%、0.160%、0.790%、0.955%、0.575%、0.115%、1.055%及0.625%,表明黄芩素对不同组织来源的白血病细胞均有抑制作用。其中6133/MPL W515L细胞对其最敏感。此外,黄芩素对来自胚胎干细胞永生化的G1ME细胞却无效果,表明黄芩素可能特异性地抑制恶变白血病细胞的增殖。见图1、2。
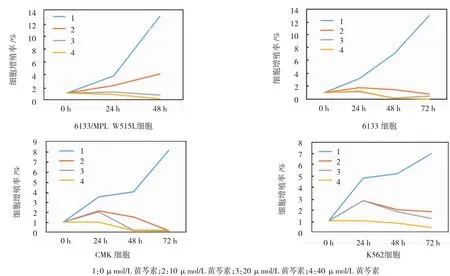
图1黄芩素对各种白血病细胞的抑制作用
2.2 黄芩素对6133/MPLW 515L细胞周期的影响
用终浓度为0、10和20 μmol/L的黄芩素作用6133/MPL W515L细胞12 h后,其S期细胞分别为56.2、28.4和13.8个,其G1/G0期细胞分别为21.4、43.0和53.8个,其G2/M期细胞分别为10.4、14.3和18.4个。由此可见,黄芩素处理6133/MPL W515L细胞可导致细胞周期阻滞在G1/S期,相应降低S期细胞数,G2/M期则没有变化。另外,通过PI染色的方法,并利用流式细胞仪分析软件Flowjo中细胞周期分析功能,同样可以看到黄芩素处理导致G1/G0期细胞增多,S期细胞减少,G2/M期细胞没有变化。由此可见,黄芩素处理能导致6133/MPL W515L细胞周期阻滞。本研究共平行进行50次实验,同一时间的50次实验结果差异较小,组内各时间比较,经方差分析,差异有统计学意义(F=43.754,P=0.000)。见图 3、4。
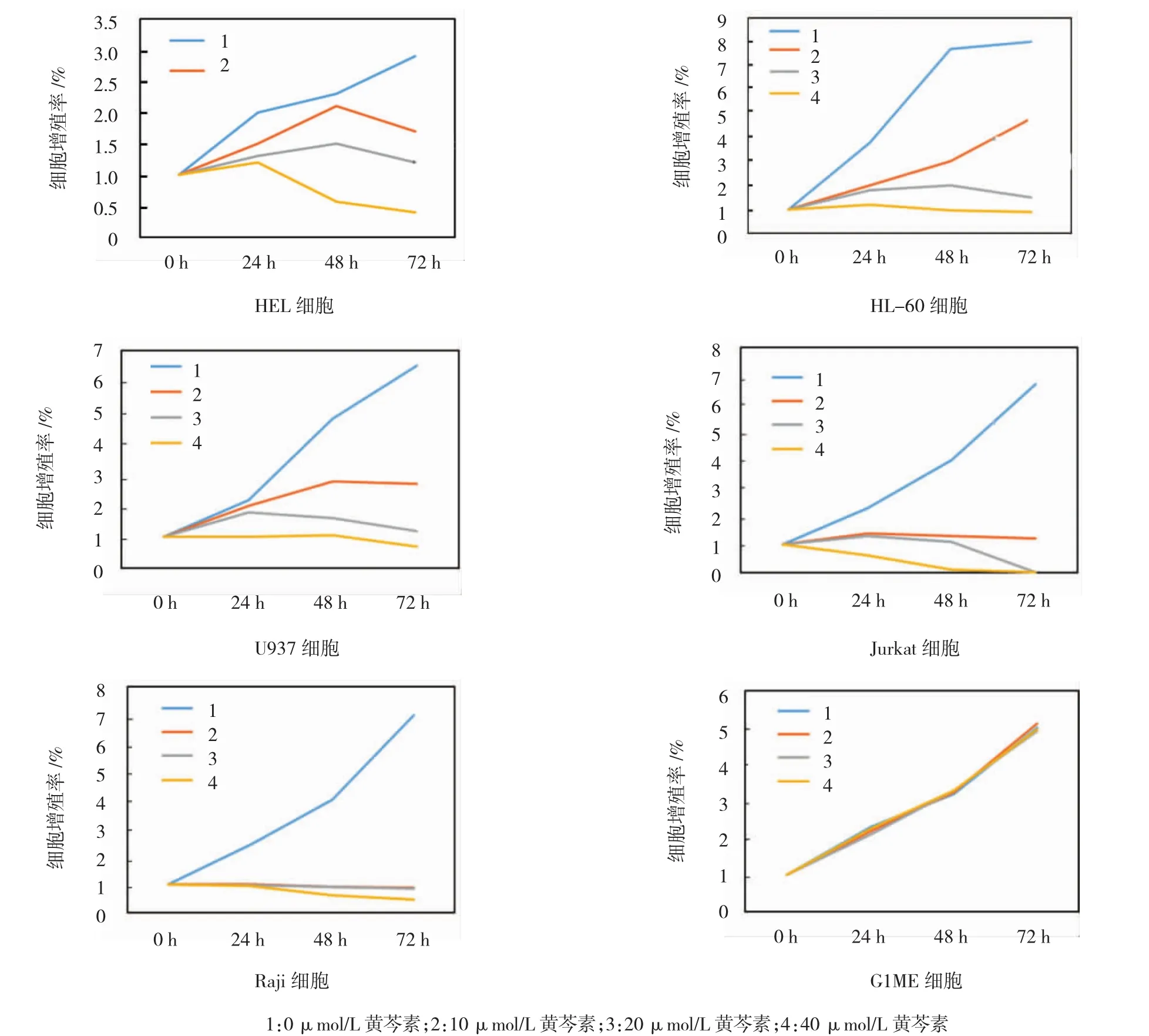
图2 黄芩素对各种白血病细胞和G1ME细胞的抑制作用
2.3 黄芩素对6133/MPLW 515L细胞凋亡的影响
随着黄芩素浓度的增加,细胞凋亡率由黄芩素终浓度为0 μmol/L时的1.62%,到20 μmol/L时的7.69%,以及在40 μmol/L时的14.3%,表现为剂量依赖性的凋亡现象。用终浓度为0、10和20 μmol/L的黄芩素作用6133/MPL W515细胞12 h后,其DNA含量低于2倍体的细胞凋亡率,分别为1.23%、1.44%和3.95%,表明黄芩素对细胞凋亡具有剂量依赖性。用终浓度为10 μmol/L的黄芩素处理6133/MPL W515L细胞12、24和48 h后,其细胞凋亡率分别为1.44%、5.19%和9.33%,用终浓度为20 μmol/L的黄芩素处理6133/MPLW515L细胞12、24和48 h后,其细胞凋亡率分别为3.95%、10.3%和13.9%,表明黄芩素对6133/MPL W515L细胞的凋亡不仅具有剂量依赖性,而且具有时间依赖性。组内各时间比较,经方差分析,差异有统计学意义(F=13.754,P=0.000)。见图 5~7。

图3 黄芩素处理后的细胞周期变化
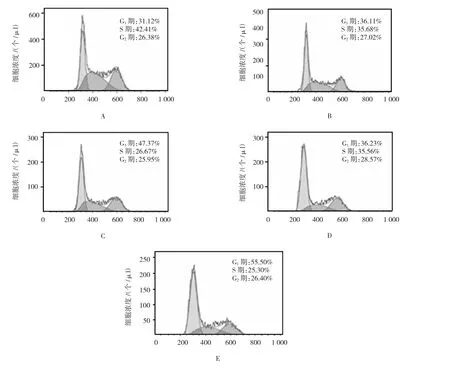
图4 黄芩素诱导6133/MPLW 515L细胞周期阻滞
2.4 芩素抑制6133/MPLW 515L细胞增殖
随着黄芩素浓度的增加,p-IκBα磷酸化降低,IκBα总蛋白无变化,说明IκBα磷酸化和降解受到抑制,抑制核转录因子-κB(nuclear transcription factor-κB,NF-κB)释放出来进入细胞核。见图8。
黄芩素抑制Erk磷酸化但激活Akt。从Western blot检测结果可以看出,与对照组终浓度0 μmol/L相比,终浓度为10、20和40 μmol/L的黄芩素作用6133/MPL W515L细胞12 h,其细胞中Erk和Akt总蛋白含量无变化;但p-Erk的含量随着黄芩素浓度的增加而降低,p-Akt的含量却随着黄芩素浓度的增加而升高,推测黄芩素可能通过MAPK-Erk和PI3K-Akt信号通路发挥作用。见图9。

图5 黄芩素诱导6133/MPLW 515L细胞凋亡
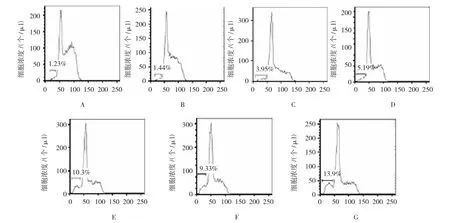
图6 黄芩素诱导6133/MPLW 515L细胞凋亡
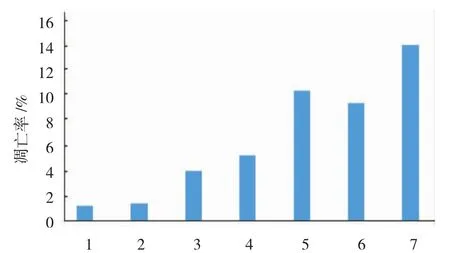
图7 黄芩素诱导6133/MPLW 515L细胞凋亡

图8 黄芩素抑制I κBα磷酸化

图9 黄芩素抑制Erk磷酸化激活Akt
终浓度10、20和40μmol/L黄芩素处理6133/MPL W515L细胞后,加工后的Caspase-3与对照组终浓度0 μmol/L相比,剪切水平逐渐增高。与此相对应,细胞内总Caspase-3下降。黄芩素可能通过激活Caspase诱导细胞凋亡。Z-VAD是一种Caspase的广谱抑制剂。为验证Caspase活化在黄芩素抑制细胞增殖中的作用,本实验在黄芩素处理细胞的同时加入Z-VAD。Z-VAD单独处理6133/MPL W515L细胞,不影响增殖;用黄芩素和Z-VAD共同处理6133/MPL W515L细胞后,也未能拯救黄芩素导致的细胞增殖抑制,提示Caspase通路活化可能在黄芩素抑制细胞增殖中未起关键作用。见图10。
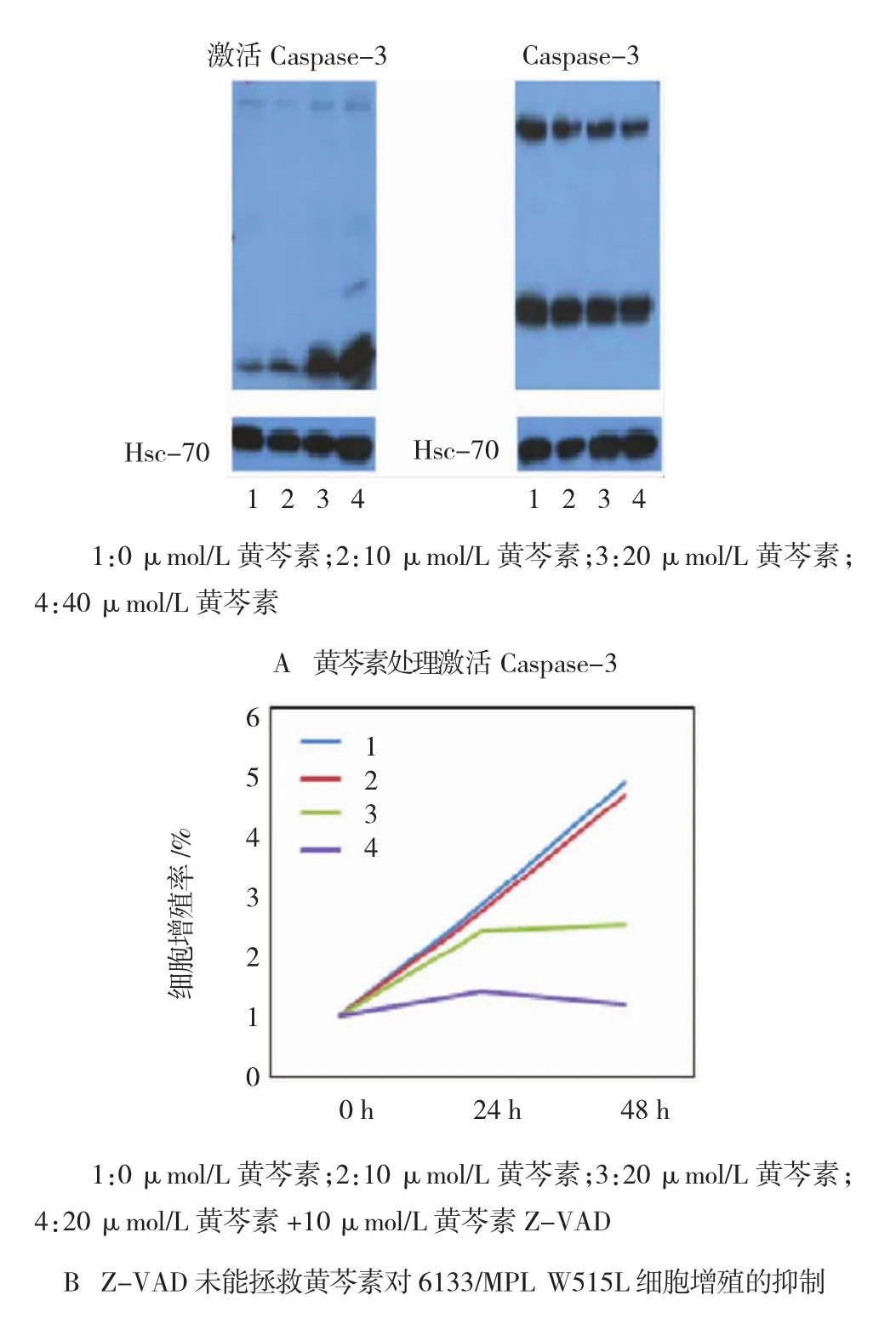
图10 黄芩素激活C aspase诱导细胞凋亡
3 结论
黄芩素对白血病肿瘤细胞的增殖抑制是一个复杂的过程。该过程牵涉很多因素,包括多个信号通路途径、活性氧及细胞周期等[8-10]。并且这些途径之间可能不是一个相对独立的过程,而是一个相互作用的网络[11-13]。本研究主要探讨NF-κB、Caspase-3、Ras/Raf/Mek/Erk通路对白血病增殖和凋亡的影响。
凋亡是在基因的调控下进行的,相关基因分为促凋亡基因、抑制凋亡基因及凋亡过程表达基因,与肿瘤的发生、发展及预后密切相关,黄芩素诱导肿瘤细胞凋亡可能与上述基因、蛋白的表达有关。黄芩素可以诱导癌细胞中的6133/MPL W515L、6133、HL-60、K562、CMK、HEL、Jurkat、U937、Raji 及 永 生化的胚胎干细胞G1ME细胞的凋亡和衰竭,黄芩素的浓度与各型癌细胞间存在着一定的比例关系。
因此,本研究以白血病肿瘤细胞中的6133/MPL W515L、6133、HL-60、K562、CMK、HEL、Jurkat、U937、Raji及永生化的胚胎干细胞G1ME细胞作为体外模型,通过细胞计数法实验研究黄芩素对上述细胞增殖的抑制作用。结果显示,黄芩素对所有受试白血病细胞均有抑制作用,但对于不同组织来源的细胞其抑制强度不尽相同,并且对上述白血病细胞的作用具有剂量和时间依赖性。实验结果表明,黄芩素对来自于永生化的胚胎干细胞G1ME细胞几乎没有抑制作用,提示黄芩素可以作为一种特异性抑制恶变白血病细胞增殖的药物。细胞增殖受到抑制可能是细胞周期阻滞或细胞凋亡导致[14-15]。
本实验通过用黄芩素处理6133/MPL W515L细胞的PI染色结果显示,随着黄芩素作用浓度和作用时间的增加,S期细胞减少,G1/G0期和G2/M期细胞增加。由此推测,黄芩素可能导致6133/MPL W515L的细胞周期阻滞在G1/S期。Annexin-V和PI染色检测细胞凋亡的结果表明,黄芩素对6133/MPL W515L细胞的凋亡不仅具有剂量依赖性,而且具有时间依赖性。多种因素可以造成细胞凋亡或周期阻滞。
为探讨多个信号通路在该过程中的作用,本实验通过黄芩素处理6133/MPL W515L细胞后Western blot检测结果表明,随着黄芩素浓度的增加,IκBα、Akt、Caspase-3及Erk总蛋白含量无明显变化,但Akt蛋白和剪切的Caspase-3含量升高,p-IκBα蛋白和p-Erk蛋白的含量降低,表明抑制p-IκBα进入细胞核内,通过抑制MAPK-Erk和促进PI3KAkt通路,以及激活Caspase的方式诱导细胞凋亡。为探讨Caspase-3在黄芩素诱导白血病细胞凋亡中的作用,用Caspase的光谱抑制剂Z-VAD单独处理6133/MPL W515L细胞,发现其细胞增殖不受影响。用Z-VAD和黄芩素同时处理6133/MPL W515L细胞,发现Z-VAD不能解救黄芩素导致的细胞增殖抑制,表明黄芩素不只是通过Caspase通路起作用。
黄芩素作为传统中药应用临床,大量研究证实其具有广泛的抗肿瘤活性,作用机制主要有:①影响花生四烯酸系统代谢途径;②抑制细胞增殖,阻滞细胞周期;③诱导肿瘤细胞凋亡;④抗肿瘤新生血管生成等。目前有关其抗肿瘤作用的临床试验尚未广泛开展,随着对黄芩素抗肿瘤作用及机制研究的逐渐深入,可为中药抗肿瘤的应用提供广阔前景。
综上所述,黄芩素能通过多条途径诱导白血病细胞凋亡和细胞周期阻滞。黄芩素抑制白血病增殖是多因素共同作用的结果。黄芩素是有效的抗白血病候选药物。
[1] ANA R S,RIBEIRO,JOSÉN V,et al.The effects of baicalein on gastric mucosal ulcerations in mice:protective pathways and anti-secretory mechanisms[J].Chem-Bio Int,2016,260(25):33-41.
[2] KAI C H,HUI J G,YI T W,et al.Baicalein attenuates αsynuclein aggregation,in flammasome activation and autophagy in the MPP+-treated nigrostriatal dopaminergic system in vivo[J].J Eth,2016,194(24):522-529.
[3] TANG Q,JI F L,SUN W H,et al.Combination of baicalein and 10-hydroxy camptothecin exerts remarkable synergetic Anti-cancer effects[J].Mat Sci Eng,2016,67(1):336-344.
[4] BALÁZS M,ZOLTÁN M,TÍMEA E,et al.Unexpected retention behavior of baicalin:hydrophilic interaction like properties of a reversed-phase column[J].J Pharm Bio Ana,2015,111(10):119-125.
[5] ZHANG H Y,WANG T Y,QIN Y L,et al.Electrochemical behavior and determination of baicalin on a glassy carbon electrode modified with molybdenum disulfide nano-sheets[J].J Elec Chem,2016,775(15):286-291.
[6] WANG P,CAO Y G,YU J,et al.Baicalin alleviates ischemiainduced memory impairment by inhibiting the phosphorylation of CaMKII in hippocampus[J].Brain Res,2016,1642(1):95-103.
[7] ZHANG C H,YU R Y,LIU Y H,et al.Interaction of baicalin with berberine for glucose uptake in 3T3-L1 adipocytes and HepG2 hepatocytes[J].J Eth,2014,151(2):864-872.
[8] LI Y C,WANG L L,PEI Y Y,et al.Baicalin decreases SGK1 expression in the hippocampus and reverses depressive-like behaviors induced by corticosterone[J].Neuroscience,2015,311(17):130-137.
[9] AKIHIRO M,KOHEI S,HIRONOBU N,et al.Neuronal differentiation of human iPS cells induced by baicalin via regulation of bHLH gene expression[J].Bio and Bio Res Com,2015,465(2):458-463.
[10] WEI X L,ZHU X Y,HU N,et al.Baicalin attenuates angiotensinⅡ-induced endothelial dysfunction[J].Bio Bio Res Com,2015,465(1):101-107.
[11] ZHANG Y,WANG X J,WANG L,et al.Interactions of the baicalin and baicalein with bilayer lipid membranes investigated by cyclic voltammetry and UV-Vis spectroscopy[J].Bioelectrochemistry,2014,95(2):29-33.
[12] LIU Z D,ZHANG L,HE Q S,et al.Effect of Baicalin-loaded PEGylated cationic solid lipid nanoparticles modified by OX26 antibody on regulating the levels of baicalin and amino acids during cerebral ischemia-reperfusion in rats[J].Int J Pharm,2015,489(1/2):131-138.
[13] LUANG Y,CHAO S,JU Z Y,et al.Therapeutic effects of baicalin on monocrotaline-induced pulmonary arterial hypertension by inhibiting inflammatory response[J].Int Immu,2015,26(1):188-193.
[14] 王宁,程琦,张延新.黄芩素对人结肠癌细胞增殖、凋亡、侵袭的影响及机制[J].山东医药,2016,59(13):10-12.
[15] ZHANG J Y,CAI W,ZHOU Y,et al.Profiling and identification of the metabolites of baicalin and study on their tissue distribution in rats by ultra-high-performance liquid chromatography with linearion trap-Orbitrap massspectrometer[J].J Chrom B,2015,985(15):91-102.
(童颖丹 编辑)
Study on molecular mechanism by which baicalein inhibits leukemic cell proliferation
Yan Qian
(Department of Public Health,Wuhan University of Technology,Wuhan,Hubei 430070,China)
R285.5;R733.7
A
10.3969/j.issn.1005-8982.2017.23.005
1005-8982(2017)23-0023-08
2016-08-26
