NF-κB在右美托咪定抑制利多卡因神经毒性中的作用*
2017-10-12覃思平周增华蒋宗滨张爱民何睿林
覃思平,周增华,蒋宗滨,张爱民,何睿林
(1.广西省百色市人民医院 麻醉科,广西 百色 533000;2.广西医科大学第二附属医院 疼痛科,广西 南宁 530007)
NF-κB在右美托咪定抑制利多卡因神经毒性中的作用*
覃思平1,周增华2,蒋宗滨2,张爱民2,何睿林2
(1.广西省百色市人民医院 麻醉科,广西 百色 533000;2.广西医科大学第二附属医院 疼痛科,广西 南宁 530007)
目的 探讨核转录因子-κB(NF-κB)在右美托咪定(Dex)抑制利多卡因对坐骨神经分支损伤(SNI)模型大鼠脊髓神经毒性中作用。方法 取40只SD雄性大鼠,随机分为5组:健康对照组(C组)、SNI模型组(S组)、SNI利多卡因组(SL组)、SNI利多卡因+Dex组(SLD组)、SNI利多卡因+Dex+NF-κB阻断剂组(SLDB组),每组8只大鼠。所有大鼠行硬膜外置管,C组未做其他处理。在疼痛稳定后,S组鞘内注射生理盐水20 μl,SL组鞘内注射10%利多卡因20 μl,SLD组在SL组基础上腹腔注射75 μg/kg Dex,SLDB组在SLD组基础上鞘内注射40μg吡咯烷二硫代氨基甲酸酯。连续药物处理7 d后取各组大鼠L4~6节段脊髓,透射电镜观察脊髓形态;末端标记法荧光染色观察脊髓背角细胞凋亡;Western blot检测Bax和Caspase-1表达量;酶联免疫吸附法检测各组脊髓匀浆液中TNF-α和IL-1β的表达。结果 ①与S组比较,SL组、SLD组及SLDB组的机械痛阈值升高,细胞凋亡数、Bax、Caspase-1、TNF-α及IL-1β表达增加(P<0.05);②与SL组比较,SLD组和SLDB组细胞凋亡数、Bax、Caspase-1、TNF-α及IL-1β表达降低(P<0.05);③与SLD组比较,SLDB组细胞凋亡数、Bax、Caspase-1、TNF-α及IL-1β表达增加(P<0.05)。结论 Dex抑制利多卡因对SNI模型大鼠脊髓神经毒性可能与激活NF-κB通路、抑制炎症及凋亡有关。
核转录因子-κB;利多卡因;右美托咪定;凋亡;炎症;神经毒性
Abstract:Objective To investigate the role of NF-κB in regulation of Lidocaine-induced spinal cord neurotoxicity of rats with sciatic nerve injury (SNI).Methods Forty male SD rats were randomly divided into 5 groups (8 in each):healthy control group (group C),SNI model group (group S),SNI+Lidocaine group(group SL),SNI+Lidocaine+Dexmedetomidine group (group SLD),SNI+Lidocaine+Dexmedetomidine+NF-κB blocker group (group SLDB)with the random number generator in SPSS 17.0 software.All rats had epidural catheterization.But the group C had no other intervention.After the pain was stable,the rats in the group S were intrathecally injected with saline 20 μl,those in the group SL were intrathecally injected with 10%Lidocaine 20 μl,those in the group SLD were intrathecally injected with 10% Lidocaine 20 μl and then intraperitoneally injected with 75 μg/kg Dexmedetomidine,those in the group SLDB were intrathecally injectedwith 40 μg of Pyrrolidine dithiocarbamate (PDTC)on the basis of the group SLD.The drugs were injected once a day for 7 d.Then L4-L6 segments of the spinal cord were extracted from the rats after anesthesia.Morphologicalchangesofthe spinalcord were observed by transmission electron microscope.TUNEL fluorescence staining was used to observe the apoptosis of spinal dorsal horn cells.The expressions of Bax and caspase-1 were detected by Western blot.TNF-α and IL-1β levels in spinal cord homogenate were detected by ELISA.Results Compared with the group S,the mechanical threshold of the groups SL,SLD and SLDB increased,so did the number of apoptic cells and the expressions of Bax,caspase-1,TNF-α and IL-1β (P<0.05).Compared with the group SL,the number of apoptic cells and the expressions of Bax,caspase-1,TNF-α and IL-1β in the groups SLD and SLDB decreased (P<0.05).Compared with the group SLD,the number of apoptic cells and the expression of Bax,caspase-1,TNF-α and IL-1β increased in the group SLDB (P<0.05).Conclusions Activation of NF-κB pathway,inhibition of inflammation and apoptosis may be the mechanism of Dexmedetomidine's inhibition of Lidocaine-induced neurotoxicity in SNI model rats.
Keywords:NF-κB;Lidocaine;Dexmedetomidine;apoptosis;inflammation;neurotoxicity
通过硬膜外腔隙注射利多卡因治疗腰椎术后神经病理性疼痛在临床上已取得良好效果[1],且不增加神经炎症与硬膜外黏连[2],但长时间使用利多卡因可导致脊髓细胞凋亡[3],出现神经毒副反应[4]。如何改善利多卡因的神经毒性、提高安全性一直是临床与基础研究的热点。右美托咪定(Dexmedetomidine,Dex)是一种α2激动剂,已有学者将其应用于硬膜外进行辅助麻醉[5]。在Dex用于硬膜外时,可有效提高镇痛效果,减少局部麻醉药物的不良反应[6]。尽管探索Dex减少局部麻醉药物毒副作用的机制研究已取得一定进展[7-8],但是仍未明了。研究发现,核转录因子-κB(nuclear transcription factor-κB,NF-κB)通路活化可有效促进细胞凋亡与炎症释放[9-10]。Dex能影响神经病理性疼痛大鼠脊髓NF-κB蛋白表达[11],减轻神经元凋亡[12]。但Dex是否能通过调控NF-κB通路,减轻利多卡因导致的脊髓神经毒性,目前缺乏相关报道。因此,本研究拟评估NF-κB通路在Dex减轻利多卡因对坐骨神经分支损伤(spared nerve injury,SNI)模型大鼠脊髓神经毒性中的作用,以明确可能的机制,为临床应用提供理论参考。
1 材料与方法
1.1 实验动物与分组
选择SD雄性大鼠40只,体重220~250 g,4~6月龄,由广西医科大学动物实验中心提供,动物合格证号:SYKX桂2015-003。空调控制动物房(SPF级)温度22℃左右,保证其正常的昼夜节律,避免强光和噪音刺激,大鼠自由饮水和进食。利用SPSS 17.0统计软件中的随机数字发生器将其随机分为5组:健康对照组(C组)、SNI模型组(S组)、SNI利多卡因治疗组(SL组)、SNI利多卡因+Dex治疗组(SLD组)、SNI利多卡因+Dex治疗+NF-κB通路阻断剂组(SLDB组),每组8只大鼠。所有大鼠行硬膜外置管术。C组未做其他处理。在疼痛稳定后,S组鞘内注射生理盐水20 μl,SL组鞘内注射10%利多卡因20μl,SLD组在SL组基础上腹腔注射75μg/kg Dex,SLDB组在SLD组基础上鞘内注射40 μg吡咯烷二硫代氨基甲酸酯(Pyrrolidine dithiocarbamate,PDTC)。连续药物处理7 d,追加相关药物和试剂1次/d。本研究通过广西医科大学动物伦理委员会审核。
1.2 实验试剂与仪器
1.2.1 主要试剂 盐酸右美托咪定(江苏恩华药业股份有限公司,H20110085),盐酸利多卡因注射液(天津大冢制药有限公司,H20065388),PDTC(美国Bio Vision公司,93-1676-100),Bax一抗(美国 Bioworld公司,BS4138),Caspase-1(美国 Bioworld 公司,BS6068),末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL)荧光(绿)试剂盒(美国Roche公司,TUN11684817),TNF-α酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国 Sigma公司,T5944),IL-1β ELISA 试剂盒(美国 Sigma公司,RAB0277),辣根过氧化物酶标记山羊抗兔IgG(H+L)(上海碧云天生物技术有限公司,A0208)。
1.2.2 主要仪器 Von Frey纤维丝测痛仪(上海玉研科学仪器有限公司),酶标仪(德国Berthold公司),Mage Lab成像仪及系统(美国Biorad Chemi Doc MP公司),透射电镜(日本电子株式会社公司,JEM-1230)。
1.3 方法
1.3.1 动物模型的复制 参照文献[13]复制SNI大鼠模型:水合氯醛腹腔注射麻醉消毒后,手术暴露大鼠右后肢坐骨神经主干及其分支,用5.0号丝线轻度结扎胫神经和腓总神经,小腿肌肉轻度颤动为有效操作。距结扎处远端2~4 mm的位置将神经剪断,术中避免接触或牵拉腓肠神经及伴行动脉,完成缝合筋膜和皮肤后,按照术前的方法饲养。参照文献[8]进行皮下隧道建立、鞘内置管及药物注射。
1.3.2 机械痛阈测定及标本提取 制模前(T0),制模后 3 d(T1)、7 d(T2),以及药物处理后 3 d(T3)、5 d(T4)、7 d(T5)用 Von Frey 各型号丝,分别测定 4 组大鼠机械缩足阈值(pain mechanical withdrawal threshold,PMWT)。操作方法参考文献[14]。最后一次测量PMWT后,麻醉处死各组大鼠,提取L4~6脊髓节段,液氮快速冷冻后置入-80℃冰箱保存,另一部分立即冷冻包埋并连续切片。
1.3.3 透射电镜观察 麻醉状态下,用2.5%戊二醛经老鼠左心室心脏灌流,取出标本送电镜室。电镜标本处理方法参考文献[15],透视电镜下观察组织超微结构,每只实验大鼠取10个视野,记录神经元及神经纤维形态学特征并拍片。
1.3.4 TUNEL荧光染色 随机选择每组标本冷冻切片3张,参照荧光TUNEL试剂盒说明书进行操作,在反应前使用DNA酶消化处理阳性对照标本,阴性标本不添加去末端拖延核苷酸转移酶。绿光标记为凋亡细胞,荧光显微镜(20×)下计算脊髓背角部位的凋亡细胞数量。
1.3.5 Werstern blot检测 取出冷冻保存标本,使用含蛋白酶抑制剂的组织裂解液RIP置于冰盒后进行超声匀浆,12 000 r/min离心30 min取上清液,使用BCA标准蛋白测定法测定并记录各组总蛋白浓度。加上样缓冲液后沸水浴5 min,取40μg总蛋白经10%SDS-PAGE凝胶分离,在冰水混合液环境中40 V恒压将蛋白转至PVDF膜。5%脱脂奶粉封闭2 h,TBST漂洗后加入BRCA1和BRCA2一抗,4℃摇床过夜,TBST洗膜3次后加入二抗37℃,2 h。TBST清洗后在Image Lab系统下成像并计算目的条带灰度值,以GAPDH为上样量的内参,计算目的蛋白/GAPDH条带灰度值的比值为目的蛋白相对表达量。
1.3.6 ELISA法 取各组脊髓标本解冻后,冰浴环境下行超声匀浆,离心提取上清液,参考ELISA试剂盒操作流程添加试剂,用酶标仪读取数据。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用单因素或重复测量设计的方差分析,两两比较用LSD-t检验,等级资料用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组机械痛阈值比较
5 组大鼠 T0、T1、T2、T3、T4及 T5的机械痛阈值比较,采用重复测量设计的方差分析,结果:①不同时间的机械痛阈值有差异(F=161.344,P=0.000);②5组的机械痛阈值有差异(F=274.592,P=0.000);③5组机械痛阈值的变化趋势有差异(F=5.881,P=0.000)。各组在不同时间的械痛阈值比较见表1和图1。
2.2 电镜观察
C组:脊髓神经细胞与神经纤维结构完整清晰;S组:慢性疼痛刺激后有部分神经细胞器溶解,结构轮廓清晰,神经纤维少量结构破坏;SL组:利多卡因治疗后,可见明显的神经纤维破损,细胞内细胞器无完整结构;SLD组:Dex治疗后,脊髓神经元结构完整,可见完整的神经纤维,组织轮廓清晰。SLDB组:使用NF-κB阻断剂PDTC后,脊髓组织结构尚可,但神经纤维出现明显的疏松及结构不完整。见图2。
表1 各组大鼠不同时间的机械痛阈值变化 (n=8,±s)
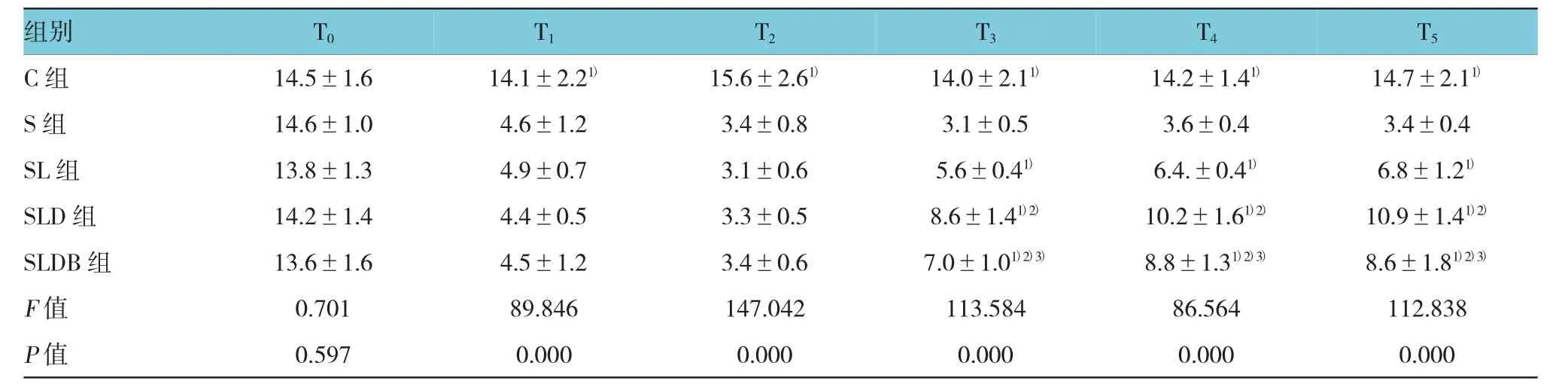
表1 各组大鼠不同时间的机械痛阈值变化 (n=8,±s)
注:1)与 S组比较,P<0.05;2)与 SL组比较,P<0.05;3)与 SLD组比较,P<0.05
组别 T0 T1 T2 T3 T4 T5C 组 14.5±1.6 14.1±2.21) 15.6±2.61) 14.0±2.11) 14.2±1.41) 14.7±2.11)S 组 14.6±1.0 4.6±1.2 3.4±0.8 3.1±0.5 3.6±0.4 3.4±0.4 SL组 13.8±1.3 4.9±0.7 3.1±0.6 5.6±0.41) 6.4.±0.41) 6.8±1.21)SLD 组 14.2±1.4 4.4±0.5 3.3±0.5 8.6±1.41)2) 10.2±1.61)2) 10.9±1.41)2)SLDB 组 13.6±1.6 4.5±1.2 3.4±0.6 7.0±1.01)2)3) 8.8±1.31)2)3) 8.6±1.81)2)3)F值 0.701 89.846 147.042 113.584 86.564 112.838P值 0.597 0.000 0.000 0.000 0.000 0.000
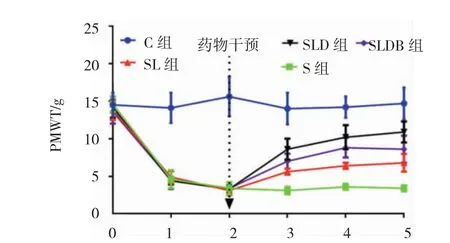
图1 各组大鼠不同时间的机械痛阈值变化 (n=8,±s)
2.3 各组凋亡细胞数比较
C组和S组标本未见凋亡细胞,SL组可见大量凋亡细胞。SLD、SLDB组及SL组的凋亡细胞数比较,差异有统计学意义(χ2=6.275,P=0.028),SLD 和SLDB组的凋亡细胞数低于SL组;SLD组的凋亡细胞数与SLDB组比较,经秩和检验,差异有统计学意义(Z=3.451,P=0.032),SLD 组的凋亡细胞数低于SLDB组。见图3。
2.4 脊髓Bax和C aspase-1蛋白的表达
5组脊髓Bax相对表达量比较,经方差齐分析,差异有统计学意义(F=237.367,P=0.000);进一步两两比较,经LSD-t检验,差异有统计学意义(P<0.05)。5组脊髓Caspase-1相对表达量比较,经方差分析,差异有统计学意义(F=131.499,P=0.000);进一步两两比较,经LSD-t检验,差异有统计学意义(P<0.05)。见图 4、5。

图2 各组脊髓标本的超纤维结构 (透视电镜×20 000)
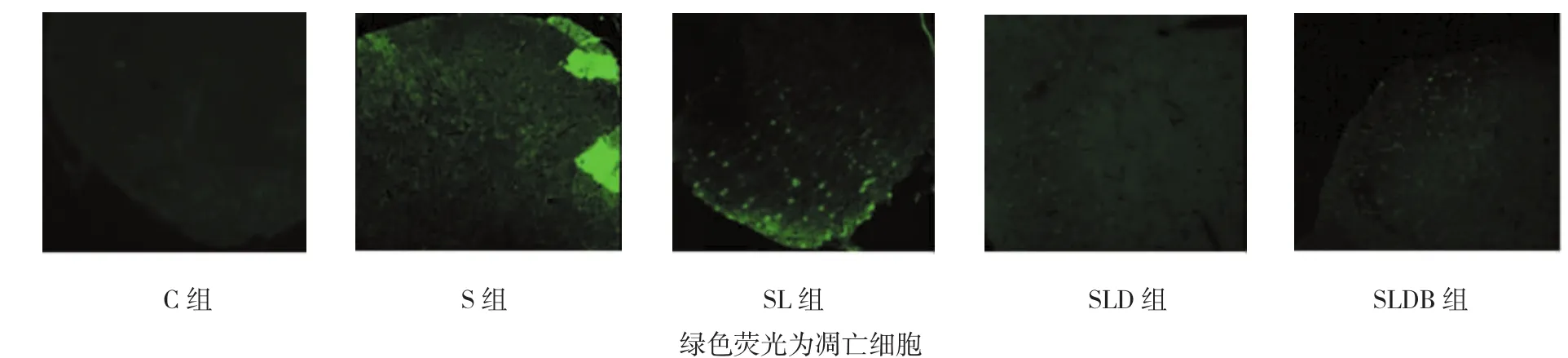
图3 各组脊髓背角凋亡细胞 (TUNEL×200)
2.5 各组TN F-α、IL-1β的表达水平比较
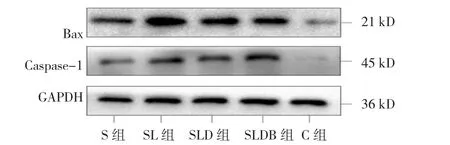
图4 各组脊髓Bax、C aspase-1蛋白的表达

图5 各组脊髓Bax、C aspase-1蛋白相对表达量比较 (n=8,±s)
5组TNF-α表达水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,经LSD-t检验,SL组与SLDB组比较差异无统计学意义(P>0.05),SL组与C组、S组SLD组比较,差异有统计学意义(P<0.05),SLDB组与C组、S组及SLD组比较,差异有统计学意义(P<0.05)。5组IL-1β表达水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,经LSD-t检验,SL组与SLDB组比较差异无统计学意义(P>0.05),SL组与C组、S组及SLD 组比较,差异有统计学意义(P<0.05),SLDB 组与C组、S组及SLD组比较,差异有统计学意义(P<0.05)。见表 2。
表2 各组TN F-α、IL-1β的表达水平比较(n=8,pg/ml,±s)
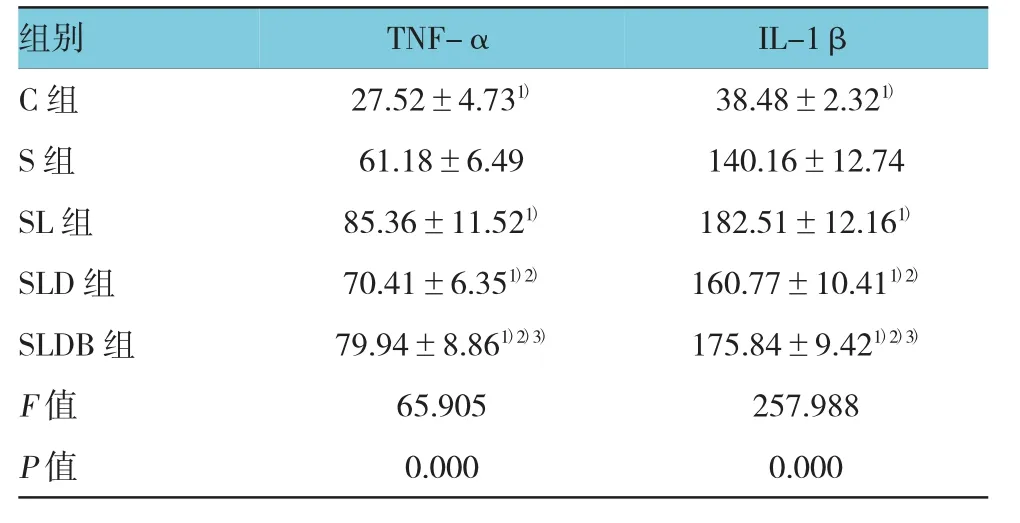
表2 各组TN F-α、IL-1β的表达水平比较(n=8,pg/ml,±s)
注:1)与 S 组比较,P<0.05;2)与 SL 组比较,P<0.05;3)与 SLD 组比较,P<0.05
组别 TNF-α IL-1β C 组 27.52±4.731) 38.48±2.321)S组 61.18±6.49 140.16±12.74 SL 组 85.36±11.521) 182.51±12.161)SLD 组 70.41±6.351)2) 160.77±10.411)2)SLDB 组 79.94±8.861)2)3) 175.84±9.421)2)3)F值 65.905 257.988P值 0.000 0.000
3 讨论
本研究在SNI慢性疼痛模型基础上,成功复制利多卡因神经毒性模型。模型大鼠腹腔注射Dex和NF-κB抑制剂PDTC后,比较了各组大鼠凋亡细胞数、促凋亡蛋白Bax和Caspase-1的表达,从模型大鼠脊髓匀浆液中炎症因子TNF-α和IL-1β的表达,推测出Dex可有效降低利多卡因对脊髓的毒副作用,可能与其激活NF-κB,从而抑制凋亡及炎症浸润有关。
NF-κB作为一种转录因子,在细胞增殖、侵袭、迁移及周期方面发挥重要作用[16],还参与神经病理性疼痛的过程。研究发现,慢性坐骨神经挤压性损伤疼痛大鼠的海马体NF-κB mRNA水平于术后4 d开始增加,7 d达高峰[17],TLR4/NF-κB信号转导通路介导大鼠骨癌痛的形成和维持[18]。在利多卡因的神经毒性研究中,细胞炎症与凋亡是重要的机制[19]。本研究及吴顺龙等[20]研究证实,Dex可以有效降低利多卡因导致的神经凋亡。同时本研究在腹腔注射Dex减轻利多卡因的毒性观察中,使用NF-κB的抑制剂PDTC后,脊髓背角的凋亡程度较未使用组增加,提示Dex可能是激活NF-κB,从而抑制凋亡。但葛亮等[11]在单独使用Dex进行镇痛观察时,Dex对NF-κB却表现出抑制作用。推测NF-κB尽管参与疼痛形成,但是更重要的是对组织凋亡进行负调节[20]。
Dex激活NF-κB通路后,Bax和Caspase-1的表达受抑制,两者是NF-κB调控凋亡的重要靶基因。Bax是Bcl-2家族中参与细胞凋亡的一个成员,当诱导凋亡时,其从胞液迁移到线粒体和核膜降解[21],促进细胞凋亡。Caspase-1存在细胞内,接受促凋亡信号后调控效应Caspases,效应Caspases是凋亡的执行蛋白[22]。Caspase-1还可激活固有免疫系统,促进包括TNF-α、IL-1β在内多种炎症因子释放[23]。因此,本研究观察Dex激活NF-κB抗利多卡因导致的神经凋亡时,在有效抑制促凋亡蛋白表达的同时,TNF-α和IL-1β释放量降低,其中Caspase-1表达程度下调可能是关键因素。
综上所述,腹腔注射Dex可有效改善利多卡因导致脊髓背角细胞凋亡与激活NF-κB有关。但也需关注使用NF-κB抑制剂PDTC后,其行为学、神经组织形态、炎症因子浓度、凋亡细胞数及凋亡蛋白的表达仍低于利多卡因毒性模型组,提示NF-κB仅是Dex减轻利多卡因毒性的通路之一,仍有未知机制需继续探讨。
[1] 朱谦,毛鹏,胡宝良,等.硬膜外应用利多卡因和倍他米松治疗腰椎术后神经病理性疼痛[J].中国疼痛医学杂志,2014,20(4):222-225.
[2] 张光明,朱明,钱刚,等.硬膜外注射倍他米松-利多卡因混合液对兔神经根炎症及硬膜外粘连的影响[J].中华麻醉学杂志,2011,31(2):180-182.
[3] 郑小兰,徐国海,周斌,等.重比重因素对利多卡因诱发糖尿病神经痛大鼠脊髓神经元凋亡的影响[J].中华麻醉学杂志,2014,34(5):604-606.
[4] 邓新波,窦兴葵,孙臻,等.右美托咪定应用于硬膜外阻滞时的量效分析[J].重庆医学,2015,44(14):1906-1907.
[5] 姜景卫,鲁华荣,毛桂琴,等.右美托咪定鞘内注射对老年患者硬膜外麻醉效果及术后认知功能的影响[J].中国老年学杂志,2016,36(22):5661-5664.
[6] 唐西宏,李霞,王海东.右美托咪定在硬膜外自控镇痛中的应用[J].临床合理用药杂志,2016,9(29):77-78.
[7] 邹振宇,钟振东,杨小霖,等.不同剂量右美托咪定对兔脊髓的神经毒性[J].临床麻醉学杂志,2016,32(3):277-279.
[8] 周斌,肖凡,黄丹,等.JNK信号通路在右美托咪定减轻利多卡因致大鼠脊髓神经毒性中的作用[J].中华麻醉学杂志,2015,35(10):1207-1210.
[9] 杨凌云,李艳秋,黄巍,等.内皮素3/内皮素受体B对A375细胞NF-κB/Bcl-2相关蛋白A1抗凋亡通路的调节[J].中华皮肤科杂志,2011,44(3):191-194.
[10] 孔杰,梁维邦,倪红斌,等.辛伐他汀对大鼠急性脊髓损伤后Toll样受体4/核因子-κB及白细胞介素-1β表达的影响[J].中华实验外科杂志,2011,28(12):2261.
[11] 葛亮,冷玉芳,高毅,等.右美托咪定对神经病理性痛大鼠脊髓Toll样受体4和NF-κB表达的影响[J].中华麻醉学杂志,2013,33(6):704-707.
[12] 王中权,王府,冉龙宽,等.右美托咪定对大鼠脊髓缺血再灌注损伤的影响及其机制[J].第三军医大学学报,2015,37(5):433-438.
[13] CHEN S R,PAN H L.Effect of systemicand intrathecal gabapentin on allodynia in a new rat model of postherpetic neuralgia[J].Brain Research,2005,1042(1):108-113.
[14] 李燕尧,张爱民,蒋宗滨,等.脉冲射频对保留性神经损伤大鼠Nav1.8 mRNA表达的影响[J].中国疼痛医学杂志,2015,21(12):903-907.
[15] MABALIRAJAN U,REHMAN R,AHMAD T,et al.12/15-lipoxygenase expressed in non-epithelial cells causes airway epithelial injury in asthma[J].Scientific Reports,2012,3(3):1540.
[16] 胡兴国,范素贞,张云翔,等.脊髓NF-κB信号通路在大鼠持续性术后痛中的作用[J].中华麻醉学杂志,2011,31(7):833-836.
[17] 张丽,谭海波,孙涛,等.神经病理性疼痛大鼠海马组织中NF-κB mRNA、iNOSmRNA、nNOSmRNA表达及意义[J].山东医药,2011,51(27):1-3.
[18] 刘思兰,杨建平,王丽娜,等.TLR4/NF-κB信号转导通路在大鼠骨癌痛形成及维持中的作用[J].中华麻醉学杂志,2013,33(9):1106-1109.
[19] 郑小兰,陈陵,徐国海,等.p38MAPK信号通路在鞘内注射利多卡因诱发糖尿病神经病变大鼠脊髓神经元凋亡中的作用[J].临床麻醉学杂志,2015,31(3):270-273.
[20] 吴顺龙,李亚军,胡瑶瑶,等.沉默NF-κB p65基因可抑制鼻咽癌CNE-2干细胞的增殖和迁移并促进凋亡[J].肿瘤,2016,36(2):158-165.
[21] LIU Y,GAO M,MA M M,et al.Endophilin A2 protects H2O2-induced apoptosis by blockade of Bax translocation in rat basilar artery smooth muscle cells[J].Journal of Molecular Cellular Cardiology,2016,92:122-133.
[22] SOLLBERGER G,STRITTMATTER G E,GROSSI S,et al.Caspase-1 activity is required for UVB-induced apoptosis of human keratinocytes[J].JournalofInvestigative Dermatology,2015,135(5):1395-1404.
[23] 王娇娇,王丽娜,叶丹丹,等.NLRP3/Caspase-1炎性体通路在大鼠根尖周炎中表达的研究[J].口腔医学研究,2016(6):549-553.
(童颖丹 编辑)
Role of NF-kappa B in Dexmedetomidine-induced inhibition of Lidocaine neurotoxicity*
Si-ping Qin1,Zeng-hua Zhou2,Zong-bin Jiang2,Ai-min Zhang2,Rui-lin He2
(1.Department of Anesthesiology,Baise People's Hospital,Baise,Guangxi 533000,China;2.Department of Pain Management,the Second Affiliated Hospital,Guangxi Medical University,Nanning,Guangxi 530007,China)
R965
A
10.3969/j.issn.1005-8982.2017.23.001
1005-8982(2017)23-0001-06
2017-04-28
广西自然科学基金(No:2013GXNSFAA019137)
周增华,E-mail:zhou123@hotmail.com
