虾肝肠胞虫Taqman荧光PCR方法的建立与应用
2017-10-12谢艳辉陈进会李家侨斯泽恩
张 娜,谢艳辉,陈进会,李家侨,斯泽恩,黄 磊
(1. 湛江出入境检验检疫局,广东湛江 524000;2. 东莞出入境检验检疫局,广东东莞 441900)
虾肝肠胞虫Taqman荧光PCR方法的建立与应用
张 娜1,谢艳辉1,陈进会2,李家侨1,斯泽恩1,黄 磊1
(1. 湛江出入境检验检疫局,广东湛江 524000;2. 东莞出入境检验检疫局,广东东莞 441900)
为给虾肝肠胞虫(EHP)的监测和控制工作提供特异、灵敏的快速检测方法,针对EHP 18S相关保守序列设计1对特异性引物,优化并建立EHP的Taqman荧光PCR检测方法,同时验证该方法的重复性和敏感性。结果显示:体系扩增的最佳退火温度为60 ℃,构建好的质粒标准品标准曲线斜率为-3.195,R2为0.991;扩增产物阈值循环数(Ct)与标准模板起始量(X)的关系曲线为-3.195×Log(X)+36.923,扩增效率为105.59。使用所构建方法检测湛江市EHP流行情况,同时对样品进行白斑综合症病毒(WSSV)、传染性皮下和造血器官坏死病毒(IHHNV)、桃拉综合征病毒(TSV)、早期死亡综合症(AHPND)病毒检测。结果显示:样品的WSSV、IHHNV、TSV检测均为阴性;AHPND检出阳性率为10%,EHP为30%,其中1份样品的EHP和AHPND检测同为阳性。本研究建立的EHP荧光PCR方法具有特异、灵敏等优点。该方法及其临床应用数据可为EHP的防控提供技术参考。
虾肝肠胞虫;南美白对虾;Taqman荧光PCR
Abstract:To provide specific,sensitive and rapid detection methods for the monitoring and control of Enterocytozoon hepatopenaei(EHP),Taqman fluorescent PCR method to detect EHP of Shrimp microsporidian was developed,a pair of specific primers was designed according to the conserved sequences of EHP 18S published in Genbank,its repeatability and sensitivity were detected in this study. The results showed that the optimum annealing temperature was 60 ℃,the standard cycles of amplification threshold(Ct)and the logarithmic of the initial template quantity[log(Sq)] conformed to Ct=-3.195×Log(X)+36.923,of which the coefficient of association R2was 0.991,the slope was -3.195,the amplification efficiency was 105.59. The results showed that the method had nice property and high sensitivity. By examing the growth of the 20 vannamei samples collected from Zhanjiang area with the method of this experiment,the samples were also examined for WSSV,IHHNV,TSV and AHPND,test results showed that WSSV,IHHNV and TSV had incidence of 0,AHPND had incidence of 10%,EHP had incidence of 30%,and one shrimp sample showed co-infection of AHPND and EHP. In conclusion,a highly specific,sensitive method was developed,which could be a useful tool in the prevention and control of Shrimp microsporidian E.hepatopenaei.
Key words:Enterocytozoon hepatopenaei;Shrimp microsporidian;Taqman fluorescent PCR method
随着南美白对虾养殖规模的不断扩大,疫病成为对虾养殖业发展的瓶颈之一。虾急性肝胰腺坏死/虾早死综合症(AHPND/EMS)[1]、虾肝肠胞虫病[2]等新发疫病的发生,更加重了养殖企业的风险和负担,使得我国对虾养殖成功率逐年下降,严重影响了对虾进出口贸易和对虾养殖产业的发展。据湛江出入境检验检疫局的数据统计,近几年湛江市对虾出口不断下滑,2015年出口对虾14.95万吨,同比减少16.28%。
虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)是近几年新发现的寄生于对虾肝胰腺组织的新病原,2009年,在泰国的斑节对虾中首次被分离和命名[2-3]。尽管EHP不会引起对虾很高的死亡率,也不会出现明显症状,但可使对虾生长缓慢,当发生混合感染时,会加重对虾疫情,增加致死率[4]。目前,EHP的传播越来越广泛。有信息表明,中国、印度尼西亚、马来西亚、越南、印度和泰国的对虾中都有EHP流行[5]。因此,对其应引起足够重视,并做好监测和控制工作。
本研究设计建立了EHP Taqman探针荧光PCR检测方法,同时用该方法对湛江市EHP流行情况进行了调查;通过临床应用证明,该方法具备较好的特异性、灵敏性,可为EHP的快速检测和监测提供参考。
1 材料与方法
1.1 材料
1.1.1试验材料。采自湛江市的南美白对虾样品,经PCR检测并测序后确认为EHP感染,由本实验室保存;ABI 核酸提取试剂盒、Premix Ex Taq(Probe qPCR)、胶回收试剂盒、PMD18-T克隆载体、质粒回收试剂盒,购自大连宝生物(TaKaRa)工程有限公司;PCR管、吸嘴等,均为Axygen产品;大肠杆菌感受态细胞,由本实验室保存。
1.1.2主要仪器设备。荧光定量PCR仪(美国ABI stepone plus);PCR扩增仪(美国ABI 公司);凝胶成像仪(德国Biometra公司);高速冷冻离心机(Eppendorf centrifuge 5417R);电泳仪(DYY-8C,北京市六一仪器厂)。
1.2 方法
1.2.1引物合成。选取EHP 18S序列中保守片段(GenBank:KX932044), 应 用 Primer 5.0和Primer Express 2.0软件分别设计引物和探针。引物 序 列 为 F:5´-tggtataggtgggcaaagaatga-3´;R:5´-aaggacgaaggctagagtatcgaa-3´;探针序列为 F:5´-FAM-caacggaggcgaaagcgatgctct-BHQ1。 引 物 和探针均由大连宝生物(TaKaRa)工程有限公司合成,预计引物扩增片断为111 bp。
1.2.2引物普通PCR扩增。用ABI核酸提取试剂盒提取的肝胰腺阳性组织DNA为模板,用设计引物进行PCR扩增。扩增体系为:10×PCR buffer(Mg2+Plus)2.5 μL,上下游引物(10 μmol/L)各1 μL,dNTP(10 mM)2 μL,TaqDNA 聚合酶 0.5 μL,提抽物5 μL,加水补至25 μL。按照以下程序进行扩增:94 ℃ 5 min;35次循环(94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s),72 ℃ 5 min;4 ℃ 保温。
1.2.3模板标准品的制备及条件优化。将10 μL PCR扩增产物,经琼脂糖电泳,切下目的条带,按照胶回收试剂盒说明书进行回收;将回收的扩增片断与pMD18-T载体连接并转化受体菌E.coli DH5a,涂布于含氨苄青霉素的LB固体培养基平板上,37 ℃倒置培养12~16 h;随机挑取白色单菌落,接种于含氨苄青霉素的LB液体培养基中,37℃振荡培养8 h;用质粒提取试剂盒提取有重组目的片断的质粒;对质粒经PCR鉴定阳性后,将目的条带送上海英骏生物技术有限公司测序;对测序结果经DNAstar软件分析后,与扩增基因的片断序列进行核苷酸序列同源性分析。用核酸分析仪测定提取的重组质粒DNA浓度。经测定,质粒浓度为 123 μg/mL,质粒拷贝数为 4×1010copies/μL。将提取好的重组质粒作为本实验定量标准品原液,-80 ℃保存。实时荧光定量PCR反应扩增体系参照Premix Ex Taq(Probe qPCR)试剂说明书进行,反应体系为25 μL(表1)。反应条件:95 ℃ 30 s;然后进行44次循环(95 ℃ 5 s,退火温度 30 s)。退火温度分别设定为56 ℃、58 ℃、60 ℃、62 ℃。
1.2.4标准曲线绘制。将构建好的质粒标准品进行梯度稀释,得到 4×101~4×108copies/μL 共 8 个梯度浓度;利用上述优化的PCR反应条件,建立质粒标准品拷贝数与Ct值对应的标准曲线,判断标准曲线扩增质量。
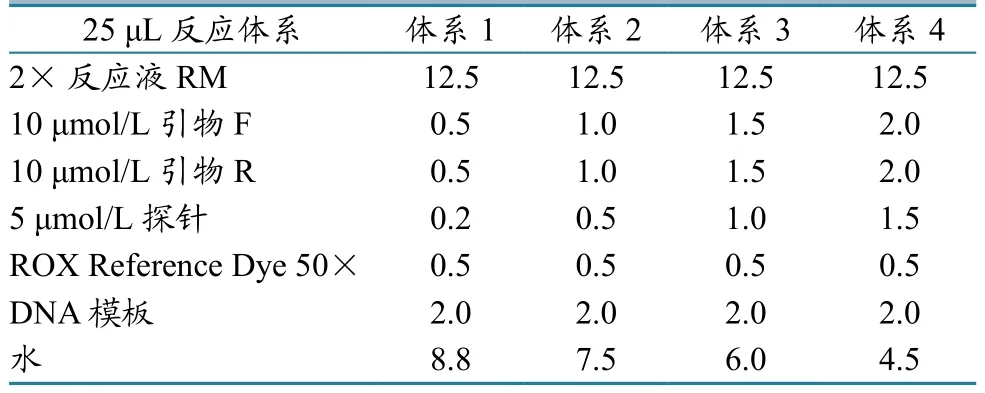
表1 反应体系构建 (单位:μL)
1.2.5稳定性试验。用阴性样品12份,37 ℃反应30 min,模拟常温下体系的稳定性,检测体系是否出现非特异性扩增。采用已知阳性样品4份和阴性样品10份,每周试验1次,检测其的稳定性。
1.2.6特异性试验。以AHPND、IHHNV、WSSV、EHP的DNA为模板,分别用建立的荧光PCR方法进行检测,对每个模板同时设2个平行样。
1.2.7重复性试验。由2名检验员进行加样,使用1个阳性质粒以及14个样本进行重复试验,比较两次结果,判断方法重复性的好坏。
1.2.8敏感性试验。对已知EHP阳性核酸(测定核酸浓度为6.5×108copies/μg)进行稀释,共得到6.5×106~6.5×101copies/μg 6个梯度;分别用梯度浓度核酸为模板,进行荧光PCR扩增。用稀释好的模板、Somjintana[6]设计的方法进行常规PCR扩增。引物F:5´-ccggagagggagcctgaga-3´;引物R:5´-gacgggcggtgtgtacaa a-3´。反应程序为:94 ℃ 4 min,然后进行40次循环(94 ℃ 30 s,55 ℃ 30 s),72 ℃ 5 min。
1.2.9临床实际应用。从湛江市随机抽取10家对虾养殖场的20份对虾样品,用建立的EHP荧光方法进行检测,同时对样品进行WSSV、IHHNV、TSV、AHPND 4种病原检测,用PCR方法对EHP进行确认(方法见1.2.8)。
2 结果
2.1 标准曲线的绘制及条件优化
对含目标基因的重组质粒进行荧光PCR扩增,对比扩增效率、扩增曲线、溶解曲线等指标。当体系为 25 μL 时,确定 10 μmol/L 的引物 F/R 各为 1.0 μL;5 μmol/L 探针 0.5 μL 为最佳引物浓度;扩增退火温度为60 ℃最佳。将构建好的质粒标准品进行10倍梯度稀释,用 4×101~4×108copies/μL共8个梯度浓度得到标准曲线斜率为-3.681,R2为0.998 8,扩增产物阈值循环数(Ct)与标准模板起始量(X)关系曲线为-3.681×Log(X)+44.114,扩增效率为105.59,证明所构建的荧光PCR反应体系对标准品的扩增质量较好。阳性质粒相应浓度测试扩增曲线显示,模板浓度梯度明显,曲线增量正常,扩增Ct值合理,与标准曲线结果相对应。扩增只出现1个波峰说明扩增产物是均一的,无非特异性扩增(图1)。
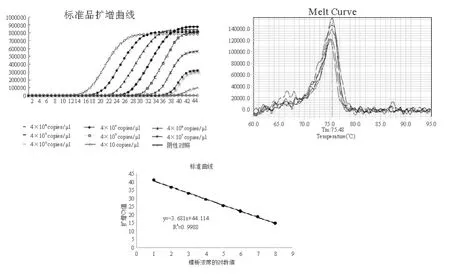
图1 EHP荧光PCR阳性标准品扩增、标准曲线、溶解曲线试验
2.2 稳定性试验
在温育过程中,如果引物探针与体系不稳定,就容易出现非特异性扩增,导致结果出现假阳性。用阴性样品12份,37 ℃反应30 min,模拟常温反应,结果显示无非特异性扩增结果,无假阳性。用已知阳性样品4份和阴性样品10份,每周试验1次,结果显示阳性扩增曲线模板浓度梯度明显,曲线增量正常,每次扩增的Ct值相同(图2)。
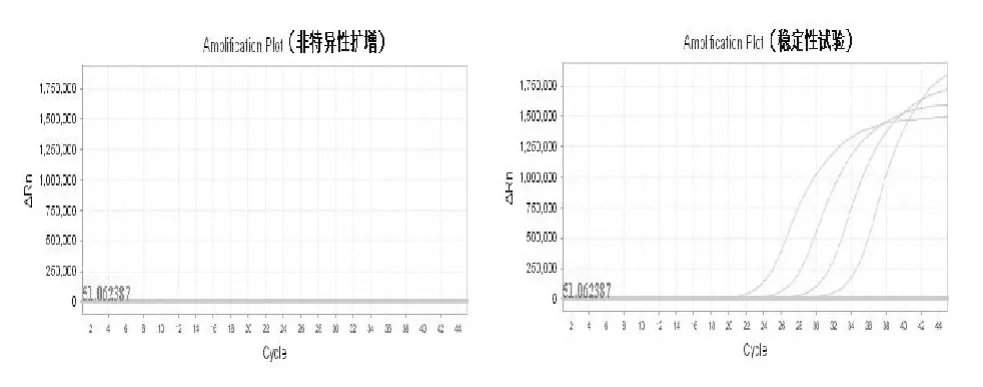
图2 EHP荧光PCR方法的非特异性扩增和稳定性试验
2.3 特异性试验
以建立的方法分别以AHPND、IHHNV、WSSV、EHP的DNA为模板进行检测,各设2个平行样。结果显示,只有EHP具有强烈的荧光信号,其他检测样品均为阴性,没有荧光吸收信号(图3)。

图3 EHP荧光PCR方法特异性试验
2.4 重复性试验
2名检验员同时加样进行重复试验,结果显示1个阳性质粒和4个阳性样品都有明显扩增,阴性样品无扩增,平行实验的结果与样本一致(图4)。

图4 EHP荧光PCR方法的重复性试验
2.4 敏感性试验
用已知浓度核酸为模板进行10倍梯度稀释,共得到 6.5×106~6.5×101copies/μg 6 个梯度,结果显示在模板浓度为6.5×102copies/μL时,仍有荧光信号(图5)。普通PCR扩增条带为942 bp,在模板浓度为6.5×102copies/μL时,扩增条带用肉眼,难以看到。结果说明所建立荧光PCR方法的检测灵敏度较普通PCR方法至少高出1个数量级(图6)。
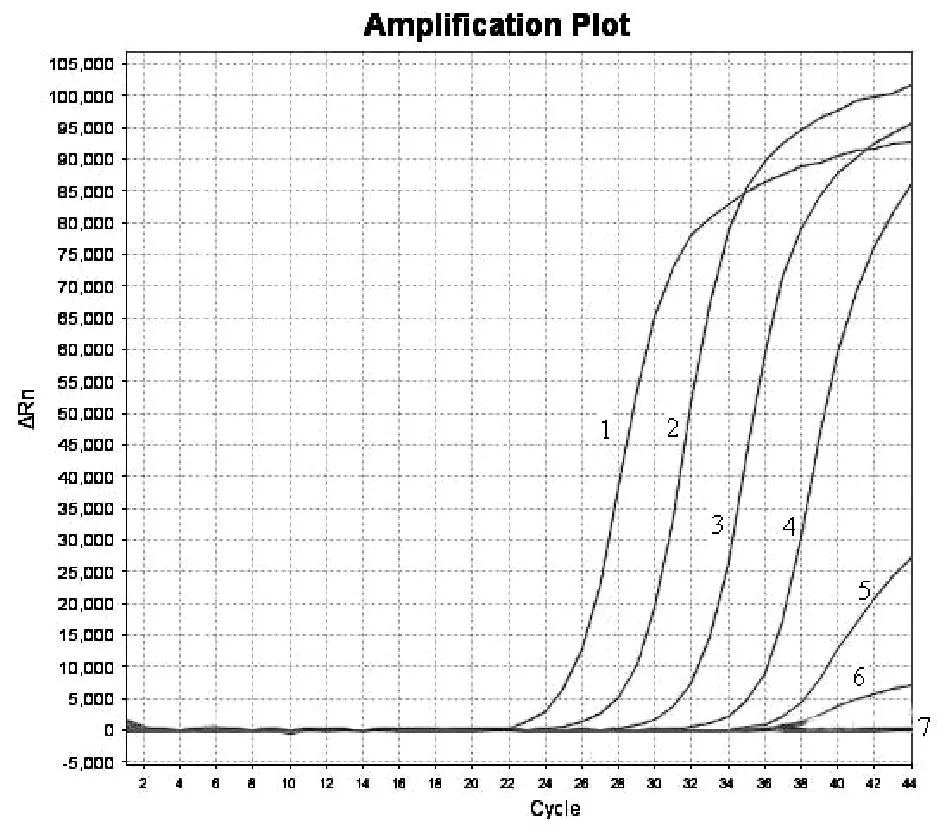
图5 EHP荧光PCR方法的敏感性试验
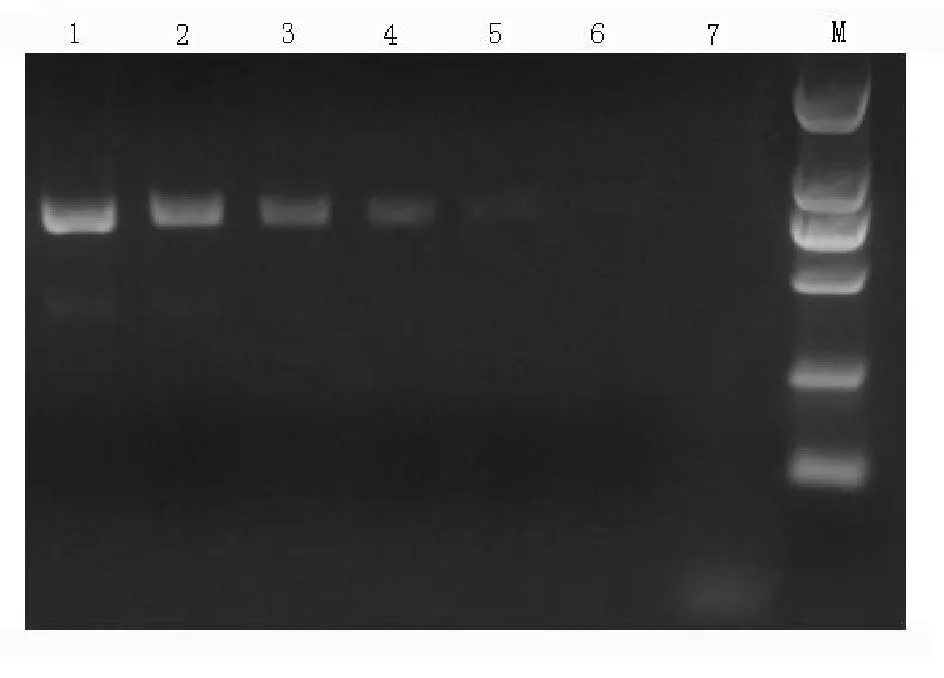
图6 普通PCR方法敏感性试验
2.5 临床应用
从湛江市10家对虾养殖场随机抽取20份对虾样品,用本实验建立的方法进行EHP检测,同时进行WSSV、IHHNV、TSV、AHPND 4种病原检测。检测结果显示:WSSV、IHHNV、TSV检出率均为0;AHPND阳性样品2份,检出率为10%;EHP阳性样品6份,检出率为30%。有1份样品的EHP和AHPND检测结果均为阳性,说明养殖场中的对虾存在EHP和AHPND的混合感染。EHP荧光PCR方法同普通PCR方法的检测结果一致(图7、图8、图9)。
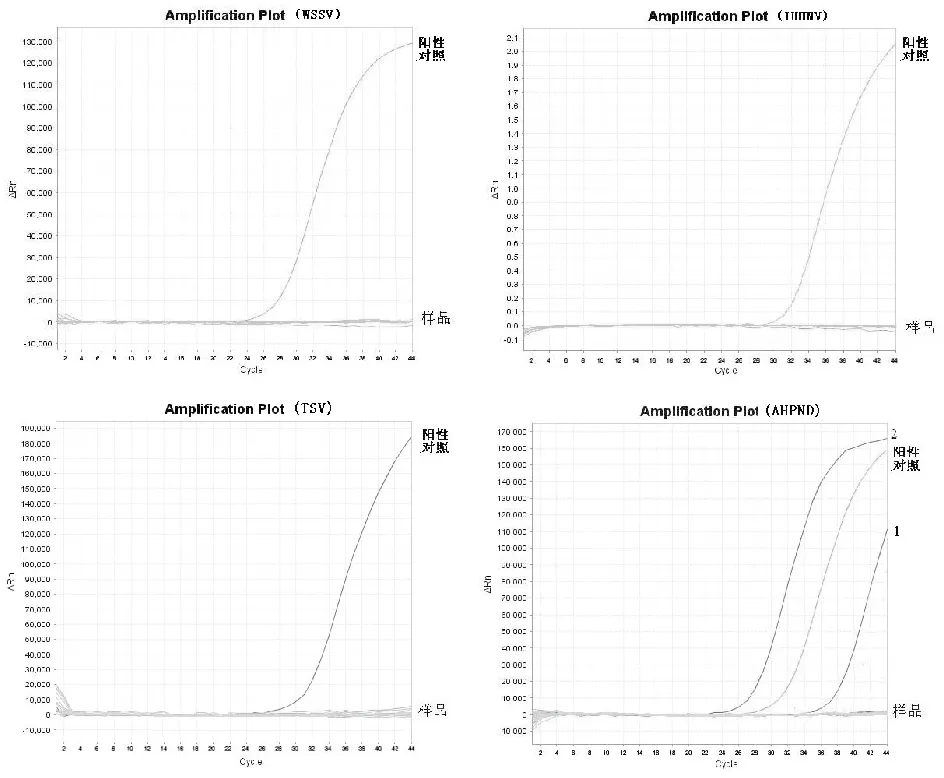
图7 样品WSSV、IHHNV、TSV、AHPND荧光PCR方法检测
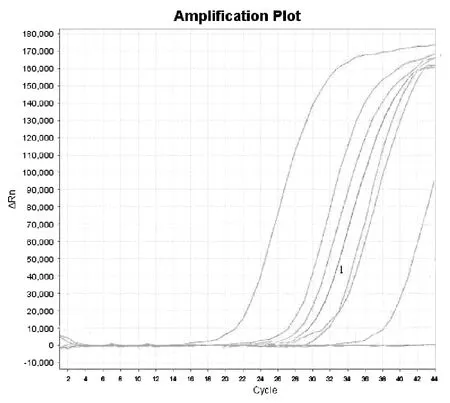
图8 样品EHP荧光PCR方法检测

图9 样品的普通PCR方法检测结果(与荧光PCR方法检测结果一致)
3 讨论
微孢子虫广泛寄生于无脊椎动物和脊椎动物体内,早期多寄生于野生对虾,如褐美对虾、白滨对虾等。常见的对虾微孢子虫病原有3种,分别为八孢虫、匹里虫、微粒子虫[7]。EHP是2009 年在泰国的斑节对虾中首次被分离和命名[2],只寄生于对虾肝胰腺组织。EHP 导致受感染对虾生长阻滞,个体大小差异明显,且会导致细菌继发感染[3]。在发现EHP之前,微孢子虫主要寄生在对虾肌肉和结缔组织中[8],引起的疾病命名为“棉花虾病”[9]、“牛奶虾病”[10]或“白背病”[11]。
目前,相关EHP检测方法的研究包括SYBR Green实时荧光PCR方法、LAMP检测方法、普通PCR方法以及巢式PCR方法等[12-16]。本研究针对EHP 18S相关保守序列,利用基因克隆方法构建重组质粒构建标准品,同时检测所建立方法的稳定性、重复性和敏感性。结果显示,不同检验员进行的样品重复性检测结果一致,方法重复性较好。敏感性结果显示,所建方法在模板浓度为6.5×102copies/μL DNA时,仍有较强荧光信号,较普通PCR方法检测灵敏度至少高出1个数量级。
从湛江市10家养殖场随机抽取20份15~20日龄的南美白对虾样品,用本研究建立的EHP荧光PCR方法进行检测,发现有6份阳性。这些样品的WSSV、IHHNV、TSV检测结果均为阴性;2个样品的AHPND为阳性,其中1份样品的EHP和AHPND均为阳性,说明存在2种疫病的混合感染。
2009年,我国首次暴发早期死亡综合症/急性肝胰腺坏死病(AHPND/EMS)[17]。该病首先从泰国快速蔓延到亚洲许多国家,并席卷了全球,给对虾养殖业带来了巨大影响[18],已经成为当前南美白对虾产业发展的最大障碍。AHPDA/EMS引起的高致死率吸引了人们更多的注意力,却使人们忽视了EHP的影响。从湛江市的EHP流行情况来看,随机抽取的虾样品EHP阳性率已达30%,但其临床症状不明显,没有引起虾农的注意。EHP是通过亲虾垂直传播,还是通过购买的虾苗水平传播,还有待研究。对对虾所有生长周期进行EHP监测,分析EHP来源和流行特点,将是下一步的工作重点。
[1] NACA-FAO. Quarterly Aquatic Animal Disease Report(Asia and Pacific Region)[R]. Bangkok:NACA,2011.
[2] CHAYABURAKUL K,NASH G,PRATANPIPAT P,et al.Multiple pathogens found in growth-retarded black tiger shrimp Penaeus monodon cultivated in Thailand[J]. Dis. Aquat. Org.2004,60(2):89-96.
[3] TOURTIP S,WONGTRIPOP S,STENTIFORD G D,et al.Enterocytozoon hepatopenaei sp.nov.(Microsporida:Enterocytozoonidae),a parasite of the black tiger shrimp Penaeus monodon(Decapoda:Penaeidae):Fine structure and phylogenetic relationships[J]. J Invert Pathol,2009,102(1):21-29.
[4] AMORNRAT T,JIRAPORN S,SAISUNEE C,et al.The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces synodrome in whiteleg shrimp Penaeus(Litopenaeus)vannamei[J]. BMC veterinary research,2013,9(1):139.
[5] FLEGEL T W. Historic emergence,impact and current status of shrimp pathogens in Asia[J]. Journal of invertebrate pathology,2012,110(2):166-173.
[6] SOMJINTANA T,SOMJAI W,GRANT D S,et al.Enterocytozoon hepatopenaei sp. nov.(Microsporida:Enterocytozoonidae),a parasite of the black tiger shrimp Penaeus monodon(Decapoda:Penaeidae):Fine structure and phylogenetic relationships[J]. Journal of invertebrate pathology,2009,102(1):21-29.
[7] LIGHTNER D V. A review of the diseases of cultured penaeid shrimps and prawns with emphasis on recent discoveries and developments[M]. Tigbauan:Aquaculture Department,Southeast Asian Fisheries Development Center,1985:79-103.
[8] KAMAISHI T,HASHIMOTO T,NAKAMURA Y,et al.Complete nucleotide sequences of the genes encoding translation elongation factors 1 and 2 from a microsporidian parasite,Glugea plecoglossi:implications for the deepest branching of eukaryotes[J]. Journal of biochemistry,1996,120(6):1095-1103.
[9] WEISS L M,VOSSBRINCK C R. Microsporidiosis:molecular and diagnostic aspects[J]. Advances in parasitology,1998,40(1):351-395.
[10] RAMASAMY P,JAYAKUMAR R,BRENNAN G P.Muscle degeneration associated with cotton shrimp disease of Penaeus indicus[J]. Journal of fish diseases,2000,23(1):77-81.
[11] PRASERTSRI S,LIMSUWAN C,CHUCHIRD N.The effects of microsporidian(Thelohania)infection on the growth and histopathological changes in pond-reared Pacific white shrimp(Litopenaeus vannamei)[J]. Kasetsart journalnatural science,2009,43(4):680-688.
[12] BURGHER-MACLELLAN K L,WILLIAMS G R,SHUTLER D,et al. Optimization of duplex real-time PCR with melting curve analysis for detecting the microsporidian Parasites Nosemaapis and Nosema ceranae in Apis mellifera[J].Can Entomol,2010,142(3):271-283.
[13] DURAND S V,LIGHTNER D V. Quantitative real time PCR for the measurement of white spot syndrome virus in shrimp[J]. J Fish Dis,2002,25(7):381-389.
[14] LOM J,DYKOA I. Ultrastructure of Nucleospora secunda n.sp.(Microsporidia),parasite of enterocytes of Nothobranchius rubripinnis[J]. Eur J Protistol,2002,38(1):19-27.
[15] PHELPS N B,GOODWIN A E. Validation of a quantitative PCR diagnostic method for detection of the microsporidian Ovipleistophora ovariae in the cyprinid fish Notemigonus crysoleucas[J]. Dis Aquat Organ,2007,76(3):215-221.
[16] SUEBSING R,PROMBUN P,SRISALA J,et al. Loopmediated isothermal amplification combined with colorimetric nanogold for tetection of the microsporidian Enterocytozoon hepatopenaei in penaeid shrimp[J]. J Appl Microbiol,2013,114(5):1254-1263.
[17] LIGHTNER D V,REDMAN R M,PANTOJA C R,et al.Early mortality syndrome affects shrimp in Asia[J]. Global aquaculture advocate,2012,15:40.
[18] TRAN L,NUNAN L M,RENMAN R M,et al.Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp[J]. Dis Aquat Organ,2013,105(1):45-55.
(责任编辑:朱迪国)
Establishment and Application of Taqman Fluorescent PCR Method for Detection of Enterocytozoon hepatopenaei
Zhang Na1,Xie Yanhui1,Chen Jinhui2,Li Jiaqiao1,Si Ze´en1,Huang Lei1
(1. Zhanjiang Entry-exit Inspection and Quarantine Bureau,Zhanjiang,Guangdong 524000;2. Dongguan Entry-exit Inspection and Quarantine Bureau,Dongguan,Guangdong 441900)
S945.4
A
1005-944X(2017)10-0098-06
10.3969/j.issn.1005-944X.2017.10.026
广东出入境检验检疫局科技计划项目(2015GDK04、2016GDK51、2017GDK04)
