PRV SD株gE基因主要抗原区域原核表达及间接ELISA方法的建立
2017-10-12董雅琴范根成吴发兴李晓成
郑 辉,张 青,邹 敏,董雅琴,刘 爽,范根成,吴发兴,李晓成
(1. 青岛易邦生物工程有限公司,山东青岛 266114;2. 中国动物卫生与流行病学中心,山东青岛 266032)
PRV SD株gE基因主要抗原区域原核表达及间接ELISA方法的建立
郑 辉1,张 青1,邹 敏1,董雅琴2,刘 爽2,范根成1,吴发兴2,李晓成2
(1. 青岛易邦生物工程有限公司,山东青岛 266114;2. 中国动物卫生与流行病学中心,山东青岛 266032)
参考猪伪狂犬病病毒(PRV)SD株gE基因序列,设计1对引物,通过PCR方法扩增一段包含gE主要抗原表位编码区的618 bp片段,将其用BamHⅠ和XhoL I双酶切后,插入到原核表达载体pET-32a(+)中,转化大肠杆菌BL21(DE3),进行表达、SDS-PAGE电泳、Western-blot检测和纯化;利用表达的PRV SD gE蛋白进行gE-ELISA鉴别检测方法研究。结果发现:gE重组蛋白得到了高效表达,融合蛋白的分子量约为42 ku;表达产物存在于上清液中,表达量可达菌体总蛋白的30%以上,并且能被PRV抗体所识别。将纯化后的gE蛋白作为抗原,以辣根过氧化物酶(HRP)标记的兔抗猪IgG为二抗,建立检测PRV抗体的间接ELISA方法。结果显示:确定的抗原最佳包被浓度为36 µg/mL,最佳包被时间为37 ℃、1 h并4 ℃过夜,待检血清(1:50稀释)37 ℃作用1 h,二抗(1:3 000)37 ℃作用1 h。重复性试验、交叉试验证明该方法重复性好、特异性强、灵敏度高。用gE-ELISA和IDEXX gE-ELISA同时对采集的92份猪血清进行平行检测,发现该方法的特异性为85.71%,敏感性为90.63%,二者符合率为89.13%。该方法为我国猪伪狂犬病的鉴别监测提供了一种可供选择的技术手段。
猪伪狂犬病病毒;gE基因;原核表达;间接ELISA;鉴别
Abstract:A pair of primers were designed according to the sequence of the isolate PRV SD. A segment containing major episode coding area of gE gene was amplified by PCR method,which was 618 bp in length. The PCR product was inserted into the expression vector pET-32a(+)after being cleaved by BamHⅠand XhoL I. And then the recombinant plasmid was formed and transformed into BL21(DE3). A recombination protein was expressed,identified by SDS-PAGE and Western-blot,and then purified. Based on that,differentiation ELISA for PRV gE antibody was studied. The results showed that a recombination protein of 42ku was expressed efficiently in forms of soluble,with expression level over 30%of total bacteria protein. The protein could be identified by PRV specific antibody. An indirect ELISA for PRV antibodies was established with the purified recombination protein as the coating antigen and HRP-conjugated rabbit anti-porcine IgG as the secondary antibody. The optimal reaction condition was that the antigen was coated with concentration of 36 µg/ml under 37 ℃ for 1 hour and then under 4℃ overnight;the samples were 1:50 diluted and incubated under 37 ℃ for 1 hour,the secondary antibody was 1:3 000 diluted and incubated under 37 ℃for 1 hour. All tests of the method indicated that ithad a good repeatability,specificity and sensitivity. 92 porcine serums were tested by the gE-ELISA and IDEXX gEELISA,which showed the new method had a specificity of 85.71%,sensitivity of 90.63% and coincidence of 89.3%.This study provided technical support for PRV differentiation test in our country.
Key words:Pseudorabies virus;gE gene;prokaryotic expression;indirect-ELISA;discrimination
猪伪狂犬病(PR)是由伪狂犬病病毒(PRV)感染猪引起的一种急性传染病,可导致妊娠母猪繁殖障碍(流产,产死胎、弱仔),公猪不育,新生仔猪出现神经症状、腹泻并大量死亡,育肥猪则表现呼吸困难、生长停滞等[1]。猪是该病毒的天然宿主和贮存者[2]。目前,除美国及欧洲部分国家宣布消灭此病外,该病仍呈世界性流行,且危害严重[3]。2011年以来,我国许多省份的猪场陆续出现仔猪“腹泻”并大量死亡。经流行病学调查、采样检测、病原分离鉴定等,确认PRV是引起该波疫情的主要病原之一[4-5]。
PRV基因为双股线状DNA,全长约150 kb,编码70~100种病毒蛋白[6]。现已发现PRV至少有11种糖蛋白。gE糖蛋白是PRV的主要毒力因子之一。gE基因的缺失不但可以使PRV毒力减弱,而且还能区分疫苗株和野毒株,因此可作为PRV的主要诊断抗原[7-8]。本研究在新分离的流行毒株基础上进行了gE糖蛋白主要抗原区域的基因扩增,采用成熟的原核表达系统对其进行了体外表达,获得了具有中和活性的蛋白,并进行了间接ELISA抗体检测方法的研究,以期为该病的鉴别检测,乃至控制净化提供技术和物质依据。
1 材料和方法
1.1 材料
1.1.1病毒、细胞系。PRV SD株由青岛易邦生物工程有限公司技术中心分离、鉴定并保存;BHK-21细胞由本室提供,按常规方法培养,外源检测纯净。
1.1.2参考血清及待检血清样品。猪口蹄疫阳性血清、猪瘟阳性血清、猪繁殖与呼吸综合征阳性血清、猪圆环病毒2型阳性血清、猪细小病毒阳性血清、猪乙型脑炎阳性血清、20份PRV gE阴性血清(经IDEXX gE-ELISA抗体检测试剂盒检测)、8份PRV gE阳性血清(经IDEXX gE-ELISA抗体检测试剂盒检测)、92份PRV待检血清样品,均由青岛易邦生物工程有限公司技术中心提供;PRV gE阳性血清、gE阴性血清,均购自中国兽医药品监察所。
1.1.4表达引物。依据PRV SD株的gE基因序列设计1对表达引物。其包含gE的5个主要抗原表位编码区,上下游引物序列为:ATGGATCCGAGGTCTGGGACCTCT(下划线表示BamHI酶切位点);ACCTCGAGCATCAGGTCGAACGTG(下划线表示XholI酶切位点)。预期扩增片段大小为618 bp。
1.1.3主要试剂。PMD18-T载体、T4 DNA连接酶、EX Taq HS、2×GC Buffer I、DL2000 Marker、DH5α感受态细胞、低分子量蛋白Marker、限制性内切酶BamHⅠ和XhoL I,均购自TaKaRa;pET-32a(+)载体、BL21(DE3)感受态细胞以及表达蛋白纯化试剂盒,均购自Novagen;DNAzol Regent,购自Intrivigen 公司;辣根过氧化物酶标记的兔抗猪二抗,购自Promega 公司;DNA胶回收试剂盒,购自天根生化公司;TMB、IPTG(异丙基-β-D硫代半乳糖苷),购自Sigma;BSA、酶标板,购自上海生工;商品化gE-ELISA抗体检测试剂盒,购自IDEXX公司。
1.2 方法
1.2.1PRV SD株gE主要抗原区域的扩增
1.2.1.1病毒增殖及总DNA提取。将病毒接种于长满BHK-21细胞的细胞瓶中,待80%细胞出现典型细胞病变时,回收全部培养物,按照 DNAzol操作说明提取DNA,-20 ℃保存备用。
1.2.1.2目的基因扩增、回收、克隆及鉴定。50 µL PCR 扩增体系,包括 2×GC Buffer 25 µL、dNTPs 4 µL、上下游引物各 1 µL、PRV SD模板 5 µL、EX Taq HS 1 µL,最后用灭菌水补至50 µL。反应条件为:95 ℃预变性5 min,然后进行95 ℃变性50 s、64 ℃退火50 s、72 ℃延伸1 min的循环扩增,共32个循环,反应结束后72 ℃延伸10 min。取PCR产物20 µL,将其经1%琼脂糖凝胶电泳后,用柱式DNA胶回收试剂盒回收目的片段;将纯化的基因片段连接到PMD18-T载体中,转化DH5α感受态细胞,涂板。挑选白斑,接种于LB液体(Amp+)培养基中培养(37 ℃过夜);取菌液,提取质粒并鉴定,筛选阳性质粒。
1.2.2PRV SD株gE主要抗原区域的表达及纯化
1.2.2.1原核表达载体的构建。按常规方法取PMD18-T质粒与pET-32a(+)用BamHⅠ和XhoL I双酶切阳性质粒,回收618 bp的目的片段,将其与经BamHⅠ和XhoL I双酶切的表达载体pET-32a连接,转化BL21大肠杆菌感受态细胞,涂布于LB(Amp+)平板培养基上,37 ℃培养过夜。挑取菌落进行培养,经PCR及双酶切鉴定后,筛选出含目的片段的重组质粒并命名为pET-gE,并交上海生物工程有限公司测序。
1.2.2.2诱导表达。将pET-gE、pET-32a菌液分别以1:1 000的体积比接种于含100 mg/L Amp的LB液体培养基中,32 ℃振荡培养至OD600=0.6;用0.025 mmol/L的IPTG进行诱导表达,分别于1 h、2 h、3 h、4 h和5 h取样,离心收集菌体,重悬于1/10体积的1×binding buffer,冰浴;用超声波处理至溶液澄清,1 0000 r/min离心15 min,分别收集上清和沉淀进行SDS-PAGE电泳。
1.2.2.3表达产物的SDS-PAGE电泳及Western blotting分析。分别于诱导前和诱导后收集上述诱导表达的菌体、空载体;经PBS洗涤后,加入2×SDS裂解缓冲液,煮沸5 min;按常规方法用12%的聚丙烯酰胺凝胶进行SDS-PAGE电泳。用电转印法转印NC膜,然后进行Western-blot免疫印迹检测。将一半NC膜用于丽春红染色,另一半NC膜经TBST洗脱后转移至BSA中封闭。洗膜后加入1:50稀释的PRV阳性血清,室温下振荡1.5~2 h;洗涤后加入1:20 000稀释的辣根过氧化物酶标记的兔抗猪IgG,室温振荡1.5~2 h后,置于DAB底物显色液中显色,待条带清晰后迅速用蒸馏水终止显色反应。
1.2.2.4表达蛋白的纯化。取阳性菌株按1.2.2.3中的方法进行4 h诱导表达,离心收集菌体,重悬于1/10体积的1×binding buffer,冰浴;用超声波处理至溶液澄清,用1×binding buffer洗2次,将其溶于含6 mol/L尿素的1×binding buffer中,4 ℃搅拌过夜,16 000 r/min离心30 min;取上清液,经0.45 µmol滤膜过滤后,上His亲和层析柱纯化。收集纯化后的蛋白取适量,进行SDS-PAGE电泳鉴定,对其余表达产物-20 ℃保存备用。
1.2.2.5表达蛋白含量测定。将纯化抗原1:1稀释后,用紫外分光光度计测其在280 nm和260 nm下的光吸收值,计算抗原蛋白含量。
1.2.3间接ELISA检测方法的建立
1.2.3.1gE蛋白抗原最佳包被浓度和抗体最佳稀释度的确定。采用方阵试验,取96孔ELISA板,将纯化的gE重组蛋白用本公司自制的包被液自上而下依次做1:10、1:20、1:40、1:80、1:100、1:200稀释,每孔100 µL,4℃过夜后,取出用PBST洗涤3次,每次5 min。在每孔用1% BSA 200 µL,4 ℃封闭过夜,洗涤。将阴、阳性血清按1:10、1:50、1:100、1:200稀释从左向右加入(阴阳性血清按同样的稀释倍数稀释且间隔加入),每孔100 µL,37 ℃放置15 min,取出后洗涤。接着每孔加入100 µL稀释至工作液浓度的兔抗猪酶标二抗,37 ℃作用10 min,随后洗涤;继而每孔加入100 µL TMB,37 ℃显5 min,最后加入终止液终止反应,用酶标仪测定OD450值;根据OD值确定抗原和血清的最佳稀释浓度。
1.2.3.2gE-ELISA反应程序的优化。按照1.2.3.1中确定的抗原包被浓度和血清稀释度,分别改变抗原包被时间、封闭时间、酶标二抗作用时间以及底物显色时间,选择最佳反应条件。
1.2.3.3gE-ELISA方法阴阳性临界值的确定。按照以上ELISA方法,用纯化抗原进行包被,封闭后分别加入20份经IDEXX gE-ELISA抗体检测试剂盒检测为阴性的猪血清(加入血清前应先用大肠杆菌培养上清吸附血清中抗大肠杆菌抗体,下同)。对每份血清设两次重复,计算其OD平均值及标准差。阴阳性临界值=阴性样本OD平均值+3×标准方差。
1.2.3.4gE-ELISA的交叉试验。用建立的gE间接ELISA分别检测猪口蹄疫阳性血清、猪瘟阳性血清、猪繁殖与呼吸综合征阳性血清、猪圆环病毒2型阳性血清、猪细小病毒阳性血清、猪乙型脑炎阳性血清,以验证其特异性。
1.2.3.5gE-ELISA重复性试验。选取8份不同OD值的PRV gE阳性血清样品,用建立的gEELISA进行5次批内重复检测,再分别用3个不同批次包被的酶标板来验证批间重复性。
1.2.4gE-ELISA的应用及与IDEXX ELISA检测试剂盒的比较。将92份临床猪血清样品,分别用建立的gE-ELISA和IDEXX公司的同类试剂盒进行平行检测,计算该间接ELISA与国外同类试剂盒的敏感性、特异性及二者的符合率。
2 结果
2.1 目的基因片段的扩增与克隆
对PCR扩增产物进行琼脂糖凝胶电泳,可见到大小约618 bp的片段。其与预期目的基因片段的大小相符(图1)。
2.2 重组质粒PET-gE的鉴定
回收目的片段,将其与PMD18-T载体连接,转化大肠杆菌增殖后提取重组质粒;经BamHⅠ、XhoL I双酶切,再与经同样双酶切的pET-32a表达载体连接、转化、增殖,提取重组质粒进行鉴定,结果证实重组质粒PET-gE构建成功(图2)。
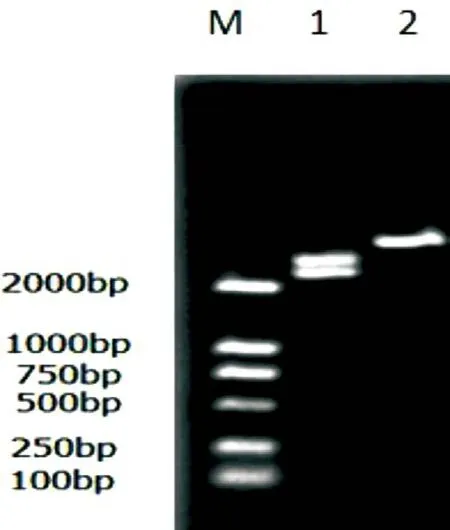
图2 重组质粒的酶切鉴定
2.3 目的蛋白的诱导表达
对PET-gE在32 ℃、0.025 mmol/L、IPTG条件下分别进行1、2、3、4、5、6 h的诱导表达。SDS-PAGE电泳结果显示,上清中均有42 ku左右的目的蛋白表达(图3)。
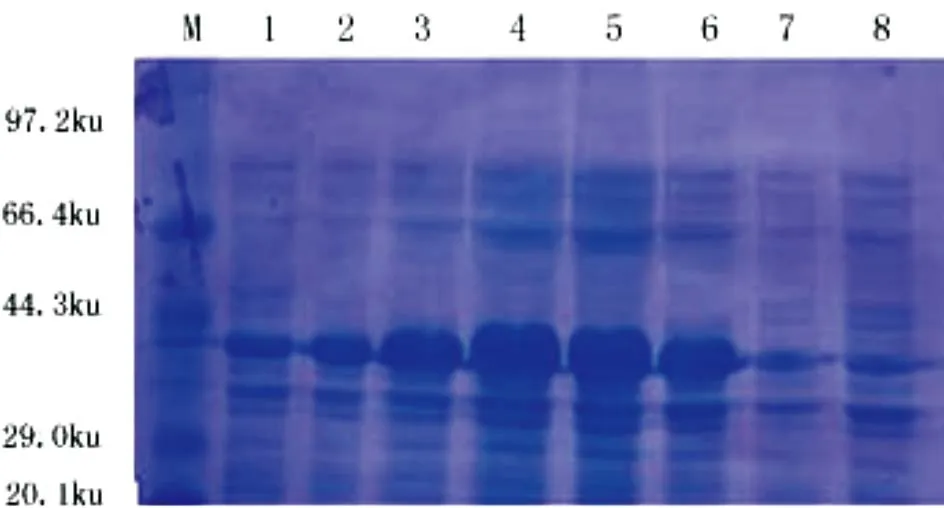
图3 表达产物SDS-PAGE 检测
2.4 Western-blott分析结果
用PRV gE阳性血清对纯化后的重组蛋白进行Western-blot 检测,发现在42 ku处出现1条清晰的特异性反应条带。该结果表明重组蛋白可以被PRV gE阳性血清识别(具有免疫学活性)(图4)。
2.5 表达产物纯化及SDS-PAGE电泳结果分析
采用His亲和层析柱对表达重组蛋白进行纯化。在SDS-PAGE电泳结果中可以清晰地看出:在分子质量约42 ku处有明显的目的蛋白条带;表达产物主要以水溶形式表达;经过洗脱收集的蛋白纯度较高(图5)。
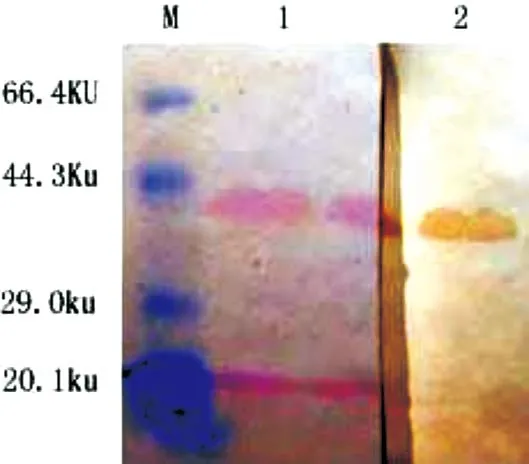
图4 表达重组蛋白的丽春红染色和Western -bloting 检测

图5 表达产物纯化SDS-PAGE 检测结果
2.6 间接ELISA检测方法的建立
2.6.1蛋白浓度测定结果。用分光光度计测定,并根据公式计算表达蛋白的浓度。蛋白质浓度=(1.45/A280-0.75/A260)×2=1.44 mg/mL。
2.6.2抗原与血清最佳稀释度的确定。由方正试验结果可见,当血清和抗原的稀释倍数较低时,他们的OD450值都维持在较高水平,随着稀释度加大,开始产生明显的梯度变化。根据阳性血清、阴性值等方面的因素,初步认为抗原1:40倍稀释,血清1:50倍稀释比较合适,在此基础上测定抗原最佳包被浓度为36 µg/mL(表1)。
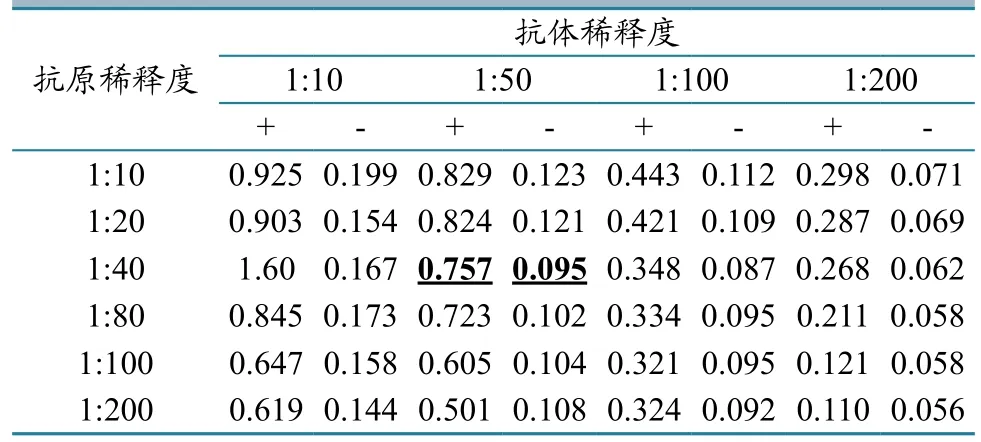
表1 抗原和血清最佳稀释度的方正试验结果
2.6.3判定标准的确定。取20份经IDEXX gEELISA抗体检测试剂盒检测为阴性的血清,按1:50稀释后进行间接ELISA,测定OD450值(表2)。以20份血清平均OD450值加3倍标准差作为阴阳性的判定临界值。经测定,20份gE抗体阴性血清的OD450平均值为0.244,标准差为0.036,则判定标准为0.244+3×0.036=0.352≈0.35。即当样品的OD450值≥0.35时,判为阳性,OD450值<0.35时,判为阴性。
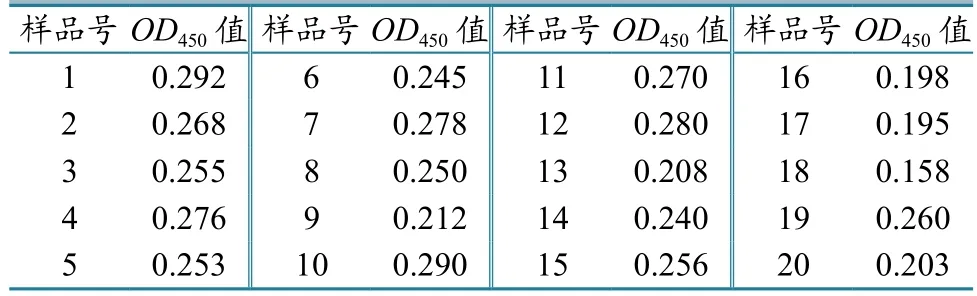
表2 20份阴性血清的OD450值
2.6.4gE-ELISA检测程序。优化过反应条件后建立的gE间接ELISA检测程序如下:以包被缓冲液(pH7.0)稀释抗原至36 µg/mL,每孔包被100 µL,4℃过夜,PBST洗板3次,每次5 min。每孔加入200 µL封闭液,4 ℃过夜,洗板。稀释液将待检血清按1:50稀释后100 µL/孔,37 ℃作用15 min;每孔加入100 µL的兔抗猪酶标二抗,37 ℃作用10 min,洗板;每孔加入自配TMB 100 µL进行显色(避光),5 min后用终止液终止反应,并立即在酶标仪上读出OD450值。ELISA 阴阳性临界值=阴性血清OD450平均值+3SD=0.35。所以样本OD450值≥0.35时,判定为阳性;OD450值<0.35时,判定为阴性。
2.6.5交叉试验。应用gE-ELISA方法,按照2.6.4中的操作步骤,对猪口蹄疫、猪瘟、猪繁殖与呼吸综合征、猪圆环病毒2型、猪细小病毒、猪乙型脑炎阳性血清用gE-ELISA检测。结果显示,这些参考阳性血清的OD450值都小于0.35,均为gE抗体阴性。结果说明本研究所建立ELISA方法具有良好的特异性。
2.6.6重复性试验。选取8份不同的PRV gE阳性血清样品,用建立的gE间接ELISA进行5次批内重复检测。结果显示不同血清样品的变异系数不超过10%(表3)。将同样的8份血清分别用3个批次的gE蛋白包被的酶标板进行检测,发现检测结果一致。该结果表明本方法具有较好的重复性。
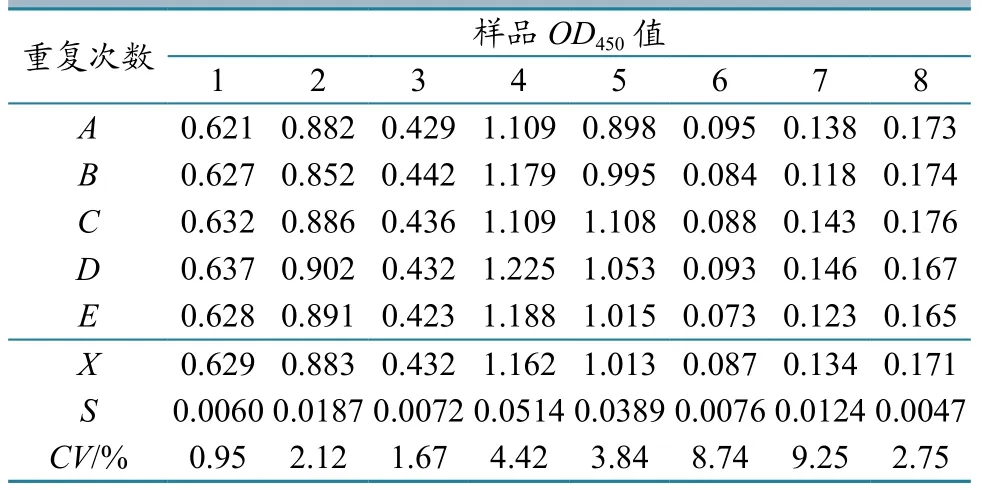
表3 gE-ELISA的批内重复试验
2.6.7gE间接ELISA的与IDEXX gE-ELISA试剂盒的平行检测结果。将92份血清样品分别用建立的gE间接ELISA与IDEXX gE-ELISA试剂盒进行平行检测发现:IDEXX gE-ELISA试剂盒检测出gE抗体阳性血清样品64份,本研究建立的gE-ELISA检出阳性62份;IDEXX gE-ELISA 试剂盒检测28份阴性样品,本方法均检出30份阴性(表4)。平行检测的92份血清样品中,两种方法检测结果一致的有82份。与IDEXX gE-ELISA产品相比,gE间接ELISA的敏感性和特异性分别为90.63%和85.71%,二者符合率为89.13%。
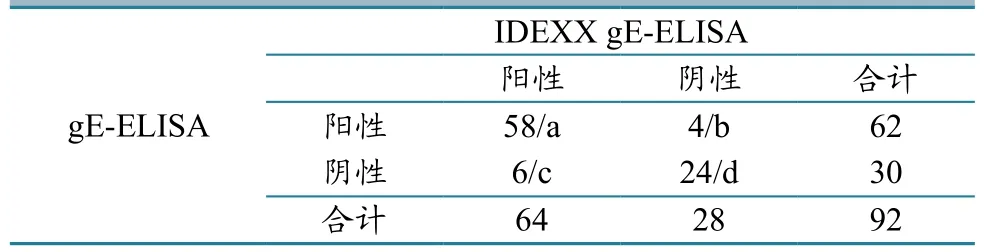
表4 gE-ELISA与IDEXX gE ELISA的结果比较
3 讨论
2011年以来,一种能导致新生仔猪腹泻,伴有神经症状的新型PRV病毒在我国多数养猪地区流行,给养猪业造成严重经济损失[9]。为此,各级动物疫病预防控制机构、科研院校的兽医科技工作者开展了流行病学调查、诊断技术、病原学、血清学、免疫学以及防控技术等方面的研究工作。本研究的出发点是,为基层动物疫病预防控制机构、兽医实验室、养殖企业提供一种针对当前流行毒株、能否有效区分PRV gE基因缺失疫苗免疫猪与野毒感染猪的快速血清学鉴别检测ELISA试剂盒。
研究证实,PRV gE蛋白的主要抗原表位主要集中在52~238位氨基酸[10]。应用DNAstar软件包中的Protean子软件,对PRV SD株的gE基因主要抗原区域进行分析。为了保持其抗原性,减少非特异性,本研究选取编码PRV SD株gE蛋白主要抗原表位的618 bp基因片段进行克隆,与pET32 a+表达载体连接构建重组质粒,发现其在大肠杆菌BL21中得到高效表达。经Western-blot印记分析、间接ELISA检测,证实该表达产物能与PRV gE阳性血清发生特异性反应,可作为PRV gE抗体的检测抗原。樊淑华[11]、吴博[12]的研究结果表明,截短的PRV gE基因在大肠埃希氏菌中成功表达后,其蛋白主要以包涵体形式存在。众所周知,对包涵体进行变性、复性、纯化的操作步骤多、耗时,回收蛋白损失较多、成本高,难以保持其生物学活性。本研究采用32 ℃低温培养的方式,实现了gE基因在0.025 mmol/L IPTG诱导下的可溶、高效表达,为gE蛋白纯化提供了方便。
由于SPF猪的PRV阳性抗体难以获得,本试验运用IDEXX gE-ELISA试剂盒检测阳性血清作为阳性血清,经IDEXX检测阴性血清作为阴性血清,建立间接ELISA方法。临床上ELISA非特异反应的强弱是建立ELISA诊断方法成功与否的关键。由于采用原核表达系统进行表达,其宿主菌为大肠杆菌,这势必会提高阴性值,不利于临界值的确立。本研究运用中和方法,在加一抗前用大肠杆菌对待检血清进行中和,明显降低了ELISA的阴性值,为间接ELISA方法的建立提供了保证。在试验中,gE重组蛋白与其它猪源病毒抗体无交叉反应,说明其具有特异性强、敏感性高的特点。同IDEXX gE-ELISA诊断试剂进行比较,IDEXX gE-ELISA试剂盒检测出gE抗体阳性血清样品64份,本研究所建立gE-ELISA检测出阳性62份。IDEXX gE-ELISA 试剂盒检出28份阴性样品,本方法检出30份阴性。平行检测的92份血清样品中,两种方法检测结果一致的有82份。与IDEXX gE-ELISA产品相比,gE间接ELISA的敏感性和特异性分别为90.63%和85.71%,二者的符合率为89.13%。
随着我国生猪养殖业模式的不断发展变化,大型养猪场尤其是大型种猪场,应树立防重于治的防疫理念,需要经常对严重影响养殖效益的重点疫病进行监测。如PR,必须坚决剔除gE抗体阳性猪,以确保猪群健康。本研究建立的gE-ELISA检测方法为各养殖企业提供了一个可以区分PRV自然感染和PRV gE基因缺失疫苗免疫的特异性检测方法,能够满足日常监测之需。虽然市场上有IDEXX等企业生产的同类试剂盒,但价格昂贵、购买周期长。本研究力求运用所在企业成熟的下游技术,开发出自主ELISA试剂盒,以满足市场需要。
[1] 李长友,李晓成. 猪群疫病防治技术[M]. 北京:中国农业出版社,2015:151-156.
[2] ZIMMERMAN J J,KARRIKER L A,RAMIREZ A,et al. Disease of swine[M],10th ed. Hoboken:John Wiley &Sons,Inc.,2012:424-434.
[3] 陈焕春,何启盖. 伪狂犬病[M]. 北京:中国农业出版社,2015,33-36.
[4] 仇华吉. 伪狂犬病病毒变异株的致病性、分子特征及基因缺失疫苗的研制[J]. 兽医导刊,2016(21):21.
[5] 王娟,杭学果. 猪伪狂犬病病毒引起哺乳仔猪腹泻的治疗[J]. 畜禽业,2012(5):73-74.
[6] DAVISON A J. The order of herpesvirales[J].Veterinary microbiology,2010,143:52-69.
[7] 裴丽华,左玉柱. 猪伪狂犬gE基因的亚克隆及原核表达[J]. 河北农业大学学报,2014,37(1):80-83.
[8] 杨尚斌,高洪,黄慧,等. 大理地区散养户猪伪狂犬病病毒野毒株感染的血清学分析[J]. 动物疫学进展,2012,33(1):121-123.
[9] 彭金美,安同庆,赵鸿远,等. 猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报,2013,35(1):1-4.
[10] 吴发兴,郑辉,亓传德,等. 猪伪狂犬病病毒PCR检测方法的建立与应用[J]. 动物医学进展,2009,30(5):5-9.
[11] 樊淑华. 伪狂犬病毒gE基因主要抗原区的表达及其表达产物间接ELISA诊断方法的研究[D].郑州:河南农业大学,2006.
[12] 吴博. 猪伪狂犬病病毒gE蛋白的表达及间接ELISA的建立[D]. 南阳:南阳师范学院,2017.
(责任编辑:朱迪国)
Prokaryotic Expression on Major Epitope Domain of gE for PRV SD and Establishment of Indirect ELISA for PRV gE Antibody
Zheng Hui1,Zhang Qing1,Zou Min1,Dong Yaqin2,Liu Shaung2,Fan Gencheng1,Wu Faxing2,Li Xiaocheng2
(1. Qingdao Yebio BioEngineering Co.,Ltd,Qingdao,Shandong 266114;2. China Animal Health and Epizootiology Centre,Qingdao,Shandong 266032)
S851.3
A
1005-944X(2017)10-0083-07
10.3969/j.issn.1005-944X.2017.10.023
国家重点研发计划项目(2017YFC1200500)
并列第一作者:郑 辉、张 青、邹 敏
吴发兴、李晓成
