布鲁氏菌野毒株A544和疫苗株104M差异蛋白的表达及抗体制备
2017-10-12王海艳赵林立赵治国郭文秀陈宇飞任彩霞敖威华马彩霞
王海艳,赵林立,赵治国,郭文秀,陈宇飞,刘 佳,任彩霞,敖威华,马彩霞
(内蒙古出入境检验检疫局,内蒙古呼和浩特 010020)
布鲁氏菌野毒株A544和疫苗株104M差异蛋白的表达及抗体制备
王海艳,赵林立,赵治国,郭文秀,陈宇飞,刘 佳,任彩霞,敖威华,马彩霞
(内蒙古出入境检验检疫局,内蒙古呼和浩特 010020)
选取布鲁氏菌差异蛋白部分基因序列,将其克隆到表达载体pGEX-6p-1中;经PCR鉴定、酶切鉴定和序列测定,得到重组质粒pGEX-6p-1-bru;将重组质粒转化到Rosetta(DE3)感受态细胞中,用1 mmol/L 异丙基硫代-B-D-半乳糖苷(IPTG)对转化菌进行诱导表达,并用表达蛋白制备多克隆抗体。结果:差异蛋白在体外获得了高效表达,表达融合蛋白分子量约为35 kD;诱导5 h后表达量最高,占菌体总蛋白的30%左右;表达蛋白能与多克隆抗体发生免疫印迹反应,证明所表达的蛋白具有良好的免疫原性。该研究结果为免疫学检测方法的建立奠定了基础。
差异蛋白;布鲁氏菌野毒株A544;布鲁氏菌疫苗株104M;表达;抗体制备
Abstract:The variant protein gene from Brucella bovis virulent strain was cloned into the pGEX-6p-1 expression vector. The recombinant plasmid pGEX-6p-1-bru was transformed into E coli Rosetta(DE3)for expression after being identified by PCR,enzyme digestion and sequencing. The transformed bacteria were cultivated and induced with 1 mmol/L isoproyhhio-B-D-galactoside(IPTG),and polyclonal antibody was prepared by the expression protein.The results showed the variant protein was expressed efficiently in fusion protein form,the molecular weight of the fusion protein was 35 kD,the expression level of the fusion protein was the highest after exposure to IPTG for 5 h and accounted for approximately 30% of the total cellular proteins. The expression protein could react with polyclonal antibody,showing that the recombinant protein had a good immunogenicity. This result was a better basic for immunological detection research on Brucellosis.
Key words:variant protein;Brucella bovis virulent strain A544;Brucella abortus vaccine strain 104M;expression;antibody preparation
布鲁氏菌病(以下简称布病)为人兽共患传染病,是我国二类传染病,主要引起母畜流产及其他并发症[1]。1990年,布鲁氏菌在海洋哺乳动物中被分离到,从而改变了人们一直认为布病主要在陆地动物中分布的认识,也使人们对布病的控制措施进行了相应调整[2]。自20世纪90年代开始,布病疫情有回升势头。全球40~50个国家和地区的布病疫情出现不同程度的波动。目前,布病疫情回升的地区主要集中在非洲、亚洲、南美洲及欧洲的部分地区[3]。目前,全球布病患病总人数约有600万,年新发病人数约50万[4-5]。
为了建立布病自然感染与疫苗免疫的鉴别诊断方法,本研究先利用比较蛋白质组学研究技术,选出野毒株A544和疫苗株104M差异蛋白;然后在A544株中高表达的赤藓糖醇转录调节子(蛋白编码BruAb2-0365)蛋白中,选出与其它野毒株同源性高、与疫苗株同源性低、抗原表位信号强、包含重要抗原决定簇的序列部分片段,利用pGEX-6P-1表达载体,对其进行体外表达。
1 材料和方法
1.1 载体、菌株
表达载体pGEX-6P-1质粒、表达菌株Rosetta(DE3),均购自上海基音生物有限公司。
1.2 主要试剂
异丙基-β-D-硫代半乳糖苷(IPTG)、Ex Taq酶、T4 DNA连接酶及BamH I和 XholI限制性内切酶,购自Takara公司;质粒DNA提取试剂盒与胶回收试剂盒,购自Takara公司;羊抗兔IgG辣根过氧化物酶(HRP)标记抗体、四甲基联苯胺(TMB)缓冲溶液,购自Sigma公司;重组蛋白纯化系统GSTrap FF,购自美国GE公司;LB培养基,购自陆桥公司;葡聚糖凝胶G-20000,购自上海化学试剂厂;弗氏完全佐剂(CAF)和弗氏不完全佐剂(IAF),购自GIBCO公司;硫酸铵,购自中国金山化工厂。
1.3 开放阅读框的选择与引物设计合成
对选取的序列(GGGTGCGACCTCGCAATAATCGAGGCCGTAAAGATCGGCCAGACGGTTTTCCAGATCGATGCATTCGGTGATGTCACCGTCGATGGTCACTTTCACCGCGCCGTCGGCAACGGCCTTGGCGATGAGACGATGCGCTTTCACCGAAGGCAGGCCAAGGCGCTTGGCAACGGCAGACTGAGTCATGCCGGCGACGAAATGAAGCCAGGCGGCGCGAAGCGCCAGAGAATCGTCTGCATCTGC)上游加起始密码子(ATG)和EcoRI酶切位点(GAATTC),下游加Xho I酶切位点(CTCGAG)。利用Oligo 6.0软件设计1对扩增此片段的引物:上游引物为5´-GAATTCATG GCAGCTCTCCTTGTAG-3´,下游引物为5´-CTCGAGGCAGATGCAGACGATT-3´。引物由上海基音生物有限公司合成。
1.4 表达载体的构建及鉴定
以布鲁氏菌野毒株A544的DNA为模板,经PCR扩增,BamH I/XholI双酶切回收纯化后,将其定向连接到经EcoR I/XholI双酶切的pGEX-6p-1表达载体中,并转化到表达菌株BL21(DE3)Plys细胞中;对提取的质粒,经PCR鉴定和酶切鉴定正确后,选取阳性菌进行测序;将重组质粒命名为pGEX-6p-1-bru。PCR鉴 定 反 应 体 系:Ex Taq(5 U/μL)0.5 μL、10×Ex Taq Buffer 5 μL、dNTP(2.5 mmol/L)5 μL、 上 下 游 引 物(25 nmol/μL) 各 1 μL、质粒 0.5 μL,加水至 50 μL。PCR 反应条件:94 ℃ 1 min;94℃ 45 s,54 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。酶切鉴定反应体系:10×Buffer for EcoR I 2 μL,EcoR I 和 XholI酶各 0.5 μL,BSA 0.5 μL、质粒 7 μL,加水至20 μL。
1.5 pGEX-6p-1-bru重组蛋白不同时间的诱导表达及SDS-PAGE电泳分析
用阳性重组质粒pGEX-6p-1-bru(或空质粒pGEX-6p-1)转化表达菌株Rosetta(DE3)感受态细胞,挑取单菌落,将其加入到10 mL含氨苄青霉素的液体LB中,37 ℃培养过夜增菌。取3 mL细菌培养物接种到50 mL含氨苄青霉素的LB中,37℃继续培养至OD600为0.6~1.0时,加诱导剂IPTG至终浓度为1.0 mmol/L。37 ℃继续培养,分别于2、3、4 、5 h后,各取1.5 mL菌液离心,收集细菌沉淀,用PBS洗2遍;加入150 µL 1×SDS-PAGE凝胶加样缓冲液,煮沸10 min;冰浴5 min后,取15 µL经15 %分离胶的SDS-PAGE电泳分析。将未加入诱导剂的细菌培养液培养5 h,作空白对照。
1.6 重组蛋白的亲和纯化
按照GSTrap FF亲和纯化系统的操作说明书进行。
1.7 多克隆抗体的制备
简单步骤:将蛋白大量表达,并用蛋白纯化柱进行纯化;取500 μg纯化蛋白溶于2 mL 弗氏完全佐剂中,使之充分乳化;皮下多点注射新西兰家兔。加强免疫时用弗氏不完全佐剂,抗原剂量为首次的1/4。每2~3周加强免疫1 次。在第1 次加强免疫后2 周,从耳缘静脉取血2~3 mL,分离血清;用间接ELISA法检测抗体效价,至抗体效价达到1:10 000以上。2 周后取血约50 mL,室温凝固后,4 ℃冷藏4 h,离心分离血清。
1.8 Western blot分析
将细菌裂解物,经SDS-PAGE分析后,再转移到硝酸纤维素膜上;用5%脱脂奶室温封闭3 h(或4 ℃过夜),用PBST洗3次;加多克隆抗体(1:100倍稀释)室温作用1 h,PBST缓冲液洗3次;加入羊抗兔IgG辣根过氧化物酶(HRP)标记抗体 (1:2 500倍稀释),37 ℃作用30 min,用PBST缓冲液洗3次;在四甲基联苯胺(TMB)缓冲溶液中显色1 min。
2 结果
2.1 表达载体的构建及鉴定
将PCR扩增产物定向连接到pGEX-6p-1表达载体,然后转化到表达菌株Rosetta(DE3)细胞中。对选取的阳性质粒,经PCR鉴定,可扩增出约240 bp的片段。酶切鉴定结果与预期结果相符,测序结果也与提供的序列完全一致(图1、图2和图3)。

图1 阳性质粒PCR鉴定结果
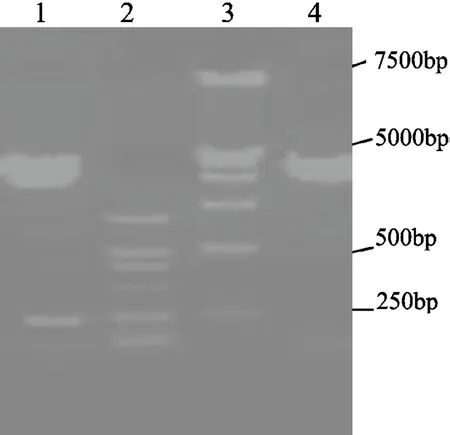
图2 阳性质粒酶切鉴定结果
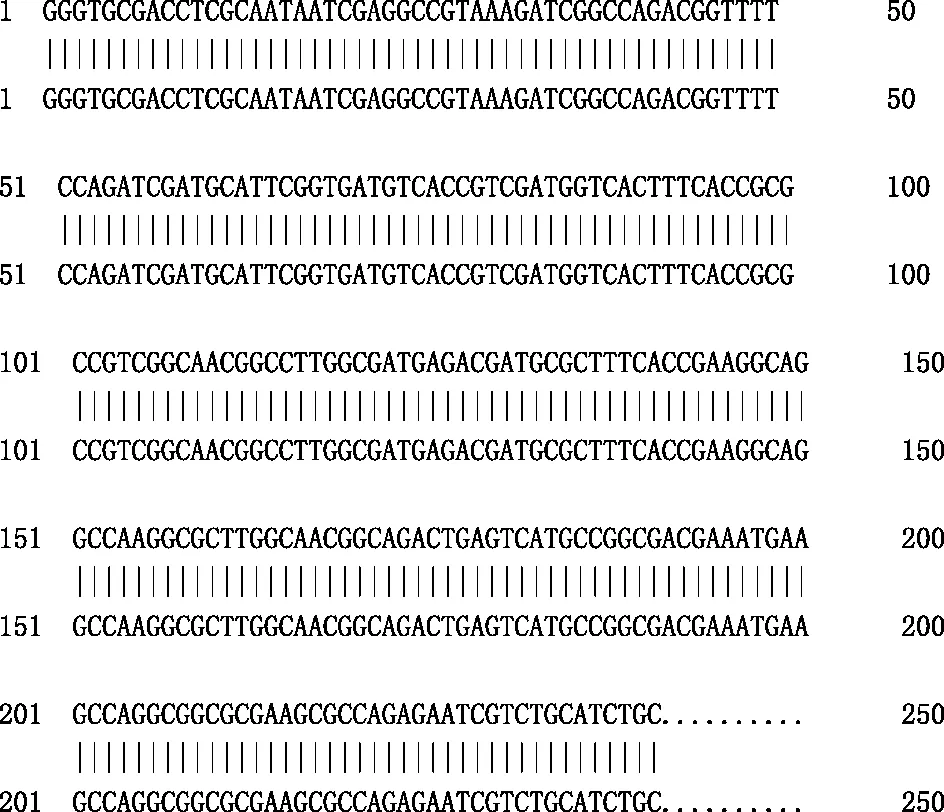
图3 阳性质粒测序结果
2.2 表达蛋白的SDS-PAGE电泳及Western blot分析结果
将不同时间诱导的菌体裂解后进行SDSPAGE电泳及Western blot分析,结果表明:差异片段在体外获得了高效表达,表达融合蛋白分子量约35 kD,诱导5 h后表达量最高,占菌体总蛋白的30 %左右;表达蛋白能与多克隆抗体发生免疫印迹反应,证明所表达的蛋白具有良好的免疫原性(图4)。
3 讨论
目前,外源蛋白的表达系统较多。其中,大肠杆菌表达系统具有培养方便、操作简单、成本低廉、表达量大、易于纯化和工业化批量生产等优点;pGEX-6P-1原核表达的载体重组蛋白,在折叠时不易掩盖被研究蛋白的表位,能够保持蛋白原本的反应性。因此,本试验利用pGEX-6P-1原核表达载体系统,表达了以包涵体形式存在的差异蛋白。以包涵体形式表达的蛋白有其不利的一面:包涵体需要变性溶解、复性后才能得到溶解的蛋白,而且复性后蛋白的活性容易降低;但也有其有利的一面:其能够避免细胞内蛋白水解酶的作用,有利于目的蛋白的富集和分离纯化。本研究用pGEX-6P-1载体系统中表达的差异蛋白,经变性溶解SDS-PAGE电泳后,用免疫印迹检测证明,该重组蛋白依然具有良好的免疫原性。因此,可利用表达蛋白及制备的多克隆抗体,建立免疫学检测方法。
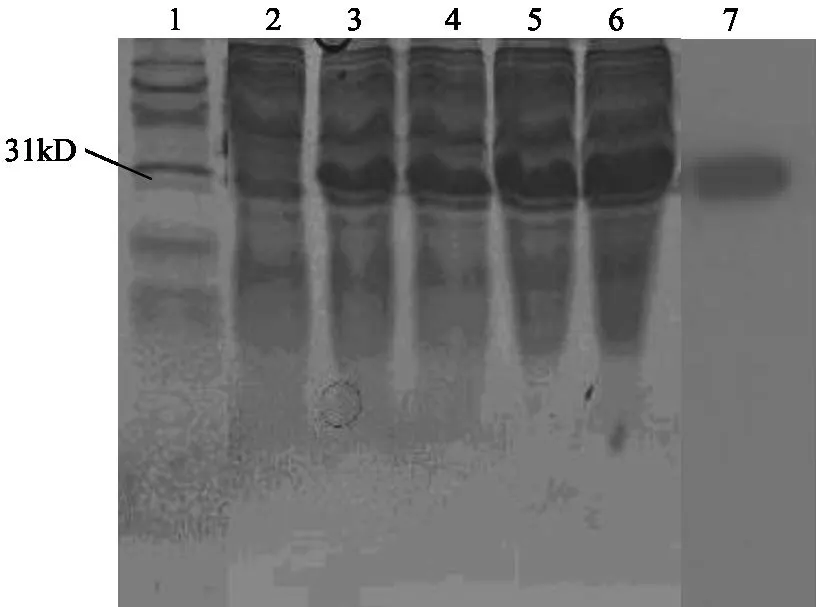
图4 诱导表达蛋白的SDS-PAGE电泳及Western blot 鉴定结果
免疫血清质量的好坏直接关系到使用的效果和研究的成败,直接影响到试验的准确性、特异性和敏感性。制备优质的免疫血清,一方面取决于抗原的种类、纯度及其免疫原性;另一方面也取决于动物的选择及动物机体免疫应答的能力。此外,还须考虑注射途径、抗原剂量、注射次数、时间间隔、有无佐剂以及合理的免疫方法和免疫程序等。
抗原是指能刺激机体免疫系统诱导免疫应答并能与应答产生的抗体或致敏淋巴细胞发生特异反应的物质。一个完整的抗原应包括两方面的免疫性能:免疫原性,指诱导机体产生免疫应答的能力,具有这种能力的物质称为免疫原;免疫反应性,指抗原与抗体或致敏淋巴细胞发生特异性结合的能力,亦称为反应原性。有些物质在独立存在时,只具有反应原性而无免疫原性,称为半抗原,而免疫原通常同时具有免疫反应能力。良好的抗原是产生优质免疫血清的重要条件。
动物机体产生抗体的过程有一定的时间规律。一般在首次接触抗原的7~10 d后,血清中才有抗体出现,并在14~21 d达到高峰,这段时间称为初次反应阶段。初次应答产生的抗体主要是IgM分子,与抗原的结合力低,为低亲和性抗体。若此后一定时间内,再次接触同一抗原,则特异抗体的量就会成倍增加,称为二次反应。这个阶段产生的主要为IgG分子,且为高亲和性抗体。依据这一规律,必须制定合理的免疫次数和间隔时间。本研究利用该程序获得了比较满意的血清效价,证明该免疫程序切实可行。但免疫程序并不是一成不变的,须综合考虑动物的种别、免疫原的种类、免疫途径及免疫剂量等,必要时还要根据具体情况随时调整。
免疫剂量需因动物种类、抗原分子大小及免疫方案不同进行调整,可分为微量、中等剂量及大剂量。免疫剂量低于一定限度时,抗体就不能形成,或不能检出;超过一定限度时,抗体的产生就会受到抑制,使控制免疫系统的神经因过度兴奋转为阻抑,产生“免疫麻痹”。因此,掌握好适当的剂量非常关键。
免疫途径的选择也是相当重要的。通常可采用静脉、腹腔、皮下、皮内或肌肉及足掌等途径注射抗原。经静脉或腹腔注射的抗原能直接或很快进入血流,可在短时间内被清除,因此没有足够的时间刺激抗体形成细胞,因而也不能获得效价满意的抗血清。但最后一次的经静脉加强免疫能使抗体水平迅速提升。一般情况下,抗原经皮下、皮内或肌肉注射后,抗原扩散速度很慢,贮留时间长,有利于抗体的产生和并可持续较长时间。因此,在免疫动物时,应遵循这一原则,以便得到满意的高效价血清,从而为下一步研究奠定基础。
必须根据抗原的性质采用适当的免疫方法。一般颗粒性抗原,如红细胞、细菌体等,通常采用无佐剂免疫法。本研究针对应用的免疫原采用佐剂免疫法,这有利于减缓抗原在体内释放速度,增加抗原在体内的存留时间,糖醇转录调节子蛋白中抗原表位信号强的包含重要抗原决定簇的序列部分片段进行了表达,从而为布病自然感染与疫苗免疫的鉴别诊断建立一种行之有效的、快速的检测方法提供了参考。
[1] PAPPAS G,PAPADIMITRIOU P. Challenges in brucella bacteraemia[J]. Int J Antimicrob,2007,30(S1):29-31 .
[2] SELEEM M N,JAIN N,POTHAYEE N,et al. Targeting Brucella melitensis with Polymeric nanoparticles containing streptomycin and doxyeyeline[J]. FEMS Microbiol Lett,2009,294(1):24-31.
[3] REGUERA J M,ALAREON A,MIRALLES F,et al.Brucella endocarditis: elinieal,diagnostie and ther apeutic approach[J]. Eur J Clin,Microbiol Infect Dis,2003,22:647-650.
[4] PAPPAS G,PAPADIMITRIOU P,AKRITIDIS N,et al. The new global map of human brucellosis[J]. Lancet Infeet Dis,2006,6(2):91-99.
[5] TALESKI V,ZERVA L,KANTARDJIEV T,et al. An overview of the epidemiology and epizootology brucellosis in selected countries of central and southeast Europe[J]. Vet Microbiol 2002,90(1-4):147-155.
(责任编辑:朱迪国)
Expression and Antibody Preparation of Variant Protein between Brucella bovis Virulent Strain A544 and Brucella abortus Vaccine Strain 104M
Wang Haiyan,Zhao Linli,Zhao Zhiguo,Guo Wenxiu,Chen Yufei,Liu Jia,Ren Caixia,Ao Weihua,Ma Caixia
(Inner Mongolia Entry-exit Inspection and Quarantine Bureau,Huhhot,Inner Mongolia 010020)
S852.65
A
1005-944X(2017)10-0060-05
10.3969/j.issn.1005-944X.2017.10.018
国家质检总局科技计划(2012IK014、2016IK165)
