APP/PS1转基因小鼠学习记忆能力下降与胼胝体脱髓鞘损伤的关系①
2017-09-29张秀峰金昊林冰冰李珑宋长明李钻芳梁胜祥毛敬洁柳维林陶静陈立典
张秀峰,金昊,林冰冰,李珑,宋长明,李钻芳,梁胜祥,毛敬洁,柳维林,陶静,陈立典
·基础研究·
APP/PS1转基因小鼠学习记忆能力下降与胼胝体脱髓鞘损伤的关系①
张秀峰1,金昊1,林冰冰1,李珑1,宋长明1,李钻芳2,梁胜祥3,毛敬洁2,柳维林1,陶静1,陈立典4,5,6
目的 探讨12月龄APP/PS1转基因小鼠学习记忆能力下降与胼胝体脱髓鞘损伤之间的关系。方法 12只12月龄APP/PS1转基因小鼠为AD组,12只同窝阴性小鼠为野生组。Morris水迷宫检测两组学习记忆能力;卢卡斯快蓝染色观察胼胝体神经纤维形态;免疫组化检测胼胝体髓鞘碱性蛋白(MBP)含量;硫黄素S染色观察淀粉样斑块在胼胝体的沉积情况。结果 与野生组相比,AD组逃避潜伏期明显延长(Z>2.873,P<0.01),穿越平台次数显著减少(t=-7.339,P<0.001)。AD组胼胝体神经纤维髓鞘稀疏,排列紊乱,出现较多空洞;MBP含量较野生组显著降低(t=-4.481,P<0.001);胼胝体区出现淀粉样斑块沉积。结论 12月龄APP/PS1转基因小鼠学习记忆能力下降,可能与淀粉样斑块在胼胝体的沉积引起胼胝体神经纤维脱髓鞘损伤有关。
阿尔茨海默病;学习记忆;胼胝体;脱髓鞘;小鼠
阿尔茨海默病(Alzheimer's disease,AD)是一种以逐渐加重的记忆丢失为主要临床特征的神经退行性疾病[1]。根据The World Alzheimer Report 2015报告,全球大约有4680万人罹患痴呆,并以每20年翻一倍的速度增长,预计到2050年,全球痴呆患者将达到1.3亿人,其中约一半是AD患者。到目前为止,AD患者记忆丢失的确切机制并不十分清楚。
越来越多的研究表明,AD患者存在大脑白质损伤[2-4],白质的变化与注意力[5]、执行功能[6]、情景记忆功能[7]等有密切关系。胼胝体是脑内最大的白质纤维束,连接左右半球,负责半球间信息传递和整合[8]。在AD发病过程中,胼胝体受到损害[9-11],包括脱髓鞘损伤[12-13]。
本研究观察12月龄APP/PS1双转基因AD小鼠空间学习记忆能力和胼胝体髓鞘的变化,以期阐明学习记忆能力与白质变化的关系。
1 材料与方法
1.1 实验动物与分组
12月龄APP/PS1双转基因小鼠12只〔B6C3-Tg(APPswe,PSEN1dE9)〕为AD组,同窝阴性野生小鼠12只为野生组,均由南京大学模式动物研究所提供,福建中医药大学实验动物中心喂养,许可证号SYXK(闽)2014-001。
本实验由福建中医药大学动物管理和使用委员会批准进行,实验过程均严格执行国际动物保护及使用指南的相关规定。
1.2 主要试剂和仪器
卢卡斯快蓝(Luxol Fast Blue,LFB)、硫磺素S(thioflavine S,THS):SIGMA公司。髓鞘碱性蛋白(myelin basic protein,MBP)一抗:ABCAM公司。免疫组化试剂盒:福州迈新生物技术开发有限公司。Morris水迷宫:上海欣软信息科技有限公司。DM4000B LED研究级生物显微镜、DMI4000B LED荧光倒置显微镜:LEICA公司。Motic Med 6.0图像分析系统:麦克奥迪公司。
1.3 Morris水迷宫测试
水迷宫为直径120 cm、深50 cm、水深30 cm的圆柱形水池,水温26℃左右,分为4个象限。平台直径6 cm、高28 cm,没于水面下2 cm左右,平台放置在第3象限。水池周围设有4个形状和颜色不同的参照物。前4 d行定位航行实验,每天4次;第5天行空间探索实验。
定位航行实验时,小鼠分别由第1象限、第2象限、第3象限、第4象限入水点面向池壁放入水中。记录90 s内找到平台的时间,记为逃避潜伏期。若小鼠在90 s内未找到平台,则该小鼠的逃避潜伏期记录为90 s,实验者将其引导至平台上,停留10 s后,再继续进行下一个象限实验。
空间探索实验时,撤去平台,从第1象限将小鼠面向池壁放入水中,记录90 s内小鼠穿越原平台所在位置的次数,连续测3次,取平均值。
1.4 动物取材
于水迷宫实验结束后第2天,小鼠10%水合氯醛0.01 ml/g腹腔注射麻醉后开胸,暴露心脏,剪开右心耳,生理盐水经左心室持续灌入,直至流出的液体清亮。4%多聚甲醛灌注固定,快速取出脑组织,浸入4%多聚甲醛中继续固定24~48 h。常规脱水,石蜡包埋,切片机切取厚4 μm全脑冠状切片。参照Paxinos&Franklin图谱,每只小鼠随机选取Bregma前囟后1.5~2.5 mm切片2张备用。每组小鼠各选4只的脑组织切片分别进行LFB染色、MBP免疫组化和THS染色。
1.5 LFB染色
石蜡切片常规脱蜡至水,置预热的LFB染液中,58℃染色16~24 h;冷却至室温,纯水冲洗1 min,入70%乙醇数秒;纯水冲洗1 min,入0.05%碳酸锂分化液中数秒,至背景变淡,髓鞘蓝色明显,纯水冲洗5 min。常规脱水透明,中性树胶封片。DM4000B LED研究级生物显微镜400倍观察胼胝体区髓鞘的形态,并拍照。
1.6 免疫组化
切片常规脱蜡入水。微波法抗原修复,内源性过氧化物酶阻断剂孵育10 min,驴血清封闭液封闭10 min。加MBP一抗(1∶500)湿盒中4℃过夜。室温复温30 min,加生物素标记的羊抗兔聚合物二抗孵育10 min,链霉素抗生物素蛋白过氧化物酶孵育10 min。各步骤间切片用PBS洗3次,每次5 min。DAB显色。DM4000B LED研究级生物显微镜400倍观察胼胝体,并拍照。每只小鼠2张切片,每张切片随机选取6个视野,使用Motic Med 6.0软件中免疫组化分析模块进行积分光密度分析。
1.7 THS染色
切片常规脱蜡入水,PBS洗3次,每次5 min。1%THS[14]染色液染色15 min,PBS洗3次,每次5 min。抗荧光淬灭封片剂封片,风干后,立即用DMI4000B LED荧光倒置显微镜200倍观察胼胝体区淀粉样斑块沉积情况。
1.8 统计学分析
采用SPSS 20.0统计软件对数据进行分析。数据以(xˉ±s)表示。符合正态分布,采用独立样本t检验;不符合正态分布,采用秩和检验。显著性水平α=0.05。
2 结果
2.1 Morris水迷宫
与野生组相比,AD组第1天、第2天、第3天、第4天逃避潜伏期明显增加(P<0.01);空间探索实验平均穿越平台次数显著减少(P<0.001)。见表1、表2。
2.2 LFB染色
野生组小鼠胼胝体髓鞘致密,排列较整齐;AD组髓鞘稀疏,排列紊乱,有较多空洞出现,脱髓鞘现象明显。见图1。
2.3 免疫组化染色
AD组MBP平均光密度与野生组小鼠相比显著降低(P<0.001);AD组髓鞘结构排列紊乱疏松,有较多空洞。见表3、图2。
2.4 THS染色
AD组胼胝体区出现淀粉样斑块沉积,野生组胼胝体区无淀粉样斑块。见图3。

图1 两组胼胝体纤维(LFB染色,400×)

表1 两组定位航行实验逃避潜伏期比较(s)
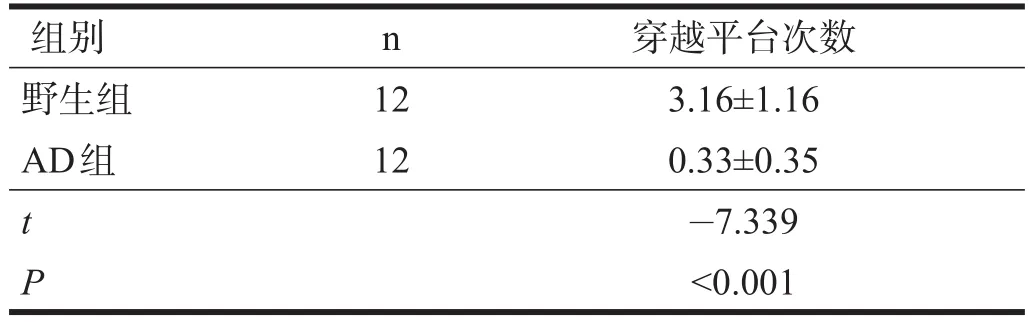
表2 两组空间探索实验穿越平台次数比较

表3 两组MBP表达(平均光密度)
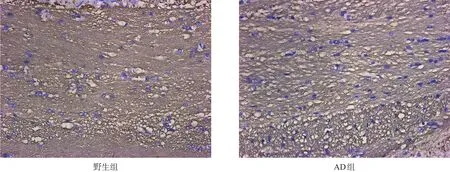
图2 两组胼胝体区MBP(免疫组化染色,400×)
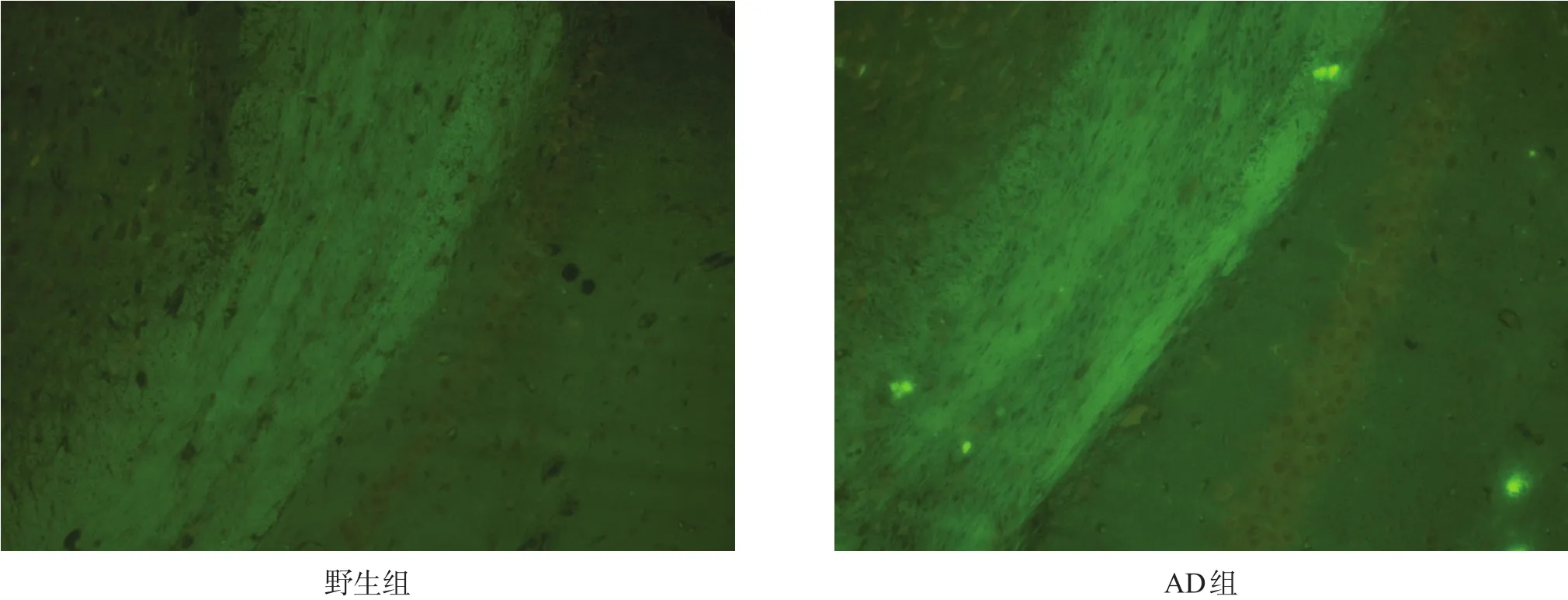
图3 两组胼胝体区淀粉样斑块(THS染色,200×)
3 讨论
APP/PS1双转基因小鼠过度表达与AD相关的两种蛋白质:淀粉样前体蛋白和早老素1,加速AD的疾病进程[15]。本研究发现,12月龄APP/PS1双转基因小鼠(AD小鼠)学习记忆能力下降。与我们前期的研究结果一致[16-17]。
大脑白质损害在AD发病机制中的作用受到越来越多的重视,AD患者认知功能下降与大脑白质完整性的破坏密切相关[5-7]。胼胝体是脑内最大的白质纤维束,连接左右侧大脑半球,在AD发病过程中受到损害[4,18-19]。本研究显示,AD小鼠神经纤维排列紊乱疏松,有较多空泡形成,且MBP含量显著降低。MBP是神经髓鞘的重要组成成分之一,MBP表达下降会抑制髓鞘形成[20],从而影响髓鞘正常的传导功能。MBP含量显著降低表明AD小鼠胼胝体区发生较严重的脱髓鞘损害。
对正常老年人和AD患者的弥散张量成像(diffusion tensor imaging,DTI)研究发现,与正常老年人相比,AD患者出现胼胝体各向异性分数(fractional anisotropy,FA)下降[4,18],胼胝体神经纤维完整性破坏。对AD患者和正常老年人为期1年的随访发现,AD患者胼胝体区FA降低[19]。8月龄的tau蛋白突变AD小鼠胼胝体出现FA降低,透射电镜观察胼胝体区神经纤维出现脱髓鞘损害,轴突排列紊乱、肿胀,轴突间距离增大[21]。这些临床和动物研究提示,AD患者存在胼胝体神经纤维完整性破坏,且这种破坏有可能由神经纤维脱髓鞘引起。
本研究显示,AD小鼠胼胝体区出现淀粉样斑块沉积,而野生组则无斑块。有研究表明,β-淀粉样蛋白42(amyloid β 42,Aβ42)能抑制少突胶质前体细胞增殖和分化,使MBP免疫染色细胞突起模糊,分支减少,从而影响神经纤维髓鞘的形成,此过程可能是通过促进少突胶质前体细胞凋亡实现的[22]。Aβ42注射入大鼠胼胝体区,能引起炎症反应,使大鼠脑组织少突胶质细胞损害,胼胝体白质脱髓鞘[23]。大鼠双侧脑室内注射Aβ寡聚体,能够引起大鼠胼胝体损害和学习记忆障碍[24]。同时AD患者大脑皮质MBP含量与Aβ42和淀粉样斑块有关[25]。对轻度认知障碍(mild cognitive impairment,MCI)和AD患者的临床DTI研究发现,较高的FA值和脑脊液中较高的Aβ42相关[26]。这些研究均表明,Aβ对神经纤维有毒性作用,能引起神经纤维脱髓鞘损害。我们推测,可能是淀粉样斑块在胼胝体区的沉积引起胼胝体区神经纤维脱髓鞘。
综上所述,本研究表明,12月龄APP/PS1转基因AD小鼠出现学习记忆能力下降,可能与淀粉样斑块在胼胝体沉积,引起胼胝体神经纤维脱髓鞘病变有关。具体机制仍需进一步的深入研究。
[1]Yin Y,Gao D,Wang Y,et al.Tau accumulation induces synaptic impairment and memory deficit by calcineurin-mediated inactivation of nuclear CaMKIV/CREB signaling[J].Proc Natl Acad Sci U S A,2016,113(26):E3773-E3781.
[2]Cooley SA,Cabeen RP,Laidlaw DH,et al.Posterior brain white matter abnormalities in older adults with probable mild cognitive impairment[J].J Clin Exp Neuropsychol,2015,37(1):61-69.
[3]周智美,陈德基,王延平,等.阿尔茨海默病早期脑白质改变的DTI研究[J].国际医药卫生导报,2015,21(10):1337-1340.
[4]Ouyang X,Chen K,Yao L,et al.Independent component analysis-based identification of covariance patterns of microstructural white matter damage in Alzheimer's disease[J].PLoS One,2015,10(3):e0119714.
[5]Chang YL,Chen TF,Shih YC,et al.Regional cingulum disruption,not gray matter atrophy,detects cognitive changes in amnestic mild cognitive impairment subtypes[J].JAlzheimers Dis,2015,44(1):125-138.
[6]Nowrangi MA,Okonkwo O,Lyketsos C,et al.Atlas-based diffusion tensor imaging correlates of executive function[J].J Alzheimers Dis,2015,44(2):585-598.
[7]Sexton CE,Mackay CE,Lonie JA,et al.MRI correlates of episodic memory in Alzheimer's disease,mild cognitive impairment,and healthy aging[J].Psychiatry Res,2010,184(1):57-62.
[8]Elahi S,Bachman AH,Lee SH,et al.Corpus callosum atrophy rate in mild cognitive impairment and prodromal Alzheimer's disease[J].J Alzheimers Dis,2015,45(3):921-931.
[9]Han LS,Bachman AH,Yu D,et al.Predicting progression from mild cognitive impairment to Alzheimer's disease using longitudinal callosal atrophy[J].Alzheimers Dement(Amst),2016,2:68-74.
[10]Wang XD,Ren M,Zhu MW,et al.Corpus callosum atrophy associated with the degree of cognitive decline in patients with Alzheimer's dementia or mild cognitive impairment:A meta-analysis of the region of interest structural imaging studies[J].J Psychiatr Res,2015,63:10-19.
[11]Di Paola M,Spalletta G,Caltagirone C.In vivo structural neuroanatomy of corpus callosum in Alzheimer's disease and mild cognitive impairment using different MRI techniques:a review[J].J Alzheimers Dis,2010,20(1):67-95.
[12]Kara F,Höfling C,Roßner S,et al.In vivo longitudinal monitoring of changes in the corpus callosum integrity during disease progression in a mouse model of Alzheimer's disease[J].Curr Alzheimer Res,2015,12(10):941-950.
[13]Di Paola M,Di Iulio F,Cherubini A,et al.When,where,and how the corpus callosum changes in MCI and AD:a multimodal MRI study[J].Neurology,2010,74(14):1136-1142.
[14]Li L,Wang XY,Gao FB,et al.Magnetic resonance T2relaxation time at 7 Tesla associated with amyloid β pathology and age in a double-transgenic mouse model of Alzheimer's disease[J].Neurosci Lett,2016,6(10):92-97.
[15]Shu X,Qin YY,Zhang S,et al.Voxel-based diffusion tensor imaging of an APP/PS1 mouse model of Alzheimer's disease[J].Mol Neurobiol,2013,48(1):78-83.
[16]张颖铮,卓沛元,林如辉,等.电针百会穴改善APP/PS1转基因小鼠空间学习记忆能力及对磁共振波谱的影响[J].康复学报,2016,26(5):42-46.
[17]卓沛元,柳维林,吴洁,等.电针百会穴对APP/PS1双转基因痴呆模型小鼠18F-FDG PET/CT成像及学习记忆的影响[J].中国康复医学杂志,2016,31(10):1050-1054.
[18]孟明,董春波,宋清伟,等.弥散张量成像对阿尔茨海默病脑白质改变的评价[J].中国神经精神疾病杂志,2016,42(3):134-140.
[19]Mayo CD,Mazerolle EL,Ritchie L,et al.Longitudinal changes in microstructural white matter metrics in Alzheimer's disease[J].Neuroimage Clin,2016,13:330-338.
[20]Nave KA.Myelination and support of axonal integrity by glia[J].Nature,2010,468(7321):244-252.
[21]Sahara N,Perez PD,Lin WL,et al.Age-related decline in white matter integrity in a mouse model of tauopathy:an in vivo diffusion tensor magnetic resonance imaging study[J].Neurobiol Aging,2014,35(6):1364-1374.
[22]张茂,詹晓黎,陈兴书,等.Aβ1-42抑制少突胶质前体细胞增殖与分化的实验研究[J].第三军医大学学报,2013,35(12):1183-1187.
[23]Jantaratnotai N,Ryu JK,Kim SU,et al.Amyloid beta peptide-induced corpus callosum damage and glial activation in vivo[J].Neuroreport,2003,14(11):1429-1433.
[24]Wong RS,Cechetto DF,Whitehead SN.Assessing the effects of acute amyloid β oligomer exposure in the rat[J].Int J Mol Sci,2016,17(9):1390.
[25]Zhan X,Jickling GC,Ander BP,et al.Myelin basic protein associates with AβPP,Aβ1-42,and amyloid plaques in cortex of Alzheimer's disease brain[J].JAlzheimers Dis,2015,44(4):1213-1229.
[26]Li X,Li TQ,Andreasen N,et al.The association between biomarkers in cerebrospinal fluid and structural changes in the brain in patients withAlzheimer's disease[J].J Intern Med,2014,275(4):418-427.
Learning and Memory Deficit and Demyelination of Corpus Callosum inAPP/PS1 Transgenic Mice
ZHANG Xiu-feng1,JIN Hao1,LIN Bing-bing1,LI Long1,SONG Chang-ming1,LI Zuan-fang2,LIANG Sheng-xiang3,MAO Jing-jie2,LIU Wei-lin1,TAO Jing1,CHEN Li-dian4,5,6
1.College of Rehabilitation Medicine,Fujian University of Traditional Chinese Medicine,Fuzhou,Fujian 350122,China;2.Academy of Integrative Medicine,Fujian University of Traditional Chinese Medicine,Fujian 350122,China;3.School of Physics and Engineering,Zhengzhou University,Zhengzhou,Henan 450001,China;4.Rehabilitation Research Center of Traditional Chinese Medicine,State Administration of Traditional Chinese Medicine,Fuzhou,Fujian 350122,China;5.Fujian Collaborative Innovation Center for Rehabilitation Technology,Fuzhou,Fujian 350122,China;6.Rehabilitation Medical Technology Joint National Local Engineering Research Center,Fuzhou,Fujian 350122,China
CHEN Li-dian.E-mail:cld@fjtcm.edu.cn
Objective To investigate the relationship between learning and memory deficit and demyelination of the corpus callosum in twelve-month old APP/PS1 transgenic mice.Methods Twelve twelve-month old APP/PS1 transgenic mice were as AD group,and age-matched wild type(WT)littermates were as WT group.Learning and memory ability was tested with Morris water maze,and the morphology of nerve fiber of corpus callosum was detected with Luxol Fast Blue staining.Immunohistochemistry was used to detect myelin basic protein(MBP)in the corpus callosum.Thioflavine S staining was used to detect amyloid plaque in the corpus callosum.Results Compared with WT group,the latency increased(Z>2.873,P<0.01)and the times crossing the location of the platform decreased(t=-7.339,P<0.001)in AD group.The nerve fibers were sparse and disorganized,with a lot of vacuoles in the corpus callosum of AD group.The positive expression of MBP in the corpus callosum was significantly decreased(t=-4.481,P<0.001)in AD group compared with WT group.There were amyloid plaques in the corpus callosum of AD group.Conclusion Twelve-month old APP/PS1 transgenic mice exhibit learning and memory deficit,which may be attributed to the deposition of the amyloid plaque mediated demyelinated injury of the corpus callosum.
Alzheimer's disease;learning and memory;corpus callosum;demyelination;mice
R749.1
A
1006-9771(2017)09-1027-05
2017-05-08
2017-06-22)
10.3969/j.issn.1006-9771.2017.09.008
[本文著录格式] 张秀峰,金昊,林冰冰,等.APP/PS1转基因小鼠学习记忆能力下降与胼胝体脱髓鞘损伤的关系[J].中国康复理论与实践,2017,23(9):1027-1031.
CITED AS:Zhang XF,Jin H,Lin BB,et al.Learning and memory deficit and demyelination of corpus callosum in APP/PS1 transgen-ic mice[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(9):1027-1031.
1.福建省康复技术协同创新中心课题(No.X2016001-协同);2.福建中医药大学科研创新平台专项(No.X2015024-平台)。
1.福建中医药大学康复医学院,福建福州市350122;2.福建中医药大学中西医结合研究院,福建福州市350122;3.郑州大学物理工程学院,河南郑州市450001;4.国家中医药管理局中医康复研究中心,福建福州市350122;5.福建省康复技术协同创新中心,福建福州市350122;6.康复医疗技术国家地方联合工程研究中心,福建福州市350122。作者简介:张秀峰(1986-),女,汉族,江苏泰州市人,硕士研究生,主要研究方向:神经康复与认知科学研究。通讯作者:陈立典(1963-),男,福建政和市人,教授,主任医师,博士生导师,主要研究方向:神经康复及认知科学。E-mail:cld@fjtcm.edu.cn。
