叶酸修饰的载药相变纳米粒体内靶向显影肿瘤的实验研究
2017-09-26叶鸣翟蓓刘莹陈昶宇李奥周洋
叶鸣 翟蓓 刘莹 陈昶宇 李奥 周洋
·实验研究·
叶酸修饰的载药相变纳米粒体内靶向显影肿瘤的实验研究
叶鸣 翟蓓 刘莹 陈昶宇 李奥 周洋
目的 研究叶酸受体(FR)靶向的、载紫杉醇(PTX)的相变纳米粒造影剂(FR-PTX-PNPCA)用于显影裸鼠移植瘤的能力。方法 制备FR-PTX-PNPCA乳剂和非靶向的相变纳米粒乳剂(PTX-PNPCA)备用;选取载卵巢癌移植瘤的裸鼠30只,根据注射药物不同随机等分为生理盐水组、非靶向组及靶向组,于注射药物前后采用活体荧光仪对裸鼠进行荧光显影,比较各组荧光显影情况。荧光显影后48 h,分别重新注射药物,2 h后采用治疗超声辐照肿瘤10 min,对肿瘤再次超声显影,比较各组显影强度,分析FR-PTX-PNPCA体内靶向显影肿瘤的能力。结果 活体荧光显影实验中,注射药物后,生理盐水组、非靶向组肿瘤内几乎未见红色荧光显影,靶向组组肿瘤内可见明显的红色荧光显影。超声显影实验中,治疗超声辐照前,各组肿瘤内显影强度无显著差异;超声辐照后,造影模式下靶向组显影强度为(383.65±32.05)U,明显高于生理盐水组和非靶向组[(86.78±7.74)U、(81.86±11.98)U],差异均有统计学意义(均P<0.01),且较常规模式下这种差异更为显著。结论 经静脉注射FR-PTX-PNPCA能靶向裸鼠卵巢癌移植瘤,并显著增强其超声显影,为肿瘤的精准医疗提供了一种有前途的、多功能的分子探针。
靶向;载药;纳米粒;相变;显影;裸鼠
现代医学的发展使人类平均生存年龄不断提高,而同时恶性肿瘤的发病率也急骤增高,人类健康仍受到严重威胁。分子影像学的应用为肿瘤的早期诊断和治疗提供了有效路径。基于超声微泡的超声分子影像学,不仅具备超声固有的无创、价廉、穿透性强及显影分辨力高的优点,而且还能利用超声靶向破坏微泡释药。其中,相变纳米粒超声造影剂被认为是较有希望取代普通微泡的新型造影剂[1]。然而,目前对其的研究多局限于体外实验,鲜见载药相变纳米粒的体内实验研究。本实验在前期制备载药相变纳米粒的研究[2-3]基础上,将其用于体内靶向显影,验证其体内靶向肿瘤的能力,进一步验证其体内增强超声显影能力。
材料与方法
一、主要试剂与设备
1.主要试剂:制作叶酸受体靶向的、载紫杉醇的相变纳米粒造影剂(FR-PTX-PNPCA)的脂质壳材,磷脂酰胆碱(DPPC)、偶联叶酸的磷脂酰乙醇胺[DSPE(PEG)Folate]、普通磷脂酰乙醇胺(DSPE)、甘油磷脂(DPPG,美国Avanti公司)、泊洛沙姆(PF68)、胆固醇(CH,美国Sigma公司);相变材料为液态氟碳(PFH,法国Elf Atochem公司);包载药物为紫杉醇(PTX,上海康朗生物科技)。
2.主要设备:制备FR-PTX-PNPCA的RE-52A型旋转蒸发器(上海亚荣生化),I25型高速分散均质机(德国IKN公司),Vcx-130型超声破碎仪(美国Sonic公司),用于检测载药性能的高效液相色谱仪,用于超声显影的MyLab 90超声诊断仪(意大利百胜公司),用于体内荧光显影的IVIS Lumina XR小动物活体荧光成像系统(美国Calipers公司)。
二、FR-PTX-PNPCA的制备和性质检测
1.制备:参照文献[2-3],将脂质壳材和PTX按比例(质量比3∶1)使用氯仿溶解,经过成膜、水合,加入相变材料,乳化后得到乳白色的乳剂FR-PTX-PNPCA,若成膜材料中用普通DSPE取代DSPE(PEG)Folate,即制得普通非靶向相变乳剂PTX-PNPCA。在成膜过程中加入少许红色荧光染料DiI制备出含红色荧光物质的纳米粒乳剂。
2.性质检测:将上述制备好的乳液稀释后在光镜下观察其形态及分布,并将样本送至重庆大学生物工程学院检测其粒径、电位及浓度。将样品交重庆医科大学药学院,采用高效液相色谱法测定FR-PTXPNPCA药物包封率和载药量[2]。
三、FR-PTX-PNPCA体内靶向增强肿瘤显影的研究
1.建立动物模型:按照常规贴壁细胞培养和传代方法,培养人卵巢癌SKOV3细胞,取对数生长的细胞,采用臀背部皮下注射的方法建立荷瘤裸鼠模型。每日观测肿瘤的生长情况,待3~4周肿瘤长至约1.0 cm×1.0 cm× 1.0 cm时,使用超声检查筛选内部无明显坏死的裸鼠进行下一步显影实验。
2.分组:选取建模成功的裸鼠30只,随机等分为3组,每组各10只,分别于显影实验前2 h通过尾静脉注射药物,即生理盐水组从尾静脉注射生理盐水200 μl;非靶向组从尾静脉注射稀释10倍的PTXPNPCA 200 μl;靶向组注射同非靶向组等量的FRPTX-PNPCA。
3.活体荧光显影:将裸鼠送至陆军军医大学(原名第三军医大学)小动物活体荧光显影中心,进行第一次荧光显影。之后在裸鼠尾静脉注射加入荧光染料的药物,2 h后将裸鼠用戊巴比妥钠麻醉后分别放入显影仓内,使用仪器对准裸鼠进行二次荧光显影。显影结束后采用仪器自带软件消除头颅、肝脏及脾脏等的显影部分,然后采用IPP软件(美国Media Cybernetics公司)分析肿瘤区的显影强度值。比较各组间荧光显影的差异。
4.超声显影:荧光显影后48 h,分别重新注射药物2 h后将裸鼠麻醉,肿瘤浸泡于37℃恒温脱气水槽中,使用L5-10探头(频率8 MHz)对准肿瘤,采用常规模式和造影模式(MI=0.10)观察肿瘤的显影情况。之后取出各组裸鼠,采用低功率治疗超声(重庆医科大学超声影像学研究所自制)探头对准裸鼠肿瘤部位辐照,辐照条件为频率1 MHz,峰值负压1 MPa,时间10 min,脉冲模式(即探头每发射声波1 min,休息10 s)。最后再将裸鼠放入水槽中用同样条件对肿瘤进行再次超声显影。观察治疗超声作用前后肿瘤显影强度的变化情况,采用IPP软件定量强度值,比较各组间显影强度的差异。
本实验经我院动物实验伦理委员会同意。
四、统计学处理
应用SPSS 14.0统计软件,所有测值以x±s表示,组间比较采用方差分析;若方差不齐,则行秩和检验。P<0.05为差异有统计学意义。
结果
一、FR-PTX-PNPCA的制备与一般性质检测
成功制备出载药靶向相变纳米粒乳液FR-PTX-PNPCA,其分散性好,约7.5×109/ml,粒径为(325±47)nm。PTX的包封率为70.42%,载药量为20.05%。
二、各组注射药物前后肿瘤荧光显影比较
注射药物后,生理盐水组和非靶向组中肿瘤内几乎未见红色荧光显影;靶向组中肿瘤内部可见明显的红色荧光显影(图1),与生理盐水组和非靶向组强度值比较差异均有统计学意义(均P<0.01),见表1。
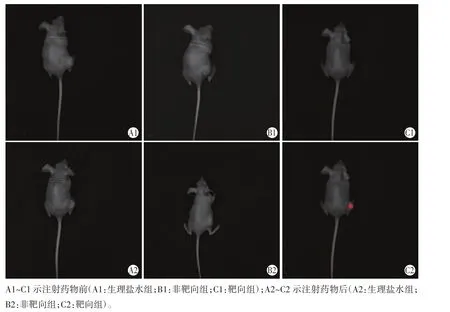
图1 各组注射药物前后裸鼠臀背部肿瘤灶荧光显影情况
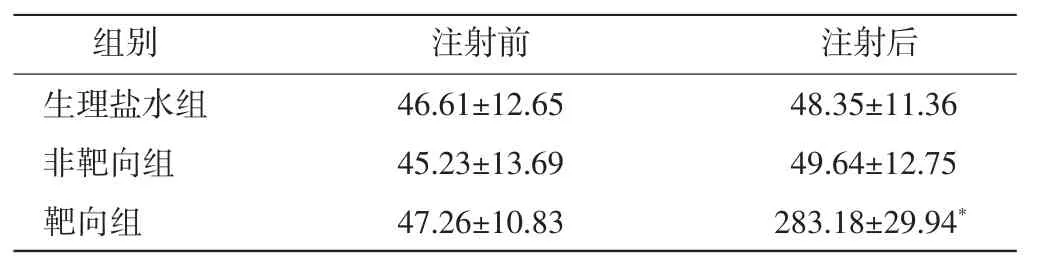
表1 各组注射药物前后肿瘤荧光显影强度比较(x±s) U
三、各组治疗超声辐照前后肿瘤内超声显影强度比较
生理盐水组和非靶向组在常规模式和造影模式下,肿瘤内部显影强度在治疗超声辐照前后均无明显变化。靶向组在常规模式和造影模式下,肿瘤内部显影强度在治疗超声辐照前与生理盐水组和非靶向组比较无明显差异;治疗超声作用后,常规模式下靶向组显影强度组均明显高于生理盐水组和非靶向组,差异均有统计学意义(均P<0.05),造影模式下这种差异更显著(均P<0.01)。见表2和图2。
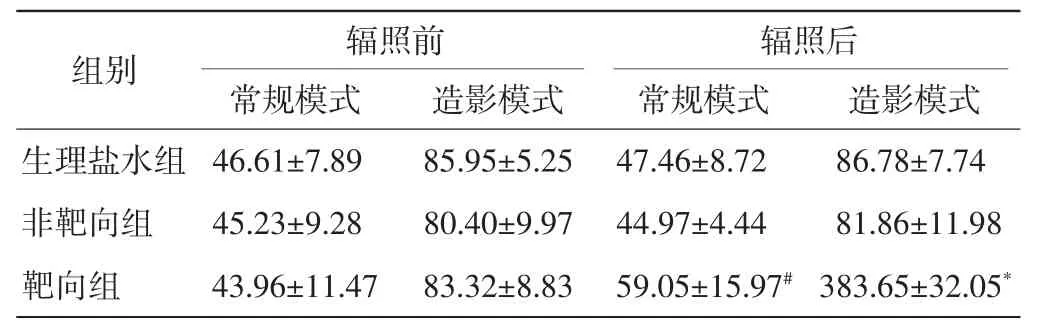
表2 各组治疗超声辐照前后常规模式与造影模式肿瘤内超声显影强度比较(x±s) U
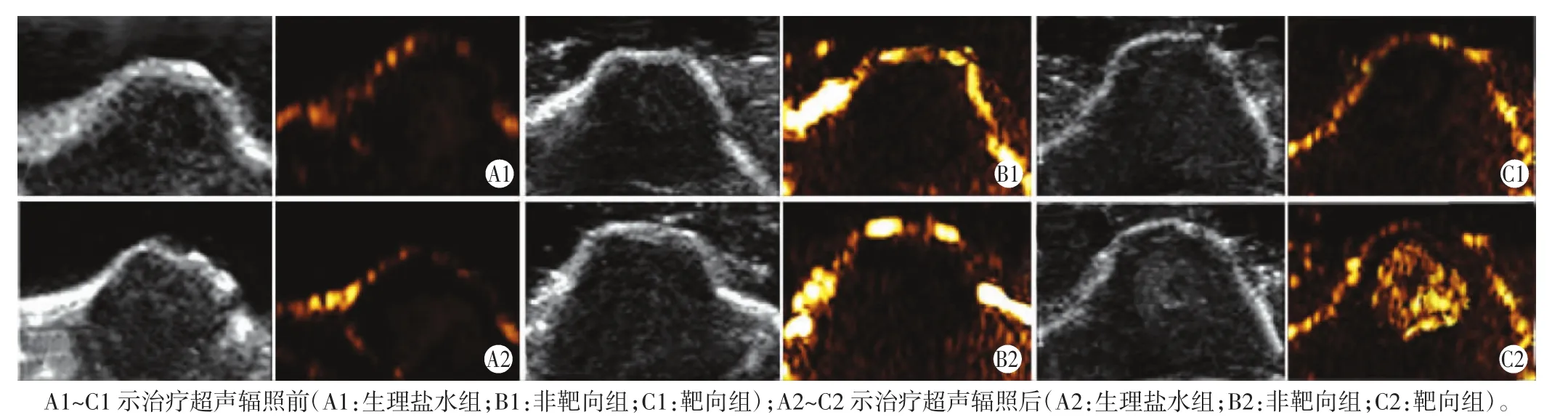
图2 各组治疗超声辐照前后体内相变增强超声显影肿瘤情况(图左为常规模式;图右为造影模式)
讨论
肿瘤的分子影像学融合了分子生物化学技术、纳米技术、医学图像及数据处理等技术,针对肿瘤进行诊治。而高特异性分子探针的研发是影响分子影像学发展的关键因素之一。普通微泡造影剂最早用于超声分子影像学的分子探针,但其却存在一系列的缺陷,如微泡粒径大,不容易穿透血管内皮间隙;性质不稳定,存留时间短;靶向性能差,载药能力不高,治疗效果差等。随着纳米技术的发展,各种靶向的、纳米级的微泡相继出现,但是,仍存在靶点选择缺乏特异性、纳米级微泡制作工艺复杂,以及谐波信号弱导致的超声显影效果差等不足。但肿瘤细胞的生长需要获取大量能量,因此叶酸受体在多数肿瘤内高表达[4],为此本实验课题组从2006年起就选择叶酸受体作为靶点,将造影剂经叶酸修饰取得了较好的肿瘤细胞靶向效果[3,5]。本实验选择的制备相变超声造影剂的方法已经文献[3-4]证实可成功制备出叶酸受体靶向的、载药的相变纳米粒超声造影剂,该方法解决了以往纳米微泡的缺陷;前期研究[6]也已证实其体外靶向和相变增强超声显影的能力。因此,本实验以高表达叶酸受体的卵巢癌为模型,进一步研究造影剂在体内的靶向能力及相变增强超声显影的能力。
目前,肿瘤的超声分子探针研究在国内各中心广泛开展,也取得了一定的成果。但是,研究多集中于各种造影剂靶向肿瘤血管内皮[7],或者在体外靶向肿瘤细胞[8],真正采用静脉注射后靶向显影肿瘤的文献[3,9]报道较少。本实验通过设计两方面的实验来验证造影剂体内靶向显影肿瘤的能力。首先采用的是活体荧光显像,其采用的Calipers成像系统穿透力较强,信噪比高,能获得满意的显像效果。在滤除内脏的显影后,能精确地显示肿瘤区域的显影情况。结果表明,靶向组裸鼠肿瘤内可见明显的红色荧光显影,而非靶向组和生理盐水组均未见肿瘤增强显影,证明FR-PTX-PNPCA能较好地靶向肿瘤细胞,并停留在肿瘤组织内;虽然已有文献[2-3,9]报道实体瘤的高通透性和滞留效应(即EPR效应)会导致纳米粒存留于肿瘤内,但本实验中非靶向组肿瘤内却未见到荧光显影,分析原因可能与本实验制备的纳米粒粒径相对大,被动存留在肿瘤内的纳米粒量较少有关。本实验选择注射药物后2 h来进行观察,其目的是给予足够的时间,使造影剂能够穿透血管内皮到达肿瘤细胞周围,达到靶向目的,也使黏附于肿瘤血管或者停留于血管内的造影剂清除,避免干扰实验结果。本实验仅在一个时间点对肿瘤进行了荧光显影,主要是为了证明纳米粒在活体内对肿瘤的靶向能力,今后实验将采取不同时间点来显影,以确定最佳的靶向时间。
在上述基础上,本实验又探讨了FR-PTX-PNPCA体内相变增强超声显影的能力。采用了治疗超声激发的方式来促进相变纳米粒的相变,使用超声在常规和造影模式分别显影。结果表明,靶向组的纳米粒能较好地靶向于肿瘤内,从而在治疗超声作用后相变产生超声微泡,最终增强超声显影;而非靶向组与生理盐水组在治疗超声作用前后却无显著的变化。本实验总结既往研究[3,5]经验发现,治疗超声采取的是固定的参数,既保证了纳米粒发生液-气相变的峰值负压,又给予了足够的时间以产生更多的微气泡。
综上所述,本实验制备的FR-PTX-PNPCA能够较好地靶向于肿瘤内,且在超声激发下发生相变,在肿瘤原位产生微泡增强超声显影,为之后的肿瘤内靶向释药奠定了实践基础。
[1] Rojas JD,Dayton PA.Optimizing acoustic activation of phase change contrast agents wth the activation pressure matching method:a review[J].IEEETransUltrasonFerroelectrFreq Control,2017,64(1):264-272.
[2] 李友伟,周薇,周洋,等.载10-羟基喜树碱的叶酸受体靶向相变超声造影剂的制备及一般特性[J].中国介入影像与治疗学,2017,14(3):169-172.
[3] Zhou Y,Wang Z,Chen Y,et al.Microbubbles from gas-generating perfluorohexane nanoemulsions for targeted temperature-sensitive ultrasonographyandsynergisticHIFUablationoftumors[J].AdvMater,2013,25(30):4123-4130.
[4] Marshalek JP,Sheeran PS,Ingram P,et al.Intracellular delivery and ultrasonic activation of folate receptor-targeted phase-change contrast agents in breast cancer cells in vitro[J].J Control Release,2016,243(1):69-77.
[5] 周洋,郑元义,冉海涛,等.叶酸受体靶向液态氟碳纳米粒造影剂的制备及体外寻靶实验研究[J].中国医学影像技术,2012,28(1):52-54.
[6] 周洋,周鸿,叶鸣,等.相变型液态氟碳纳米粒造影剂的制备及相变超声显影研究[J].临床超声医学杂志,2014,16(10):649-652
[7] Son HN,Nam JO,Kim S,et al.Multiple FAS1 domains and the RGD motif of TGFBI act cooperatively to bind αvβ3 integrin,leading to anti-angiogenic and anti-tumor effects[J].Biochim Biophys Acta,2013,1833(10):2378-2388.
[8] Ali MRK,Wu Y,Ghosh D,et al.Nuclear membrane-targeted gold nanoparticles inhibit cancer cell migration and invasion[J].ACS Nano,2017,11(4):3716-3726.
[9] Liu J,Shang T,Wang F,et al.Low-intensity focused ultrasound(LIFU)-induced acoustic droplet vaporization in phase-transition perfluoropentane nanodroplets modified by folate for ultrasound molecular imaging[J].Int J Nanomedicine,2017,12(1):911-923.
Study on targeted imaging of tumors by folic acid modified drug-loaded phase transition nanoparticles
YE Ming,ZHAI Bei,LIU Ying,CHEN Changyu,LI Ao,ZHOU Yang
Department of Ultrasound,the Third People’s Hospital of Chengdu,Chengdu 610031,China
Objective To explore the performance of folate receptor-targeted(FR),paclitaxel(PTX)loaded phase transition nanoparticle contrast agent(FR-PTX-PNPCA)in imaging xenograft in nude mice.Methods The FR-PTX-PNPCA emulsions and non-targeted phase change nanoparticle emulsions(PTX-PNPCA)were prepared.Then 30 nude mice with xenograft ovarian cancer were randomly divided into normal saline group,non-targeted group and targeted group according to different injection.The fluorescence imaging of nude mice was performed before and after the injection.The mice were re-injected with drug 48 h after the fluorescence imaging,and 2 h later the tumors were irradiated with therapeutic ultrasound for 10 min,then the ultrasonography of tumor was re-performed.Meanwhile,the ultrasound intensity of all images was measured by software.And the differences in the intensity among groups were compared to summarize the ability of FR-PTX-PNPCA to image the tumor in vivo.Results There was hardly any fluorescence in tumors area in the saline group and non-targeted group after the injection,in contrast,obvious red fluorescence was observed in targeted group.In ultrasound imaging experiment,there was no significant difference in intensity among three group before the irradiation of therapeutic ultrasound.However,after the irradiation,the intensity in targeted group was(383.65±32.05)U,which was significantly higher than that in saline group and non-targeted group[(86.78±7.74)U,(81.86±11.98)U]in contrast mode,there were difference(all P<0.01),and there were significant difference intraditional mode(all P<0.05).Conclusion Intravenous injection of FR-PTX-PNPCA can target to the xenograft tumor of nude mice and significantly enhance the ultrasound imaging.It provides a promising and multi-functional molecular probe for the precise medical care of the tumor.
Targeted;Drug loaded;Nanoparticle;Phase transition;Imaging;Nude mouse
R-332
A
2017-05-08)
国家自然基金青年基金项目(81401433,81401427);四川省卫计委课题(130417)
610031 成都市第三人民医院超声科(叶鸣、翟蓓、刘莹、陈昶宇、周洋);南京医科大学第一附属医院超声科(李奥)
周洋,Email:hansenzy@126.com
