曼氏迭宫绦虫cathepsin L样蛋白酶的生物信息学分析
2017-09-20李奕基梁培
李奕基 梁培★
曼氏迭宫绦虫cathepsin L样蛋白酶的生物信息学分析
李奕基1,2梁培1,2★
目的通过生物信息学预测曼氏迭宫绦虫cathepsin L样蛋白酶(Smcathepsin L样蛋白酶)的生物学特征及其潜在功能和结构,为下一步Smcathepsin L样蛋白酶参与寄生虫和宿主相互作用过程研究提供依据。方法通过NCBI的ORF finder工具对Smcathepsin L样蛋白酶的开放阅读框(ORF)进行分析,利用ExPASy网站进行蛋白的物理化学参数、信号肽、跨膜螺旋和潜在分子生物学功能的预测,通过NCBI/BLAST对蛋白保守功能域进行预测。从NCBI网站获取不同物种的cathepsin L样蛋白酶序列,并利用Vector NTI suit 8.0和TreeView软件进行分析。利用SWISS⁃MODEL网站和SPDBV 4.10软件分析Smcathepsin L样蛋白酶的三维空间结构。结果Smcathepsin L样蛋白酶是一个全长基因,编码336个氨基酸。蛋白由2个典型的cathepsin L样蛋白酶结构域组成,序列当中有信号肽,是一个稳定的可溶性蛋白分子。三维空间立体结构分析结果显示Smcathepsin L样蛋白酶是一个保守的蛋白。Smcathepsin L样蛋白酶编码氨基酸序列与细粒棘球绦虫、链状带绦虫、多房棘球绦虫和人的cathepsin L样蛋白酶基因的同源性分别是50%、50%、49%和46%。分子进化分析显示Smcathepsin L样蛋白酶与日本血吸虫、多房棘球绦虫和链状带绦虫亲源性更近,而与其他物种,例如原虫、线虫和哺乳动物亲源性较远。结论Smcathepsin L样蛋白酶可能是一个潜在的分泌蛋白,该蛋白能在胞外发挥作用,即在寄生虫的消化、转移、入侵及宿主⁃寄生虫相互作用中起着重要的作用,是一个具有潜在研究价值的多功能分子。
曼氏迭宫绦虫;cathepsin L样蛋白酶;生物信息学分析
作者单位:1.海南医学院病原生物学教研室,海南,海口571199
2.海南医学院热带病转化医学教育部重点实验室,海南,海口571199
[KEY WOEDS]Spirometra mansoni;Cathepsin L⁃like proteinase;Bioinformatics analysis
曼氏迭宫绦虫(Spirometra mansoni,Sm),属于迭宫绦虫属,其成虫和裂头蚴都能够寄生于人,引起人兽共患寄生虫病。曼氏迭宫绦虫成虫主要寄生于猫科动物的小肠内,偶尔寄生于人体。而幼虫曼氏裂头蚴(Sparganum mansoni)是主要致病阶段,在人体内寄生引起裂头蚴病(Sparganosis),裂头蚴能够寄生在人体的各种组织引起严重的损害,比如引起严重的眼部疾病、组织损伤和脑部功能紊乱。曼氏迭宫绦虫分布在我国、日本、韩国和泰国等东南亚国家[1]。在我国,裂头蚴病主要分布于27个省、市、自治区,感染人数超过 1 000 人[1⁃2]。
组织蛋白酶(cathepsin)是在动物组织细胞内(主要是溶酶体)发现的一类蛋白酶,包括丝氨酸蛋白酶、天冬氨酸蛋白酶和半胱氨酸蛋白酶等,其中半胱氨酸蛋白酶类包括组织蛋白酶B、F、H、K、L、O、S、V、W 和 X[3]。20世纪80年代组织蛋白酶L才被鉴定和测序,到目前为止从组织蛋白酶A到组织蛋白酶Z均已有报道[4]。半胱氨酸蛋白酶在寄生生物中起着极为重要的作用,除了基本的蛋白降解代谢功能外还参与寄生虫免疫逃避,脱包囊/形成包囊脱鞘孵化以及细胞组织入侵等部分,同时寄生虫半胱氨酸蛋白酶具有较好的抗原性,已作为血清诊断疫苗以及药物研制的靶标分子得到应用[5]。纯化的猪带绦虫囊尾蚴的可溶性重组半胱氨酸蛋白酶TsCL⁃1具有生物活性,其水解活性能被半胱氨酸蛋白酶特异性抑制剂E⁃64所抑制,同时TsCL⁃1重组蛋白有较好的免疫原性和抗原性,这为猪囊尾蚴病的诊断与检测提供了一种简便、快捷、价格低廉的技术手段[6]。在华支睾吸虫中,半胱氨酸蛋白酶重组蛋白对检测血清中特异性IgG具有较高敏感性和特异性,是华支睾吸虫一个有潜在血清学诊断价值的重组蛋白抗原[7]。而对贾第虫组织蛋白酶B的研究发现,其为贾第虫病毒复制相关分子[8]。在旋毛虫中,组织蛋白酶F具有胚胎致死性,同时其可作为治疗旋毛虫病的潜在药物靶标[9]。有研究证明天冬氨酸组织蛋白酶D在顶复门寄生虫的蛋白运输机制中具有重要的作用,在疟原虫、扁形动物、线虫和蜱虫中引起血液消化,并是多酶蛋白水解复合物的组成成分,同时具有作为抗寄生虫病的新型有效干预策略的潜在靶标[10]。
在本次研究中,我们对曼氏迭宫绦虫的ca⁃thepsin L样蛋白酶进行了潜在生物化学特性的生物信息学分析。为进一步探讨cathepsin L样蛋白酶在曼氏迭宫绦虫生长发育过程中的作用奠定基础。
1 材料与方法
1.1 Smcathepsin L样蛋白酶核酸序列分析
从狗肠中分离的成虫用来构建曼氏迭宫绦虫的cDNA文库,得到的EST标签由上海联众基因科技研究院完成测序,编码SmcathepsinL样蛋白酶的cDNA序列从该文库调取,其开放阅读框(open reading frame,ORF)是通过利用Expasy(http://www.expasy.org/)中的 ORF finder tool进行查找。
1.2 Smcathepsin L样蛋白酶氨基酸序列分析
Smcathepsin L样蛋白酶蛋白的物理化学参数是通过ExPASy ProtParam获取,并利用ExPASy网站进行该蛋白的信号肽和跨膜螺旋的预测。Smca⁃thepsin L样蛋白酶的保守功能域是通过NCBI/BLAST HOME进行检测。
1.3 同源性和分子进化树分析
为了进行同源性和分子进化树分析,我们通过NCBI获取了不同物种的Smcathepsin L样蛋白酶序列,利用生物信息学分析软件Vector NTI suit 8.0和TreeView进行结果分析。
1.4 Smcathepsin L样蛋白酶结构模型构建
Smcathepsin L样蛋白酶三维空间结构是利用编码蛋白氨基酸通过SWISS⁃MODEL进行预测和SPDBV 4.10进行结果分析。在RAMPAGE服务器使用拉氏构象图(Ramachandran plot)(http://mordred.bioc.cam.ac.uk/~rapper/rampage.php)检 验最优预测模型。
2 结果
2.1 核酸序列分析
ORF finder结果显示Smcathepsin L样蛋白酶核酸序列是全长序列,由1 011个碱基对组成,见图1。
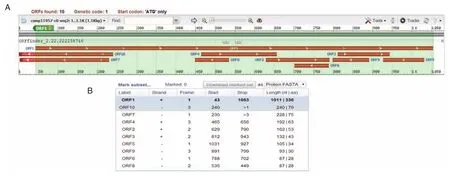
图1 曼氏迭宫绦虫cathepsinL样蛋白酶的开放阅读框Figure 1 The open reading frame ofSmcathepsin L⁃like proteinase
2.2 编码氨基酸的特征
Smcathepsin L样蛋白酶蛋白由336个氨基酸组成,如图2所示。氨基酸组成部分主要为Gly、Leu、Val、Ala和 Ser,分别占 9.5%、7.7%、7.7%、7.1%和7.1%。预测该蛋白的理论分子量是38.0 kDa,理论pI值是8.28。该蛋白在哺乳动物中的半衰期是30 h,在酵母和大肠埃希杆菌中体内表达的半衰期分别大于20 h和10 h。该蛋白是一个稳定的蛋白,其不稳定系数是32.06。预测的C值、S值和Y值都高于0.5,这提示了该蛋白有信号肽,如图3A所示。跨膜螺旋分析结果显示了该蛋白不是一个跨膜蛋白,可能是一个可溶性的蛋白分子,如图3B所示。
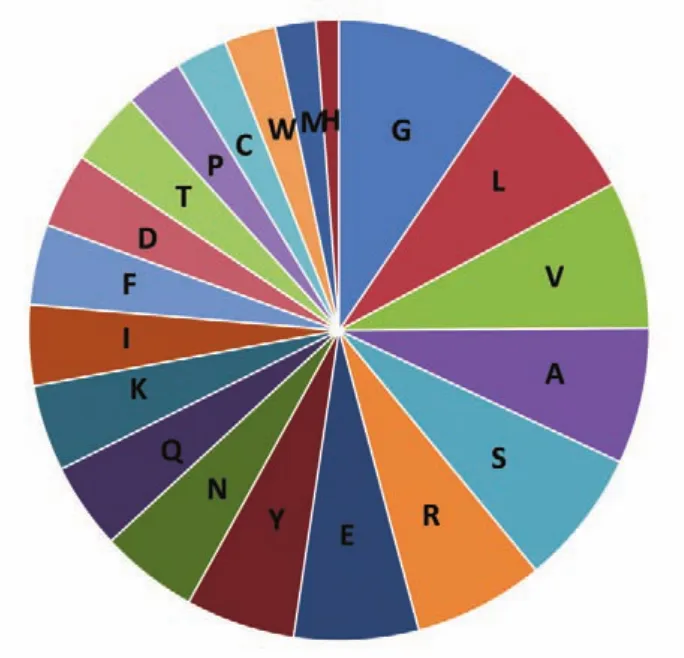
图2 曼氏迭宫绦虫cathepsinL样蛋白酶的氨基酸组成Figure 2 Amino acid composition ofSmcathepsin L⁃like proteinase
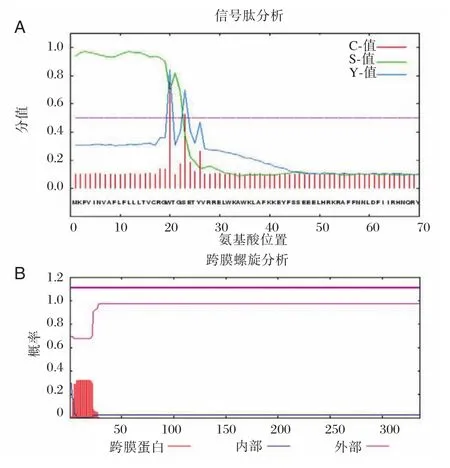
图3 曼氏迭宫绦虫cathepsin L样蛋白酶的功能区域分析Figure 3 Analysis ofSmcathepsin L⁃like proteinase functional domain
2.3 同源性和进化树分析
通过Smcathepsin L样蛋白酶的多序列比对,结果如图4显示,Smcathepsin L样蛋白酶编码氨基酸序列与细粒棘球绦虫、链状带绦虫和多房棘球绦虫的cathepsin L样蛋白酶基因的同源性分别是50%、50%、49%。该蛋白是含有Inhibitor_I129和Peptidase_C1 2个结构域,其中Peptidase_C1结构域含有4个活性位点(图4红色方框)和5个S2亚单位(图4黑色方框)。不同物种间4个活性位点氨基酸高度保守,而5个S2亚单位氨基酸变异较大。
Smcathepsin L样蛋白酶的分子进化树结果显示Smcathepsin L样蛋白酶与日本血吸虫、多房棘球绦虫和链状带绦虫亲源性更近,而与其他例如原虫、线虫和哺乳动物亲源性较远,见图5。
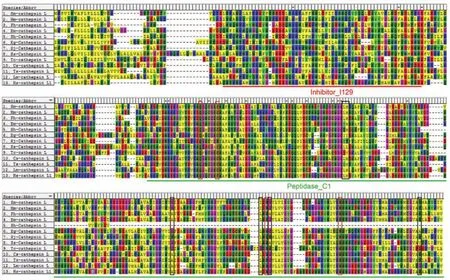
图4 曼氏迭宫绦虫cathepsin L样蛋白酶与其他物种cathepsin L样蛋白酶的序列比对Figure 4 Alignment ofSmcathepsin L⁃like proteinase amino acid sequence with cathepsin L⁃like proteinase from other species
2.4 Smcathepsin L样蛋白酶结构模型
Smcathepsin L样蛋白酶的保守功能区有2个:Inhibitor_I129结构域和Peptidase_C1结构域。该结构域的组成分别是32(aa)⁃91(aa)、121(aa)⁃335(aa),其中,2个结构域分别由红色和绿色下划线显示出来,见图4。通过SWISS⁃MODEL对Smcathep⁃sin L样蛋白酶的三维空间结构进行预测,如图6B所示。根据Ramachandran plots分析结果表明这个结构模型是最优化的(最合理区以及允许残基数占比分别为85.5%和11.2%,在允许区内总计占96.7%)。
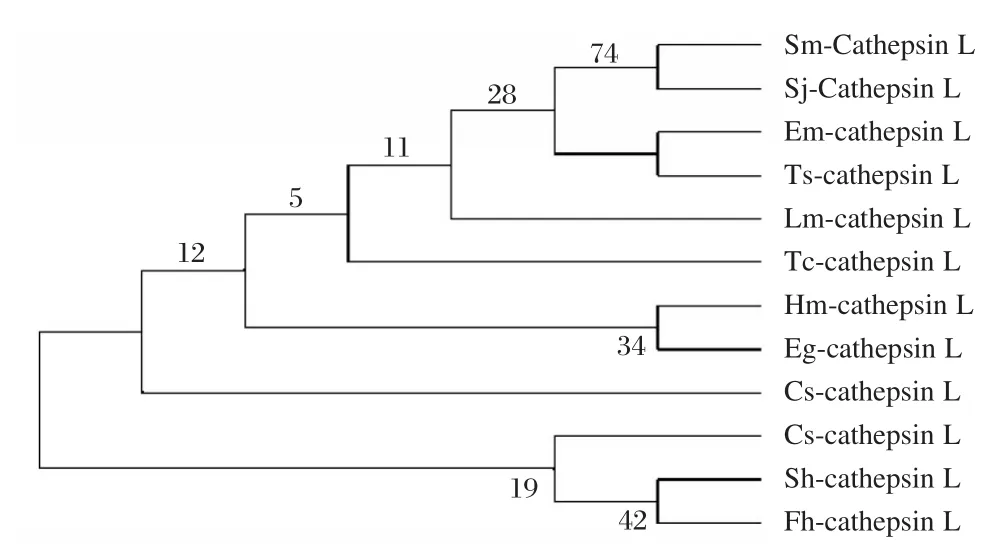
图5 曼氏迭宫绦虫cathepsin L样蛋白酶的分子进化树Figure 5 Molecular evolution tree of theSmcathepsin L⁃like proteinase
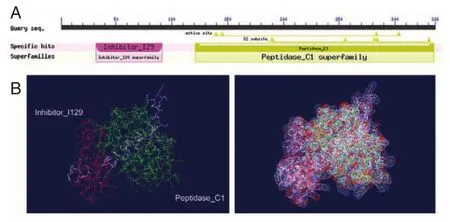
图6 曼氏迭宫绦虫cathepsin L样蛋白酶典型的2个序列分析Figure 6 Analysis of 2 classic sequences ofSmcathepsin L⁃like proteinase
3 讨论
组织蛋白酶分布广泛,从低等到高等的各种类群生物体中均有被发现,在生物界已发现20余种[11]。组织蛋白酶L是绦虫的一类重要的半胱氨酸蛋白酶,其参与绦虫生命周期的多种活动,在寄生生物中起着极为重要的作用[12⁃14]。
在本实验研究中,曼氏迭宫绦虫cathepsin L样蛋白酶是第一次被鉴别和进行生物信息学分析。并对曼氏迭宫绦虫cathepsin L样蛋白酶的结构和潜在的功能特征进行了描述。在本实验研究中,我们从曼氏迭宫绦虫成虫的cDNA文库中分离得到其cathepsin L样蛋白酶的全长序列(图1),该序列由336个氨基酸组成。曼氏迭宫绦虫cathepsin L样蛋白酶的理论分子量是38 kDa,含有信号肽,但它不是一个跨膜蛋白,提示其可能是一个潜在的分泌蛋白[15]。Smcathepsin L样蛋白酶的保守结构域的预测表明其属于C1A肽酶家族,该家族在溶酶体蛋白的降解中起到作用[16]。另外,进化树分析结果显示,曼氏迭宫绦虫cathepsin L样蛋白酶与日本血吸虫、多房棘球绦虫和链状带绦虫亲源性较近,这可能是由于它们都属于蠕虫,说明此蛋白在生物学和生物化学方面具有一定的相似作用。在日本血吸虫成虫消化道内发现了组织蛋白酶B和L,水解来源于宿主的红细胞以满足寄生虫的生长、发育和生存需要[17⁃18]。因此,曼氏迭宫绦虫 cathepsin L 样蛋白酶通过分泌到细胞外来为寄生虫营养供应方面发挥作用。
本研究表明不同物种间4个活性位点氨基酸高度保守,半胱氨酸和组氨酸是肽酶C1家族的催化残基,形成催化二聚体。其他2个残基在催化作用中起着重要的作用,其中谷氨酰胺在催化半胱氨酸之前,被认为是有助于氧离子洞的形成,而天冬酰胺残基识别催化性组氨酸的咪唑环[19⁃20]。同时发现5个S2亚单位氨基酸变异较大。木瓜蛋白酶的特异性主要决定于位于该疏水区的疏水氨基酸或芳香族氨基酸残基,那么曼氏迭宫绦虫ca⁃thepsin L样蛋白酶具有其特异性。比如肝片吸虫的cathepsin L样蛋白酶在S2亚单位偏好脯氨酸并且能够水解胶原蛋白[21]。结构域Inhibitor_I129作为前肽,作为单一结构域蛋白或蛋白质内部单一或多重结构域的肽蛋白酶抑制剂。在很多情况下,他们是合成大的前体蛋白的一部分,作为前多肽原或者作为N端结构域与未激活的肽酶或酶原有关。这个结构域能够阻止酶作用底物接近活性位点,其通过与另一个肽酶的相互作用或通过自动催化切割激活酶原而去除N端抑制剂结构域[22⁃23]。S2亚单位是木瓜蛋白酶样半胱氨酸蛋白酶主要的底物特异性亚单位,该单位可容纳底物P2侧链的大体积疏水性或芳香残基。组织蛋白酶B除外,由于在口袋的底部存在一个谷氨酸,其在此亚位点容易接受精氨酸[24⁃25]。目前,伪异盘并殖吸虫(Pseudo Paragonimus)的电脑模拟三维结构和肝片吸虫的组织蛋白酶原L1的晶体结构已经有报道[26⁃27]。蛋白质特定的功能都是由其特定的构象所决定的,为此进一步的研究曼氏迭宫绦虫cathepsin L样蛋白酶的空间结构显得尤为重要。
cathepsin多序列比对结果显示cathepsin L样蛋白酶的编码氨基酸序列与人cathepsin L样蛋白酶序列相似性仅有46%,同源性相对较低,因此,Smcathepsin L样蛋白酶有望成为控制人类裂头蚴病的有价值的疫苗靶点。此外,还有研究表明[28]寄生虫的重组cathepsin L样蛋白酶具有较好的免疫原性和抗原性,那么对曼氏迭宫绦虫Smcathep⁃sin L样蛋白酶免疫原性和抗原性仍需进一步的研究,以确定其在寄生虫和宿主间的相互作用,以进一步开展免疫诊断和为治疗研究奠定基础。综上所述,Smcathepsin L样蛋白酶将是一个具有潜在研究价值的多功能分子。
[1]Hong Q,Feng J,Liu H,et al.Prevalence of Spirome⁃tra mansoni in dogs,cats,and frogs and its medical relevance in Guangzhou,China[J].Int J Infect Dis,2016,53:41⁃45.
[2]Mo Z,Li X,Lei Z,et al.Clinical analysis of 25 spar⁃ganosis cases[J].Zhong guo ji sheng chong xue yu ji sheng chong bing za zhi,2013,31(3):218⁃220.
[3]Zhou J,Zhang Y,Li Q,et al.Evolutionary history of cathepsin L(L⁃like)family genes in vertebrates[J].Int J Biol Sci,2015,11(9):1016⁃1025.
[4]曾广智,谭宁华,贾锐锐,等.组织蛋白酶及其抑制剂研究进展[J].云南植物研究,2005,27(4):337⁃354.
[5]Sajid M,Mckerrow JH.Cysteine proteases of parasitic organisms[J].Mol Biochem Parasit,2002,120(1):1⁃21.
[6]宋军科.猪囊尾蚴半胱氨酸蛋白酶TsCL⁃1基因的原核表达及生物学特性研究[D].陕西:西北农林科技大学,2010.
[7]江文才.华支睾吸虫半胱氨酸蛋白酶基因克隆、表达及血清学诊断效果评价[D].江苏:江苏省血吸虫病防治研究所,2011.
[8]田甜.贾第虫组织蛋白酶B基因干扰对虫体生长和贾第虫病毒mRNA的影响[D].吉林:吉林大学,2013.
[9]曲自刚.旋毛虫组织蛋白酶F的功能鉴定及药物靶标筛选[D].北京:中国农业科学院,2016.
[10]Sojka D,Hartmann D,Bartosova⁃Sojkova P,et al.Parasite cathepsin D⁃like peptidases and their relevance as therapeutic targets[J].Trends Parasitol,2016,32(9):708⁃723.
[11]Lecaille F,Kaleta J,Bromme D.Human and parasitic papain⁃like cysteine proteases:their role in physiology and pathology and recent developments in inhibitor de⁃sign[J].Chem Rev,2002,102(12):4459⁃4488.
[12]Robinson MW,Corvo I,Jones PM,et al.Collageno⁃lytic activities of the major secreted cathepsin L pepti⁃dases involved in the virulence of the helminth patho⁃gen,Fasciola hepatica[J].PLoS NTD,2011,5(4):e1012.
[13]Yoonuan T,Nuamtanong S,Dekumyoy P,et al.Mo⁃lecular and immunological characterization of cathep⁃sin L⁃like cysteine protease of Paragonimus pseudohet⁃erotremus[J].Parasitol Res,2016,115(12):4457⁃4470.
[14]Chung YB,Kita H,Shin MH.A 27 kDa cysteine pro⁃tease secreted by newly excysted Paragonimus wester⁃mani metacercariae induces superoxide anion produc⁃tion and degranulation of human eosinophils[J].Kore⁃an J Parasitol,2008,46(2):95⁃99.
[15]Liang P,He L,Xu Y,et al.Identification,immuno⁃localization,and characterization analyses of an exo⁃peptidase of papain superfamily,(cathepsin C)from Clonorchis sinensis[J].Parasitol Res,2014,113(10):3621⁃3629.
[16]Marchler⁃Bauer A,Bo Y,Han L,et al.CDD/SPAR⁃CLE:functional classification of proteins via subfami⁃ly domain architectures[J].Nucleic Acid Res,2017,45(D1):D200⁃D203.
[17]Noya O,De Noya BA,Ballen DE,et al.Immunoge⁃nicity of synthetic peptides from the Sm31 antigen(ca⁃thepsin B)of the Schistosoma mansoni adult worms[J].Parasite Immunol,2001,23(11):567⁃573.
[18]徐丛荣.日本血吸虫组织蛋白酶B基因的克隆、表达及初步鉴定[D].福建:福建医科大学,2007.
[19]Rawlings ND,Barrett AJ.Evolutionary families of peptidases[J].Biochem J,1993,290(Pt 1):205⁃218.
[20]Lewis SD,Johnson FA,Shafer JA.Effect of cysteine⁃25 on the ionization of histidine⁃159 in papain as deter⁃mined by proton nuclear magnetic resonance spectros⁃copy.Evidence for a his⁃159⁃⁃Cys⁃25 ion pair and its possible role in catalysis[J].Biochemistry,1981,20(1):48⁃51.
[21]Corvo I,Cancel M,Cappetta M,et al.The major ca⁃thepsin L secreted by the invasive juvenile Fasciola he⁃patica prefers proline in the S2 subsite and can cleave collagen[J].Mol Biochem Parasit,2009,167(1):41⁃47.
[22]Olonen A,Kalkkinen N,Paulin L.A new type of cys⁃teine proteinase inhibitor⁃⁃the salarin gene from Atlan⁃tic salmon(Salmo salar L.)and Arctic charr(Salveli⁃nus alpinus)[J].Biochimie,2003,85(7):677⁃681.
[23]Groves MR,Taylor MA,Scott M,et al.The prose⁃quence of procaricain forms an alpha⁃helical domain that prevents access to the substrate⁃binding cleft[J].Structure,1996,4(10):1193⁃1203.
[24]Lecaille F,Authie E,Moreau T,et al.Subsite speci⁃ficity of trypanosomal cathepsin L⁃like cysteine prote⁃ases.Probing the S2 pocket with phenylalanine⁃derived amino acids[J].Eur J Biochem,2001,268(9):2733⁃2741.
[25]Bromme D,Bonneau PR,Lachance P,et al.Engi⁃neering the S2 subsite specificity of human cathepsin S to a cathepsin L⁃and cathepsin B⁃like specificity[J].J Biol Chem,1994,269(48):30238⁃30242.
[26]Turk V,Stoka V,Vasiljeva O,et al.Cysteine cathepsins:from structure,function and regulation to new frontiers[J].BBA⁃Biomembra,2012,1824(1):68⁃88.
[27]Stack CM,Caffrey CR,Donnelly SM,et al.Structur⁃al and functional relationships in the virulence⁃associat⁃ed cathepsin L proteases of the parasitic liver fluke,Fasciola hepatica[J].J Biol Chem,2008,283(15):9896⁃9908.
[28]刘莉娜.曼氏迭宫绦虫半胱氨酸蛋白酶的表达与鉴定及其用于裂头蚴病血清学诊断的研究[D].河南:郑州大学,2015.
Sequence bioinformatics analysis of cathepsin L⁃like proteinase fromSpirometra mansoni
LI Yiji1,2,LIANG Pei1,2★
(1.Department of Pathogen Biology,Hainan Medical College,Haikou,Hainan,China,571199;2.Key Laboratory of Translational Medicine for Tropical Diseases, Ministry of Education,Hainan Medical University,Hainan,Haikou,China,571199)
ObjectiveTo provide information and pave the way for further research on cathepsin L ⁃like proteinase ofSpirometra mansoni(Smcathepsin L⁃like proteinase)which may participate in the interaction between parasite and host.MethodsThe open reading frame ofSmcathepsin L⁃like proteinase was identified with open reading frame(ORF)finder tool in NCBI website.ExPASy website was used topredict the physical and chemical parameters of protein,signal peptide,transmembrane helices and potential molecular and biological functions.The conserved domains of the protein were detected by NCBI/BLAST home.In order to analyze the homology and phylogenetic tree,sequences of cathepsin L⁃like proteinase from various species were obtained from NCBI website,and the results were analyzed by Vector NTI suil 8.0 and TreeView software.The three⁃dimensional structure ofSmcathepsin L⁃like proteinase was predicted by SWISS⁃MODEL and analyzed by SPDBV 4.10.ResultsSmcathepsin L⁃like proteinase is full⁃length gene and encoded 336 amino acid residues.The protein is composed of 2 classic conserved domains with signal peptide and a stably soluble molecule.It has a conservative cathepsin L⁃like proteinase in three⁃dimensional structure.Smcathepsin L⁃like proteinase is homologous to cathepsin L⁃like proteinase fromEchinococcusgranulosus,Taeniasolium,Echinococcus multilocularisandHomo sapienswith 50%,50%,49%and 46%identities,respectively.Smcathepsin L⁃like proteinase clustered with the L⁃like proteinase from theSchistosoma japonicum,Echinococcus multilocularis,and Taeniasolium,but not with other species like protozoon,trematode and mammal animals.ConclusionsSmcathepsin L⁃like proteinase is a potential secreted protein,and play a role in extracellular environment,such as digestion,metastasis,invasion and parasite⁃host interaction.Therefore,Smcathepsin L⁃like proteinase could be a potential important target.
国家自然科学基金课题(No.81560332,No.81660345);海南省自然科学基金课题(No.814298);海南医学院2016年引进人才科研启动经费(No.2016011);海南医学院大学生创新创业训练计划项目(HYCX2016029)
★通讯作者:梁培,E⁃mail:liangpeilp2012@163.com
