基于三引物荧光PCR⁃毛细管电泳法的FMR1基因突变检测技术建立及其在自闭症辅助诊断中的应用
2017-09-20孙莉杨琳艳叶倩平杨旭杨学习
孙莉 杨琳艳 叶倩平 杨旭 杨学习
基于三引物荧光PCR⁃毛细管电泳法的FMR1基因突变检测技术建立及其在自闭症辅助诊断中的应用
孙莉1杨琳艳2叶倩平2杨旭3杨学习4★
目的对自闭症患者FMR1基因5′非编码区CGG重复序列及重复数进行检测,探索检测脆性X综合征的新方法。方法应用三引物荧光PCR⁃毛细管电泳法(Qseq100TM全自动核酸分析系统检测)对111例自闭症患者进行筛查,检测其FMR1基因5′非编码区CGG序列,计算CGG重复数,并与ABI 3500Dx基因分析仪毛细管电泳测序法进行结果比较验证。结果111例临床检测为自闭症的样本中,有2例为FMR1前突变携带者,一例为中间型。与3500Dx毛细管电泳测序结果一致。结论三引物荧光PCR⁃毛细管电泳法能够用来检测FMR1基因5′非编码区CGG重复序列,在脆性X综合征发病机制及大规模携带者筛查方面都具有一定的应用价值。
自闭症;FMR1基因;脆性X综合征;三引物荧光PCR⁃毛细管电泳
作者单位:1.华北石油管理局总医院检验科,河北,任丘062552
2.广州市达瑞生物技术股份有限公司,广东,广州510665
3.南方医科大学基础医学院,广东,深圳518110
4.南方医科大学检验与生物技术学院,广东,广州510515
脆性X综合征是X连锁不完全显性遗传病[1⁃2],是最常见的遗传性智力障碍类型之一。其致病基因为FMR1(fragile X mental retardation 1),位于X染色体上的Xq27.3[3],该病主要是由于FMR1基因5′非编码区的CGG重复序列动态突变导致。根据CGG重复数不同可以分为4种类型:全突变(>200个 CGG重复),前突变(55~200个CGG重复),中间型突变(45~54个CGG重复)和正常型(<45个CGG重复)[4]。CGG重复数在亲代向子代传递时可发生动态突变,由前突变扩展为全突变,导致相应基因组区域高甲基化而阻止mRNA合成,其产物智力低下蛋白合成被阻断,该蛋白对胎儿神经发育和结缔组织形成非常重要,缺乏该蛋白的全突变患者会发病。约有20%的前突变型脆性X综合征女性携带者晚期易发生“脆性X原发性卵巢功能不全”,而部分前突变型脆性X综合征男性携带者在其老年时期易发生“脆性X相关震颤⁃共济失调综合征,前突变携带者的另一个亚表型是自闭症谱系疾病⁃学习困难[5]。女性前突变携带者中约15%~30%是自闭症患者,而男性自闭症患者中仅约6%患有脆性X综合征[6]。有上述3个亚表型之一者即可作为FMR1基因前突变携带者的候选筛查人群。脆性X综合征发病率为女性 1/2 500,男性 1/1 250[7]。在我国智力低下患者中发病率约 6.3%[8]。
脆性X综合征临床表现程度各异、复杂多样。其主要特征为中度至重度智力低下,且随着年龄增加病情有加重的趋势。其他临床表现为特殊面容,如长脸,招风耳,青春期以后出现大睾丸,许多患者还表现为冲动、多动、焦虑、恐惧社交、语言呆板等孤独症行为[9]。目前,大部分脆性X综合征患者尚未得到诊断。脆性X综合征严重危害儿童生长发育,早发现、早治疗、早干预能显著改善患儿预后,且可通过提供产前遗传咨询,避免家族中再次出现同样的患者。如何建立一个快速、经济、有效的方法进行前突变和全突变筛查,产前诊断是预防、辅助诊断和遗传阻断的基础。
脆性X综合征得以确诊需要从基因水平进行检测,目前关于脆性X综合征的实验室检测方法主要包括基因组DNA特异性酶切、荧光探针法、多重连接探针扩增技术(multiplex ligation depen⁃dent probe amplification,MLPA)、Southern blot法等,这些技术存在操作难度高、检测耗时长或成本高等不足。本研究拟采用三引物荧光PCR⁃毛细管电泳法进行FMR1基因CGG重复的检测,探索适合于检测脆性X综合征的快捷有效的方法。
1 材料和方法
1.1 对象
实验所用的全血样本共111例,是由南方医院于2016年9月份在广州地区收集的自闭症患者样本。
1.2 方法
1.2.1 核酸提取
采用核酸提取或纯化试剂(广州市达瑞生物技术股份有限公司)提取样本基因组DNA,严格按照试剂盒的说明书进行操作,提取完成后,用荧光定量法(Qubit®3.0荧光定量仪,Life Technologies,美国)进行定量,以检测DNA浓度,提取的DNA于-20℃保存。
1.2.2 引物设计
该方法选取人基因组中编码脆性X综合征FMR1基因的5′端非翻译区(CGG)n重复序列为扩增靶区域,针对(CGG)n重复序列区段设计3条特异性引物。CGG重复序列的两端设计用于扩增目标片段(含CGG重复区)的引物F、R,正向引物F序列为:5′⁃GCTCAGCTCCGTTTCG⁃GTTTCACTTCCGGT⁃3′,5′端带FAM荧光;反向引物R序列为:5′⁃AGCCCCGCACTTCCACCAC⁃CAGCTCCTCCA⁃3′;在CGG重复区域设计用于扩增CGG重复序列的引物M。M的序列为:5′⁃AGCGTCTACTGTCTCGGCACTTGCCCGCCGCC⁃GCCG⁃3′。
1.2.3 荧光PCR⁃毛细管电泳及3500Dx毛细管电泳测序
荧光PCR反应体系①:对照样本和受检样本的PCR反应体系的体积均为20μL,其中含有80 ng的模板 DNA,10μL 的 2×GC BufferⅠ(TaKa⁃Ra,日本),0.4μL 的 dNTPs(10 mmol/L)(TaKaRa,日本),5.2μL的PCR增强剂,0.3μL的上游引物F(10 μmol/L),0.3μL 的下游引物 R(10 μmol/L),0.3μL的DNA聚合酶(5 U/μL),无核酸酶水补足至20μL。荧光PCR反应体系②:对照样本和受检样本的PCR反应体系的体积均为20μL,其中含有 80 ng的模板 DNA,10μL 的 2×GC BufferⅠ(TaKaRa,日本),0.4μL 的 dNTPs(10 mmol/L)(TaKaRa,日本),5.2μL的PCR增强剂,0.3μL的上游引物 F(10 μmol/L),0.3μL 的下游引物 M(10 μmol/L),0.3μL 的DNA聚合酶(5 U/μL),无核酸酶水补足至20μL。震荡混匀,瞬时离心后转入PCR扩增仪中,PCR反应条件为:98℃预变性10min后,进行30个扩增反应循环:97℃ 35 s,62℃35 s,68℃ 4min;最后68℃ 终延伸10min。
PCR反应结束后,取1μL PCR扩增产物,加无核酸酶水稀释10倍后,采用Qseq100TM全自动核酸分析系统进行毛细管电泳检测;同时取1μL PCR 扩增产物,加 8.5μL Hi⁃Di™ Formamide和 0.5μL GeneScan 600 LIZ®size standard,混匀后 98℃变性5min,立即放冰上2min,上ABI 3500Dx仪进行毛细管电泳测序检测。通过3500Dx毛细管电泳测序法,观察结果图中连续峰中间的小凹陷还能发现AGG插入数。
1.2.4 样本CGG重复数的计算
根据正常男性对照样本的CGG重复数,采用数学模型获得受检者CGG重复数及AGG插入信息。
2 结果
对111例样本和一例正常男性对照样本采用Qseq100TM全自动核酸分析系统进行毛细管电泳检测,分析其检测结果(图1),所有样本CGG重复数范围为21~62。绝大部分样本属于正常型(<45个CGG 重复),其中D1609187、D1609192、D1609168共3例样本的CGG重复数大于45。
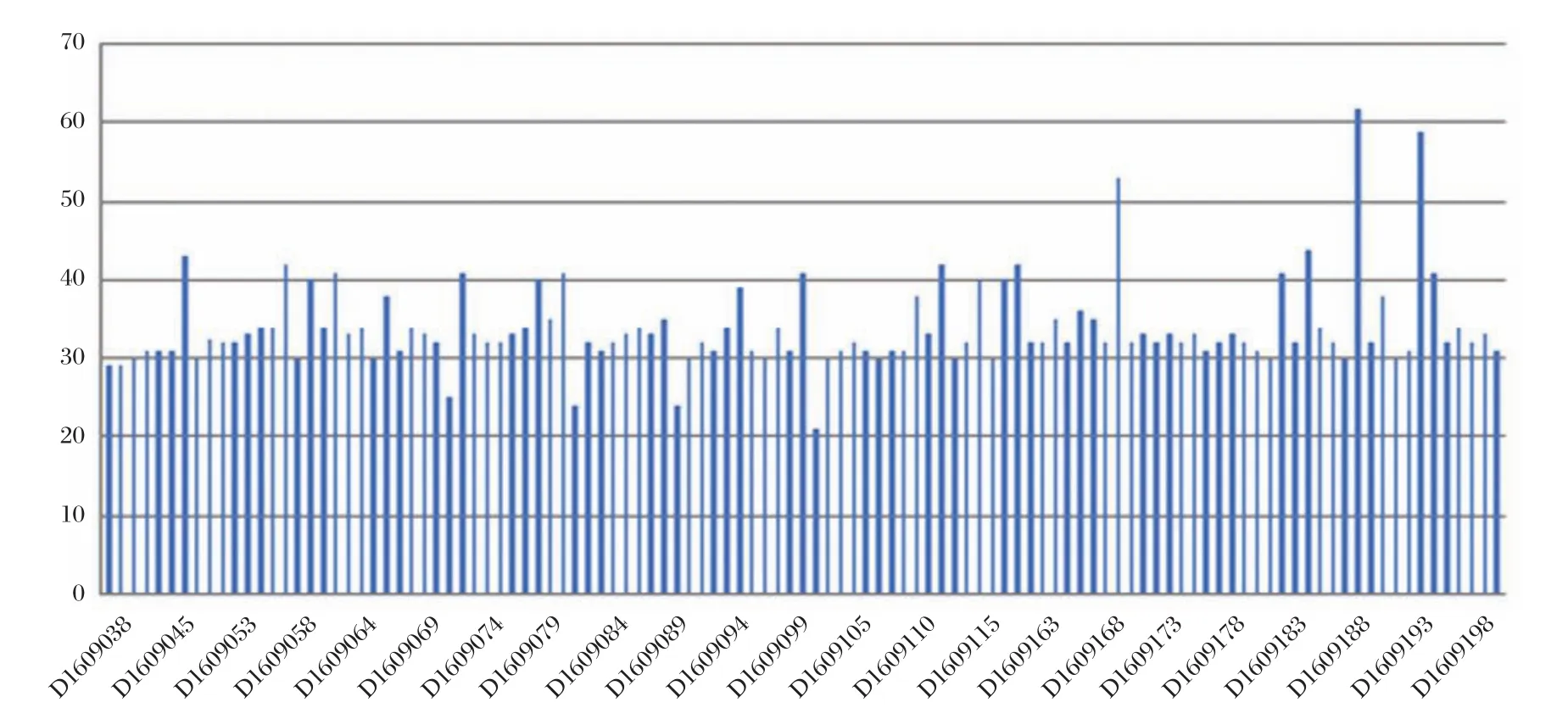
图1 111例样本检测结果图Figure1 Test result of 111 samples
临床检测正常男性样本,Qseq100毛细管电泳检测其扩增目的片段长度为420 bp(图2),计算得出其CGG重复数为30,并且和Qseq100毛细管电泳检测结果一致的是:3500Dx毛细管电泳测序结果显示(图3A)在420 bp处有检测峰,并且观察该样本的X染色体上连续峰中间有2处小凹陷(图3B),说明CGG重复序列中插入了2个AGG。111例自闭症患者中样本D1609187,Qseq100毛细管电泳检测其2条X染色体上扩增的目的片段长度分别为430 bp和516 bp(图2B),计算其CGG重复数分别为33和62,判断为杂合型前突变携带者,3500Dx毛细管电泳测序结果显示(图3C)在430 bp和516 bp处有检测峰,这和Qseq100毛细管电泳检测结果一致,并且观察该样本中一条X染色体上连续峰中间有2处小凹陷(图3D),说明该染色体CGG重复序列中插入了2个AGG,而另一条X染色体上连续峰中间并没有凹陷,说明该X染色体CGG重复序列中没有AGG插入;Qseq100毛细管电泳检测样本D1609192 2条X染色体扩增的目的片段长度分别为434 bp和508 bp(图2C),计算其CGG重复数分别为34和59,判断为杂合型前突变携带者,3500Dx毛细管电泳测序结果显示(图3E)在434 bp和508 bp处有检测峰,这和Qseq100毛细管电泳检测结果一致,并且观察该样本中一条X染色体上连续峰中间有2处小凹陷(图3F),说明该染色体CGG重复序列中插入了2个AGG,而另一条X染色体上连续峰中间并没有凹陷,说明该X染色体CGG重复序列中没有AGG插入;Qseq100毛细管电泳检测样本D1609168的X染色体扩增的目的片段长度为486 bp(图2D,计算其CGG重复数为52,判断为中间型,3500Dx毛细管电泳测序结果显示(图3G)在486 bp有检测峰,这和Qseq100毛细管电泳检测结果一致,并且观察该样本的X染色体上连续峰中间有一处小凹陷(图3H),说明CGG重复序列中插入了一个AGG。
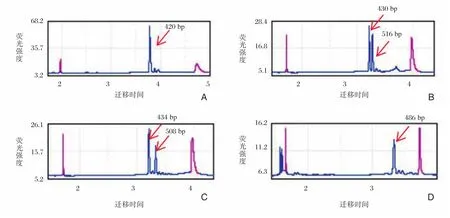
图2 Qseq100毛细管电泳结果图Figure 2 The results of Qseq100 capillary electrophoresis
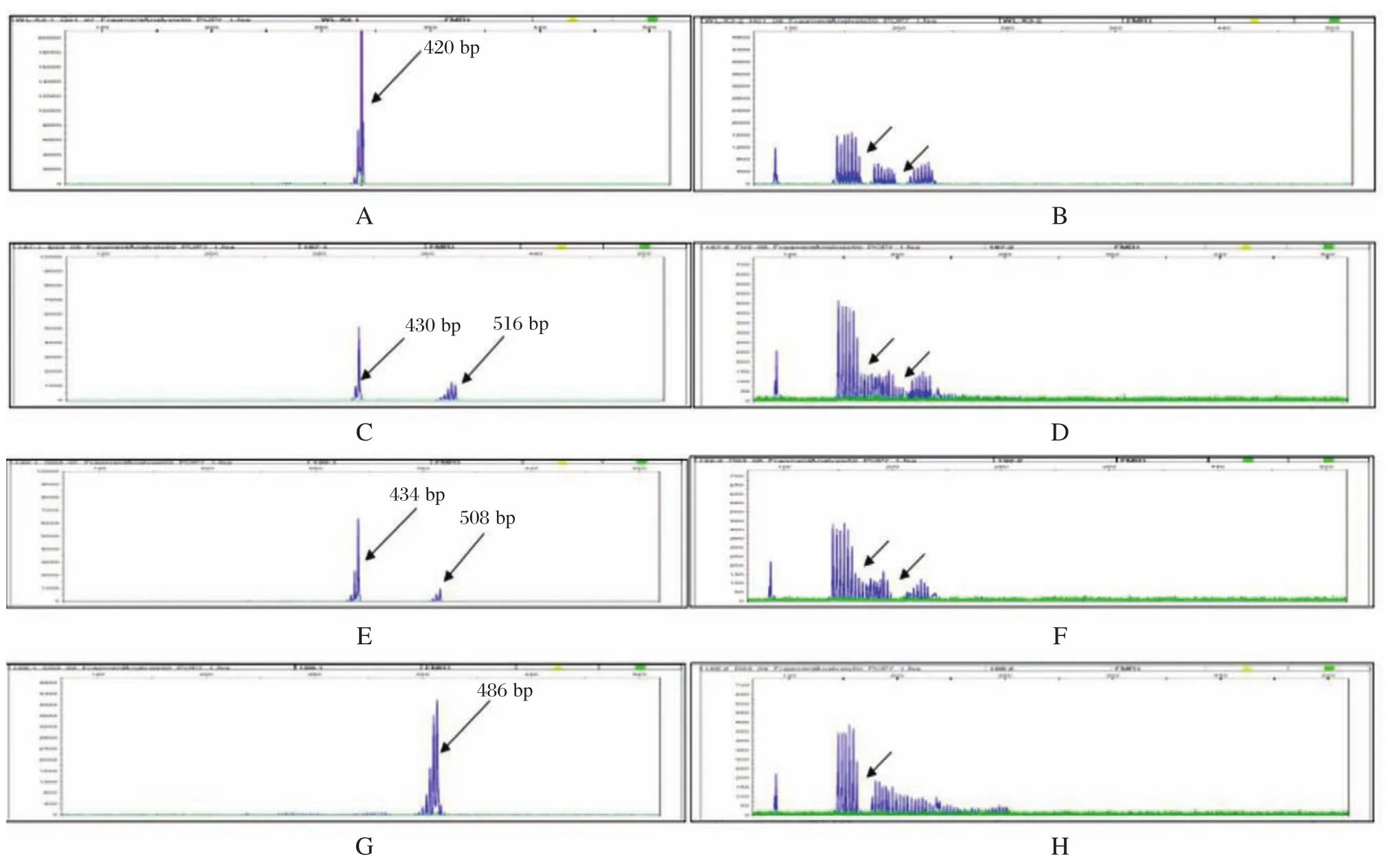
图3 3500Dx毛细管电泳测序结果图Figure 3 3500Dx capillary electrophoresis sequencing results
3 讨论
脆性X综合征常表现出自闭症样症状,如社交恐惧、语言呆板甚至言语交流障碍。而且脆性X综合征是自闭症谱系障碍最常见的共患病[10]。因此进行FMR1基因前突变携带者筛查,具有自闭症类似表型或者自闭症患者是不可忽视的候选人群。CGG(动态突变的最小重复数为59)由亲代向子代传递的过程中会发生动态突变,有报道称亲代向子代传递CGG时的动态突变除了和CGG重复片段长度有关外,还与母亲的年龄以及CGG重复序列中AGG的插入数密切相关[11]。正常的FMR1基因(CGG)n结构中每隔9~11个CGG就会有一个AGG插入,通过稳定性原理,AGG的插入能够增加CGG的稳定性,限制其扩展[12]。缺少AGG插入时,CGG重复数容易扩展,形成前突变。本研究采用三引物荧光PCR⁃毛细管电泳法对收集的111例自闭症样本进行检测,同时使用2种检测系统即Qseq100TM全自动核酸分析系统和ABI 3500Dx仪进行结果比较验证,Qseq100毛细管电泳法可直接分析扩展的目的片段长度,进而计算CGG重复数的范围,3500Dx毛细管电泳测序法同样可以根据测出的目的片段长度计算CGG重复数,同时还可以分析AGG的插入个数从而快速诊断样品特征。该方法首先选取一例临床上已知FMR1基因CGG重复数为30的男性样本作为检测对照,毛细管电泳结果显示其PCR扩增目的片段长度为420 bp,在此基础上计算受检样本的CGG重复数,并且利用3500Dx毛细管电泳测序法对上述方法的检测结果进行验证,发现测序得到的目的片段长度以及计算得出的CGG重复数均和Qseq100毛细管电泳的结果一致。说明我们针对脆性X综合征FMR1基因前突变携带的三引物荧光PCR⁃毛细管电泳法是可行的,能够准确快速地检测出样本的FMR1基因CGG重复数及AGG插入情况。我们对111例自闭症样本进行筛查,分析所有样本的CGG重复数,其中有2例是前突变携带者,1例是中间型。这些结果表明有脆性X综合征患者确实会表现出自闭症样症状,对自闭症患者进行脆性X综合征筛查具有一定的实际意义。因而本方法可用于脆性X综合征和自闭症的辅助诊断。
目前已有多种筛查及诊断脆性X综合征的方法,但每种方法各有其局限性。如细胞遗传学分析虽可以直接观察染色体脆性位点的病变,但检出率较低[13];DNA连锁分析较细胞遗传学分析增加了可信度,但该技术需要有先证者,致使检测受到一定程度的限制;经典的检测方法Southern blot法虽然准确性很高,也有其明显的缺点,该方法对基因组DNA质量和数量的要求较高,需用同位素来标记,具有一定的危害性,并且操作繁杂,另外费用昂贵,耗时长。最重要的是Southern印迹并不能准确地区分前突变和正常序列[14],也无法准确地计算出受检样本的CGG重复数。为此本研究对常规PCR法进行改良,通过采用耐高温酶及碱基替代法、添加PCR增效剂、提高退火温度和改善扩增条件等多个参数优化,实现对FMR1基因中CG含量较高的重复序列进行扩增。本方法具有操作简单、方便,耗时短,且通过Qsep100毛细管电泳法可以准确地计算CGG重复数的优点。这种快捷、经济、有效的脆性X综合征的检测方法的建立,对前突变携带者的群体筛查、高风险胎儿的产前诊断以及脆性X综合征和自闭症的辅助诊断具有较大实际应用价值。
[1]Terracciano A,Chiurazzi P,Neri G.Fragile X syn⁃drome[J].Am J Med Genet C Semin Med Genet,2005,137C(1):32⁃37.
[2]Crawford DC,Acuna JM,Sherman SL.FMR1 and the fragile X syndrome:human genome epidemiology review[J].Genet Med,2001,3(5):359⁃371.
[3]Borra VM,Steenackers E,Freitas FD,et al.Localiza⁃tion of the gene for X⁃linked calvarial hyperostosis to chromosome Xq27.3⁃Xqter[J].Bone,2014,58(1):67.
[4]Lozano R,Rosero CA,Hagerman RJ.Fragile X spec⁃trum disorders[J].Intractable&Rare Diseases Re⁃search,2014,3(4):134⁃146.
[5]牛曼曼,韩颖,秦炯,等.FMR1基因前突变的临床表现和分子机制[J].中华实用儿科临床杂志,2016,31(20):1588⁃1590.
[6]沙莎,贺学,袁东亚,等.应用三引物荧光PCR⁃Sanger测序法检测FMR1全突变者和前突变携带者[J].中华医学遗传学杂志,2016,33(6):844⁃848.
[7]陈萱,赵杨,秦鸣,等.应用Pfu DNA聚合酶进行脆性X综合征的筛查和产前基因诊断[J].中国优生与遗传杂志,2004,12(3):25.
[8]于莉,段然慧.智力低下和孤独症等人群中脆性X综合征的筛查[J].中华医学遗传学杂志,2015,32(4):593⁃596.
[9]滕丽萍,赵正.FMR⁃1基因敲除小鼠的焦虑及探索行为分析[J].中国保健营养旬刊,2014(5):3267.
[10]于莉,段然慧.智力低下和孤独症等人群中脆性X综合征的筛查[J].中华医学遗传学杂志,2015,32(4):593⁃596.
[11]Yrigollen CM,Martorell L,Durbinjohnson B,et al.AGG interruptions and maternal age affect FMR1 CGG repeat allele stability during transmission[J].Journal of Neurodevelopmental Disorders,2014,6(1):1⁃12.
[12]Yrigollen CM,Tassone F,Durbinjohnson B,et al.The role of AGG interruptions in the transcription of FMR1 premutation alleles[J].Plos One,2011,6(7):e21728.
[13]李斌元,马云,何淑雅,等.脆性X智力低下基因FMR1中不稳定DNA序列的研究[J].中华实用医药杂志,2005,5(7):579⁃581.
[14]Grasso M,Boon EM,Filipovic⁃Sadic S,et al.A nov⁃el methylation PCR that offers standardized determina⁃tion of FMR1 methylation and CGG repeat length with⁃out southern blot analysis[J].J Mol Diagn,2014,16(1):23⁃31.
Development ofFMR1gene mutation detection based on tri⁃primer fluorescence PCR⁃capillary electrophoresis and its application in auxiliary diagnosis of autism
SUN Li1,YANG Linyan2,YE Qianping2,YANG Xu3,YANG Xuexi4★
(1.Laboratory of North China Petroleum Administration Bureau General Hospital,Renqiu,Hebei,China,062552;2.Guangzhou Darui Biotechnology Co.,Ltd,Guangzhou,Guangdong,China,510665;3.School of Basic Medicine,Southern Medical University,Guangzhou,Guangdong,China,510515;4.School of Laboratory Medicine and Biotechnology,Southern Medical University,Guangzhou,Guangdong,China,510515)
ObjectiveTo detect the repetition of CGG repeats and repeat numbers of 5′non⁃coding regions ofFMR1gene in autistic patients,and to explore a new method for detecting fragile X syndrome.MethodA total of 111 autistic patients were screened by tri⁃primer fluorescence PCR and capillary electrophoresis(Qseq100TMautomatic nucleic acid analysis system).TheFMR1gene 5′non⁃coding region CGG sequence was detected and the CGG repeats were calculated.The results were verified by ABI 3500Dx capillary electrophoresis sequencing.ResultsAmong the 111 cases of autistic samples,2 cases wereFMR1pre⁃mutation carriers and 1 case was intermediate.This result is consistent with the results of 3500Dx capillary electrophoresis sequencing.ConclusionTri⁃primer fluorescence PCR⁃capillary electrophoresis can be used to detect the CGG repeats of 5′non ⁃coding regions ofFMR1gene.It is of great value to study on the pathogenesis and crowd screening of fragile X syndrome.
Autism;FMR1gene;Fragile X syndrome;Tri-primer fluorescence PCR-capillary electrophoresis
广东省科技计划(2015A030401040)
★通讯作者:杨学习,E⁃mail:yxxzb@sohu.com
