胺鲜酯提高雨生红球藻(HaematococcuspluvialisLUGU)虾青素含量的作用
2017-09-18,,
,,
(1.昆明理工大学生命科学与技术学院,云南昆明 650500; 2.云南省第一人民医院胸外科,云南昆明 650228)
胺鲜酯提高雨生红球藻(HaematococcuspluvialisLUGU)虾青素含量的作用
丁巍1,余旭亚1,彭俊2,*
(1.昆明理工大学生命科学与技术学院,云南昆明 650500; 2.云南省第一人民医院胸外科,云南昆明 650228)
探究添加不同浓度的胺鲜酯(diethyl aminoethyl hexanoate,DA-6)在雨生红球藻HaematococcuspluvialisLUGU培养过程中对生物量、虾青素含量、活性氧(ROS)水平以及叶绿素浓度的作用。结果表明,0.1 mmol/L DA-6可以略微增加生物量(0.52 g/L),但相对于同一天对照组,可以显著(p<0.05)提高虾青素含量,最大含量可达24.94 mg/g,是对照组(16.43 mg/g)的1.52倍,此时藻细胞内ROS水平以及叶绿素浓度相比于对照组均出现了降低。研究表明,DA-6诱导可以促进虾青素含量的提高,这为虾青素产业化生产提供了一种有效的策略。
胺鲜酯,雨生红球藻,虾青素,活性氧,叶绿素
虾青素(astaxanthin)是一种具有高附加值的酮式类胡萝卜素,由于其具有极强的抗氧化性,在食品、保健品、医药行业得到了广泛的应用[1-3]。目前天然虾青素主要来源有微藻、植物、细菌、水产品下脚料、红发夫酵母[4],绿藻门单细胞绿藻雨生红球藻由于能积累比其他来源高的虾青素(达藻细胞干重的5%)而备受关注[5]。
诱导条件下,促进雨生红球藻大量积累虾青素已成为当前研究的热点。研究发现雨生红球藻在加入诱导子的条件下,如茉莉酸、赤霉素、乙烯利等能促使雨生红球藻大量积累虾青素[6-7]。胺鲜酯(diethyl aminoethyl hexanoate,DA-6)是一种合成的植物生长调节剂,能刺激植物合成叶绿素、蛋白、核酸,增强干物质的积累,提高碳、氧的代谢,延长植物的生长期[8]。Jiang等[9]发现,添加适宜浓度的DA-6可以促进微藻次级代谢产物的积累。由此推测,DA-6对雨生红球藻中虾青素的积累可能具有一定的影响。

本文采用DA-6作为诱导剂,测定了雨生红球藻生长、叶绿素含量、ROS以及虾青素含量等指标,以便为在生产上利用活性氧诱生剂提高虾青素含量提供技术支持。
1 材料与方法
1.1材料与仪器
雨生红球藻(HaematococcuspluvialisLUGU) 本实验室筛选、保存;胺鲜酯(DA-6) ≥99.8%,(江苏)金坛茂盛精细化工;DMSO ≥99.5%,北京鼎国昌盛生物技术有限公司;KOH ≥99.5%,北京鼎国昌盛生物技术有限公司;甲醇 分析纯,北京鼎国昌盛生物技术有限公司;2′,7′-二氯荧光黄双乙酸盐(DCFH-DA) (上海)碧云天。
XS-212-202显微镜 JNOEC;VS-840-1超净工作台 上海博讯;FD5-12冷冻干燥机 SIM International Group;Ultrospec 2100pro紫外可见分光光度计 Amersham Biosciences;LDZX-50KBS灭菌锅 上海申安;FA2004N分析天平 上海箐海;HHW-D6水浴锅 金坛双捷;5804R离心机 Eppendorf;1730R高速冷冻离心机 Labogene Scanspeed;DS-8510DTH超声波微波组合体系 上海生析;RF-540荧光分光光度计 日本岛津。
1.2实验方法
1.2.1 雨生红球藻的培养 以BBM培养基(Bold’s Basal Medium)为基础培养基[15],取保藏于试管中的藻种,接种到3 L(内置2 L培养基)光生物反应器中,室内恒温(25±1) ℃,光照强度2800 Lx,通入0.1 vvm的无菌空气进行培养,直至培养到指数中期(12 d,约6.5×105cells/mL)。
1.2.2 胺鲜酯处理 将培养至指数中期的种子液3800×g离心5 min,用无菌水洗去营养盐,然后把藻液沉淀重新悬浮到0.25 g/L NaNO3BBM(MBBM)[16]培养基中(接种量约为2×105cells/mL,培养基总体积为400 mL)。用去离子水溶解DA-6作为母液,将不同体积的DA-6母液添加到MBBM培养基诱导培养,使诱导培养基中添加DA-6浓度分别为0(Control)、0.05、0.1、0.2 mmol/L(保持液位相等),每组设3个平行样。持续鼓入0.4 vvm的含1.5%二氧化碳的无菌空气,24 h 8000 Lx光照,置于(27±1) ℃室内培养15 d,以诱导藻细胞积累虾青素。每隔一天取样一次,测定H.pluvialisLUGU虾青素含量和生物量。
1.2.3 虾青素含量和生物量浓度的测定 为了测定基础培养基中培养的H.pluvialisLUGU虾青素的含量,采用Boussiba等[17]的方法稍加改进测定其虾青素含量。每隔一天定期取出5 mL处于诱导阶段的藻液,5000 r/min离心5 min,弃上清液。于收集的藻细胞沉淀中加入5% KOH和30%甲醇混合液置于65 ℃水浴锅内5 min,5000 r/min离心收集沉淀,加入3 mL二甲亚砜(DMSO),利用超声波破壁(20 s/5 s,输出功率40 W),反复抽提直至藻体发白后,高速离心机10000 r/min离心10 min,取上清液于490 nm下测定OD值,按公式(1)计算虾青素浓度。另外,每隔一天定期取出5 mL处于诱导阶段的藻液5000 r/min离心10 min、-20 ℃冷冻、干燥、称重,按公式(2)计算藻细胞生物量浓度,按公式(3)得虾青素含量。
c=(4.5×A490×Va)/Vb
式(1)
式中:c为虾青素浓度(mg/L),4.5为固定常数,A为OD490值,Va为DMSO的体积(mL),Vb为藻液体积(mL)。
DBW=WA/V
式(2)
式中,DBW为细胞生物量浓度(g/L),WA:藻粉干重(g);V:藻液体积(L)。
P=c/DBW
式(3)
式中,P为虾青素含量(mg/g),c为虾青素浓度(mg/L),DBW为细胞生物量浓度(g/L)。
1.2.4 微藻叶绿素和活性氧的测定 取微藻培养液5 mL,5000×g离心10 min,弃上清得藻细胞,加5 mL 90%丙酮,振荡混匀,在40 ℃恒温振荡2 h,5000×g离心10 min,重复上述操作直至藻体发白,取上清液,分别在663、645 nm测定光密度值,提取液中叶绿素含量按Becker的方法计算[18]。叶绿素浓度(mg/L)=20.21×OD645+8.02×OD663。
取微藻培养液5 mL,调节细胞浓度1×105cells/mL,5000×g离心10 min,弃上清得藻细胞,去离子水洗涤两遍去除残留培养基,加10 mmol/L 2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)1 mL,避光37 ℃恒温振荡孵育30 min,5000×g离心10 min,弃上清,PBS缓冲液(0.05 mmol/L,pH=7)洗涤两次去除未反应的DCFH-DA,5000×g离心10 min,弃上清,加3 mL PBS缓冲液(0.1 mmol/L,pH=7)重新悬浮。DCFH-DA作为荧光探针,本身不具有荧光,进入细胞后被酯酶水解为二氯荧光黄(DCFH),在活性氧存在时DCFH被氧化为不能透过细胞膜的强绿色荧光物质DCF,强度与细胞内活性氧水平成正比,通过荧光分光光度计,488 nm激发波长,500~600 nm吸收波长检测细胞荧光强度,对细胞内ROS产生水平进行测定。
1.2.5 数据处理 本文全部实验均设置三组平行,利用ANOVA(SPSS19.0)一步法分析实验数据。最小显著性差异进行多重比较检验调查不同实验的组间差异,且当p<0.05具有显著性意义。
2 结果与分析
2.1 DA-6对诱导培养微藻细胞生长的影响
在诱导条件下,雨生红球藻细胞的生长发生明显的变化。图1显示,添加不同浓度的DA-6对藻细胞的生长产生了显著地影响,刚接种后各组生物量增加缓慢,可能是由于刚转入新环境,其代谢系统需要适应新的环境,同时要合成酶、辅酶、其他代谢产物等,所以此时期生物量浓度增加较低。3 d后,各组开始表现出不同速率的生长,代谢、酶系逐渐变得活跃,在诱导培养的第15 d达到最大值。对照组最高生物量达到0.67 g/L,实验组的DA-6浓度从0.05 mmol/L增加到0.2 mmol/L,对应的生物量最大值分别为0.46、0.52、0.56 g/L,相比之下,虽然在接种后生物量浓度均出现了增加但都低于对照组生物量。由此可见藻细胞在诱导阶段,添加诱导剂DA-6对藻细胞的生长并没有起到积极作用。这种现象与之前文献中发现低浓度2,4-D不能促进藻细胞生长相同[19]。这可能是由于DA-6对生长的调节作用还依赖于藻种以及培养条件。
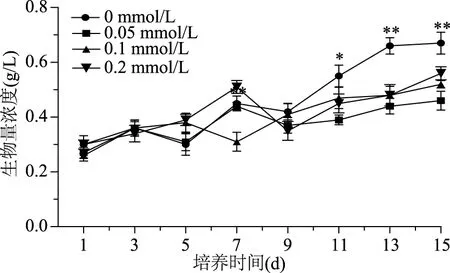
图1 不同质量浓度DA-6对雨生红球藻生长的影响Fig.1 Effect of DA-6 on biomass of H. pluvialis during induction days注:*:同一时间与对照组比较差异显著(p<0.05); **:同一时间与对照组比较差异极显著(p<0.01),图2、图4同。
2.2 DA-6对微藻含量的影响
从虾青素积累结果来看(图2),在诱导培养条件下,雨生红球藻的细胞分裂虽然受到了抑制,但能加速虾青素的积累并提高累积量。接种后3 d开始,各组虾青素开始快速增加,藻细胞逐渐从绿色游动细胞转变为红色包囊细胞,但虾青素积累的高峰时间却不相同。对照组虾青素含量在诱导培养阶段持续增加,在9 d达到了最大值16.43 mg/g。实验组中,在0.1 mmol/L胺鲜酯处理下,虾青素含量在13 d时达到了最大值24.94 mg/g,是对照组的1.52倍。11 d时,与对照组相比,虽然0.05 mmol/L DA-6处理组虾青素含量表现出了促进作用(18.75 mg/g),但与0.1 mmol/L处理组最高值相比还是相对较低,没有对虾青素含量提高起到明显的促进作用。0.2 mmol/L DA-6处理组虾青素含量一直处于较低水平,在11 d含量达到最大值16.47 mg/g,说明只有合适浓度的DA-6 才能促进H.pluvialisLUGU虾青素含量的增加。
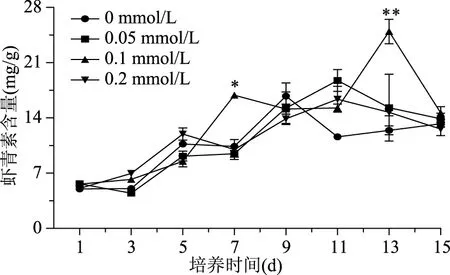
图2 不同质量浓度DA-6对雨生红球藻虾青素含量的影响Fig.2 Effect of DA-6 on astaxanthin content of H. pluvialis during induction days
相对0.05、0.1 mmol/L处理组,0.2 mmol/L处理组虽然能增加生物量浓度,但却不利于虾青素含量的增加,此结论与添加不同浓度盐诱导积累虾青素结果相同[20],也没有表现出良好的剂量效应。推测可能是由于低剂量的诱导物未能激活虾青素合成相关位点活性,相反,高剂量的诱导物则是抑制了虾青素合成相关位点活性。随后对0.1 mmol/L处理组培养基DA-6浓度进行检测,结果如图3所示,在微藻的培养过程中培养基中DA-6浓度随培养时间延长快速下降,经15 d培养仅剩余0.05 mmol/L,因此推断DA-6虽然没有对H.pluvialisLUGU的生长起到积极地作用,但虾青素含量的增加可能与DA-6的消耗有关。可能是由于外源DA-6的添加只干扰了细胞的分裂,但并没有影响H.pluvialis对碳源的同化能力[21]。
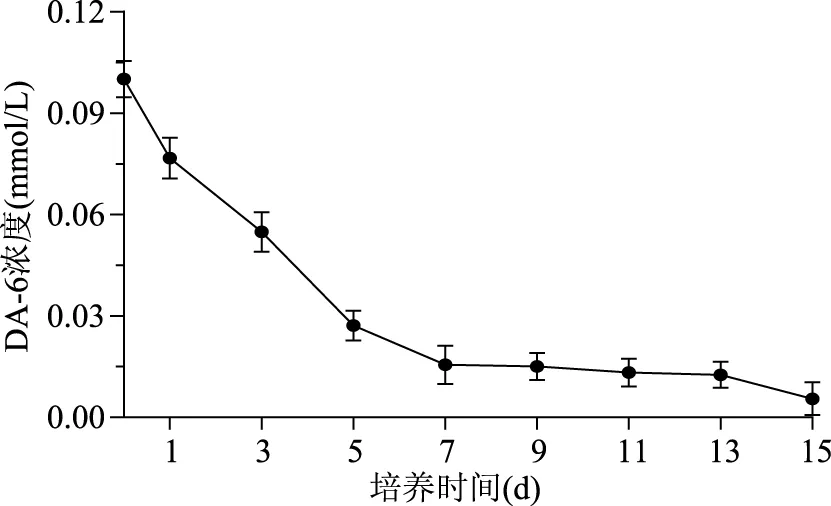
图3 培养期间培养基DA-6浓度变化Fig.3 Changes of DA-6 concentration in the medium during induction days
2.3 DA-6对微藻活性氧的影响
2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)是非标记性的氧化敏感的荧光探针,本身不具有荧光,进入细胞后被酯酶水解为二氯荧光黄(DCFH),在活性氧存在时DCFH被氧化为不能透过细胞膜的强绿色荧光物质DCF,强度与细胞内活性氧水平成正比[22]。因此可通过检测DCF荧光强度反映细胞内ROS变化。从图2可以看出,0.1 mmol/L DA-6处理组在培养第13 d相比其他浓度DA-6处理组虾青素最大含量要高,因此对0.1 mmol/L DA-6 处理组和对照组细胞内ROS水平进行检测,结果见图4。从图4中看出,对照组在接种后的1 d开始,细胞内ROS水平开始增加,在3 d达到了最大值,然后开始逐渐降低,0.1 mmol/L DA-6处理组相比对照组,在诱导培养的1 d内增加更剧烈,可能是由于DA-6的加入提高了碳、氧的代谢,使藻细胞提前进入稳定期,从而诱发了ROS的大量产生,随即随着培养时间增加虾青素开始逐渐积累,并有效淬灭细胞体内过多的ROS,使细胞内ROS水平出现了降低,由图2看出,此段时间虾青素大量积累。由此推测,ROS作为一种次级信号分子[23],可能是诱导条件下,其水平的快速增加激活了虾青素合成相关元件的活性,从而促进了虾青素的积累,降低了细胞内ROS水平,这与之前的研究,活性氧胁迫能够促进单细胞虾青素含量的增加相同[24]。由此可见,适宜浓度的DA-6既可以产生活性氧胁迫促进虾青素的合成,又对细胞的伤害较小,细胞密度下降幅度小,因此其总虾青素含量相对较高。
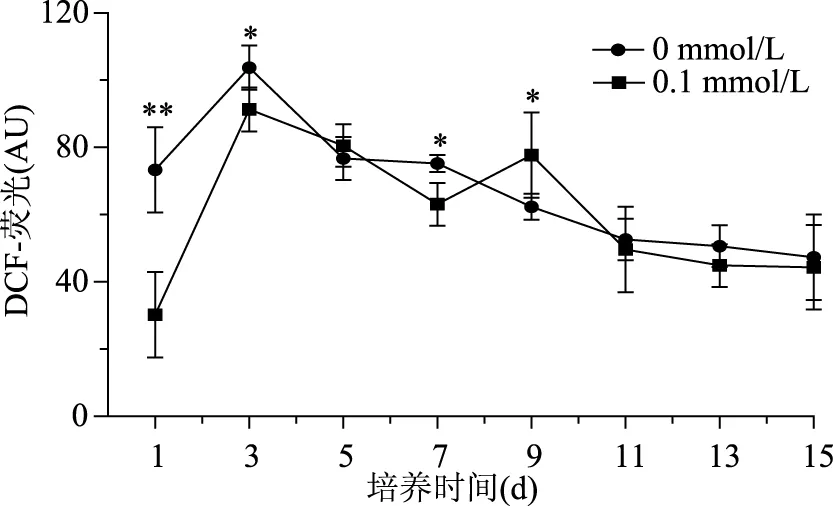
图4 DA-6对雨生红球藻细胞活性氧水平的影响Fig.4 Effect of DA-6 on ROS of H. pluvialis during induction days
2.4 DA-6对微藻叶绿素的影响
DA-6对微藻细胞叶绿素浓度的影响实验结果见图5,可见在培养的前3 d,对照组和0.1 mmol/L DA-6处理组叶绿素浓度均出现了增加,并都在第3 d达到了峰值,接着随着培养时间的延续缓慢地降低。虽然对照组和0.1 mmol/L DA-6 处理组在诱导培养的过程中都出现了增加与减少,但在此过程中0.1 mmol/L DA-6处理组叶绿素浓度基本都低于对照组,可能是由于ROS的增加影响了叶绿素的合成。这与之前研究,使用活性氧诱生剂增加虾青素积累的结果,活性氧诱生剂处理可大幅降低叶绿素含量[25]相同。另一方面,对照组和0.1 mmol/L DA-6处理组分别在诱导培养的第5、7 d,叶绿素浓度出现了略微的增加。根据以上变化规律推断:在活性氧产生的前期,细胞虾青素合成相对滞后,不能及时清除氧自由基,活性氧的毒害作用损伤细胞,叶绿素浓度在ROS产生后开始降低。随着虾青素逐渐积累,活性氧对微藻细胞的毒害作用逐渐被抵消,从而叶绿素浓度不再急剧下降或略微增加。另外,虾青素合成是利用细胞中已经存在的无色前体或碳水化合物合成而来[21],虾青素的大量合成消耗了细胞内的无色前体或碳水化合物,从未降低细胞内叶绿素含量。然而,这些推断还需进一步实验证明。
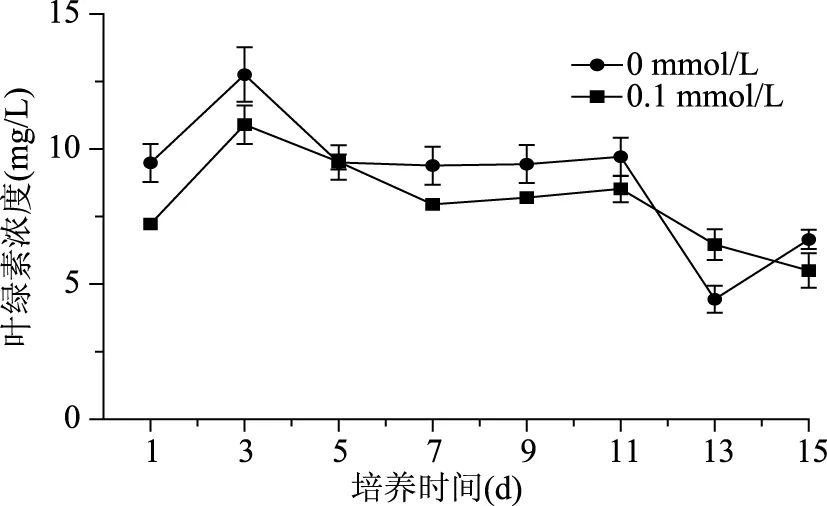
图5 DA-6对雨生红球藻细胞叶绿素的影响Fig.5 Effect of DA-6 on chlorophyll of H. pluvialis during induction days
3 结论
适宜浓度的DA-6有利于促进雨生红球藻H.pluvialisLUGU细胞虾青素含量的提高。添加浓度为0.1 mmol/L DA-6,微藻细胞虾青素含量达到最大24.94 mg/g,是对照组的1.52倍;通过对细胞内ROS、叶绿素分析,结果表明诱导条件下诱导培养前期细胞内活性氧水平上升,可以作为信号分子激活H.pluvialisLUGU利用细胞内的无色前体或碳水化合物合成虾青素进行防御。本文就DA-6与虾青素合成的关系进行了初步的分析,帮助人们了解植物生长调节剂与虾青素合成启动之间的联系。
[1]Han D,Li Y,Hu Q. Astaxanthin in microalgae:pathways,functions and biotechnological implications[J]. Algae,2013,28(2):131-147.
[2]Sheikhzadeh N,Panchah I K,Asadpour R,et al. Effects of Haematococcus pluvialis in maternal diet on reproductive performance and egg quality in rainbow trout(Oncorhynchusmykiss)[J]. Animal Reproduction Science,2012,130(1):119-123.
[3]Tominaga K,Hongo N,Karato M,et al. Cosmetic benefits of astaxanthin on humans subjects[J]. Acta Biochimica Polonica,2012,59(1):43.
[4]黄文文,洪碧红,易瑞灶,等. 虾青素生产方法及生物活性的研究进展[J]. 中国食品添加剂,2013(6):214-218.
[5]Boussiba S. Carotenogenesis in the green algaHaematococcuspluvialis:cellular physiology and stress response[J]. Physiologia Plantarum,2000,108(2):111-117.
[6]Lu Y,Jiang P,Liu S,et al. Methyl jasmonate-or gibberellins A3-induced astaxanthin accumulation is associatedwith up-regulation of transcription ofβ-carotene ketolase genes(bkts)in microalgaHaematococcuspluvialis[J]. Bioresource Technology,2010,101(16):6468-6474.
[7]高政权,孟春晓. 外源乙烯利对雨生红球藻中虾青素积累的影响[J]. 食品科学,2007,28(10):376-380.
[8]Jiang Y,Jiang Y,He S,et al. Dissipation of diethyl aminoethyl hexanoate(DA-6)residues in pakchoi,cotton crops and soil[J]. Bulletin of Environmental Contamination and Toxicology,2012,88(4):533-537.
[9]Jiang L,Pei H,Hu W,et al. Effect of diethyl aminoethyl hexanoate on the accumulation of high-value biocompounds produced by two novel isolated microalgae[J]. Bioresource Technology,2015,197:178-184.
[10]Heo S J,Ko S C,Kang S M,et al. Cytoprotective effect of fucoxanthin isolated from brown algae Sargassum siliquastrum against H2O2-induced cell damage[J]. European Food Research and Technology,2008,228(1):145-151.
[11]Terao J. Antioxidant activity of beta-carotene-related carotenoids in solution[J]. Lipids,1989,24:659-661.
[12]Asada K. The water-water cycle in chloroplasts:scavenging of active oxygens and dissipation of excess photons[J]. Plant Physiol Plant Molecular Biology,1999,50:601-639.
[13]Fridovich I. Superoxide radical and superoxide dismutases[J]. Journal of Biochemistry,1995,64:97-112.
[14]Kobayashi M,Kakizono T,Nagai S. Enhanced carotenoid biosynthesis by oxidative stress in acetate-induced cyst cells of a green unicellular alga,Haematococcuspluvialis[J]. Applied and Environmental Microbiology,1993,59(3):867-873.
[15]Boussiba S,Vonshak A. Astaxanthin accumulation in the green algaHaematococcuspluvialis[J]. Plant and Cell Physiology,1991,32(7):1077-1082.
[16]Orosa M,Torres E,Fidalgo P,et al. Production and analysis of secondary carotenoids in green algae[J]. Journal of Applied Phycology,2000,12(3-5):553-556.
[17]Boussiba S,Vonshak A. Astaxanthin accumulation in the green alga Haematococcus pluvialis[J]. Plant and Cell Physiology,1991,32(7):1077-1082.
[18]Becker E W. Microalgae:biotechnology and microbiology[M]. Cambridge University Press,1994.
[19]de Jesus Raposo M F,de Morais R M S C. Influence of the Growth Regulators Kinetin and 2,4-D on the Growth of Two Chlorophyte Microalgae,HaematococcuspluvialisandDunaliellasalina[J]. Journal of Basic and Applied Sciences,2013,9:302-308.
[20]Liang C X,Li Y B,Xu J W,et al. Enhanced biosynthetic gene expressions and production of ganoderic acids in static liquid culture of Ganodermalucidum under phenobarbital induction[J]. Applied Microbiology and Biotechnology,2010,86(5):1367-1374.
[21]邱保胜,刘其芳. 红球藻研究进展[J]. 水生生物学报,2000(5):546-554.
[22]He Y Y,Häder D P. UV-B-induced formation of reactive oxygen species and oxidative damage of the cyanobacteriumAnabaenasp.:protective effects of ascorbic acid and N-acetyl-L-cysteine[J]. Journal of Photochemistry and Photobiology B:Biology,2002,66(2):115-124.
[23]Rastogi R P,Singh S P,Häder D P,et al. Detection of reactive oxygen species(ROS)by the oxidant-sensing probe 2′,7′-dichlorodihydrofluorescein diacetate in the cyanobacteriumAnabaenavariabilisPCC 7937[J]. Biochemical and Biophysical Research Commol/Lunications,2010,397(3):603-607.
[24]Kobayashi M,Kakizono T,Nagai S. Enhanced carotenoid biosynthesis by oxidative stress in acetate-induced cyst cells of a green unicellular alga,Haematococcuspluvialis[J]. Applied and Environmental Microbiology,1993,59(3):867-873.
[25]王劲,段舜山. 活性氧对雨生红球藻生长及虾青素含量的影响[J]. 生态科学,2006,25(3):213-215.
EffectofdiethylaminoethylhexanoateonastaxanthincontentinHaematococcuspluvialisLUGU
DINGWei1,YUXu-ya1,PENGJun2,*
(1.Faculty of Life Sciences and Technology,Kunming University of Science and Technology,Kunming 650500,China; 2.Department of Thoracic Surgery,the First People’s Hospital of Yunnan Province,Kunming 650228,China)
It was studied the effects of different concentrations of DA-6 inHaematococcuspluvialisLUGU cultivation process on biomass,astaxanthin content,reactive oxygen species(ROS)level and chlorophyll concentration. The results demonstated that the 0.1 mmol/L DA-6 might slightly increase the biomass(0.52 g/L),but optimal for astaxanthin production with 24.94 mg/g,which was 1.52 times than that of the control(16.43 mg/g).Meanwhile,intracellular ROS level and chlorophyll concentration compared with the control group in the lower. The research showed that DA-6 induction could promote astaxanthin accumulation inHaematococcuspluvialisLUGU,which provided an effective strategy for the industrialization of astaxanthin.
diethyl aminoethyl hexanoate(DA-6);HaematococcuspluvialisLUGU;astaxanthin;reactive oxygen species(ROS);chlorophyll
2017-01-09
丁巍(1993-),男,硕士研究生,研究方向:微藻资源开发,E-mail:dingweikmust@163.com。
*通讯作者:彭俊(1972-),男,硕士,主任医师,研究方向:胸外科诊疗,E-mail:389647518@qq.com。
云南省健康科技计划项目(2014 NS227)。
TS201.2
:A
:1002-0306(2017)16-0150-05
10.13386/j.issn1002-0306.2017.16.028
