猪血浆蛋白水解物对水包油型乳状液氧化稳定性的影响
2017-09-18,,,,
, ,,,
(东北农业大学食品学院,黑龙江哈尔滨 150030)
猪血浆蛋白水解物对水包油型乳状液氧化稳定性的影响
李月,刘骞,陈益春,孔保华,夏秀芳*
(东北农业大学食品学院,黑龙江哈尔滨 150030)
本实验主要研究了猪血浆蛋白水解物(Porcine plasma protein hydrolysate,PPPH)对水包油型(O/W型)乳状液储藏过程氧化稳定性的影响。分别将PPPH以0、2.5、5、10和20 mg/mL的浓度添加到以Tween-20为乳化剂的菜籽油O/W型乳状液中,测定乳状液在37 ℃条件下储藏10 d时间内的荧光光谱分析、共轭二烯(Conjugated diene,CD)和硫代巴比妥酸值(Thiobarbituric acid reactive substances,TBARS)的变化趋势。研究结果表明,色氨酸的氧化降解发生在蛋白氧化的初级阶段,而荧光蛋白氧化产物(Fluorescent protein oxidation products,FP)的形成是蛋白氧化第二阶段的产物。另外,在乳化体系储藏期间,与对照组相比,添加2.5 mg/mL PPPH的处理组具有最高的色氨酸荧光强度和FP(p<0.05),同时具有最低的CD和TBARS值(p<0.05)。与此同时,色氨酸荧光强度与CD含量和TBARS值之间呈现显著的负相关关系。总之,PPPH的添加能够显著提高O/W型乳状液的氧化稳定性,为其作为抗氧化剂在乳状液食品中的潜在应用奠定了理论基础。
猪血浆蛋白水解物,乳状液,色氨酸荧光光谱,氧化稳定性,脂质氧化
在食品加工贮藏过程中,氧化会产生多种自由基,引起食品发生氧化酸败,产生难闻的气味,降低产品质量,减少食品贮藏期。为防止食品变质带来的危害,抑制食品的氧化就尤为重要,而防止氧化最直接有效的方法就是添加抗氧化剂[1]。现已有研究者将抗氧化剂添加到乳状液中以抑制氧化,提高乳状液的稳定性[2-5]。作为传统抗氧化剂的潜在替代品,天然来源的抗氧化剂更符合现代人对食品安全营养的需求,因此开发天然来源的抗氧化剂引起了食品制造商的广泛关注[6-7]。乳状液在油滴粒径减小的过程中会产生较大的界面面积因而易于被氧化,而动植物蛋白经适度水解所产生的由多肽组成的蛋白水解物可以在油滴表面形成物理屏障以阻碍氧化剂的渗入和扩散[2,8],并且能够迅速分散在油水界面上的同时形成较大的界面层,从而起到抑制脂质氧化的作用[9]。
由于O/W型乳状液容易发生分层、絮凝、聚集等不稳定现象,可以通过添加表面活性剂来降低乳化体系的液面张力、增加油滴之间的排斥力以防止聚集现象的再次发生[10-11]。此外,研究还发现一些食品级表面活性剂(比如吐温、斯潘、单甘酯等)能够与蛋白水解物协同作用在油滴表面,从而改善由蛋白水解物制备的乳化体系的稳定性[12]。虽然已经有大量的研究证明猪血浆蛋白水解物具有良好的抗氧化活性,但其在植物油预乳化体系中抑制脂质和蛋白氧化的抑制机制研究相对较少。因此,本研究以Tween-20为乳化剂的菜籽油水包油型(O/W型)乳状液为基础,通过添加不同浓度的猪血浆蛋白水解物,以荧光光谱扫描结合传统理化指标,分析探讨乳状液在贮藏期间氧化稳定性的变化,为蛋白水解物在复杂食品体系中的应用奠定理论基础。
1 材料与方法
1.1材料与仪器
猪血浆蛋白粉 黑龙江北大荒肉类有限公司;碱性蛋白酶(酶活为2.4 AU/g) 丹麦Novozymes公司;菜籽油 哈尔滨九三油脂;十二烷基磺酸钠(SDS) Sigma公司;磷酸二氢钠、磷酸氢二钠 天津市巴斯夫化工有限公司;硫代巴比妥酸、三氯乙酸、盐酸、异辛烷、异丙醇等 哈尔滨市万太生物药品公司。
JD500-2电子天平 沈阳龙腾电子称量仪器有限公司;AL-104型精密电子天平、FE20K型pH计 上海梅特勒-托利多仪器设备有限公司;DK-8B电热恒温水浴锅 上海惊宏实验设备有限公司;JB-2恒温磁力搅拌器 上海雷磁新径仪器有限公司;GL-21M冷冻离心机 湖南湘仪实验室仪器开发有限公司;TU-1800紫外可见光分光光度计 北京普析通用仪器有限公司;T18匀浆机 德国IKA公司;SPCH-10高压均质机 安盛联合科技有限公司。
1.2实验方法
1.2.1 猪血浆蛋白水解物(PPPH)的制备 根据Liu等人[13]的方法将加热处理(95 ℃,5 min)的猪血浆蛋白水溶液(4% w/w,pH8.0)用碱性蛋白酶在55 ℃下水解1 h,酶与底物浓度之比为2∶100 (w/w),反应过程中不断加入1 mol/L的NaOH,使pH保持8.0不变。水解结束后95 ℃水浴5 min进行灭酶,然后用1 mol/L HCl 将水解液pH调至7.0。水解物以9000×g离心10 min除去不溶颗粒。
1.2.2 乳状液的制备 将10 wt%的菜籽油和90 wt%的水相溶液用高速均质机在13500 r/min下乳化2 min后,35 MPa下经高压均质机均质两次。加入叠代钠(0.03%,w/v)进行抑菌。其中,水相为Tween-20溶于不同浓度的PPPH(0、2.5、5、10、20 mg/mL)溶液,使Tween-20的最终浓度为10 mg/mL。
1.2.3 荧光光谱扫描 通过使用荧光光谱法测定乳状液中天然色氨酸荧光损失和蛋白质氧化产物的荧光排放来评价猪血浆蛋白的氧化。
参照Estévez等人[14]的方法用磷酸盐缓冲溶液(5 mL)稀释乳状液(检测色氨酸荧光时,向磷酸盐缓冲溶液中加入100 μL的乳状液;检测FP时,向磷酸盐缓冲溶液中加入250 μL的乳状液),混匀后分散在4 mL石英荧光比色皿中。当激发波长为283 nm时,在320~400 nm之间记录色氨酸发射光谱;当激发波长为350 nm时,在400~450 nm之间FP发射光谱。在这两种测量中,激发和发射狭缝宽度设置是10 nm,以240 nm/min的速度收集数据。
1.2.4 共轭二烯烃的测定 按照Viljanen等人[11]的方法进行分离分析。100 μL乳液与1.5 mL异辛烷-2-丙醇(3∶1,v/v)混合,涡流10 s,进行三次。在548×g下离心5 min得到0.2 mL有机溶剂相,用5 mL异辛烷稀释混匀,在234 nm下测量吸光度,使用25200 M-1·cm-1作为摩尔消化系数来计算CD。
1.2.5 硫代巴比妥酸值的测定 参考Mei等人[15]的方法并稍作修改。硫代巴比妥酸溶液的配制:将0.375 g硫代巴比妥酸、15 g的三氯乙酸、12 mol/L的盐酸1.76 mL和82.9 mL水混合,并与2%的BHA溶液3 mL混匀。取上述溶液4 mL,样品1 mL以及水1 mL混匀,在沸水浴中加热15 min,冷却到室温,过0.45 μm滤膜,得到的滤液在532 nm处测其吸光度。以1,1,3,3-四乙氧基丙烷做标准曲线(y=0.8133x-0.051;其中:y为吸光度,x为硫代巴比妥酸值),确定样品中的TBARS值。
1.3统计分析
每个实验重复3次,结果表示为平均值±标准差。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(p<0.05)分析使用Tukey HSD程序,采用Sigmaplot 11.0软件作图。
2 结果与分析
2.1乳状液贮藏期间荧光光谱的变化
由于乳状液中同时含有小分子肽和油脂,所以油脂的氧化也会引起小分子肽的氧化[16]。因此,本研究用色氨酸荧光光谱扫描的方法来测定乳状液在0~10 d储藏期内的蛋白氧化。Nooshkam等人[17]通过研究发现,色氨酸能够在与氧分子发生色氨酸过氧化基反应后生成氢过氧化物,从而能够通过色氨酸荧光的损失来判断脂质体或者乳状液中蛋白氧化的程度。由图1可以看出,在乳状液储藏期间,PPPH的含量从2.5 mg/mL增加到20 mg/mL时,乳状液的荧光强度显著降低(p<0.05),添加2.5 mg/mL PPPH的乳状液具有最高的色氨酸荧光强度,而含有10、20 mg/mL PPPH的乳状液的色氨酸荧光损失较为严重。而随着时间的推移,色氨酸荧光强度逐渐降低(p<0.05)。在乳状液存储过程中,氨基酸氧化降解会导致色氨酸荧光损失,因此乳状液荧光强度较低时蛋白氧化程度较高。图2为含2.5 mg/mL猪血浆蛋白水解物的O/W型乳状液贮藏过程中的色氨酸荧光光谱。在乳化体系储藏期间,波长大约在340~360 nm时,色氨酸的最大峰值发生改变,在第10 d时乳状液的荧光强度最低。本研究中各处理组之间差异性显著(p<0.05),具有较低浓度PPPH的乳状液因较高水平的色氨酸残基表现出较高的荧光排放物。

图1 含有不同猪血浆蛋白水解物浓度的O/W型乳状液贮藏过程中色氨酸荧光强度的损失Fig.1 Decrease of tryptophan fluorescence during oxidation of emulsions containing different levels of PPPH注:不同小写字母表示同一贮藏时间不同处理组间差异显著(p<0.05);图3同。
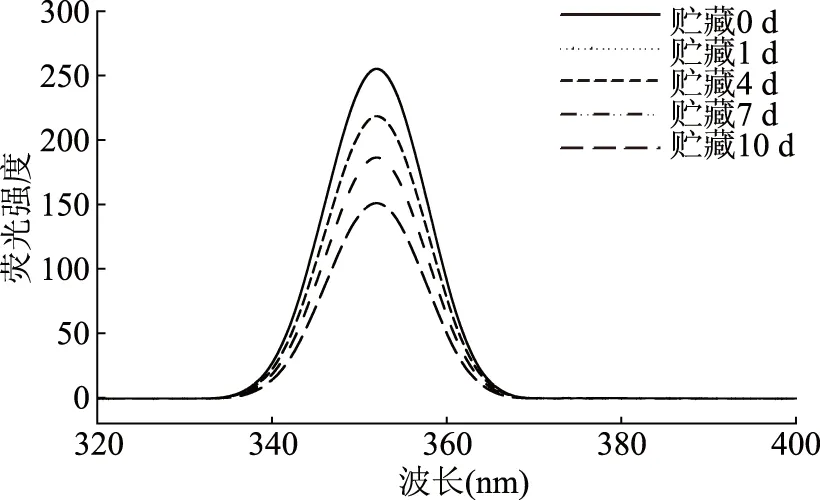
图2 含2.5 mg/mL猪血浆蛋白水解物的O/W型乳状液贮藏过程中的色氨酸荧光光谱Fig.2 Spectrum corresponding to tryptophan fluorescence in emulsions containing 2.5 mg/mL PPPH during prooxidant storage注:激发波长=283 nm。
色氨酸的氧化分解发生在氧化过程的早期,而FP是由蛋白质氧化的次级过程产生。对含不同浓度PPPH乳状液的荧光蛋白氧化产物之间的显著差异进行检测。由图3可知,在整个测定过程中,2.5 mg/mL的PPPH的乳状液表现出较高的荧光性,约是含20 mg/mL PPPH的乳状液的两倍。然而,不同浓度的PPPH所制备的乳状液的荧光强度之间存在着差异,是由于FP来自于蛋白质的氧化,具有较低PPPH含量的乳状液将有较高含量的氧化产物。FP发射的荧光强度随着时间的增加,在第10 d检测到最高水平的荧光强度。由图4可知,与色氨酸荧光相比,荧光蛋白质氧化产物的最高峰发射波长在415~425 nm时发生改变,蛋白质氧化产生的化合物的荧光吸收峰通常是在大约420 nm左右。色氨酸荧光损失的同时,随着贮藏时间的延长,FP的荧光强度呈现增加的趋势,这是因为氧化的PPPH和次级脂质氧化产物之间相互作用的结果。PPPH可能在防止脂质和蛋白质氧化中发挥了保护作用。
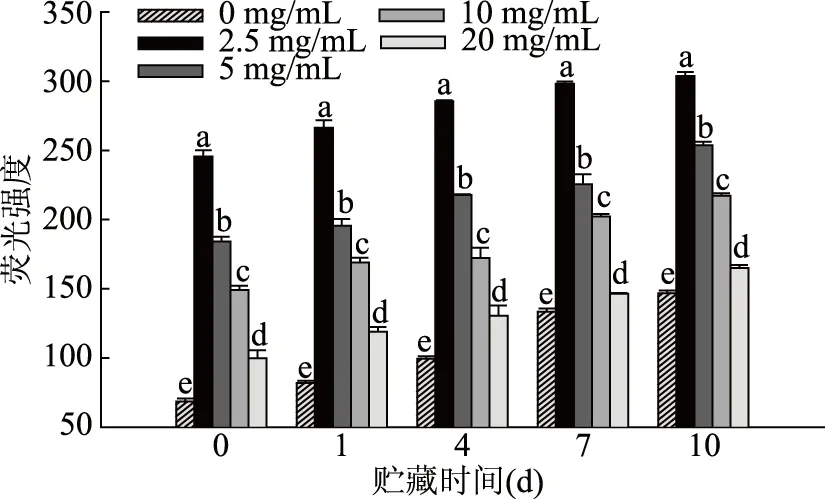
图3 含有不同猪血浆蛋白水解物浓度的O/W型乳状液贮藏过程中蛋白氧化产物荧光强度的增加Fig.3 Increase of FP fluorescence during oxidation of emulsions containing different levels of PPPH

图4 含2.5 mg/mL猪血浆蛋白水解物的O/W型乳状液促氧化贮藏过程中的蛋白氧化产物荧光光谱Fig.4 Spectrum corresponding to FP fluorescence in emulsions containing 2.5 mg/mL PPPH during prooxidant storage注:激发波长=350 nm。
2.2乳状液贮藏期间CD和TBARS的变化
由于肽能够清除自由基并对促氧化的金属具有螯合能力,因此蛋白或者肽水解物的主要好处是可以抑制脂质体的氧化[18]。表1和表2分别为PPPH制备的O/W乳状液贮藏过程中氧化产物共轭二烯反应物(CD)和硫代巴比妥酸值(TBARS)的变化趋势,这两种指标可以较为可靠地反映油脂氧化的程度。一些研究表明,一定浓度的蛋白水解物的存在可以提高乳状液的抗氧化活性[19-21]。在本研究中,以PPPH和Tween 20为乳化剂时,37 ℃避光贮藏10 d后,含PPPH的乳状液的CD和TBARS值都低于未加蛋白水解物的乳状液,所有实验浓度都起到了降低CD和TBARS氧化产物的作用。因此,结果表明添加PPPH能够明显抑制O/W乳状液初级和次级氧化产物的形成。随着贮藏期的延长,CD的生成量呈现着逐渐增加的趋势。而一旦脂质过氧化物形成后,PPPH可以通过稳定自由基、隔离Fe2+的氧化、促进氧化金属分解,作为金属螯合剂打断过氧化二级产物的分解,从而抑制TBARS的形成。
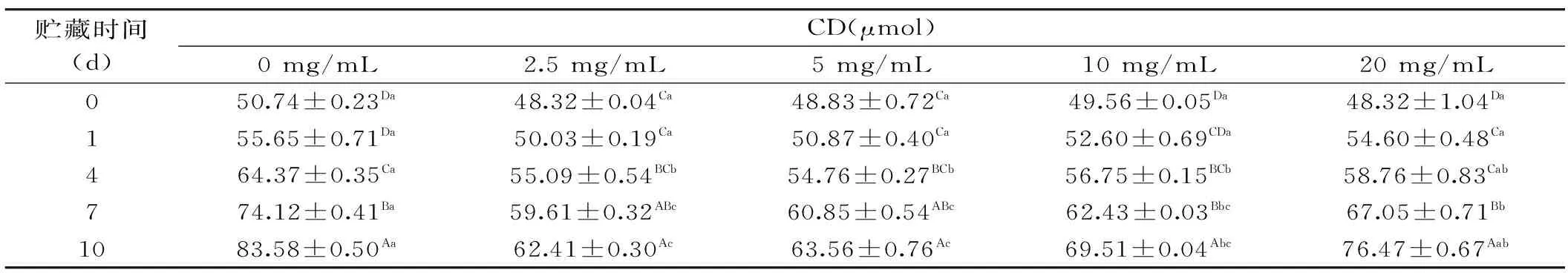
表1 含有不同猪血浆蛋白水解物浓度的O/W乳状液贮藏过程中氧化产物共轭二烯反应物(CD)含量的变化Table 1 Formation of CD during storage of rapeseed O/W emulsions prepared with PPPH at various concentrations
注:数据表示为平均值±标准差(n=3)。A~D在同一列字母中,a~d在同一行字母中相同表示差异不显著,不同则表示差异显著(p<0.05);表2同。
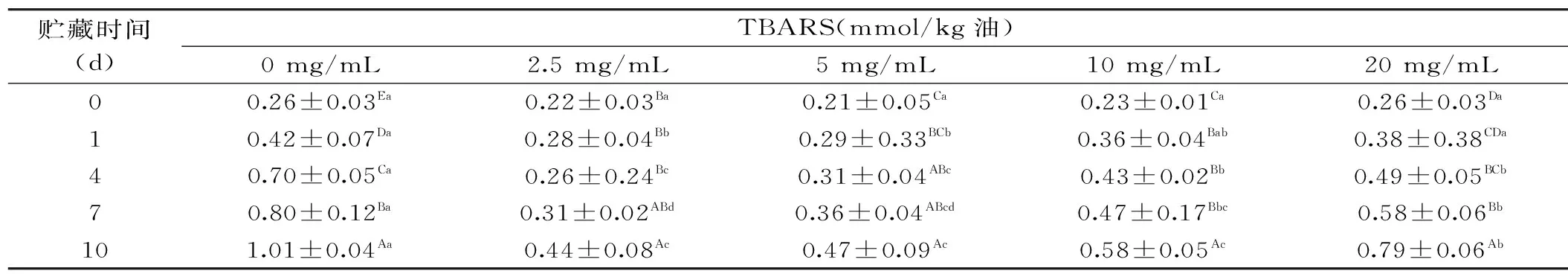
表2 含有不同猪血浆蛋白水解物浓度的O/W乳状液贮藏过程中氧化产物硫代巴比妥酸值(TBARS)的变化Table 2 Formation of TBARS during storage of rapeseed O/W emulsions prepared with PPPH at various concentrations

表3 含有不同猪血浆蛋白水解物浓度的O/W乳状液贮藏过程中色氨酸荧光强度与CD含量和TBARS值的相关性Table 3 Correlation of CD or TBARS with fluorescence intensity of rapeseed O/W emulsions prepared with PPPH at different concentrations
而PPPH的抗氧化性能主要归因于各种性能的协同效应,包括芳香氨基酸和含硫氨基酸清除自由基能力还可作为金属离子螯合剂的抑制脂质体的氧化[22-23]。另外,PPPH还可能在脂质体表面形成一层物理屏障来阻止氧化的渗透和扩散,类似于一些蛋白质在乳状液中的作用[8]。本研究中脂质氧化产物的变化与其他研究人员研究的水包油乳状液氧化的模式相似[24-26]。在氧化初期,脂肪酸氧化分解产生氢过氧化物,CD与TBARS的含量在储藏期间逐渐增加,在第10 d时达到最大值。本研究中含量为2.5 mg/mL的PPPH抑制脂质氧化作用效果最好,具有最低的CD和TBARS值。这可能是由于高浓度PPPH和Tween-20之间在界面上存在着竞争吸附[27],并且PPPH在界面上的累积会引起了不同油滴表面多肽的桥联作用,从而促进了液滴间的聚集及脂自由基的链增长[28]。
2.3荧光强度与CD和TBARS的相关性分析
表3描述含有不同猪血浆蛋白水解物浓度的O/W乳状液贮藏过程中色氨酸荧光强度与CD含量和TBARS值的相关性,结果发现色氨酸的荧光强度与CD含量和TBARS值存在显著的负相关关系。在O/W乳状液中,氨基酸残基位于油滴的表面,例如色氨酸,它能够显著影响脂质氧化。事实上,色氨酸的氧化降解是发生在氧化的前期,当脂质氧化进入增值阶段时变得更加明显。此外,蛋白质中游离的氨基酸能够与次级氧化产物反应致使荧光蛋白氧化产物形成[29-30]。本研究中使用荧光分光光度计对这些脂蛋白复合物进行检测,发现天然的色氨酸荧光强度与CD及TBARS呈现显著的负相关关系,能够更好地反映出初级氧化产物与色氨酸残基之间存在相互作用。这一相关性更好地反映出使用荧光光谱法评价猪血浆蛋白水解物对水包油型乳状液氧化稳定性的方便性和准确性,避免了传统测定方法中产生的可能误差。
3 结论
将不同浓度(0~20 mg/mL)的PPPH添加到由Tween-20和菜籽油制备的O/W型乳状液中,在37 ℃储存0~10 d的条件下,PPPH的添加能够显著提高整个乳状液的氧化稳定性。另外,整个乳状液在储存期间的色氨酸荧光强度与CD、TBARS值之间呈现显著的负相关关系。因此,PPPH可以作为一种功能性成分添加到食品乳状液中来提高整体乳状液的氧化稳定性。研究结果将有助于蛋白水解物在复杂乳状液类食品中的实际应用奠定了理论基础,而且能够提高多不饱和脂肪酸在乳状液类食品中的应用。
[1]Sakanaka S,Tachibana Y. Active oxygen scavenging activity of egg-yolk protein hydrolysates and their effects on lipid oxidation in beef and tuna homogenates[J]. Food Chemistry,2006,95(2):243-249.
[2]Cheng Y,Xiong Y L,Chen J. Antioxidant and emulsifying properties of potato protein hydrolysate in soybean oil-in-water emulsions[J]. Food Chemistry,2010,120(1):101-108.
[3]Zhang X,Xiong Y L,Chen J,et al. Synergistic Inhibition of Lipid Oxidation by Pea Protein Hydrolysate Coupled with Licorice Extract in a Liposomal Model System[J]. Journal of Agricultural & Food Chemistry,2013,61(35):8452-8461.
[4]Zhang X,Xiong Y L,Chen J,et al. Synergy of Licorice Extract and Pea Protein Hydrolysate for Oxidative Stability of Soybean Oil-in-Water Emulsions[J]. Journal of Agricultural and Food Chemistry,2014,62(32):8204-8313.
[5]Phoon P Y,Narsimhan G. Effect of hydrolysis of soyβ-conglycinin on the oxidative stability of O/Wemulsions[J]. Food Hydrocolloids,2014,35:429-443.
[6]Kong B H,Xiong Y L. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J]. Journal of Agricultural and Food Chemistry,2006,54(16):6059-6068.
[7]Kong B,Zhang H,Xiong Y L. Antioxidant activity of spice extracts in a liposome system and in cooked pork patties and the possible mode of action[J]. Meat Science,2010,85(4):772-778.
[8]Hirose A,Miyashita K. Inhibitory Effect of Proteins and their Hydolysates on the Oxidation of Triacylglycerols Containing Docosahexaenoic Acids in Emulsion[J]. Nippon Shokuhin Kagaku Kogaku Kaishi,1999,46(12):799-805.
[9]O’Regan J,Mulvihill D M. Sodium caseinate-maltodextrin conjugate hydrolysates:preparation,characterisation and some functional properties[J]. Food Chemistry,2010,123(1):21-31.
[10]李媛媛,刘骞,汪海棠,等. 不同浓度阿拉伯树胶-肌原纤维蛋白共建乳状液体系的物理稳定性[J]. 食品科学,2016,http://www. cnki. net/kcms/detail/11. 2206. TS. 20160828.1819. 024.html.
[11]Lam R S H,Nickerson M T. Food proteins:a review on their emulsifying properties using a structure-function approach[J]. Food Chemistry,2013,141:975-984.
[12]Mcclements D J,Rao J. Food-grade nanoemulsions:formulation,fabrication,properties,performance,biological fate,and potential toxicity[J]. Critical Reviews in Food Science & Nutrition,2011,51(4):285-330.
[13]Liu Q,Kong B H,Jiang L Z,et al. Free radical scavenging activity of porcine plasma protein hydrolysates determined by electron spin resonance spectrometer[J]. LWT-Food Science and Technology,2009,42(5):956-962.
[14]Mario E,Petri K,Eero P,et al. Fluorescence spectroscopy as a novel approach for the assessment of myofibrillar protein oxidation in oil-in-water emulsions[J]. Meat Science,2008,80(4):1290-1296.
[15]Mei L,Mcclements D J,Wu J,et al. Iron-catalyzed lipid oxidation in emulsion as affected by surfactant,pH and NaCl[J]. Food Chemistry,1998,61(3):307-312.
[16]Xu X,Liu W,Liu C,et al. Effect of limited enzymatic hydrolysis on structure and emulsifying properties of rice glutelin[J]. Food Hydrocolloids,2016,61:251-260.
[17]Nooshkam M,Madadlou A. Maillard conjugation of lactulose with potentially bioactive peptides[J]. Food Chemistry,2016,192:831-836.
[18]Cheng Y,Xiong Y L,Chen J. Fractionation,Separation,and Identification of Antioxidative Peptides in Potato Protein Hydrolysate that Enhance Oxidative Stability of Soybean Oil Emulsions[J]. Journal of Food Science,2010,75(9):C760-C765.
[19]Mcclements D J,Li Y. Structured emulsion-based delivery systems:Controlling the digestion and release of lipophilic food components[J]. Advances in Colloid and Interface Science,2010,159(2):213-228.
[20]Cheng Y,Xiong Y L,Chen J. Antioxidant and emulsifying properties of potato protein hydrolysate in soybean oil-in-water emulsions[J]. Food Chemistry,2010,120(1):101-108.
[21]Wang L L,Xiong Y L. Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J]. Journal of Agricultural and Food Chemistry,2005,53(23):9186-9192.
[22]Kaul S,Sharma S S,Mehta I K. Free radical scavenging potential of L-proline:evidence frominvitroassays[J]. Amino Acids,2008,34(2):315-320.
[23]Díaz M,Decker E A. Antioxidant mechanisms of caseinophosphopeptides and casein hydrolysates and their application in ground beef[J]. Journal of Agricultural and Food Chemistry,2004,52(26):8208-8213.
[24]Shao Y,Tang C H. Characteristics and oxidative stability of soy protein-stabilized oil-in-water emulsions:Influence of ionic strength and heat pretreatment[J]. Food Hydrocolloids,2014,37(2):149-158.
[25]Qiu C,Zhao M,Decker E A,et al. Influence of protein type on oxidation and digestibility of fish oil-in-water emulsions:gliadin,caseinate,and whey protein.[J]. Food Chemistry,2015,175:249-257.
[26]Berton C,Ropers M H,Viau M,et al. Contribution of the interfacial layer to the protection of emulsified lipids against oxidation[J]. Journal of Agricultural and Food Chemistry,2011,59(9):5052-5061.
[27]Zhao Q,Selomulya C,Wang S,et al. Enhancing the oxidative stability of food emulsions with rice dreg protein hydrolysate[J]. Food Research International,2012,48(2):876-884.
[28]Mattia C D D,Sacchetti G,Mastrocola D,et al. Surface properties of phenolic compounds and their influence on the dispersion degree and oxidative stability of olive oil O/W emulsions[J]. Food Hydrocolloids,2010,24(6-7):652-658.
[29]Ventanas S,Estevez M,Tejeda J F,et al. Protein and lipid oxidation in Longissimus dorsi and dry cured loin from Iberian pigs as affected by crossbreeding and diet[J]. Meat Science,2006,72(4):647-655.
[30]Xi F,Dong U A. Volatile profile,lipid oxidation and protein oxidation of irradiated ready-to-eat cured turkey meat products[J]. Radiation Physics and Chemistry,2016,127:27-33.
Effectsofporcineplasmaproteinhydrolysatesonoxidationstabilityofoil-in-wateremulsions
LIYue,LIUQian,CHENYi-chun,KONGBao-hua,XIAXiu-fang*
(College of Food Science,Northeast Agricultural University,Harbin 150030,China)
Potential effects of porcine plasma protein hydrolysates(PPPH)on oxidative stability of oil-in-water type(O/W)emulsions were investigated during the storage. Different concentration of PPPH(0~20 mg/mL)were added to rapeseed O/W emulsions which used Tween-20 as the emulsifier. The changes of tryptophan fluorescence spectroscopy,conjugated diene(CD)and thiobarbituric acid-reactive substances(TBARS)values of the emulsions were determined during 0~10 days which storage at 37 ℃. The results showed that the oxidative degradation of tryptophan residues occurred as an early event in protein oxidation whereas fluorescent protein oxidation product(FP)formed later as secondary protein oxidation products. In addition,compared with the control group,the treatment group with the addition of 2.5 mg/mL PPPH had the highest tryptophan fluorescence intensity and FP(p<0.05),while having the lowest CD and TBARS values(p<0.05). At the same time,the significant negative correlations were found between tryptophan fluorescence and CD. In conclusion,PPPH could significant increase the stability of oil-in- water type emulsions,the antioxidant properties of PPPH at the interface of emulsion droplets would render them suitable as natural antioxidants in some food products.
procine plasma protein hydrolysates;emulsion;tryptophan fluorescence spectroscopy;oxidative stability;lipid oxidation
2017-02-07
李月(1993-),女,硕士研究生,研究方向:畜产品加工,E-mail: li_yue@yeah.net。
*通讯作者:夏秀芳(1973-),女,博士,教授,研究方向:畜产品加工,E-mail:xxfang524@163.com。
国家自然科学基金面上项目(31671788);东北农业大学“学术骨干”项目(16XG18)。
TS251.9
:A
:1002-0306(2017)16-0024-05
10.13386/j.issn1002-0306.2017.16.006
