射波刀治疗原发性肝癌肺转移10例临床分析
2017-09-16孙颖哲范毓泽何卫平段学章
李 欢,孙 静,王 卉,张 弢,孙颖哲,范毓泽,何卫平,段学章
射波刀治疗原发性肝癌肺转移10例临床分析
李 欢,孙 静,王 卉,张 弢,孙颖哲,范毓泽,何卫平,段学章
目的 回顾性分析射波刀(cyberknife, CK)治疗原发性肝癌肺转移瘤的临床结果,评估CK治疗原发性肝癌肺转移瘤的安全性和有效性。方法 CK治疗原发性肝癌肺转移患者10例(共22个病灶)。其中,金标追踪9个病灶,肺追踪6个病灶,脊柱追踪7个病灶。结果 3个月、6个月、1年局部控制率分别为100%、100%、93%。1年、2年总生存率分别为60%、40%。根据肿瘤放射治疗协作组分类,无Ⅲ级及以上毒性。结论 CK治疗原发性肝癌肺转移瘤相对安全有效,可获得较好的肿瘤局部控制率,但远期效果还须进一步观察及随访。
原发性肝癌;肺转移瘤;射波刀;立体定向放射治疗;局部控制率
我国是原发性肝癌的高发地区(约占全球发病率的50%),病死率高(每年约11万患者死于肝癌),患者一旦被发现时肿瘤多处于晚期。原发性肝癌易发生肝内及肝外转移,肺是肝癌患者最常见的肝外转移器官[1]。肝癌肺转移率高达41.6%~43.6%以上[2]。有研究发现肺转移患者生存期约8.8个月[3]。肝癌肺转移,目前多采用全身化疗、局部切除及介入治疗。有研究表明病灶完全切除率低,生存率下降,完全切除病灶患者术后5年生存率为36%,但部分切除病灶患者生存率仅为13%[4]。目前抑制肿瘤血管生成的分子靶向药物(索拉非尼)被认为是治疗中晚期肝癌的标准用药。针对欧洲人群SHARP和针对亚洲人群的Oriental大样本研究表明索拉非尼能够延长中晚期肝癌患者的生存期,但治疗费用高,且存在腹泻及皮疹等严重并发症,部分患者难以耐受,普及性差[5]。
目前随着放疗技术的发展,尤其立体定向放射治疗(stereotactic body radiation therapy, SBRT)作为用于治疗肺肿瘤的新技术,有效可行且耐受性良好,与手术切除相比,在肿瘤局部控制(local control, LC)率方面具有优越性[6-7]。
1 对象与方法
1.1 对象 2011年4月—2014年4月就诊于解放军第三〇二医院肿瘤放射治疗中心的原发性肝癌肺转移患者共10例,年龄24~57岁,平均为45.0岁,其中男7例,女3例。纳入标准:原发性肝癌诊断明确,且肝脏原发病灶控制,另有CT或PET-CT影像学依据提示肝癌肺转移。治疗前相关化验、检查资料完善,包括胸部和腹部增强CT、MRI等,血常规、生化等常规化验指标以及肿瘤标志物。所有患者均经我中心放疗及临床医师评估,明确符合治疗指征,排除治疗禁忌。患者生存质量评分标准:卡氏评分>80,且所有患者或家属签署射波刀(cyberknife, CK)治疗的知情同意书。
1.2 仪器 G4 cyberknife(美国Accuracy),是一种新型的SBRT设备,将计算机技术、机器人技术、实时影像引导技术、同步呼吸追踪技术结合在一起,兼顾放射治疗及放射外科2种功能。CK的追踪技术,体现在其通过金标追踪,肺追踪,脊柱追踪等多种方式追踪肿瘤。金标追踪,在肿瘤周围或肿瘤内植入1~4个金属标记物,通过追踪金标位置来确定肿瘤位置;肺追踪,通过肺部肿瘤的轮廓范围代替植入的金标,把肿瘤当作标记物进行跟踪;脊柱追踪,主要用于脊柱周围的,相对静止不动的脊柱的追踪。
1.3 CT定位及治疗前准备 采用真空垫固定,制作放疗体位固定装置。选用64排CT扫描采图。CT扫描图像输送到治疗计划系统,由医师和物理师共同勾画靶区和危及器官。结合CT、MRI或PET-CT等影像学资料,勾画大体肿瘤体积(gross tumor volume, GTV)。一般对于肿瘤直径<5 cm,GTV外扩1.5~2.0 cm;肿瘤直径5~10 cm,GTV外扩0.5~1.5 cm;肿瘤直径>10 cm,GTV外扩0.1~0.5 cm。放疗期间应尽可能避开周围重要器官(如肝组织、食管等),使得其受量不超过耐受剂量。
1.4 观察指标和疗效评价 主要观察指标为近期疗效、不良反应、LC。近期疗效评价:放疗起始至放疗后1个月住院或门诊复查,行影像学检查后评估疗效。疗效评价标准:①完全缓解(complete remission, CR),影像学检查提示肿瘤消失。②部分缓解(partial remission, PR),影像学检查提示肿瘤缩小>30%。③病灶稳定(stable disease, SD),肿瘤缩小<30%或增大<20%。④病灶进展(progression disease, PD),肿瘤增大20%。LC率=存活患者中CR+PR+SD的病灶数/病灶总数×100%。急性肺损伤按肿瘤治疗协作组的急性放射损伤分级标准评定。
1.5 随访 以开始治疗时间为随访起点,每3个月随访1次,直至死亡或者最后一次随访为时间终点。
1.6 统计学处理 用SPSS 18.0统计软件进行数据处理,用Kaplan-Meier法作生存曲线。
2 结 果
2.1 临床资料 10例患者中肺部转移瘤22个,GTV平均为34.9 cm3,每个肿瘤平均治疗剂量35 Gy(30~50 Gy)。6个月内无PD,无死亡病例。1年内死亡4例(包括7个病灶),6例存活者中1个PD。因此3个月、6个月、1年LC率分别为100%、100%、93%。1年、2年总生存率分别为60%、40%。患者基本资料见表1,生存曲线见图1。
2.2 不良反应 CK治疗后2例患者出现乏力,Ⅰ级急性肺损伤1例,Ⅱ级1例,无Ⅲ级以上毒性。

表1 患者病灶及治疗剂量Table 1 Lesion and therapeutic dose for the patients

图1 10例患者生存曲线Figure 1 Survival curve of 10 patients
2.3 CK治疗前后CT表现 以患者A为例CK治疗前后CT表现见图2。放疗前右肺病灶CT图像如图2标注,放疗后3个月CT图像显示肿瘤基本消失,6个月后图像较3个月前无明显差异。
2.4 随访情况 随访过程中4例死于肺内广泛进展和肝转移,1例死于肝衰竭,1例死因不详,4例存活。
3 讨 论
原发性肝癌是我国常见的恶性肿瘤之一,病死率在消化道肿瘤中居第3位。近年来发病率呈上升趋势,但起病隐匿,发病时疾病多处于中晚期阶段,最易合并肺转移,因此治疗肝癌病灶同时兼顾治疗肺转移瘤显得尤为重要。目前多采用手术切除、介入及靶向药物(索拉非尼)等多种治疗方案,但部分患者疗效欠佳,耐受性差,目前越来越多的研究将治疗焦点转移至放射治疗。
随着放疗技术快速发展,SBRT在临床中快速应用。其中CK作为当前全球较为先进的SBRT设备,采用实时图像引导系统以及呼吸追踪系统,其剂量大、精度高,以及对照射周围的正常组织或器官影响小等优点,在多处肿瘤治疗中取得了显著效果。Whyte等[8]在2003年首次将CK用于治疗肺部肿瘤以及肺部转移瘤,结果证实可行,安全有效。Wang等[9]报道95例患者共134个病灶,应用CK治疗肺转移瘤,1年LC率为97.6%,2年LC率为90.6%,3年LC率为87.0%。亦有研究发现SBRT治疗肺转移瘤的2年LC率高达67.0%~96.0%[10]。本文通过小样本回顾性分析,一定程度上体现了CK治疗肺部转移瘤的优势,但样本量较少,须扩大样本量继续临床观察及总结。CK治疗肺转移瘤体现了较高的LC率,考虑除了与CK本身高精度及大剂量射线的特性有关外,有研究发现LC率还与病灶大小、体积和高生物学剂量有关。Osti等[11]通过研究103例肺转移病灶发现,<10 cm3的病灶较>10 cm3的病灶LC率高,差异具有统计学意义(P=0.024)。
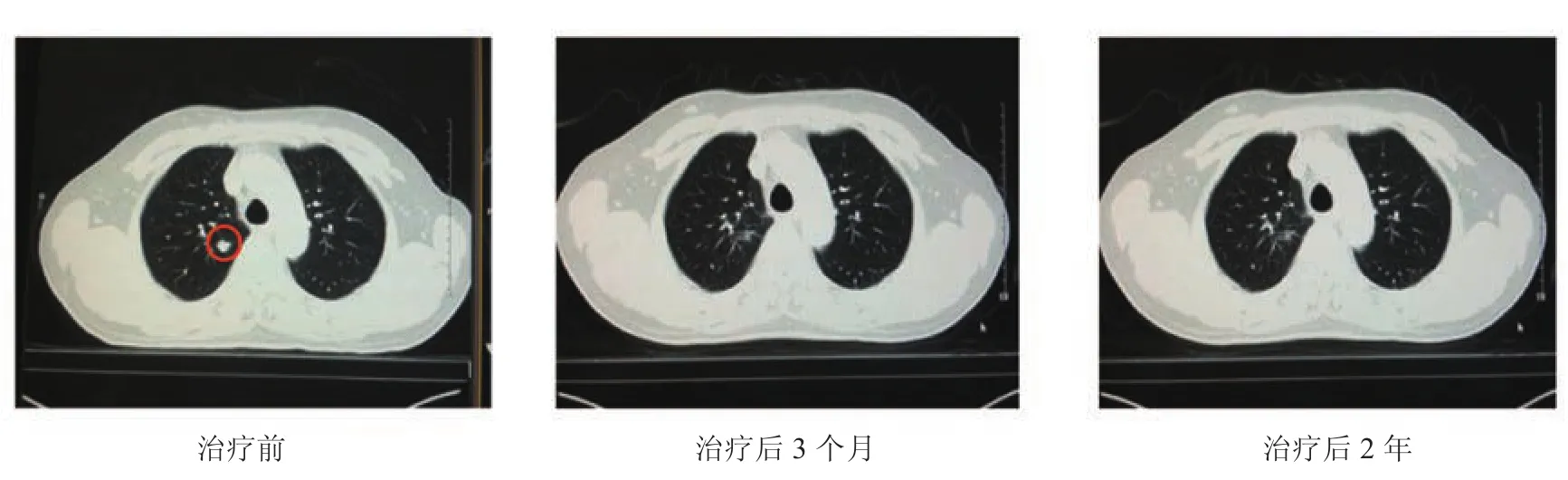
图2 患者A CK治疗前后的肺部CT图像Figure 2 Lung CT images before and after CK treatment of patient A
放射性肺炎是肺部肿瘤放疗中较常见及严重并发症,与放疗剂量、体积相关。减少照射体积可明显降低放射性肺炎的发生率。CK因单次剂量高,相对于常规照射次数大为缩小,研究显示其对放射性肺损伤有防护及延缓的作用[12]。本研究发现Ⅰ级急性肺损伤1例,Ⅱ级1例,无III级以上毒性,放射性肺损伤发生率较低,安全性较高。有较大样本的研究(共134个病灶)发现仅3.2%患者发生III级放射性肺损伤(肺炎),亦说明了CK的相对安全性[9]。
4 小 结
近年来,CK在原发性肝癌及多种恶性肿瘤治疗中取得了一定疗效,我中心相关研究亦显示CK治疗肝癌病灶,尤其在肿瘤LC率方面的优势[13],但国内在肝癌肺转移瘤行CK治疗的临床研究或报道相对较少。本文通过10例病例回顾性分析,借助LC率指标探讨CK治疗肝癌肺转移瘤的近期疗效,结果提示CK治疗肝癌肺转移病灶疗效尚可,且未出现明显不良反应,安全性相对较高。但本文患者例数少,另外患者总生存率偏低,缺乏长期随访数据,因此须不断累积临床数据以进一步研究。
[1] Katyal S, Oliver JH 3rd, Peterson MS, et al. Extrahepatic metastases of hepatocellular carcinoma[J]. Radiology, 2000, 216(3):698-703.
[2] Ikai I, Itai Y, Okita K, et al. Report of the 15th follow-up survey of primary liver cancer[J]. Hepatol Res, 2004, 28(1):21-29.
[3] 张树民,曾韶冲,孙菁,等. 肝细胞癌肺转移的预后因素分析[J]. 实用肿瘤杂志,2005,20(5):395-399.
[4] Pastorino U, Buyse M, Friedel G, et al. Long-term results of lung metastasectomy: prognostic analyses based on 5206 cases[J]. J Thorac Cardiovasc Surg, 1997, 113(1):37-49.
[5] Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebocontrolled trial[J]. Lancet Oncol, 2009, 10(1):25-34.
[6] Hatime M, Elmorabit B, Elkhoti Y, et al. Oligometastatic disease,a new concept: stereotactic irradiation for lung metastases[J].Cancer Radiother, 2012, 16(5-6):351-357.
[7] Alongi F, Arcangeli S, Filippi AR, et al. Review and uses of stereotactic body radiation therapy for oligometastases[J].Oncologist, 2012, 17(8):1100-1107.
[8] Whyte RI, Crownover R, Murphy MJ, et al. Stereotactic radiosurgery for lung tumors: preliminary report of a phase I trial[J]. Ann Thorac Surg, 2003, 75(4):1097-1101.
[9] Wang Z, Kong QT, Li J, et al. Clinical outcomes of cyberknife stereotactic radiosurgery for lung metastases[J]. J Thorac Dis,2015, 7(3):407-412.
[10] Siva S, MacManus M, Ball D. Stereotactic radiotherapy for pulmonary oligometastases: a systematic review[J]. J Thorac Oncol, 2010, 5(7):1091-1099.
[11] Osti MF, Carnevale A, Valeriani M, et al. Clinical outcomes of single dose stereotactic radiotherapy for lung metastases[J]. Clin Lung Cancer, 2013, 14(6):699-703.
[12] Yamashita H, Takahashi W, Haga A, et al. Radiation pneumonitis after stereotactic radiation therapy for lung cancer[J]. World J Radiol, 2014, 6(9):708-715.
[13] 薛慧,钟青,刘虎,等. 射波刀联合经导管肝动脉化疗栓塞治疗原发性肝癌的疗效及预后分析[J]. 传染病信息,2015,28(5):301-305.
(2016-05-18 收稿 2016-08-21 修回)
(本文编辑 胡 玫)
Clinical analysis of cyberknife treatment for 10 primary hepatic carcinoma with pulmonary metastasis patients
LI Huan, SUN Jing, WANG Hui, Zhang Tao, SUN Ying-zhe, FAN Yu-ze, HE Wei-ping, DUAN Xue-zhang*
Tumor Radiotherapy Center, 302 Military Hospital of China, Beijing 100039, China
Objectives To respectively analyze the clinical outcome of cyberknife treatment for primary hepatic carcinoma with pulmonary metastasis and to assess its safety and efficacy. Methods Ten patients of primary hepatic carcinoma with pulmonary metastasis, involving 22 lesions were treated with cyberknife. Among them, 9 lesions were tracked with gold fiducial, 6 were lung tracking and 7 were spine tracking. Results The 3-month, 6-month, 1-year local control rates were 100%, 100% and 93%, respectively. The 1-year, 2-year survival rate were 60% and 40%. According to the classification of Radiation Therapy Oncology Group, no case appeared Grade III toxicity. Conclusions Cyberknife treatment of primary hepatic carcinoma with pulmonary metastasis is relatively safe and effective, and can achieve a good tumor local control rate, but the long-term effect needs further observation and follow-up.
primary hepatic carcinoma; pulmonary metastasis; cyberknife; stereotactic radiotherapy; local control rate
R454.12;R734.2;R735.7
A
1007-8134(2017)04-0220-03
10.3969/j.issn.1007-8134.2017.04.009
首都特色基金(Z151100004015002)
100039 北京,解放军第三○二医院肿瘤放射治疗中心(李欢、孙静、王卉、张弢、孙颖哲、范毓泽、何卫平、段学章)
段学章,E-mail: duanxuezhang2006@163.com
*Corresponding author, E-mail: duanxuezhang2006@163.com
