CYP2E1和NAT2基因多态性与抗结核药物诱导的药物性肝损伤关系的荟萃分析
2017-09-16盛云建何鸿雁
盛云建,何鸿雁
CYP2E1和NAT2基因多态性与抗结核药物诱导的药物性肝损伤关系的荟萃分析
盛云建,何鸿雁
目的 明确细胞色素氧化酶P450 2E1(cytochrome P450 2E1, CYP2E1)和 N-乙酰基转移酶-2(N-acetyltransferase-2,NAT2)基因多态性与抗结核药诱导的药物性肝损伤(anti-tuberculosis drug-induced hepatotoxicity, ATDH)之间的关系。方法 计算机检索Medline/Pubmed、EMBASE、Web of Science数据库和Cochrane图书馆中所有有关CYP2E1基因多态性与ATDH关系的研究文献。根据文献纳入及排除标准筛选文献,并对文献进行质量评价。采用OR及95% CI作为分析疗效的统计量。采用Revman 5.0软件统计分析。结果 共计纳入研究文献9篇,入选2049例研究对象。CYP2E1基因PstI/RsaI多态性中, c1/c1型比c1/c2和c2/c2型有更高的ATDH发生率(OR=1.38,95% CI: 1.08~1.77,P=0.01);在DraI多态性中各型之间无差异(OR=0.78,95% CI: 0.51~1.18,P=0.23)。与携带NAT2快速或中速乙酰化的c1/c1型人群比较,携带NAT2慢速乙酰化的c1/c1型人群具有更高的ATDH风险(OR=3.10,P<0.0001)。结论 CYP2E1基因c1/c1型是ATDH发生的风险因素,且合并慢速乙酰化的NAT2基因型时可进一步增加ATDH发生率。
细胞色素氧化酶P450 2E1;基因多态性;结核;药物性肝损伤;荟萃分析
结核病目前在全球导致死亡的传染病中排名第1位,标准的成人肺结核采用异烟肼、利福平、吡嗪酰胺和乙胺丁醇进行治疗[1]。抗结核治疗最常见的不良反应有肝损伤、胃肠道反应和皮疹等。抗结核药物诱导的肝损伤(anti-tuberculosis drug-induced hepatotoxicity, ATDH) 在结核病标准治疗中发生率约为2%~28%[2],如果没有及时发现并停止用药,将导致患者肝衰竭甚至死亡。新近多篇文献报道了细胞色素氧化酶P450 2E1(cytochrome P450 2E1, CYP2E1)基因型与ATDH的关系,但各研究结论仍存在争议,且单个研究样本量偏小,不能提供高级别的循证依据。本研究的目的是通过系统评价,明确CYP2E1和 N-乙酰基转移酶-2(N-acetyltransferase-2, NAT2)基因多态性与ATDH间的关系,以期提供高级别的循证医学依据。
1 资料与方法
1.1 纳入与排除标准 纳入标准:①病例对照研究,病例组为有肝损伤结核病患者,对照组为无肝损伤结核病患者;②基因检测方法描述清楚,研究方案和设备描述清楚;③研究对象有明确的纳入和排除标准,结核病和ATDH有清楚的定义;④有足够数据来分析。排除标准:①研究对象为儿童;②重叠HBV或HCV或HIV感染;③非英文发表文献;④单纯治疗而无CYP2E1基因多态性分布数据。
1.2 检索策略 计算机检索Medline/Pubmed、EMBASE、Web of Science数据库和Cochrane图书馆公开发表的文献,并追踪所纳入文献的参考文献。检索年限均从建库到2017年1月。检索词包括“cytochrome P450 2E1”或“CYP2E1”,“polymorphism”, “tuberculosis”或“TB”。
1.3 数据提取和文献质量评价 资料提取由2位作者独立进行,结果有分歧时应由2位作者商议决定。按照Little核对表[3]进行文献质量评价:①设计合理;②清晰的纳入和排除标准;③说明了研究对象信息;④说明了结核病和ATDH的诊断标准;⑤基因检测方法;⑥正确的统计分析;⑦有逻辑的讨论。满足1条标准为1分,大于4分为高质量文献。
1.4 统计学处理 用Revman 5.3软件进行分析。计数资料计算OR及95% CI。各效应量计算合并效应量前先进行异质性检验,无异质性(P≥0.1)时采用固定效应模型合并效应量。敏感性分析为对种族进行分层分析。
2 结 果
2.1 纳入文献特征及质量评分 检索总共得到文献105篇,最终纳入研究文献9篇[4-12],总共纳入研究对象2049例,其中有ATDH 506例,无ATDH 1543例。纳入文献特征及质量评分见表1。
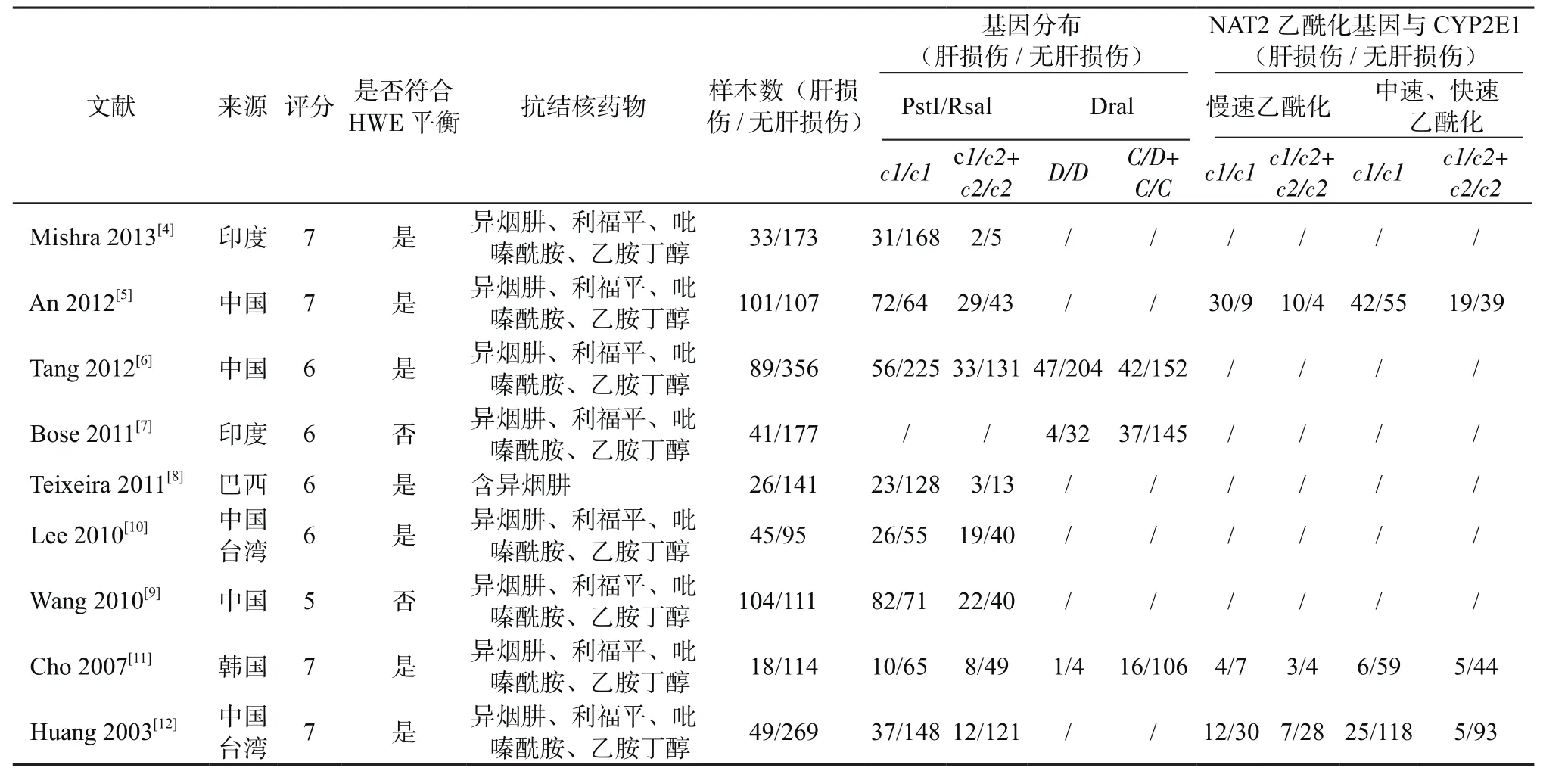
表1 纳入文献的基本特征Table 1 Basic feature of studies included in this meta-analysis
2.2 荟萃分析结果
2.2.1 CYP2E1-PstI/RsaI基因多态性 CYP2E1-PstI/RsaI基 因 型c1/c1、c1/c2+c2/c2在ATDH和无ATDH分布频率分别为72.47%、27.53%和67.64%、32.36%。基因型c1/c1在ATDH组中的分布频率高于无ATDH组。当纯合子的野生型(c1/c1)与有c2携带的基因型(c1/c2+c2/c2)比较,整体的ATDH的OR为1.38(95% CI: 1.08~1.77,P=0.010)。结果显示CYP2E1 c1/c1基因型将增加发生ATDH的风险(图1)。
2.2.2 CYP2E1-DraI 基因多态性 本研究也对基因CYP2E1-DraI多态性进行了分析。CYP2E1-DraI D/D基因型在有ATDH和无ATDH分布频率分别为35.10%、37.10%。基因型D/D与C/D+C/C比较,ATDH的合并OR为0.78(95%CI: 0.51~1.18,P=0.230)。结果表明CYP2E1-DraI基因型与ATDH的发生之间无明显的相关性(图2)。
2.2.3 NAT2乙酰化状态与CYP2E1基因型的联合效应 CYP2E1 c1/c1 基因型的NAT2 慢乙酰化与中速、快速乙酰化比较,合并的ATDH OR为3.10(95% CI: 1.83~5.26, P<0.0001)。在基因c1/c2+c2/c2中,慢乙酰化与中速、快速乙酰化比较,合并的ATDH OR为5.14 (95% CI: 2.32~11.40,P<0.0001)。表明慢乙酰化会增加ATDH的风险。 见表2。
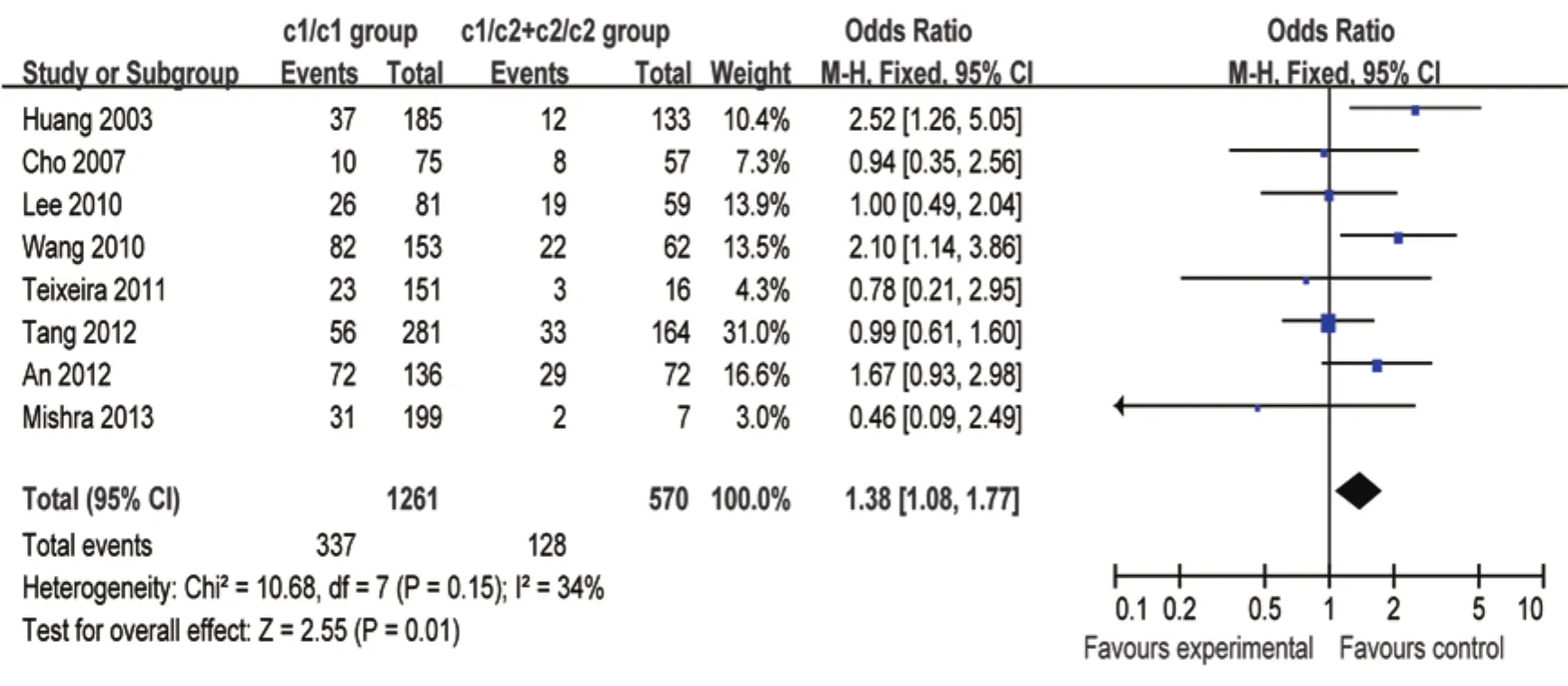
图1 CYP2E1 c1/c1基因型与c1/c2+c2/c2基因型发生ATDH比较的森林图Figure 1 A forest map of CYP2E1 c1/c1 genotype versus c1/c2+c2/c2 genotype for ATDH
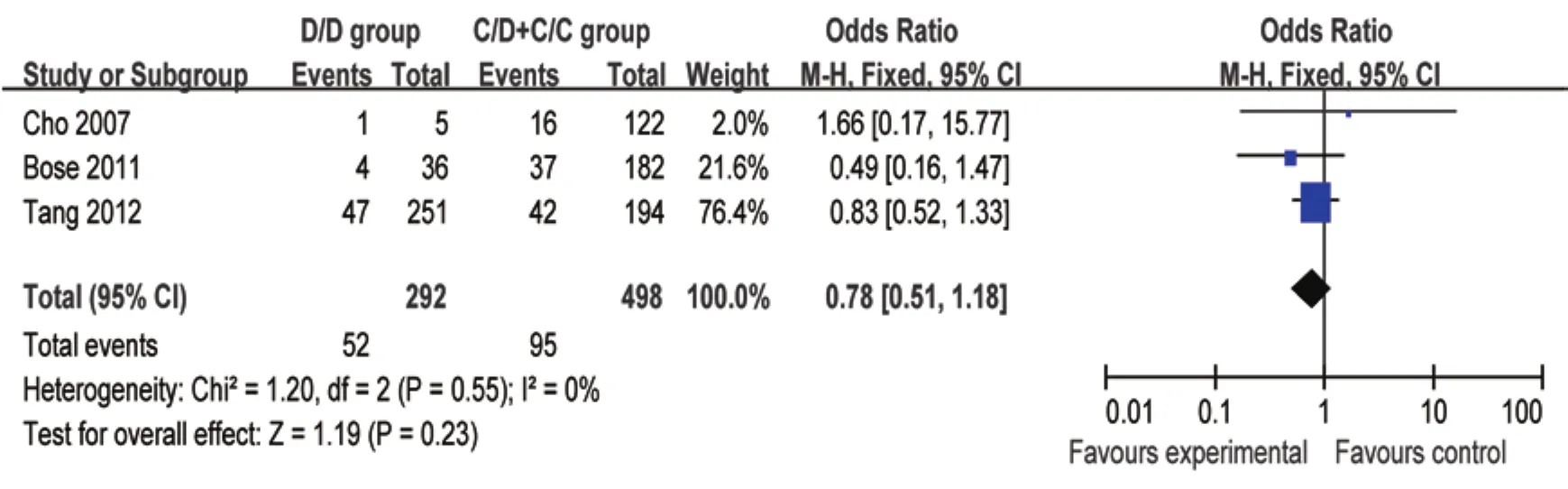
图2 CYP2E1 D/D基因型与C/D+C/C基因型发生ATDH比较的森林图Figure 2 A forest map of CYP2E1 D/D genotype versus C/D+C/C genotype for inducing ATDH

表2 CYP2E1基因型与NAT2乙酰化状态合并发生ATDH的风险Table 2 ATDH risk of NAT2 acetylator status combined with CYP2E1 genotype
2.3 敏感性分析 对种族进行分层分析后发现,CYP2E c1/c1基因型在亚洲人群中能明显增加发生ATDH的风险(OR=1.41,95% CI: 1.09~1.82,P=0.008)(图3)。
3 讨 论
药物代谢酶的基因多态性可明显影响酶的活性。在CYP2E1基因多态性中,仅PstI/RsaI、DraI基因多态性被研究发现与ATDH的发生相关[13]。有等位基因c1的个体在蛋白水平和酶活性上,比c2等位基因显示出来更高的转录活性;DraI位于CYP2E1的6号内含子,与外显子区域的其他多态性位点相关[14]。
本研究分析了 CYP2E1(PstI/RsaI、DraI)基因多态性与ATDH发生之间的关系。CYP2E1-PstI/RsaI c1/c1基因型在ATDH患者中的分布频率明显高于无ATDH组。研究结果显示CYP2E1-PstI/RsaI c1/c1野生型基因型具有更高的ATDH发生易感性。本研究同时进行了敏感性分析,在进行分层分析中发现,亚洲人群中该基因型也具有更高的ATDH发生的易感性。Chamorro等[15]的研究也发现c1/c1基因型在阿根廷和玻利维亚人群中与ATDH的发生无明显相关性。本文推测CYP2E1-PstI/RsaI c1/c1基因型不是非亚洲人群发生ATDH的危险因素,但需更多关于非亚洲人群的研究文献来证实。本研究未发现CYP2E1-DraI基因多态性与ATDH的发生有相关性,因研究仅纳入了3篇关于该基因的研究,样本量和统计效能偏小,需要更多相关研究来进一步明确DraI多态性与ATDH风险之间的关系。
有数篇文献分析了NAT2与ATDH之间的关系,结果显示NAT2慢乙酰化是发生ATDH的一个风险因素[4,16]。本研究也探讨了NAT2乙酰化状态与CYP2E1基因型联合的效果,结果显示在基因c1/c1中,慢乙酰化状态较中速、快速乙酰化有更高的ATDH发生的风险;而且在基因c1/c2+c2/c2中也有同样的研究结果。当患者为慢乙酰化状态时,乙酰肼的脱毒作用将减弱,更多的将被CYP2E1氧化为有毒性的中间物[13]。因此基因c1/c1型合并NAT2慢乙酰化将会进一步增加发生ATDH的风险。在结核病的联合治疗中,与单用异烟肼比较,发生ATDH的几率明显增高。因为利福平同样是肝脏CYP450的酶诱导剂,而且可以降低NAT2的活性,导致其他多种化合物的代谢。
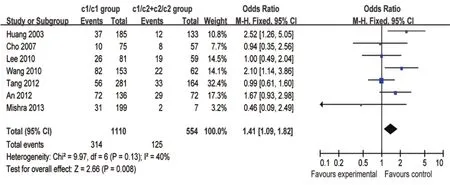
图3 CYP2E1 c1/c1基因型与c1/c2+c2/c2基因型在亚洲人群中发生ATDH比较的森林图Figure 3 A forest map of CYP2E1 c1/c1 genotype and c1/c2+c2/c2 genotype for inducing ATDH in Asian population
本研究存在一些不足:纳入的研究相对较少;排除不符合哈迪-温伯格平衡的文献后,结论发生了改变;仅仅纳入了英文发表的文献,可能会有语言偏倚;纳入的文献大部分来自亚洲,尚须跟踪非亚洲人群的研究。尽管有以上缺点,本研究也证明了NAT2慢乙酰化状态和CYP2E1 c1/c1基因型的并存效应。
本研究表明CYP2E1 c1/c1基因型是发生ATDH的风险因素,而且当合并存在NAT2慢乙酰化状态时,会进一步增加这种风险,尤其是在亚洲人群中。需要进一步的研究来明确在非亚洲人群中的这种基因型和ATDH发生的相关性。
[1] WHO. Global tuberculosis report 2016[EB/OL]. [2017-02-15].http://www.who.int/tb/publications/global_report/en/.
[2] Tostmann A, Boeree MJ, Aarnoutse RE, et al. Antituberculosis drug-induced hepatotoxicity: concise up-to-date review[J]. J Gastroenterol Hepatol, 2008, 23(2):192-202.
[3] Little J, Bradley L, Bray MS, et al. Reporting, appraising, and integrating data on genotype prevalence and gene-disease associations[J]. Am J Epidemiol, 2002, 156(4):300-310.
[4] Mishra S, Daschakraborty S, Shukla P, et al. N-acetyltransferase and cytochrome P450 2E1 gene polymorphisms and susceptibility to antituberculosis drug hepatotoxicity in an Indian population[J].Natl Med J India, 2013, 26(5):260-265.
[5] An HR, Wu XQ, Wang ZY, et al. NAT2 and CYP2E1 polymorphisms associated with antituberculosis drug-induced hepatotoxicity in Chinese patients[J]. Clin Exp Pharmacol Physiol, 2012, 39(6):535-543.
[6] Tang SW, Lv XZ, Zhang Y, et al. CYP2E1, GSTM1 and GSTT1 genetic polymorphisms and susceptibility to antituberculosis druginduced hepatotoxicity: a nested case-control study[J]. J Clin Pharm Ther, 2012, 37(5):588-593.
[7] Bose PD, Sarma MP, Medhi S, et al. Role of polymorphic N-acetyl transferase2 and cytochrome P4502E1 gene in antituberculosis treatment-induced hepatitis[J]. J Gastroenterol Hepatol, 2011,26(2):312-318.
[8] Teixeira RL, Morato RG, Cabello PH, et al. Genetic polymorphisms of NAT2, CYP2E1 and GST enzymes and the occurrence of antituberculosis drug-induced hepatitis in Brazilian TB patients[J].Mem Inst Oswaldo Cruz, 2011, 106(6):716-724.
[9] Wang T, Yu HT, Wang W, et al. Genetic polymorphisms of cytochrome P450 and glutathione S-transferase associated with antituberculosis drug-induced hepatotoxicity in Chinese tuberculosis patients[J]. J Int Med Res, 2010, 38(3):977-986.
[10] Lee SW, Chung LS, Huang HH, et al. NAT2 and CYP2E1 polymorphisms and susceptibility to first-line anti-tuberculosis drug-induced hepatitis[J]. Int J Tuberc Lung Dis, 2010,14(5):622-626.
[11] Cho HJ, Koh WJ, Ryu YJ, et al. Genetic polymorphisms of NAT2 and CYP2E1 associated with antituberculosis drug-induced hepatotoxicity in Korean patients with pulmonary tuberculosis[J].Tuberculosis (Edinb), 2007, 87(6):551-556.
[12] Huang YS, Chern HD, Su WJ, et al. Cytochrome P450 2E1 genotype and the susceptibility to antituberculosis drug-induced hepatitis[J]. Hepatology, 2003, 37(4):924-930.
[13] Roy PD, Majumder M, Roy B. Pharmacogenomics of anti-TB drugs-related hepatotoxicity[J]. Pharmacogenomics, 2008,9(3):311-321.
[14] Metushi IG, Cai P, Zhu X. A fresh look at the mechanism of isoniazid-induced hepatotoxicity[J]. Clin Pharmacol Ther,2011, 89(6):911-914.
[15] Chamorro JG, Castagnino JP, Musella RM, et al. Sex, ethnicity,and slow acetylator profile are the major causes of hepatotoxicity induced by antituberculosis drugs[J]. J Gastroenterol Hepatol,2013, 28(2):323-328.
[16] Ng CS, Hasnat A, Al Maruf A, et al. N-acetyltransferase 2 (NAT2)genotype as a risk factor for development of drug-induced liver injury relating to antituberculosis drug treatment in a mixed-ethnicity patient group[J]. Eur J Clin Pharmacol, 2014, 70(9):1079-1086.
(2017-03-15收稿 2017-04-25修回)
(本文编辑 张云辉)
Association between CYP2E1 and NAT2 polymorphisms and hepatotoxicity due to anti-tuberculosis drugs: a meta-analysis
SHENG Yun-jian, HE Hong-yan*
Department of Infectious Diseases, The Affiliated Hospital of Southwest University College, Luzhou 646000, China
Objective To explore the potential association between cytochrome P450 2E1 (CYP2E1) and N-acetyltransferase-2(NAT2) polymorphisms and the risk of anti-tuberculosis drug-induced hepatotoxicity. Methods Medline/PubMed, EMBASE, Web of Science, and the Cochrane Library for the literatures about CYP2E1 polymorphism and anti-tuberculosis drug-induced hepatotoxicity were retrieved. All literatures were screened according to the inclusive and exclusive criteria, and the quality was measured. The efficacy was analyzed by odds ratios (OR) and 95% confidence interval (CI) using Revman 5.0 software. Results A total of 9 literatures involving 2049 cases were included. Compared with the c1/c2 and c2/c2 genotypes, the c1/c1 genotype induced a higher risk of anti-tuberculosis drug-induced hepatotoxicity (OR=1.38, 95% CI: 1.08-1.77, P=0.01) for the PstI/RsaI polymorphism, and there was no significant difference for the DraI polymorphism (OR=0.78, 95% CI: 0.51-1.18, P=0.23). Compared with individuals with NAT2 fast or intermediate acetylator genotype and c1/c1 genotype, patients who were NAT2 slow acetylators and carried the high activity CYP2E1 c1/c1 genotype had higher risk for anti-tuberculosis drug-induced hepatotoxicity (OR=3.10, P<0.0001). Conclusions CYP2E1 c1/c1 genotype is a risk factor for anti-tuberculosis drug-induced hepatotoxicity, and the concomitant presence of slow acetylator NAT2 genotype may further increase this risk.
CYP2E1; polymorphisms; tuberculosis; drug-induced hepatotoxicity; meta-analysis
R52
A
1007-8134(2017)04-0212-04
10.3969/j.issn.1007-8134.2017.04.007
四川省重点学科建设项目资助(SZD0421)
646000 泸州,西南医科大学附属医院感染科(盛云建);西南医科大学公共卫生学院实验中心(何鸿雁)
何鸿雁,E-mail: hehongyanboy@163.com
*Corresponding author, E-mail: hehongyanboy@163.com
