金花茶叶醇提物对LPS导致RAW炎症的保护作用
2017-09-15阎新佳
阎 新 佳
(哈尔滨商业大学 药学院,哈尔滨 150076)
金花茶叶醇提物对LPS导致RAW炎症的保护作用
阎 新 佳
(哈尔滨商业大学 药学院,哈尔滨 150076)
考察金花茶叶醇提物对内毒素(LPS)刺激腹腔巨噬细胞(RAW264.7)后细胞炎症的保护作用.通过噻唑蓝(MTT)法检测不同浓度金花茶叶醇提物作用下细胞的存活率;通过Griess法检测金花茶叶醇提物对LPS刺激后RAW264.7细胞NO释放量;通过酶联免疫吸附法检测炎症因子TNF-α,IL-1β,IL-6含量;通过蛋白免疫印迹法检测NF-κB p65的表达量.MTT结果显示,LPS及不同浓度的金花茶叶醇提物均未对细胞存活率产生明显影响(P>0.05).3、10、30、100 μmol/L的金花茶叶醇提物均可以明显减少LPS诱导的RAW264.7细胞NO的释放(P<0.05).100 μmol/L的金花茶叶醇提物可以明显减少LPS诱导的RAW264.7细胞IL-1β、IL-6和TNF-α的释放(P<0.001).10、30、100 μmol/L的金花茶叶醇提物均可以明显抑制LPS诱导的RAW264.7细胞NF-κB p65蛋白表达(P<0.05).金花茶叶提取物对内毒素导致的腹腔巨噬细胞炎症具有一定的保护作用,其作用机制可能与NF-κB通路相关.
金花茶叶醇提物;腹腔巨噬细胞;内毒素;细胞炎症
炎症是十分常见而又重要的基本病理过程,可以对组织损伤做出快速响应,主要目的是阻止外来微生物对机体的损害并清除毒素,修复组织和器官.但在炎症的发展过程中往往伴随着多种疾病的发生和发展,有研究表明,恶性肿瘤的发生中大部分都伴随有慢性炎症[1].此外,各种急慢性炎症也参与多种疾病发展的中间环节,如全身炎性反应综合征、急性呼吸窘迫综合征、哮喘、类风湿性关节炎等[2].革兰氏阴性菌是一种常见致病菌,其释放的脂多糖(LPS)可以诱导免疫和炎症反应,伴随引起发热、组织损伤、感染等炎症反应,严重者可以导致死亡.LPS进入机体后,可以通过活化NF-κB通路促进炎症因子的合成和分泌,最终导致机体损伤.
金花茶(Camellia chrysantha(Hu) Tuyama)是山茶科、山茶属、金花茶系植物,属于世界珍贵的植物品种,有“茶花皇后”之称.近些年研究认为金花茶叶中含有多种生理活性成分和对人体有益的微量元素,具有清热解毒等功效[3].现代药理研究发现,其活性成分还具有抑制肿瘤细胞生长、提高机体免疫力、延缓衰老、增强肝脏代谢能力、降低血糖、降低血压、调节血脂等功效[4-6].目前,还没有针对金花茶开发的抗炎药物,本研究采用LPS诱导小鼠腹腔巨噬细胞(RAW264.7)建立体外炎症模型,体外给予不同浓度的金花茶叶醇提物用于研究金花茶叶醇提物对小鼠腹腔巨噬细胞炎症的保护作用及相关的机制.以期为进一步开发金花茶有关的药物提供一定的理论基础.
1 实验材料与方法
1.1金花茶叶醇提物的制备
干燥的金花茶叶(10 g)粉碎过40目筛,用75%乙醇水(液料比1∶20)溶液浸泡20 min,超声(功率40 kHz)提取两次,每次30 min.合并提取液并减压浓缩,得浸膏1.158 g.用蒸馏水稀释浓缩液至一定浓度备用.实验前将金花茶叶提取物用无血清培养基稀释至所用浓度.
1.2实验试剂
LPS(Sigma-Aldrich,0111:B4),DMEM培养液(Gibco,1280001,添加NaHCO31.5 g/L),胎牛血清(Gibco,16000-044),胰蛋白酶(Gibco,15050-057),MTT(武汉博士德生物公司,AR1156),NO检测试剂盒(碧云天生物技术有限公司,S0021),IL-1β,IL-6,TNF-αELISA检测试剂盒(武汉伊莱瑞特生物科技有限公司,E-EL-M0037c,E-EL-M0044c,E-EL-M0049c),BCA检测试剂盒(碧云天生物技术有限公司,P0010S),SDS-PAGE凝胶试剂盒(北京鼎国昌盛生物技术有限责任公司,WB-0201),NF-κB p65抗体(Abcam,ab16502).
1.3实验仪器
371型二氧化碳培养箱(美国Thermo Forma);LG-1002-A超净工作台(苏州真田洁静设备有限公司);CKX41倒置显微镜(日本Olympus);Wellscan MK3酶标仪(芬兰Thermo);165-1801电泳仪(美国Bio-Rad).
1.4细胞培养
小鼠巨噬细胞系RAW264.7购买于中国科学院细胞库,加入含10%胎牛血清的DMEM培养液,于5% CO2的37℃培养箱内常规培养.每2~3 d更换一次培养基,细胞长至占瓶底80%~90%后传代,传代比例为1∶3~1∶6.取长势良好的3~6代对数生长期细胞用于实验.
1.5细胞存活率检测
取对数生长期的细胞,胰酶消化后调整细胞悬液浓度为5×104个/mL,加入到96孔板中,每孔体积为100 μL,于5% CO2的37 ℃培养箱内培养24 h.弃去96孔板内旧培养液,同时加入含3、10、30、100 μmol/L不同浓度金花茶叶醇提物的无血清培养液100 μL,并设置空白对照孔和模型孔,空白对照孔和模型孔均加入不含金花茶叶醇提物的无血清培养液,所有浓度平行3个复孔,于5% CO2的37 ℃培养箱内培养24 h.弃去96孔板内培养液,每孔加入含LPS 1 mg/L的无血清培养液100 μL,空白对照组加入LPS的无血清培养液,于5% CO2的37 ℃培养箱内培养24 h.24 h后每孔加入含MTT 0.5 mg/L的培养液100 μL,培养4 h后弃去上清液,每孔加入150 μL的DMSO,震荡10 min,使结晶物充分溶解.酶联免疫检测仪490 nm处测定各孔的吸光值.
1.6 NO量的检测
取对数生长期的细胞,胰酶消化后调整细胞悬液浓度为2×105个/mL,加入到24孔板中,每孔体积为1 mL,于5% CO2的37 ℃培养箱内培养24 h.弃去旧培养液,同时加入含3、10、30、100 μmol/L不同浓度金花茶叶醇提物的无血清培养液1 mL,并设置空白对照组和模型组,每组设3个复孔,5% CO2的37℃培养箱内培养24 h后,弃去旧培养液,加入含LPS 1 mg/L的无血清培养液1 mL,其中空白对照组加入不含LPS的无血清培养液,于5% CO2的37 ℃培养箱内培养24 h.24 h后用Griess法检测NO释放量.
1.7细胞炎症因子量的检测
取对数生长期的细胞,胰酶消化后调整细胞悬液浓度为2×105个/L,加入到24孔板中,每孔体积为1 mL,于5% CO2的37 ℃培养箱内培养24 h.弃去旧培养液,同时加入含3、10、30、100 μmol/L不同浓度金花茶叶醇提物的无血清培养液1 mL,并设置空白对照组和模型组,每组设3个复孔,5% CO2的37℃培养箱内培养24 h 后,弃去旧培养液,加入含LPS 1 mg/L的无血清培养液1 mL,其中空白对照组加入不含LPS的无血清培养液,于5% CO2的37 ℃培养箱内培养24 h.24 h后用ELISA试剂盒检测上清液内IL-1β、IL-6和TNF-α的浓度.
1.8蛋白表达检测
取对数生长期的细胞,胰酶消化后调整细胞悬液浓度为1×106个/L,加入到6孔板中,每孔体积为2 mL,于5% CO2的37 ℃培养箱内培养24 h.弃去旧培养液,同时加入含3、10、30、100 μmol/L不同浓度金花茶叶醇提物的无血清培养液1 mL,并设置空白对照组和模型组,每组设3个复孔,5% CO2的37 ℃培养箱内培养24 h后,弃去旧培养液,加入含LPS 1 mg/L的无血清培养液1 mL,其中空白对照组加入不含LPS的无血清培养液,于5% CO2的37 ℃培养箱内培养24 h.24 h后弃去培养液,提取胞核蛋白,BCA法检测总蛋白浓度,根据待测蛋白分子质量选择SDS-PAGE胶电泳分离蛋白,转膜,加入5%脱脂奶粉封闭后,加入NF-κB p65一抗,4 ℃孵育过夜,加二抗室温下孵育2 h,显影拍照.
1.9统计分析
蛋白表达结果采用Quantity One软件分析.结果以x±S表示,采用SPSS数据分析软件对数据进行统计学分析.组间数据比较采用One-Way ANOVA法分析,P<0. 05表示有统计学意义.
2 结 果
2.1金花茶叶醇提物作用下对细胞存活率的影响
MTT实验结果显示,LPS及不同浓度的金花茶叶醇提物均未对细胞存活率产生明显影响(P>0.05),见表1.

表1 金花茶叶醇提物及LPS对RAW264.7细胞活力的影响
2.2金花茶叶醇提物对LPS导致RAW264.7NO含量增多的影响
NO检测结果显示,与空白对照组相比,LPS能明显增加RAW264.7细胞NO的释放量(P<0.01).与模型组比较结果显示,加入不同的金花茶叶醇提物均可以明显减少LPS诱导的RAW264.7细胞NO的释放(P<0.05),详见表2.
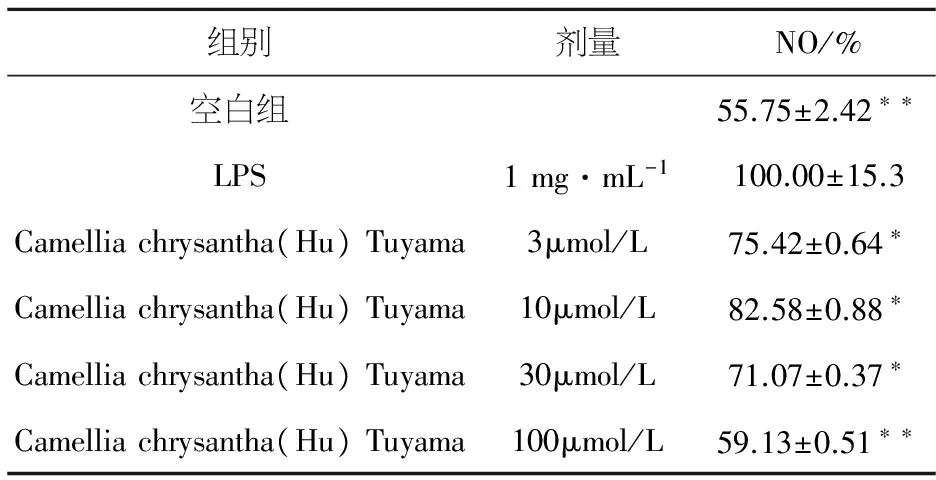
表2 金花茶叶提取物对LPS刺激RAW264.7细胞NO释放量的影响
与模型组比较:*P< 0.01**P< 0.01
2.3金花茶叶醇提物对LPS导致RAW264.7炎症因子含量
炎症因子释放量检测结果显示,与空白对照组相比,LPS均能明显增加RAW264.7细胞IL-1β、IL-6和TNF-α的释放量(P<0.01).与模型组比较结果显示,100 μmol/L的金花茶叶醇提物可以明显减少LPS诱导的RAW264.7细胞IL-1β、IL-6和TNF-α的释放(P<0.001);金花茶叶醇提物30 μmol/L可以明显减少TNF-α的释放量(P<0.01).金花茶叶醇提取3 μmol/L和10 μmol/L浓度对LPS诱导的RAW264.7细胞IL-1β、IL-6和TNF-α释放无明显影响(P>0.05),金花茶叶醇提取30 μmol/L对LPS诱导的RAW264.7细胞IL-1β和IL-6释放无明显影响(P>0.05),详见表3.
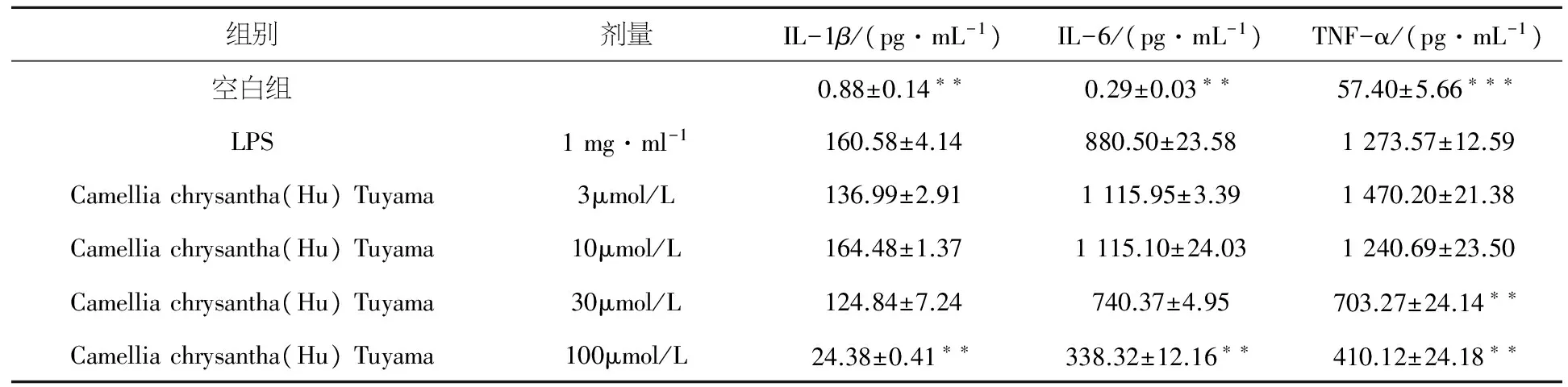
表3 金花茶叶提取物对LPS刺激RAW264.7细胞IL-1β (A), IL-6 (B)和TNF-α (C)释放量的影响
与模型组比较:*P< 0.05,**P< 0.01,***P< 0.001.
2.4 NF-κB p65蛋白表达
NF-κB p65蛋白表达结果显示,与空白组相比,LPS能明显增加RAW264.7细胞NF-κB p65 蛋白表达量(P<0.05);与模型组相比,10、30、100 μmol/L的金花茶叶醇提物可以明显抑制LPS诱导的RAW264.7细胞中NF-κB p65蛋白表达(P<0.05),见图1,表4.
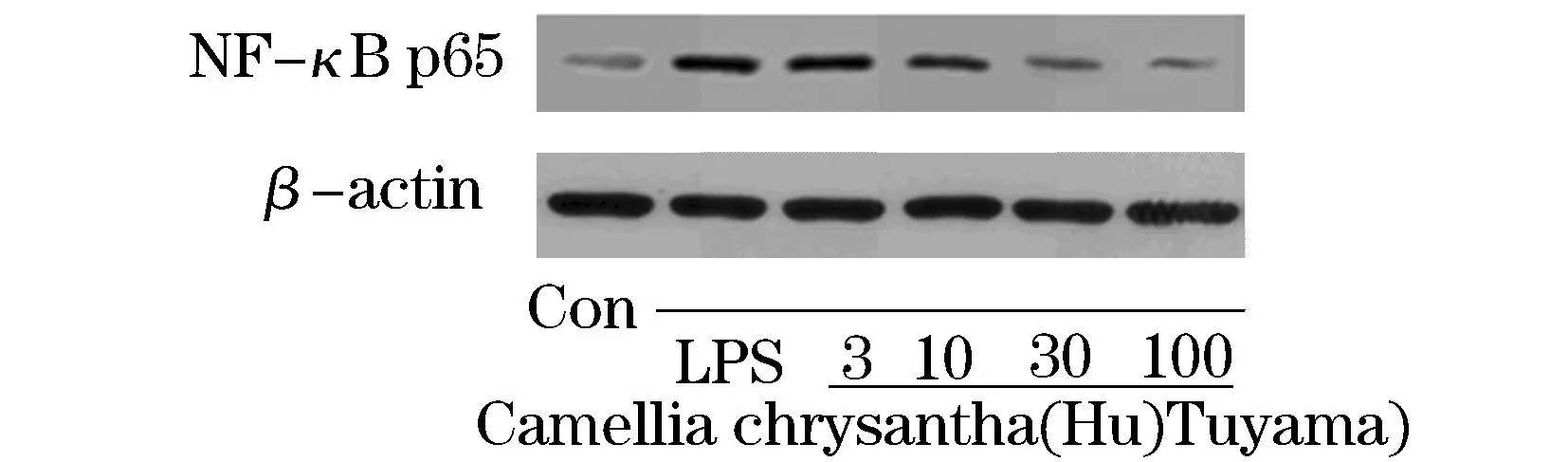
图1 金花茶叶提取物对LPS刺激RAW264.7细胞NF-κB p65 蛋白表达量的影响
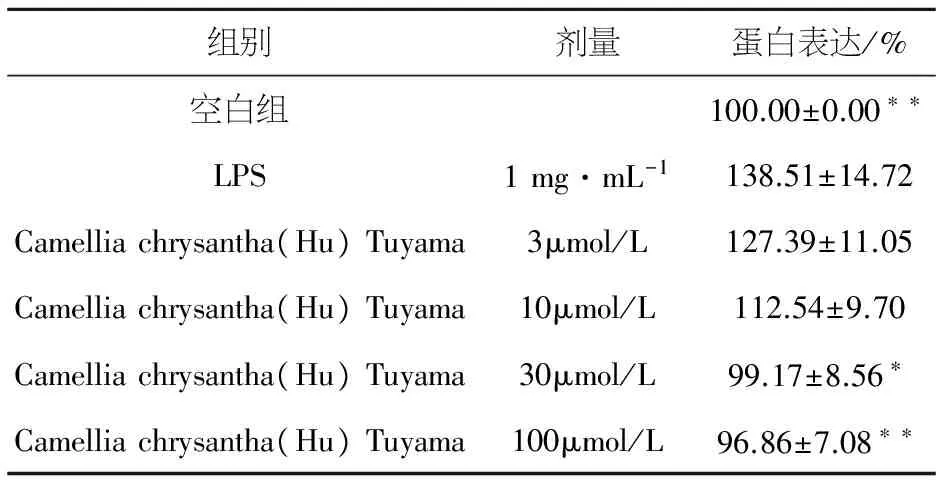
组别剂量蛋白表达/%空白组100.00±0.00∗∗LPS1mg·mL-1138.51±14.72Camelliachrysantha(Hu)Tuyama3μmol/L127.39±11.05Camelliachrysantha(Hu)Tuyama10μmol/L112.54±9.70Camelliachrysantha(Hu)Tuyama30μmol/L99.17±8.56∗Camelliachrysantha(Hu)Tuyama100μmol/L96.86±7.08∗∗
与模型组比较:*P< 0.05,**P< 0.01.
3 讨 论
炎症是在疾病发展过程中出现的一种常见的病理现象,在早期炎症中,巨噬细胞可以释放IL-1, IL-6, TNF-α等炎症因子,促进中性粒细胞活化,最终导致炎症损伤反应[7].LPS可以诱导炎症反应,因此本研究以小鼠腹腔巨噬细胞RAW264.7为研究对象,建立LPS诱导小鼠腹腔巨噬细胞RAW264.7体外炎症模型,首先考察不同浓度的金花茶叶对RAW264.7细胞活性的影响,结果显示,3、10、30、100 μmol/L不同浓度的金花茶叶醇提物均未对细胞存活率产生明显影响(P>0.05).NO对炎症因子的表达已被广泛研究[8],过量的NO会促进炎症的发生和发展.此外,NO供体可以上调IL-6等炎症因子的表达,目前NO的供体上调或下调炎症因子表达这一研究已经广泛应用于调控炎症反应[9-10].本研究采用Griess法检测LPS刺激后RAW264.7细胞NO释放量结果发现,3, 10, 30, 100μmol/L不同的金花茶叶醇提物均可以明显减少LPS诱导的RAW264.7细胞NO的释放(P<0.05).IL-1β、IL-6和TNF-α是促炎性细胞因子,是早期炎症反应的标志物,并介导炎症反应.本研究采用ELISA法检测LPS刺激后RAW264.7细胞IL-1β、IL-6和TNF-α释放量结果发现,100 μmol/L的金花茶叶醇提物均可以明显减少LPS诱导的RAW264.7细胞IL-1β、IL-6和TNF-α的释放(P<0.001).因此,本研究结果表明金花茶叶醇提物对LPS介导的RAW264.7细胞炎症损伤具有保护作用.
NF-κB参与调控炎症反应中部分细胞因子,当机体受到刺激时,IκB激酶复合体活化,诱导IκB磷酸化,解离NF-κB与IκB的复合体.游离的NF-κB可以转移到细胞核,诱导炎症刺激相关的细胞因子的基因表达[11].LPS可以激活NF-κB通路[12],因此本文通过LPS刺激小鼠腹腔巨噬细胞RAW264.7,考察金花茶叶醇提物对NF-κB p65 蛋白表达的影响.Western blot结果表明,10、30、100μmol/L的金花茶叶醇提物可以明显抑制LPS诱导的RAW264.7细胞中NF-κB p65蛋白表达(P<0.05),提示金花茶叶提取物对LPS诱导的腹腔巨噬细胞炎症保护作用的机制与NF-κB通路相关.
[1] HAYATO, NAKAGAWA, SHIN,etal. Inflammation- and stress-related signaling pathways in hepatocarcinogenesis [J]. World Journal of Gastroenterology, 2012, 31(18):4071-4081.
[2] SEKI H, FUKUNAGA K, ARITA M,etal. The anti-inflammatory and proresolving mediator resolvin E1 protects mice from bacterial pneumonia and acute lung injury [J]. Journal of Immunology, 2010, 184(2): A1364-A1364.
[3] 黄永林, 陈月圆, 文永新, 等. 不同溶剂提取及初步纯化的金花茶叶提取物降血脂功能实验研究[J]. 时珍国医国药, 2009, 20(4): 776-777.
[4] 牛广俊, 邢建宏, 朱 思, 等. 金花茶活性成分及抗氧化活性测定[J]. 福建林学院学报, 2015, 35(2): 165-168.
[5] 韦 璐, 秦小明, 林华娟, 等. 金花茶多糖的降血脂功能研究[J]. 食品科技, 2008, 33(7): 247-249.
[6] 陈永欣, 吕淑娟, 韦锦斌. 金花茶化学成分和药理作用研究进展[J]. 广西中医药, 2013, 36(1): 4-6.
[7] ISHII D, SCHENK A D, BABA S,etal. Role of TNFalpha in early chemokine production and leukocyte infiltration into heart allografts[J]. American Journal of Transplantation, 2010, 10(1): 59-68.
[8] KOVAYASHI Y. The regulatory role of nitric oxide in proinflammatory cytokine expression during the induction and resolution of inflammation [J]. Journal of Leukocyte Biology, 2010, 88(6): 1157-1162.
[9] SIEDNIENKO J, NOWAK J, MOYNAGH P N,etal. Nitric oxide affects IL-6 expression in human peripheral blood mononuclear cells involving cGMP-dependent modulation of NF-κB activity[J]. Cytokine, 2011, 54(3): 282-288.
[10] MORITA R, UCHIYAMA T, HORI T. Nitric oxide inhibits IFN-alpha production of human plasmacytoid dendritic cells partly via a guanosine 3', 5'-cyclic monophosphate-dependent pathway [J]. Journal of Immunology, 2005, 175(2): 806-812.
[11] SMALE S T. Hierarchies of NF-κB target-gene regulation [J]. Nature Immunology, 2011, 12(8): 689-94.
[12] THOLANDER M, ARONSSON K. New insight in LPS antagonist [J]. Mini Reviews in Medicinal Chemistry, 2009, 9(3): 306-317.
ProtectioneffectofethanolextractfromCamelliachrysantha(Hu)TuyamaonLPS-stimulatedinflammatoryinperitonealmacrophages
YAN Xin-jia
(School of Pharmacy, Harbin University of Commerce, Harbin 150076, China)
To investigate the anti-inflammatory effect of ethanol extract from Camellia chrysantha (Hu) Tuyama in LPS-stimulated peritoneal macrophages (RAW264.7) inflammatory. MTT assay was used to measure the RAW264.7viability in ethanol extract from Camellia chrysantha (Hu) Tuyama treated and untreated cells. Griess assay was used to measure the secretion of NO in ethanol extract from Camellia chrysantha (Hu) Tuyama treated and untreated cells. ELISA assay was used to measure the secretion of TNF-α, IL-1β, and IL-6 in ethanol extract from Camellia chrysantha (Hu) Tuyama treated and untreated cells. The protein expression of NF-κB p65 was detected by Western blot. There was no significant effect on viability of RAW264.7 (P>0.05). The secretion levels of NO was significantly lower in 3, 10, 30 and 100 μmol/L methanol extract from Camellia chrysantha (Hu) Tuyama treated groups (P<0.05). The secretion levels of TNF-α, IL-1βand IL-6 were significantly lower in 100 μmol/L ethanol extract from Camellia chrysantha (Hu) Tuyama treated group (P<0.01). The protein expression of NF-κB p65 was significantly decrease in 10, 30 and 100 μmol/L ethanol extract from Camellia chrysantha (Hu) Tuyama treated groups (P<0.05). The ethanol extract from Camellia chrysantha (Hu) Tuyama could inhibit inflammation in LPS-stimulated peritoneal macrophages and the underlying mechanism may involve the NF-κB pathway.
ethanol extract from Camellia chrysantha (Hu) Tuyama; peritoneal macrophages; LPS; inflammatory
2017-01-04.
哈尔滨商业大学研究团队支持项目(2016TD009);哈尔滨商业大学青年创新人才支持项目(2016QN074)
阎新佳(1984-),男,博士,讲师,研究方向:中药药效物质基础和质量控制.
R285
:A
1672-0946(2017)04-0394-05
