3种胰岛素类似物联合口服降糖药治疗糖尿病的疗效比较
2017-09-11刘仁海陈小莲穆伽俐
刘仁海,高 霞,陈小莲,穆伽俐,肖 蓉
(1.重庆市武隆区人民医院内分泌科,重庆 408500; 2.重庆市涪陵中心医院内分泌科,重庆 408000)
·临床研究·
3种胰岛素类似物联合口服降糖药治疗糖尿病的疗效比较
刘仁海1,高 霞1,陈小莲1,穆伽俐1,肖 蓉2
(1.重庆市武隆区人民医院内分泌科,重庆 408500; 2.重庆市涪陵中心医院内分泌科,重庆 408000)
目的 比较3种胰岛素类似物联合口服降糖药(OADs)治疗2型糖尿病(T2DM)的效果。方法 将73例T2DM患者根据随机数字表法分为双时相门冬胰岛素 30(BIAsp30)组(A组,n=23)、地特胰岛素组(B组,n=23)、甘精胰岛素组(C组,n=27),3组均配合合理 OADs治疗。结果 3组治疗后糖化血红蛋白(HbA1C)、空腹血糖(FBG)较治疗前均有明显下降(P=0.000),各组治疗前后组间HbA1C,FBG及体质量指数(BMI)的变化、下降幅度差异均无统计学意义(P>0.05);3组 HbA1C达标率分别为 52.00%,43.00%,59.00%,差异无统计学意义(P=0.058);3组均无重度低血糖事件发生(P=0.971,0.061,0.213)。结论 3种胰岛素类似物联合OADs治疗T2DM的降糖效果相当,重度低血糖发生率均较低,体质量增加不明显。
胰岛素类似物;双时相门冬胰岛素30;地特胰岛素;甘精胰岛素;2型糖尿病
随着科技的进步,糖尿病治疗已经进入到胰岛素类 似物时代。胰岛素治疗糖尿病具有疗效良好、低血糖发生率低、体质量增加少、依从性好等优点。而随着病程的进展,很多糖尿病患者无法仅靠口服降糖药(OADs)将血糖控制在达标范围内,2013年版《中国2型糖尿病防治指南》指出,对于单纯使用口服药物不能达到疗效的患者,可使用预混胰岛素或基础胰岛素。本研究中选择了OADs治疗或既往使用人胰岛素后血糖控制欠佳的2型糖尿病(T2DM)患者,分别用OADs联合3种常用胰岛素类似物治疗,观察其安全性及治疗效果。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:年龄为18~65岁,确诊为T2DM的患者;已经规范治疗半年以上,但疗效仍不理想;空腹血糖(FBG)≥7.0 mmol/L及糖化血红蛋白(HbA1C)≥7.0%,体质量指数(BMI)≤35.0 kg/m2;符合1975年赫尔辛基宣言及作者所在单位人体试验伦理委员会所制订的伦理学标准,并取得患者的知情同意。
排除标准:合并严重并发症;出现急性并发症;严重的心肺功能不全;肾功能和/或肝功能异常不能使用OADs,如血肌酐女性超过124 μmol/L(1.4 mg/dL)或男性超过133 μmol/L(1.5 mg/dL),[丙氨酸氨基转移酶(ALT)和/或天门冬酸氨基转移酶(AST)]超过2.5倍参考值上限;妊娠及哺乳期妇女;对胰岛素过敏。
病例选择与分组:选取2013年10月至2014年11月于重庆市武隆区人民医院就诊的T2DM患者73例,其中女34,男39例;满足1999年由世界卫生组织(WHO)制订的相关诊断标准。根据随机数字表法分为A组(n=23)、B组(n=23)、C组(n=27),3组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
表1 3组患者一般资料比较(±s)
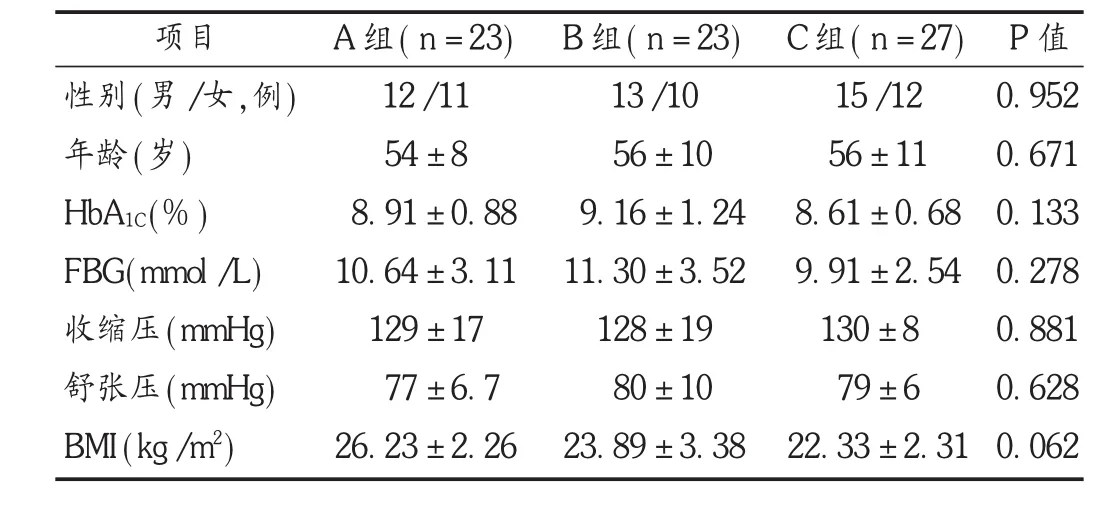
表1 3组患者一般资料比较(±s)
项目性别(男/女,例)年龄(岁) HbA1C(%) FBG(mmol/L)收缩压(mmHg)舒张压(mmHg) BMI(kg/m2) A组(n=23) 12/11 54±8 8.91±0.88 10.64±3.11 129±17 77±6.7 26.23±2.26 B组(n=23) 13/10 56±10 9.16±1.24 11.30±3.52 128±19 80±10 23.89±3.38 C组(n=27) 15/12 56±11 8.61±0.68 9.91±2.54 130±8 79±6 22.33±2.31 P值0.952 0.671 0.133 0.278 0.881 0.628 0.062
1.2 方法
所有患者均进行糖尿病健康饮食等教育,A组给予双时相门冬胰岛素30(BIAsp30,商品名诺和锐30),每日早晚餐前各注射1次,B组给予地特胰岛素(商品名诺和平),每日睡前注射1次;C组给予甘精胰岛素(商品名来得时),每日睡前注射1次。共治疗24周。首次使用胰岛素者起始剂量0.1~0.2 U/kg;既往使用胰岛素者以入组前1 d总剂量为基础进行调整(按1∶1于早晚餐前或以中效胰岛素的80%作为基础胰岛素起始)。A组除二甲双胍保留以外停用所有OADs,B组和C组维持原有OADs。研究期间,根据血糖水平调整治疗方案,BIAsp30于每天早晚餐前即刻腹部皮下注射,注射甘精胰岛素和地特胰岛素的患者,于每天睡觉前完成腹部注射。详见表2。

表2 所有患者血糖水平调整治疗方案
1.3 观察指标
专人记录低血糖发生的相关情况。低血糖:无症状性低血糖(仅血糖低于正常水平,不出现相应症状);症状性低血糖(血糖低于正常值,且出现相关症状,但进食后能得到改善);严重低血糖(参与研究者要在别人帮助下才能处理低血糖事件而,无法单独完成)。除自测血糖值外,实验室指标均由本院检验科完成检测。其中血糖测定葡萄糖采用己糖激酶法,HbA1C采用最新的高效液相色谱法进行检测。记录并比较患者BMI。
1.4 统计学处理
采用SPSS 18.0统计学软件处理数据。以百分比表示计数资料,以均数±标准差(±s)表示计量资料。3组间的比较采用单因素方差分析,并进行方差齐性的检验,非齐性的数据采用 K-W秩和检验;数据若不符合正态或方差不齐,两两比较采用非参数检验法,齐性时两两比较采用LSD法;计数资料及率的比较采用 χ2检验,治疗前后的比较采用自身的配对 t检验。P<0.05为差异有统计学意义。
2 结果
2.1 HbA1C,FBG及BMI比较
结果见表3至表5。A组、B组、C组的HbA1C达标率分别为52.00%,43.00%,59.00%,HbA1C<7%达标率3组间差异无统计学意义(P=0.058),见图1。同时,各组治疗前后BMI变化的差异无统计学意义(P=0.213,0.971,0.061)。
2.2 不良反应
治疗期于24周后终止,10例发生低血糖,其中A组5例(21.74%),B组3例(13.04%),C组2例(7.41%)。所有患者均未出现严重低血糖事件,3组低血糖发生率无明显差异(P=0.911,0.061,0.213),见图2。
表3 3组患者FBG变化比较(±s,mmol/L)

表3 3组患者FBG变化比较(±s,mmol/L)
P值A组B组C组时间治疗前治疗后前后差值P值(n=23) 10.64±3.11 6.13±1.96 4.51±3.59 0.000 (n=23) 11.30±3.52 6.87±1.07 4.44±3.59 0.000 (n=27) 9.91±2.54 6.34±0.63 3.56±2.50 0.000 0.278 0.161 0.506
表4 3组患者HbA1C变化比较(±s,%)

表4 3组患者HbA1C变化比较(±s,%)
P值A组B组C组时间治疗前治疗后前后差值P值(n=17) 8.91±0.88 6.58±0.70 2.33±1.28 0.000 (n=23) 9.16±1.24 7.05±0.96 2.12±1.21 0.000 (n=27) 8.61±0.68 6.66±0.79 2.00±1.00 0.000 0.133 0.112 0.552
表5 3组患者BMI变化比较(±s,kg/m2)

表5 3组患者BMI变化比较(±s,kg/m2)
P值A组B组C组时间治疗前治疗后前后差值P值(n=23) 26.22±2.27 25.89±2.61 0.33±1.27 0.213 (n=23) 23.89±3.38 23.90±3.01-0.01±1.02 0.971 (n=27) 22.33±2.31 22.16±2.23 0.16±0.43 0.061 0.145 0.155 0.087

图1 3组患者HbA1C<7%达标情况
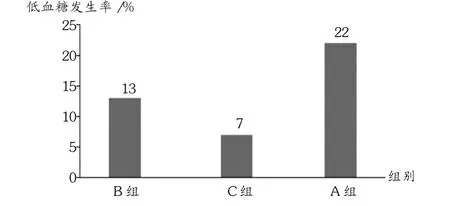
图2 3组患者低血糖发生率
3 讨论
降低糖尿病并发症死亡风险的最重要因素是严格控制血糖,这一事实已经得到大量研究证实。但随着糖尿病患者胰岛β细胞功能的不断衰退,OADs将难以控制HbA1C在正常范围内,因此国际糖尿病联合会(IDF)及美国糖尿病协会(ADA)均强调,如果患者的HbA1C不能被调整到正常范围,那么必须改变患者的治疗方案,而众多药物中,胰岛素是最直接且有效的选择[1-2]。人胰岛素起效慢,作用时间长,会引起血糖较大波动。由于患者对于胰岛素认识不够,很多都拒绝使用胰岛素进行治疗,不仅会延误病情,也不利于疾病的治疗。近年来,通过科学家的不断努力,研发的胰岛素类似物具有更佳的降糖效果及更好的安全性。
2000年4月,批准上市的甘精胰岛素(来得时)是第1个长效人胰岛素类似物,其注射后先在皮下形成微沉淀,再通过转化为单体物质进入血液循环,过程大约24 h,与人体正常的基础胰岛素分泌极其类似。因此被很多业内专家所看好。地特胰岛素(诺和平)是一个14碳脂肪酸连接在人胰岛素B链29位赖氨酸残基部位,同时去掉了30位的苏氨酸,该方法修饰的胰岛素类似物与白蛋白的亲和力及稳定性均有增加[3],体内最长作用仍可持续24 h。与人胰岛素NPH相比,副作用明显变少,低血糖及体质量增加风险较小,体内吸收变异也较少[4-5]。BIAsp30是包含70%鱼精蛋白结合的门冬胰岛素和30%可溶性门冬胰岛素的生物合成的预混人胰岛素类似物。其中,可溶性门冬胰岛素就人胰岛素而言,起效及达峰均更快[6],缩短了药物起效时间,可于进餐前即刻注射。
HbA1C是目前评价血糖控制达标与否的重要指标之一,能反映测试前2~3个月的平均血糖水平。2017 Standards of Medical Care in Diabetes Care中指出,HbA1C<7.0%对血糖达标尤为关键。日本科学家发现,给患者每天重复注射2次 BIAsp30,能够使患者不在正常范围的HbA1C值下降大约2.5%[7]。另有研究显示,每天注射1次甘精胰岛素的患者与每天注射2次BIAsp30的患者相比,HbA1C值虽都能明显下降,但注射甘精胰岛素患者下降幅度更大[8]。其他研究显示,甘精胰岛素与地特胰岛素对患者的降糖作用非常相似,效果差异也不明显[9]。3种药物对 HbA1C的调整作用也无差异。因此,学者一致认为,通过使用口服药物,HbA1C不能被调整到正常范围的患者,使用注射用胰岛素,如 BIAsp30、地特胰岛素、甘精胰岛素,效果类似,无明显区别。
研究显示,如果患者FBG不在正常范围内,则提示患者全体的血糖控制状况不好,对于HbA1C贡献超过50%。一项研究发现,对于初诊T2DM的患者,FBG和HbA1C之间存在着紧密联系[10],FBG首先达标显得更为重要。经24周治疗结束后,A组、B组、C组FBG均控制达标,且分别下降了4.5,4.0,3.6 mmol/L,组间血糖下降幅度差异不显著,提示BIAsp30与地特胰岛素、甘精胰岛素有相似的控制FBG的作用,从而较好地帮助患者达到血糖控制目标。患者不能很好地控制体质量,在一定程度上会影响血糖的控制。有学者做过类似的研究发现,如果患者的体质量增长了3%~9%,且独立于血糖控制、研究周期、胰岛素类型[11]。相反,体质量增加同样妨碍血糖的达标控制,特别是在胰岛素剂量不足的情况下[12-13]。本研究中,24周治疗结束后,3组均无显著的BMI增加。低血糖是患者使用胰岛素治疗最可能发生的不良事件[14]。研究发现,注射用3种胰岛素药物对于引发低血糖的频率并无显著差异。提示低血糖的发生与患者对血糖控制严格有关,因此,通过加强患者对低血糖的认识和一定的预防措施,能够在不同程度上减少低血糖的发生。
综上所述,对于那些单纯使用药物不能达到满意疗效的T2DM患者,通过使用胰岛素类似物(BIAsp30、地特胰岛素、甘精胰岛素)治疗后,HbA1C和FBG均较治疗前显著下降,糖代谢得到明显改善。3组患者治疗前后BMI均无显著增加。值得注意的是,A组在取得相似血糖控制的同时,低血糖的发生率与基础胰岛素类似。同时,显示预混胰岛素与基础胰岛素有相似的有效性和安全性,可为临床提供更多有效的糖尿病胰岛素治疗方案。本研究设计仍存在不足,如样本量较小、未对组间胰岛素使用剂量进行对比、未对餐后血糖进行评估,需要进一步进行临床研究。
[1]Pillonetto G,Caumo A,Cobelli C.Dynamic insulin sensitivity index:importance in diabetes[J].American Journal of Physiology-Endocrinology and Metabolism,2010,298(3):E440-E448.
[2]Berntorp K,Haglund M,Larsen S,et al.Initiation of biphasic insulin aspart 30/70 in subjects with type 2 diabetes mellitus in a largely primary care-based setting in Sweden[J].Primary Care Diabetes,2011,5(2):89.
[3]Lucidi P,Porcellati F,Rossetti P,et al.Pharmacokinetics and pharmacodynamics of therapeutic doses of basal insulins nph,glargine,and detemir after 1 week of daily administration at bedtime in type 2 diabetic subjects:A randomized crossover study[J].Diabetes Care,2011,34(6):1312.
[4]Dornhorst A,Lüddeke HJ,Koenen C,et al.Transferring to insulin detemir from NPH insulin or insulin glargine in type 2 diabetes patients on basal-only therapy with oral antidiabetic drugs improves glycaemic control and reduces weight gain and risk of hypoglycaemia:14-week follow-up data from PR[J].Diabetes Obesity&Metabolism,2008,10(1):75-81.
[5]Smeeton F,Moradie FS,Jones RH,et al.Differential effects of insulin detemir and neutral protamine Hagedorn(NPH)insulin on hepatic glucose production and peripheral glucose uptake during hypoglycaemia in type 1 diabetes[J].Diabetologia,2009,52(11): 2317-2323.
[6]Nauck MA,Duran S,Kim D,et al.A comparison of twice-daily exenatide and biphasic insulin aspart in patients with type 2 diabetes who were suboptimally controlled with sulfonylurea and metformin:a non-inferiority study[J].Diabetologia,2007,50(2): 259-267.
[7]MäkelÄJK,Schmüser C,Askonen K,et al.Starting or switching to biphasic insulin aspart 30(BIAsp 30)in type 2 diabetes:A multicenter,observational,primary care study conducted in Finland[J].Diabetes Research&Clinical Practice,2012,95(1):10-18.
[8]Shah SN,Litwak L,Haddad J,et al.The A1chieve study:a 60 000-person,global,prospective,observational study of basal,meal-time,and biphasic insulin analogs in daily clinical practice[J].Diabetes Research and Clinical Practice,2010,88(Suppl 1): S11-S16.
[9]Koehler G,Treiber G,Wutte A,et al.Pharmacodynamics of the long-acting insulin analogues detemir and glargine following single-doses and under steady-state conditions in patients with type 1 diabetes[J].Diabetes Obesity&Metabolism,2014,16(1): 57-62.
[10]Hage C,Lundman P,Rydén L,et al.Fasting glucose,HbA1C,or oral glucose tolerance testing for the detection of glucose abnormalities in patients with acute coronary syndromes[J].European Journal of Preventive Cardiology,2013,20(4):549.
[11]Kramer CK,Zinman B,Retnakaran R.Short-term intensive insulin therapy in type 2 diabetes mellitus:a systematic review and meta-analysis[J].LancetDiabetes& Endocrinology,2013,1(1):28-34.
[12]Xin K,Wang C,Chen D,et al.Contributions of basal glucose and postprandial glucose concentrations to hemoglobin A1c in the newly diagnosed patients with type 2 diabetes-the preliminary study[J].Diabetes Technology&Therapeutics,2015,17(7):445.
[13]Peyrot M,Barnett AH,Meneghini LF,et al.Factors associated with injection omission/non-adherence in the Global Attitudes of Patients and Physicians in insulin therapy study[J].Diabetes Obesity&Metabolism,2012,14(12):1081-1087.
[14]Lipska KJ,Warton EM,Huang ES,et al.HbA1Cand risk of severe hypoglycemia in type 2 diabetes:the diabetes and aging study[J].Diabetes Care,2013,36(11):3535.
Comparison Effect of Three Insulin Analogues Combined with Oral Antidiabetic Drugs in Treating Type 2 Diabetes M ellitus
Liu Renhai1,Gao Xia1,Chen Xiaolian1,Mu Jiali1,Xiao Rong2
(1.Department of Endocrinology,Wulong District People′s Hospital of Chongqing,Chongqing,China 408500; 2.Department of Endocrinology,Chongqing Fuling Central Hospital,Chongqing,China 408000)
Objective To compare the efficacy of three insulin analogues combined with oral antidiabetic drugs(OADs)in the treatment of patients with type 2 diabetic mellitus(T2DM).M ethods Totally 73 patients with T2DM were randomly divided into BIAsp30 group (group A,n=23),detemir insulin group(group B,n=23)and glargine insulin group(group C,n=27)according to the digital table method,the 3 groups were treated with appropriate OADs.The efficacy and adverse events of the patients were evaluated by monitoring the indexes before and after treatment.Results The glycosylated hemoglobin A1C(HbA1C),fasting blood glucose(FBG)of the three groups after treatment significantly decreased than before treatment(P=0.000).The changes of HbA1C,FBG and body mass index(BMI) in the 3 groups were not statistically significant before and after treatment(P>0.05).The success rate of HbA1Cof the group A,B,C were 52.00%,43.00% and 59.00%,respectively,there was no statistically significant difference(P=0.058).No severe hypoglycemic events occurred in the 3 groups(P=0.971,0.061,0.213).Conclusion The effects of three insulin analogues combined with OADs in the treatment of patients with T2DM are similar,and no significant weight gain,lower the incidence of severe hypoglycemia.
insulin analogues;biphasic insulin aspart 30;insulin detemir;insulin glargine;type 2 diabetes mellitus
R969.4;R977.1+5
A
1006-4931(2017)15-0034-04
2017-04-10)
10.3969/j.issn.1006-4931.2017.15.011
重庆市卫生局资助项目[2011-2-523]。
刘仁海,大学本科,副主任医师,研究方向为糖尿病的治疗,(电子信箱)317908496@qq.com。
