不同迁徙能力奇异变形杆菌的比较蛋白质组学研究
2017-09-11刘艳霞刘俊康
唐 雨,刘艳霞 ,刘俊康,邓 渝
(中国人民解放军第三军医大学药学院生药学与天然药物化学教研室,重庆 400038)
·实验研究·
不同迁徙能力奇异变形杆菌的比较蛋白质组学研究
唐 雨,刘艳霞 ,刘俊康,邓 渝
(中国人民解放军第三军医大学药学院生药学与天然药物化学教研室,重庆 400038)
目的 应用比较蛋白质组学的方法,检测2种不同迁徙能力奇异变形杆菌变化显著的差异蛋白,为深入研究奇异变形杆菌的耐药性提供重要依据。方法 采用LB培养基培养迁徙能力不同的内环与外环变形杆菌,通过菌落直径比值反映2种菌迁徙能力的差异;采用比较蛋白质组学的方法,检测2种菌总体蛋白表达差异,并着重分析差异明显的核糖蛋白各种类间的相互作用。结果 内环菌菌落直径较小,外环菌菌落直径较大,其菌落直径比值为3.84±0.56;与内环菌相比,外环菌蛋白表达变化显著,仅外环菌表达的蛋白29种,外环菌表达显著下调的蛋白129种,显著上调的蛋白269种;针对核糖蛋白分析发现,表达显著增高的核糖蛋白种类有34种。结论 外环菌从形态到蛋白质表达均有显著变化,其核糖体蛋白表达的显著增加可能是其产生耐药性的原因。
奇异变形杆菌;迁徙能力;比较蛋白质组学;耐药
奇异变形杆菌是肠杆菌科变形杆菌属的细菌,广泛存在于人和动物的肠道内,是导致泌尿系统感染的第二大病原菌,仅次于大肠埃希菌[1]。同时,其致病机制为在感染部位大量繁殖并利用菌毛黏附于靶细胞表面,在靶细胞表面分化生长,并超量表达鞭毛和多糖荚膜,然后侵入细胞和细胞间质,释放大量尿素酶、溶蛋白酶、溶血素等毒力因子,使受染细胞产生病变,最终导致相应组织和器官功能的异常,引起疾病[2]。奇异变形杆菌感染尿路后的治疗较困难,虽然各种广谱抗菌药物可控制感染,但近年来,关于奇异变形杆菌耐药的报道逐渐增多,且呈上升趋势。有研究从耐药菌株产生超广谱β-内酰胺酶及AmpC酶等角度进行探索[3],希望解决奇异变形杆菌的耐药问题。本研究中为深入探讨不同迁徙能力的奇异变形杆菌蛋白质表达的差异,寻找更为确切的耐药靶点,为后续深入地研究耐药分子机制提供依据,有利于解决其耐药问题。
1 材料与方法
1.1 仪器与材料
仪器:质谱系统(Thermo LTQ Orbitrap Elite);液相系统(Thermo EASY-nlc1000);Thermo EASY-Spray Column Pepmap C18柱,15 cm×75 μm,3 μm);低温高速离心机(美国 Thermo公司);Milli-Q超纯水机(美国Millipore公司);超声破碎仪(宁波新芝生物科技有限公司)。
材料:奇异变形杆菌(Proteus mirabilis,PM)由本实验室保存。细菌裂解液(7 mol/L尿素,2 mol/L硫脲,4%CHAPS,0.2%Bio-Lyte,0.001%溴酚蓝);LB指示培养基(胰蛋白胨1%,酵母提取物0.5%,NaCl 1%,pH=7.2,1.5%琼脂,0.05%TTC,0.1%葡萄糖);LB无指示培养基(同LB指示培养基,无TTC溶液)。
1.2 细菌接种
已经高压灭菌的LB培养基,待其温度降至50℃左右时按比例加入TTC、葡萄糖混匀,制板后室温冷凝,37℃倒置,敞口无菌烤板0.5 h,正中心点种奇异变形杆菌,37℃培养3 d。待接种的奇异变形杆菌波动生长3 d后,用接种针取内环菌和外环菌点种于LB指示培养基平板上,分别标记为A和B,37℃恒温培养过夜。观察不同区域细菌生长速度及迁徙能力。
1.3 不同迁徙能力菌体的比较蛋白质组学检测[4]
1.3.1 样品制备
按1.2项下方法取内环菌和外环菌,点种于LB无指示培养基上,收集2种不同迁徙能力的细菌,于4℃,以5 000 r/min的速率,离心10 min,收集菌体。用PBS洗1次,再次离心后,菌体加入适量含PMSF的细菌裂解液,0℃超声裂解10 min,于4℃,以1 3 000 r/min的速率离心10 min,收集上清液,即为制备好的全细菌蛋白液。BCA法测定蛋白浓度。
1.3.2 蛋白质的变性、纯化、烷基化、酶解及脱盐
参照文献[5-6]相关方法并加以改进。取样品添加细菌裂解液及上样缓冲液配制成质量浓度为3 g/L的蛋白样品,96℃变性10 min,冷却至室温,每孔上样60 μg,SDS-PAGE凝胶电泳约0.5 cm即停止,考马斯亮蓝染色、脱色后,切胶,每样不超过1 cm2,置1.5 mL无菌离心管中,继续脱色至无色,加乙腈脱水至胶粒变白,真空抽干,加10 mmoL DTT(25 mmol NH4HCO3)200 μL,56℃保温1 h,冷却至室温,吸干,快速加IAA(25 mmoL NH4HCO3)200 μL,置暗室 45 min。依次用25 mmoL NH4HCO3(2次)、25 mM NH4HCO3+50%乙腈(2次)、乙腈(1次),每次10 min。乙腈脱水至胶粒变白,真空抽干。将0.1 g/L酶液用25 mmoL NH4HCO3稀释10~20倍,每管加20~30 μL,瞬时离心,使酶液和胶粒充分接触,4℃放置30 min。待酶液被胶粒完全吸收,加25 mmoL NH4HCO3至总体积100~150 μL,37℃过夜。加1%TFA终止酶切,震荡混匀,离心收集酶解液。
1.3.3 质谱检测[5-6]
nano-LC-MS/MS液质联用系统作比较蛋白质组学检测。
色谱条件:液相系统为 Thermo EASY-nlc1000;质谱系统:Thermo LTQ Orbitrap Elite;分析柱为 C18色谱柱(15 cm×75 μm,3 μm);进样量为2 μL,流速为300 nL/min;流动相A:0.1%甲酸水溶液,流动相B:0.1%甲酸乙腈;梯度洗脱,时间120 min。
质谱条件:电喷雾(ESI)离子源,喷雾电压约为2.2 kV,毛细管温度为250℃,碰撞能量35%,碰撞诱导解离(CID),正离子模式;由Tune and Xcalibur控制软件根据数据依赖的自动模式实施一级和二级切换,一级质谱使用全质量扫描,m/z范围300~1 800。
1.4 数据处理及生物信息学分析[5-6]
使用Thermo Proteome discoverer 1.4搜索引擎对数据库进行检索,检索奇异变形杆菌种属的ΜniProt数据库;参数:相对分子质量范围350~5 000,母离子分辨率10 mg/kg,子离子0.8,2个漏切位点的全酶切;信噪比阈值(S/N Threshold)1.5;固定修饰:半胱氨酸(烷基化)+57.021 5;可变修饰:蛋氨酸(氧化)+15.994 9;假阳性率(FDR):0.01。采用SIEVE v2.1×64进行无标定量分析,寻找相关差异蛋白,根据实验组与对照组丰度比值分析差异蛋白。选用 iProXpress(integrated protein expression)在线蛋白表达分析系统进行(Gene Ontology,GO)注释的索引及细胞组分、过程、生物学功能、信号通路聚类的统计分析;寻找2种菌的差异蛋白;利用STRING(version 10,http://string-db.org/)数据库进行蛋白-蛋白相关网络分析。
2 结果
2.1 培养观察结果

图1 TTC指示剂培养观察结果

图2 不同区域菌体接种培养观察结果
初始阶段生长状态与贾雄飞等[7]报道的增殖方式类似,但环间距稍大于其报道,后出现环间距增大的菌群,形如扇面(见图1)。环间距小处于中央位置的为内环菌,间距大处于边缘位置的为外环菌。不同区域菌体分别接种后,由菌落直径可见,内环菌菌落直径较小,外环菌菌落直径较大,菌落直径比值为3.84±0.56,说明外环菌与内环菌相比迁徙能力更强(见图2)。
2.2 比较蛋白质组学检测
凝胶电泳法去除电解质后,比较蛋白质组学检测和分析,共鉴定到蛋白质1 003种,其中仅内环菌组表达的29种,仅外环菌组表达的29种,通过表达丰度比较,丰度减少少于50%的129种,丰度增加至2倍以上的269种,2种菌蛋白质表达变化不大的547种。结果显示,外环菌相比内环菌的蛋白质表达情况发生了巨大变化。
实验发现,2种菌在细胞形态方面呈现出极大差异,内环菌为短杆状,外环菌则为细长杆状。有研究对不同迁徙能力的奇异变形杆菌进行鞭毛染色观察发现,迁徙速度更快的变形杆菌的鞭毛从数量及长度均远超过迁徙速度慢的菌,提示两者的蛋白质表达会有较大差异[8]。细胞内蛋白质合成的分子机器是核糖体,核糖体是细胞内一种核糖核蛋白颗粒,主要由rRNA和蛋白质构成,其唯一功能是按照mRNA的指令将氨基酸合成蛋白质多肽链。核糖体蛋白种类的变化对细菌蛋白质表达的影响是关键的。因此本研究中着重分析外环菌比内环菌表达丰度显著增加的核糖体蛋白并展示各蛋白间的相互作用(见图3和表1)。
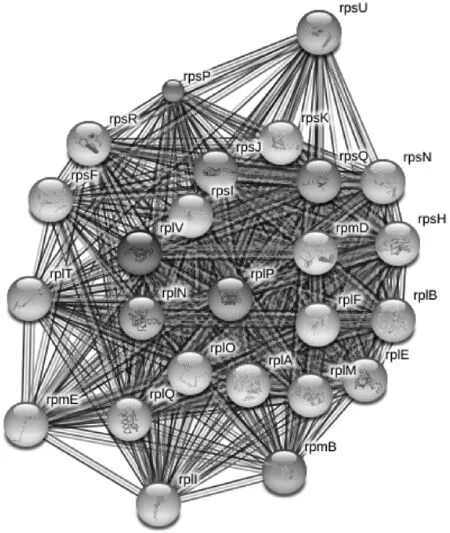
图3 外环菌表达丰度增加2倍以上的核糖体蛋白相互作用图
3 讨论
由于无标记蛋白质组学检测方法本身容易出现假阳性和定量不准的问题,采用内环菌与外环菌平行操作的方法保证可比性,同时在搜库时设置信噪比阈值(S/N Threshold)1.5以去除背景。另因 iProXpress数据库与STRING数据库的差异,有9种在iProXpress中聚类的核糖蛋白种类未在STRING上识别。
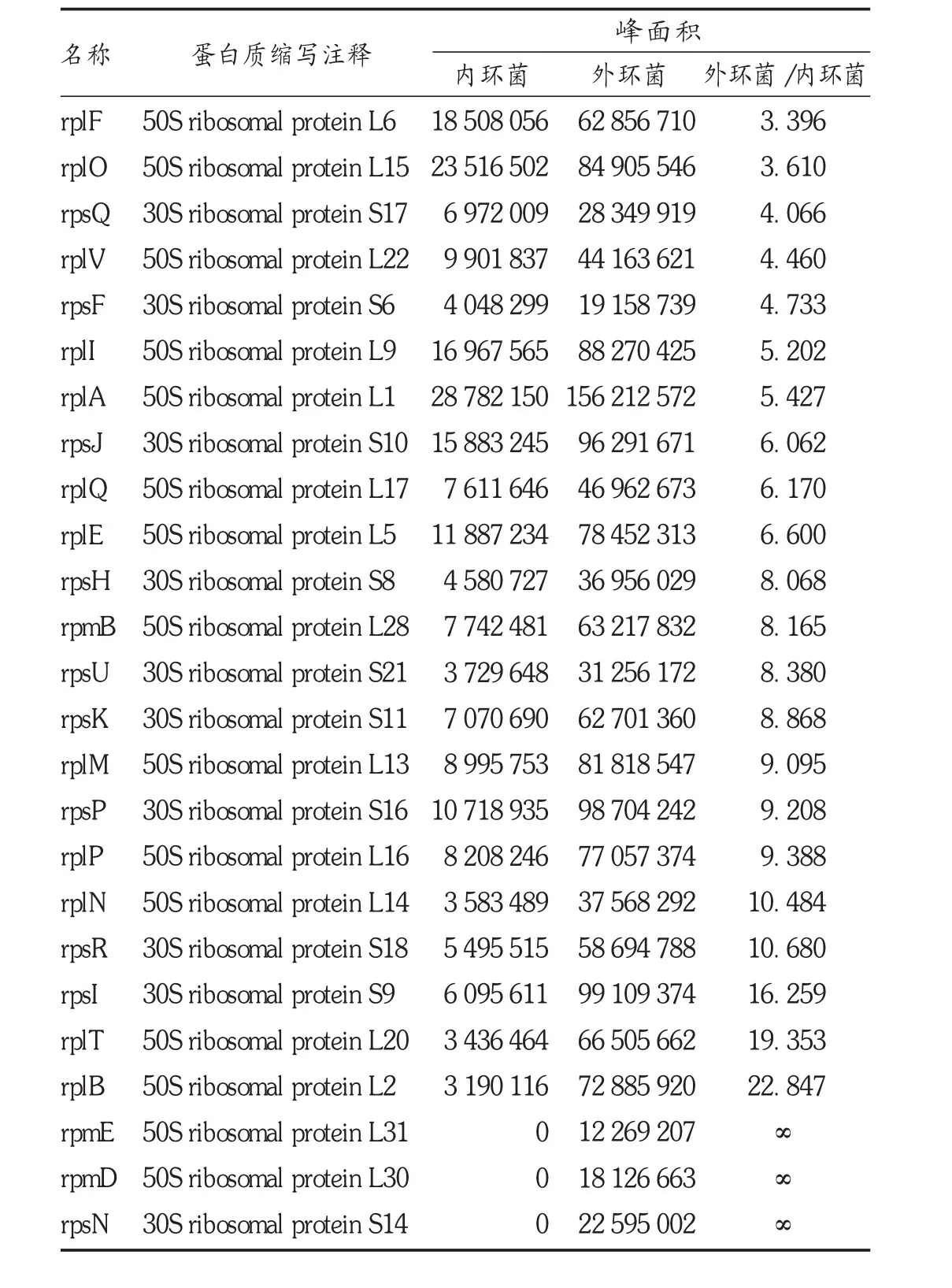
表1 外环菌表达丰度增加2倍以上的核糖体蛋白注释表
在固体培养基上培养奇异变形杆菌时,通常形态上会出现短杆状菌与纤细长条状菌之间的交替变化,分别为繁殖体(Vegeta-tive cells,VC)及潜生体(Cryptic growth cells,CGC)。刘俊康等[9]观察到奇异变形杆菌节律性波动生长过程中表现潜-生序变化,潜生体可以回复到繁殖体,并以多位断裂、自旋端位断裂、出芽生长、梳状繁殖等新的繁殖方式进行稳定性传代。根据奇异变形杆菌的生长特性及细胞形态,初步判断本试验中的外环菌可能为该菌的潜生体,并能进行稳定传代。有研究发现,奇异变形杆菌潜生体的耐药程度普遍高于繁殖体,并从外膜通透性方面对该菌的耐药机制进行了探索,认为外膜蛋白的大面积减少或缺失对潜生体耐药程度的提高可能起着重要作用[10]。本研究中运用比较蛋白质组学检测方法,对2种不同迁徙能力的奇异变形杆菌体内蛋白进行比对分析,外环菌中表达的核糖体蛋白比内环菌至少高3倍以上,通过展示显著增加的各蛋白间的相互作用关系,以期为奇异变形杆菌容易发生耐药问题提供新的靶点。
[1]Hola V,Peroutkova T,Ruzicka F.Virulence factors in Proteu bacteria from biofilm communities of catheter-associated urinary tract infections[J].FEMS Immunol Med Microbiol,2012,65(2):343-349.
[2]李文建,汪正清.奇异变形杆菌的毒力因子[J].中国人兽共患病杂志,2001,17(2):80-86.
[3]石兰峰,钮 博.奇异变形杆菌ESBL和AmpC酶的检测与耐药分析[J].中国厂矿医学,2009,22(1):75-76.
[4]章常华,涂秀英,熊淑平,等.基于蛋白质组学技术筛选葛根芩连汤防治胰岛素抵抗作用的血清差异表达蛋白[J].中药新药与临床药理,2016,27(1):81-85.
[5]刘艳霞,李雨浓,傅若秋,等.多柔比星对乳腺癌细胞核内丝切蛋白相互作用蛋白影响的比较蛋白质组学研究[J].第三军医大学学报,2017,39(6):522-528.
[6]Capriotti AL,Caruso G,Cavaliere C,et al.Proteomic characterization of human platelet-derived microparticles[J].Anal Chim Acta,2013,776:57-63.
[7]贾雄飞,刘俊康,徐启旺.奇异变形杆菌周期性群集运动的研究[J].第三军医大学学报,2005,27(9):868-870.
[8]刘 蕾,刘艳霞,邓 渝,等.同株奇异变形杆菌存在不同生长状态[J].微生物学杂志,2011,31(4):100-103.
[9]刘俊康,丛延广,王 源,等.应用干涉相差显微镜观察细菌潜生体繁殖方式的研究[J].第三军医大学学报,1999,21(1):13-15.
[10]黄春基,徐启旺,解晓珍,等.奇异变形杆菌潜生体与繁殖体的耐药性差异及其机制探讨[J].第三军医大学学报,1999,21(2):106-108.
Comparative Proteomics of Proteus Mirabilis with Different M igratory Abilities
Tang Yu,Liu Yanxia,Liu Junkang,Deng Yu
(College of Pharmacy,3rd Military Medical University,Chongqing,China 400038)
Objective To detect differentially expressed proteins of two different migratory abilities of Proteus Mirabilis through comparative proteomics,to provide an important basis for further study on drug resistance of Proteus Mirabilis.M ethods LB medium was used to culture the inner and outer ring Proteus Mirabilis with different migratory ability,and the difference of migration ability between the two strains was determined by the ratio of colony diameter.Comparative proteomic analysis was used to detect the differences in overall protein expression between the two speciesofbacteria and to focuson the interaction between distinctclassesofribose proteins.Results The results showed that diameter of the inner colonies was small and the diameter of outer colonies was large.The colony diameter ratio were 3.84±0.56,compared with the inner ring,the outer ring of bacteria protein expression changes significantly, only the outer ring bacteria expressed 29 proteins,the outer ring of bacteria significantly down-regulation of 129 proteins and significantly up-regulation of 269 proteins.According to the analysis of ribosomal proteins,there were significant increase in expression of 34 kinds of proteins.Conclusion The morphology and protein expression of outer ring bacteria changed significantly,and the significant increase of ribosomal protein expression might be the cause of drug resistance.
Proteus Mirabilis;migratory abilities;comparative proteomics;drug resistance
2017-05-01)
10.3969/j.issn.1006-4931.2017.15.004
唐雨(1986-),女,硕士研究生,助教,主要从事天然药物化学及其药理作用研究,(电子信箱)tangyuflower@163.com。
刘艳霞(1982-),女,硕士研究生,讲师,主要从事天然产物抗肿瘤分子机制研究及新药开发,(电子信箱)liuyibin_04@163.com。
Q935;R378
A
1006-4931(2017)15-0013-04
