兔心房颤动时间依赖性对心肌纤维化的影响
2017-09-06赵晔谷天祥王春张光伟刘化刚
赵晔 谷天祥 王春 张光伟 刘化刚
基础研究
兔心房颤动时间依赖性对心肌纤维化的影响
赵晔 谷天祥 王春 张光伟 刘化刚
目的 研究兔心房颤动持续时间长短对心肌纤维化程度的影响。方法 健康雄性新西兰大白兔给予左心外膜电起搏,以900次/min高频不间断起搏建立兔房颤模型。40只新西兰大白兔随机分为2组:假手术组和快速起搏组。两组大白兔因术后第3、7、14、28天处死而随机分为A1、A2、A3、A4和B1、B2、B3、B4亚组(各5只)。取各组家兔心房组织,检测左房重量指数及心肌羟脯氨酸含量,行Masson染色检测心房肌纤维化的情况,同时检测兔心房组织Ⅰ型胶原、Ⅲ型胶原的表达情况。结果 起搏组家兔的左房重量指数为(1.02±0.12)g/kg,心肌羟脯氨酸含量为(21.15±1.02)μg/mg,均高于假手术组(P<0.05)。与假手术组家兔相比,起搏组家兔出现明显的心肌纤维化,同时兔心房组织Ⅰ型胶原、Ⅲ型胶原的表达均呈明显的时间依赖性的增加(P<0.05)。结论 快速起搏建立兔房颤模型后,随着时间的推移心肌组织逐渐出现纤维化改变。
心房颤动; 兔; 心肌; 纤维化
房颤是临床工作中除早搏以外最常见的心律失常,一般人群的患病率为0.4%~1.0%[1],而且随着人口的老龄化,房颤的发病率明显上升[2,3]。房颤的发病机制目前尚未明确。根据近年来世界范围内对房颤发病机制的基础及临床研究,房颤的发生和维持过程中心房组织发生的心房重塑是房颤产生的主要病理基础。大量研究显示,心房重构可能是房颤发生早期的病理基础[4],但仍无法阐明房颤发展与维持的机制。本研究通过对心房进行快速电起搏建立的慢性心房颤动模型,在不同时间点取左房心肌组织,探讨房颤发生后时间依赖性心肌纤维化的变化规律。
1 材料与方法
1.1 实验动物、分组及试剂
1.1.1 实验动物及分组 40只新西兰大白兔(购买自中国医科大学动物中心),体重2.0~2.5 kg,雄性,3~6个月龄,随机分为2组:假手术组和快速起搏组。两组大白兔又因于术后第3、7、14、28天处死而随机分为 A1、A2、A3、A4 和 B1、B2、B3、B4 亚组(各5只)。
1.1.2 试剂 速眠新(长春军事医学科学院);兔抗GAPDH多克隆抗体(美国SantaCruz公司);SABC免疫组化染色试剂盒(武汉博士德生物工程有限公司);蛋白定量试剂盒(美国Bio-Rad公司);HRP-兔抗单克隆IgG(美国SantaCruz公司);山羊抗兔Ⅰ型胶原多克隆抗体(美国SaniaCmz公司);山羊抗兔Ⅲ型胶原多克隆抗体(美国SaniaCmz公司)。
1.2 动物模型建立 术前6 h禁食、禁饮,用速眠新按2 ml/kg肌肉注射麻醉,将兔仰卧位固定于实验台上。经左胸第3肋间切口进胸,将起搏电极置于左心房心外膜及胸壁并固定,起搏导线经背部穿出,固定于背部。术后连续3 d保暖,青霉素80万单位经耳缘静脉滴注补液抗炎,伤口换药消毒。动物休息3 d,术后第4天假手术组不予起搏处理,快速起搏组把电极与自制起搏器连接,持续不间断地起搏4周,起搏频率为900次/min,电压为6 V。
1.3 检测指标
1.3.1 左房重量指数 实验结束家兔称重后麻醉,固定。开胸,充分暴露心脏,并在主动脉根部剪下心脏,4℃生理盐水冲洗,快速剪去大血管、右心房及心室,滤纸吸干,称取左心房重量(左房重量指数=左房重量/体重)。
1.3.2 心肌羟脯氨酸含量的测定 心肌羟脯氨酸含量的测定采用氯胺T法。
1.3.3 Masson染色 配液:Bouin液 (饱和苦味酸水溶液 75 ml,甲醛 25 ml,冰乙酸 5 ml);Ⅰ液(1%比布列西猩红水溶液90 ml,1%酸性品红水溶液 10 ml,冰乙酸 1 ml);Ⅱ液(磷钼酸 2.5 g,磷钨酸2.5 g,蒸馏水 100 ml);Ⅲ液(苯胺蓝 2.5 g,冰乙酸 2 ml,蒸馏水 100 ml)。
具体步骤:常规脱蜡至水;置Bouin液室温过夜,流水冲洗至黄色消失,蒸馏水洗;Weigert铁苏木精染核10 min,盐酸乙醇分化,流水冲洗10 min,蒸馏水洗;Ⅰ液染2 min,蒸馏水洗;Ⅱ液染15 min;Ⅲ液染5 min,蒸馏水洗;1%冰乙酸溶液浸洗5 min,常规脱水透明,中性树胶封片。
唐代的孙过庭在其《书谱》中说:“写乐毅则情多怫郁,书画赞则意涉瑰奇,黄庭经则怡怿虚无,太师箴又纵横争折。暨乎兰亭兴集,思逸神超;私门诫誓,情拘志惨。所谓涉乐方笑,言哀已叹……岂知情动形言,取会风骚之意,阳舒阴惨,本乎天地之心。”[10]就像《国风》、《离骚》的写作行为一样,书者在书法创作时或风或骚的心绪变化,阳舒阴惨的感情波动都是本乎天地之心——主宰宇宙万物内在运化的秩序。这就是说书法是本乎天地之心的行为,即秩序化行为。
1.3.4 免疫组化检测Ⅰ型胶原(CollagenⅠ,ColⅠ)和Ⅲ型胶原(CollagenⅢ,ColⅢ)表达 所用载玻片均经多聚赖氨酸处理,连续切片厚4μm,一抗分别为羊抗兔ColⅠ多克隆抗体和羊抗兔ColⅢ多克隆抗体;二抗为生物素化鼠抗羊IgG,以0.01 mol/L磷酸盐缓冲液(PBS)代替一抗作阴性对照,S-P法免疫组化染色步骤按试剂盒说明书进行。
1.3.5 Western blot检测ColⅠ和ColⅢ蛋白表达 一抗采用山羊抗兔ColⅠ和山羊抗兔ColⅢ。
1.3.6 RT-PCR半定量检测心脏组织目标mRNA表达 在Genbank中查找兔ColⅠ和ColⅢN端的mRNA已知序列,同时查找兔管家基因GAPDH己知序列,应用引物设计软件Primer 5.1设计特异性引物。所设计引物用BLAST软件比对和检索确认其同源性。ColⅠ和ColⅢ的基因名、引物序列及其扩增产物资料,见表1。
1.4 统计学方法 数据分析采用SPSS 13.0软件。计量资料采用±s表示;两组间比较用t检验,多组间比较用方差分析。P<0.05认为差异具有统计学意义。
2 结果
2.1 心电图 正常家兔心电图(图1);900次/min起搏家兔心电图(图2);家兔持续性房颤心电图(图3),P波消失,RR间期绝对不齐。
2.2 左心房重量指数 与假手术组相比,在术后第3天快速起搏组家兔左心房重量指数无明显变化(P>0.05);在术后第 7、14、28 天,左房重量指数明显升高(P均<0.05)。见表 2。
表2 两组实验兔房颤左房重量指数比较(±s)

表2 两组实验兔房颤左房重量指数比较(±s)
注:与假手术组比较,aP<0.05;与术后第3天比较,bP<0.05
左心房重量指数(g/kg)第3天 第7天 第14天 第28天假手术组 5 0.61±0.03 0.64±0.04 0.65±0.07 0.58±0.05快速起搏组 5 0.63±0.04 0.76±0.05ab 0.95±0.05ab 1.02±0.12ab组别 例数
2.3 心肌羟脯氨酸含量 与假手术组相比,在术后第3天,快速起搏组家兔心肌羟脯氨酸含量无明显变化(P>0.05);在术后第 7、14、28 天,心肌羟脯氨酸含量明显升高(P均<0.05)。见表 3。
表3 两组实验兔房颤心肌羟脯氨酸含量比较(±s)

表3 两组实验兔房颤心肌羟脯氨酸含量比较(±s)
注:与假手术组比较,aP<0.05;与术后第3天比较,bP<0.05
组别 例数 心肌羟脯氨酸(μg/mg)第3天 第7天 第14天 第28天假手术组 5 6.51±0.10 6.53±0.13 6.47±0.10 6.50±0.11快速起搏组 5 6.42±0.08 10.23±0.17ab 15.77±1.26ab 21.15±1.02ab
2.4 Masson染色
2.4.2 Masson染色半定量分析 与假手术组相比,在术后第3天快速起搏组家兔左房心肌Masson染色半定量分析无明显变化(P>0.05);在术后第7、14、28天,左房心肌Masson染色半定量分析明显升高(P均<0.05)。见表 4。
表4 两组左房心肌组织Masson染色半定量分析(±s)

表4 两组左房心肌组织Masson染色半定量分析(±s)
注:与假手术组比较,aP<0.05;与术后第3天比较,bP<0.05
组别 例数 Masson染色半定量分析第3天 第7天 第14天 第28天假手术组 5 0.47±0.05 0.49±0.05 0.47±0.04 0.45±0.05快速起搏组 5 0.63±0.05 0.84±0.05ab 1.13±0.04ab 1.43±0.06ab
2.5 用免疫组化方法检测Ⅰ型胶原和Ⅲ型胶原 与假手术组相比,在术后第3天开始快速起搏组家兔左房心肌逐渐出现Ⅰ型胶原表达,并且随着时间的延长,Ⅰ型胶原表达逐渐增多(图5棕色颗粒);同时与假手术组相比,在术后第3天开始快速起搏组家兔左房心肌逐渐出现Ⅲ型胶原表达,并且随着时间的延长,Ⅲ型胶原表达逐渐增多(图6棕色颗粒)。
2.6 Western blot检测ColⅠ和ColⅢ蛋白表达
2.6.1 用 Western blot方法检测 ColⅠ和 ColⅢ蛋白表达 与假手术组相比,在术后第3天开始起搏组家兔左房心肌逐渐出现ColⅠ和ColⅢ蛋白表达,并且随着时间的延长,ColⅠ和ColⅢ蛋白表达逐渐增多(图 7)。
2.6.2 ColⅠ和ColⅢ蛋白表达半定量分析 与假手术组相比,在术后第3天快速起搏组家兔左房心肌ColⅠ和ColⅢ蛋白表达半定量分析无明显变化(P>0.05);在术后第 7、14、28 天,左房心肌 ColⅠ和ColⅢ蛋白表达半定量分析明显升高(P<0.05)。见表5。
2.7 RT-PCR检测ColⅠ和ColⅢmRNA表达
2.7.1 用RT-PCR方法检测ColⅠ和ColⅢmRNA表达 与假手术组相比,在术后第3天开始起搏组家兔左房心肌逐渐出现ColⅠ和ColⅢmRNA表达,并且随着时间的延长,ColⅠ和ColⅢmRNA表达逐渐增多(图8)。
2.7.2RT-PCR检测半定量分析ColⅠ和ColⅢmRNA表达 与假手术组相比,在术后第3天快速起搏组家兔左房心肌ColⅠ和ColⅢmRNA表达半定量分析无明显变化(P>0.05);在术后第 7、14、28天,左房心肌ColⅠ和ColⅢmRNA表达半定量分析明显升高(P<0.05)。见表 6。
表5 两组Western blot检测ColⅠ和ColⅢ蛋白表达半定量分析比较(±s)
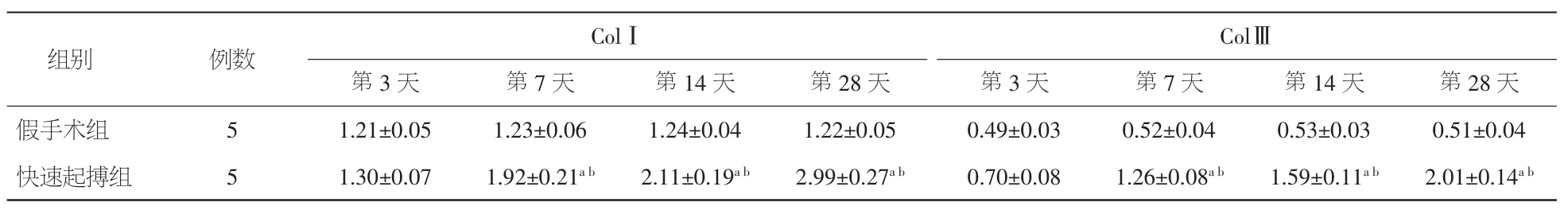
表5 两组Western blot检测ColⅠ和ColⅢ蛋白表达半定量分析比较(±s)
注:与假手术组比较,aP<0.05;与术后第3天比较,bP<0.05
ColⅢ第3天 第7天 第14天 第28天 第3天 第7天 第14天 第28天假手术组 5 1.21±0.05 1.23±0.06 1.24±0.04 1.22±0.05 0.49±0.03 0.52±0.04 0.53±0.03 0.51±0.04快速起搏组 5 1.30±0.07 1.92±0.21ab 2.11±0.19ab 2.99±0.27ab 0.70±0.08 1.26±0.08ab 1.59±0.11ab 2.01±0.14ab组别 例数 ColⅠ
表6 两组RT-PCR检测ColⅠ和ColⅢmRNA表达半定量分析比较(±s)

表6 两组RT-PCR检测ColⅠ和ColⅢmRNA表达半定量分析比较(±s)
注:与假手术组比较,aP<0.05;与术后第3天比较,bP<0.05
ColⅢ第3天 第7天 第14天 第28天 第3天 第7天 第14天 第28天假手术组 5 0.60±0.05 0.60±0.06 0.60±0.04 0.60±0.05 0.30±0.03 0.30±0.04 0.40±0.03 0.40±0.04快速起搏组 5 0.70±0.07 0.93±0.11ab 1.11±0.10ab 1.34±0.13ab 0.60±0.06 0.86±0.08ab 1.09±0.09ab 1.15±0.10ab组别 例数 ColⅠ
3 讨论
心肌纤维化(myocardial fibrosis,MF)是指心肌中纤维性胶原成分不成比例的增多。在形态上心肌纤维化主要表现为间质中胶原沉积增多,各型胶原比例失调(Ⅰ型和Ⅲ型胶原比率增加)的排列紊乱。它的形成是一个缓慢的动态过程,涉及到包括细胞、细胞因子和细胞外基质(extracellular matrix,ECM)等多种因素,因而心肌纤维化是一个多因素相互促进和相互制约的过程。心肌纤维化的发生可引起心力衰竭、心律失常和心源性猝死等严重并发症,危害十分严重。
如同其他脏器一样,病理学家习惯于把心脏区分为实质和间质两部分。心脏间质包括成纤维细胞等多种非肌性细胞、胶原纤维等多种纤维和由蛋白多糖、糖蛋白等构成的胶样无定形基质。其中的各种纤维及无定形物质,即心脏的ECM。在MF乃至所有器官纤维化的发生发展过程中,组织内ECM异常增多和过度沉积都扮演了重要的角色,但纤维化时ECM的沉积并非是简单的空间占据,既有ECM的量和组成成分的改变,又有原来基质中不存在的新成分出现。ECM中含量最多的是胶原蛋白。在正常大鼠心肌组织中胶原含量为3%~5%[5]。尽管在心肌间质内有诸多细胞均可产生ECM,但在MF中发挥作用的则主要是心脏成纤维细胞(cardial fibroblasts,cFB),是 ECM 的主要来源细胞[6]。
心肌纤维化是房颤时心房结构重塑的特征改变之一。心脏的细胞外基质含量最多的是胶原纤维,包括Ⅰ型和Ⅲ型胶原纤维,这些胶原纤维主要由心肌成纤维细胞分泌。当成纤维细胞受刺激后,其分裂、增殖增多,胶原合成上调[7]。研究[8]发现,当心肌成纤维细胞受到牵拉刺激48 h内,细胞计数及胶原合成明显增加。同时还有研究[9-11]表明,房颤患者的心肌间质胶原纤维沉积、排列紊乱。本实验用高频快速起搏家兔左心房建立房颤动物模型,起搏后,左房重量及左房重量指数逐渐增大,心肌间质Ⅰ、Ⅲ型胶原表达逐渐增加,胶原排列紊乱,羟脯氨酸含量逐渐增加。上述是本组实验动物经历房颤心房重塑后的主要异常表现。在本研究快速起搏家兔左心房过程中,心房被刺激牵拉,心房的搏动频率增加,心房压力增大,可能激活成纤维细胞合成和分泌胶原纤维,导致心肌间质胶原沉积增多,羟脯氨酸含量增加。由此提示,心房组织的纤维化与房颤的发生同时存在。
羟脯氨酸是机体胶原蛋白的主要成分之一,在正常胶原蛋白中含量约13.4%,在弹性蛋白中含量极少,而在其他蛋白则不存在。因此,组织中羟脯氨酸含量可作为衡量其胶原组织代谢和判断纤维化程度的重要指标。心肌纤维化可用生化方法测定,即通过测定心肌组织羟脯氨酸含量来作为心肌纤维化的标志(1 g羟脯氨酸相当于8.2 g胶原蛋白)。
胶原是最主要的细胞外基质蛋白,心脏间质成分约85%由Ⅰ型胶原和Ⅲ型胶原构成,其中主要为Ⅰ型胶原,占80%左右。本实验运用半定量RTPCR方法检测结果显示,与假手术组比较,快速起搏组左房心肌组织中Ⅰ型胶原和Ⅲ型胶原mRNA表达显著增加,且与房颤持续时间呈明显正相关。实验结果与Li等[12]的研究发现和在心衰犬模型中研究[13]发现基本一致。本实验结果提示,房颤时心房纤维化可能与Ⅰ型胶原和Ⅲ型胶原基因转录水平上调、合成分泌Ⅰ型胶原和Ⅲ型胶原增多,导致心房组织中胶原的异常堆积有关,为房颤的发生和维持提供了病理基础。
以上实验结果表明,心肌纤维化是房颤发生的重要病理基础,因此,改善心房重塑将成为治疗房颤的重要靶标之一。

图1 正常家兔心电图(走纸速度50 mm/s)

图2 900次/min起搏家兔心电图(走纸速度50 mm/s)

图3 家兔持续性房颤心电图(走纸速度50 mm/s)

图4 两组左房心肌组织Masson染色(×200)
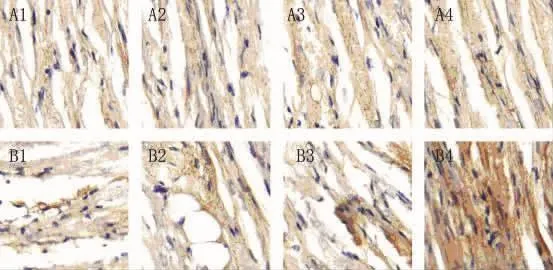
图5 两组免疫组化检测左房心肌组织ColⅠ表达(×200)
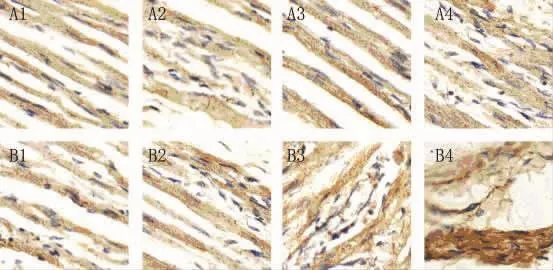
图6 两组免疫组化检测左房心肌组织ColⅢ表达(×200)

图7 Western blot检测ColⅠ和ColⅢ蛋白表达
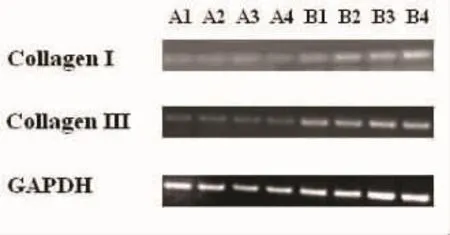
图8RT-PCR检测ColⅠ和ColⅢmRNA表达
[1]梁森,吴明华,张秀胜,等.心房颤动患者预防卒中的药物治疗进展.中华临床医师杂志:电子版,2012,6:5595-5598.
[2]张荣峰,张树龙.2010欧洲心脏病学会房颤管理指南解读.中华临床医师杂志:电子版,2011,5:655-658.
[3]Wang TJ,Larson MG,Levy D,et al.Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality:the Framingham Heart Study. Circulation,2003,107:2920-2925.
[4]Kostin S,Klein G,Szalay Z,et al.Structural correlate of atrial fibrillation in human patients.Cardio Res,2008,54:361-379.
[5]Weber KT.Cardiac interstitium in health and disease:the fibrillar collagen network.J Am Coll Cardiol,1989,13:1637-1652.
[6]张月娥,许祖德,王新禾,等.实验性器官硬化细胞外基质及间充质效应细胞的研究.中华病理学杂志,1994,23:111-114.
[7]Weber KT,Brilla CG,Pathological hypertrophy and cardiac interstitium.Fibrosis and the renin angiotensin aldosterone system.Circulation,1991,83:l849-l865.
[8]Carver W,Nagpal ML,NaChtigal M,et al.Collagen expression in mechanically stimulated cardiac fibmblasts. Circ Res,1991,69:116-122.
[9]Yongjun Q,Huanzhang S,Wenxia Z,et al.Histopathological characteristics and oxidative injury secondary to atrial fibrillation in the left atrial appendages of patients with different forms of mitral valve disease.Cardiovasc Pathol,2012,10:211-218.
[10]Chen MC,Chang JP,Wang YH,et al.Autophagy as a mechanism for myolysis of cardiomyocytes in mitral regurgitation.Eur J Clin Invest,2011,41:299-307.
[11]Corradi D,Callegari S,Maestri R,et al.Differential structural remodeling of the left-atrial posterior wall in patients affected by mitral regurgitation with or without persistent atrial fibrillation:a morphological and molecular study.J Cardiovasc Electrophyiol,2012,23:271-279.
[12]Li D,Shinagawa K,Pang L,et al.Effects of angiotensin-converting enzyme inhibition on the development of the atrial fibrillation substrate in dogs with ventricular tachypacing-induced congestive heart failure.Circulation,2001,104:2608-2614.
[13]林亚洲,陈林,许春萱,等.心力衰竭犬心房组织Ⅰ型胶原、基质金属蛋白酶-2及组织抑制因子与心房纤维化和颤动的关系.中华老年医学杂志,2006,25:141-145.
Changes of myocardial fibrosis in rabbit atrial fibrillation model
ZHAO Ye,GU Tian-xiang,WANG Chun,et al.Department of Cardiac Surgery,the First Affiliated Hospital of China Medical University,Shenyang 110001,China
GU Tian-xiang,E-mail:cmugtx@sina.com
Objective To investigate the changes of myocardial fibrosis of rabbit atrial fibrillation model.Methods40 rabbits were sutured with pacing electrodes to left atrium.Rapid atrial pacing at 900 ppm was initiated for the establishment of atrial fibrillation models.All rabbits were then randomly assigned to two groups:sham group and rapid pacing group.Rabbits in the two groups were killed immediately after 3,7,14 and 28 days after intervention(n=5).Animals in the two groups were marked with A1,A2,A3,A4,B1,B2,B3 and B4 at each time point.The atrial tissue samples were collected for molecular biology test.ResultsPace group rabbits showed left atrial mass index(LAMI)and myocardial hydroxyproline were(1.02±0.12)g/kg and(21.15±1.02)μg/mg,respectively,which were significantly increased compared with sham group(P<0.05).There was obvious myocardial fibrosis in Pace group.All of test result of ColⅠand ColⅢ showed a time-dependent increase.ConclusionAfter rapid pacing,the left atrium appeared gradually myocardial fibrosis with the passage of time.
Atrial fibrillation; Rabbit; Myocardium; Fibrosis
国家自然基金项目(项目编号:39700059);辽宁省自然科学基金项目(项目编号:20092114);沈阳市科学技术项目(项目编号:F11-264-1-75)
110001 辽宁省沈阳市,中国医科大学附属第一医院心脏外科
谷天祥,E-mail:cmugtx@sina.com
10.3969/j.issn.1672-5301.2017.02.023
Q95-33;R541.7
A
1672-5301(2017)02-0179-05
2016-09-19)
