白念珠菌中的自噬研究进展
2017-08-31张金宇秦玉璘张璐璐王晓娟姜远英韩冰曹永兵
张金宇 秦玉璘 张璐璐 王晓娟 姜远英 韩冰 曹永兵
(1.第二军医大学药学院药理学 新药研究中心,上海 200433;2.上海市闵行区中心医院,上海 201100)
白念珠菌中的自噬研究进展
张金宇1秦玉璘2张璐璐1王晓娟2姜远英1韩冰2曹永兵1
(1.第二军医大学药学院药理学 新药研究中心,上海 200433;2.上海市闵行区中心医院,上海 201100)
自噬影响着真核细胞的适应性、分化和发育,在白念珠菌中自噬影响着白念珠菌的代谢和毒力等,也可以减缓应激反应带来的损伤,增强菌体存活能力。但过度的自噬可能导致自噬性细胞死亡。该文根据近期研究进展,从白念珠菌中与自噬相关的Cvt (Cytoplasm to vacuole trafficking pathway)通路、TOR (target of rapamycin)通路和自噬在应激中的作用等几个方面,对白念珠菌中的自噬进行综述。
白念珠菌;自噬;Cvt通路;TOR通路;应激刺激;氮饥饿
等重要现象的一个新途径。白念珠菌中自噬的相关分子机制研究较少,故本文从近期研究中,对白念珠菌中的自噬发生相关基因和调节自噬的可能通路以及自噬在应激等条件下的作用进行综述。
1 白念珠菌中Cvt通路与自噬
1.1 Cvt通路与自噬
自噬的发生和Cvt通路可能有相似的机制。在饥饿状态或者不利生长的应激条件下,胞质被包裹起来并运向液泡 (Cvt通路)内进行降解。近期研究发现,在氮饥饿的环境中,抑制液泡V-ATPase酶活性,酵母细胞则不能发生自噬[10]。当菌体自噬缺陷时Cvt通路也缺陷,已有实验将Cvt通路发生标志性蛋白ApeI与绿色荧光蛋白 (GFP)连接,在显微镜下观察到,在自噬缺陷菌体中绿色荧光蛋白在液泡边缘,并不能进入液泡,即自噬缺陷,Cvt通路亦缺陷[11-12]。酵母细胞中Cvt通路蛋白API (aminopeptidase I)前体在胞质中合成,然后被募集组成结构高度有序的Cvt复合物[13],在诱导自噬的饥饿条件下,API前体通过自噬小体进入液泡内[14],如果液泡内缺失水解酶A和B,API前体则不能成熟[15]。
Cvt通路通过形成Cvt小泡来运送物质,并发现内质网膜外包Cvt复合物形成Cvt小泡。与典型的分泌型运输小泡 (直径50~100 nm)相比,Cvt小泡的体积要大2~27倍不等,而自噬小体的体积则要大1 000倍左右[16]。因此,在研究Cvt通路和自噬等相关现象时,可以通过观察膜泡的大小来判断膜泡是否是自噬小体,从而推测自噬的发生,并可进一步对内质网膜示踪标记,对自噬小体的运动进行观察[13]。
Cvt小泡和自噬小体在形成后与液泡融合,膜融合过程是自噬发生的关键环节,Cvt小泡和自噬小体与液泡融合的研究也是现今的热点。膜融合过程的机制中有相同也有不同之处,两者与液泡融合过程均是SNARE定向机制 (Soluble N-ethylmaleimide sensitive fusion protein attachment protein receptor),且在膜融合的过程中,蛋白识别过程均需要Vam3p以及GTP酶Ypt7p参与[17-18],而Cvt小泡与液泡融合蛋白识别过程还需要蛋白Vti1p和Vps18p[19]参与。
1.2 白念珠菌自噬基因ATG9与Cvt通路
为研究Cvt通路和自噬调控通路中的关键蛋白,Ohsumi等利用基因敲除和基因克隆等技术,考察了Cvt、APG系列基因对酵母自噬的调控作用,发现对酵母自噬具有重要调控作用的关键基因,包括Cvt小泡相关蛋白[20]和调节激酶[21]。然而,这些蛋白都是与膜相关联的可溶性蛋白。Apg9p/Cvt7p是Apg/Cvt通路第1个被发现的膜整合蛋白。在白念珠菌ATG9缺失菌中,观察到API前体在Cvt小泡内,但位于液泡边缘,不能进入液泡,这表示Cvt通路缺陷。这个现象与之前酵母细胞中Cvt通路缺陷的现象相同,并且ATG9缺失菌在缺氮培养基中生长缺陷,故推测ATG9在自噬早期阶段,也就是小泡形成阶段可能发挥作用[11]。
1.3 白念珠菌液泡相关基因与自噬
液泡是白念珠菌中生物反应的主要中心,当菌体与宿主相互作用时,能够独立调节自身pH值,增强菌体毒力。其中液泡膜上V-ATPase质子泵是多亚基复合物,使液泡内环境酸化,抑制V-ATPase V1B亚基的编码基因VMA2的表达,使得V-ATPase不能在液泡膜上聚集且不能进行质子的转运,液泡内呈碱性,形态也发生变化。菌体内的自噬也发生延迟,尤其是在氮饥饿的条件下,VMA2缺失或者抑制V-ATPase酶活性,自噬发生缺陷[22],可能是液泡内相关生物反应影响Cvt通路运送物质,从而抑制了自噬的发生。
当白念珠菌CCZ1基因缺失时,观察到经染色的液泡呈碎裂状,但液泡膜的通透性和液泡内pH并没有改变。在诱导自噬的氮饥饿生长环境中,CCZ1缺失菌生长十分微弱[9]。可能由于液泡形态变化,自噬发生缺陷。
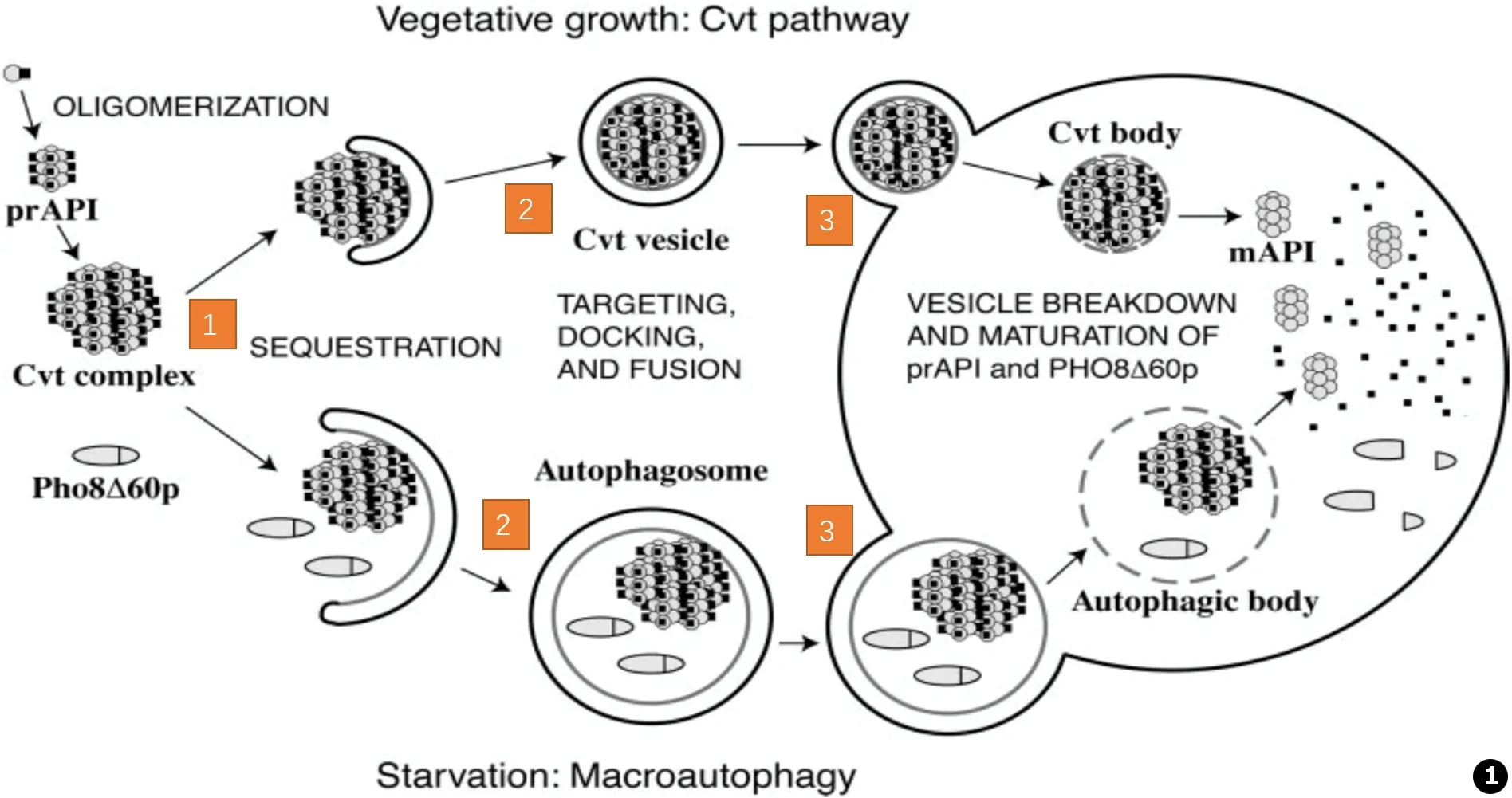
图1 Cvt通路和自噬中包被小泡从胞质运向液泡的模型。两种通路中有许多相似的机制:1.Cvt复合物形成:API在胞质中合成,低聚成十二聚体,形成Cvt复合物;2.双层膜小泡的形成:扩增完成后的膜包裹Cvt复合物,形成双膜Cvt小泡 (Cvt通路过程)或自噬小体 (自噬过程);3.膜定向过程:双层膜泡通过与液泡膜融合后,释放被包裹的胞质进入液泡内,这个过程称为Cvt小泡 (Cvt通路过程)或者自噬小体 (自噬过程)进入液泡腔内。随之Cvt小泡和自噬小体破裂释放API进入液泡腔内,API通过蛋白酶A途径,水解成成熟的API。这两种通路中存在的不同之处:Cvt通路是一个选择性的过程,Cvt小泡在包裹的过程中排除了大量的胞质。自噬是一个非选择性的过程,自噬小体包裹了大量的胞质同时也包括了Cvt复合物,最终释放入液泡。API通过Cvt小泡和自噬小体均能运送[19]
Fig.1 A model for the transportion of coated vesicles from cytoplasm to vacuole in Cvt pathway and autophagy.There are many similar mechanisms in the two pathways:1.The formation of Cvt complex:API synthesis in the cytoplasm,oligomerization into Cvt complex;2.The formation of double membrane vesicles:the expansion and completion of membrane encapsulated Cvt complexes,the formation of double membrane Cvt vesicles (Cvt pathway) or autophagic bodies (autophagy);3.Membrane orientation process:double membrane vesicles fusion with the vacuole membrane,release cytoplasm wrapped into the vacuoles,this process is called Cvt vesicle (Cvt pathway) or autophagosomes (autophagy) into the vacuole lumen.With the release of Cvt vesicles and autophagic bodies,API released into the vacuole lumen,and API hydrolyzed into mature API through the protease A pathway.The difference between these two pathways:Cvt pathway is a selective process,Cvt vesicles in the process of the exclusion of a large number of the cytoplasm.Autophagy is a non selective process,autophagic body includes a large amount of cytoplasm and Cvt complex,which is finally released into the vacuole.API can be transported by Cvt vesicles and autophagic bodies[19]
当液泡质子泵功能受损使得液泡内pH值变化,液泡发生如破裂等形态变化时,自噬缺陷。已有研究表明白念珠菌的液泡V-ATPaseV0和V1亚基对菌丝生长和菌体外分泌分别有不同作用[10],推测在白念珠菌中,自噬可能会影响到菌丝生长和毒力,VMA2和CCZ1等液泡相关基因,也会通过自噬影响到菌体的毒力和菌丝等方面。
2 TOR通路与自噬
在哺乳动物和酵母中,TOR (Target of Rapamycin)通路的结构和功能较为保守,Tor蛋白包含Tor1和Tor2。近期有研究表明,Tor蛋白参与胞内氮源的利用,尤其是液泡和溶酶体内分解代谢的氮源[23]。但在白念珠菌中,只发现一种Tor1同源性蛋白[24],对调节细胞生长和营养利用十分重要。但TOR通路如何感受胞外营养,目前还没有明确结论。
2.1 白念珠菌中可能存在TOR样自噬信号通路
在酵母中,TOR通路主要通过TorC1来调控。TORC1本身的激活依赖于小分子G蛋白Rheb,Rheb又受到具有GTP酶激活活性的TSC1、TSC2蛋白的负向调控[25]。正常生长状态下的菌体,TorC1不受抑制,而在有限氮源等条件下,TorC1被抑制,则会诱导自噬发生。已有研究表明,敲除TOR2基因后的温度敏感酵母细胞中大量表型,与氮饥饿诱导的自噬表型相同[26]。TorC1通过直接调控ATG自噬基因,或者间接调控蛋白的翻译和蛋白间相互作用来调控自噬[23],例如Tor1通过磷酸化激活作用使ATG13蛋白失活,从而抑制自噬[27]。
白念珠菌中Rhb1蛋白即为真核生物中的Rheb,其活性也受GTP酶的激活蛋白Tsc2调控。Rhb1的编码基因RHB1,RHB1缺失菌对雷帕霉素极为敏感,另外,在诱导自噬的氮饥饿环境下,白念珠菌中Rhb1/Tsc2信号通路被激活,通过调控MEP2 (铵透性酶基因)诱导菌丝生长[28]。因此推测,Rhb1在白念珠菌中也可能参与调控TOR通路,而且通过TOR通路影响白念珠菌的自噬。已有研究发现,Rhb1参与细胞壁融合的调控作用也是通过Tor激酶来转导的。保守的Tsc/Rheb/TOR通路是真核细胞内诸多信号通路的交点[29]。因此,在白念珠菌中很有可能存在TOR样自噬信号调控通路。
2.2 雷帕霉素通过抑制靶点Tor激酶诱导自噬
雷帕霉素 (Rapamycin)近年来被作为抗真菌药物使用[30],它是脂溶性大环内酯类免疫抑制剂。白念珠菌中RBP1基因编码肽基辅氨酰异构酶同源性蛋白Fkbp12[31]。雷帕霉素与胞内Fkbp12结合后,抑制了Fkbp12酶活性,并同时与FKBP12形成复合物抑制靶点Tor激酶活性,使Tor信号通路被阻断,从而诱导自噬的发生[32]。所以,雷帕霉素可能通过抑制Tor激酶发挥抗菌作用。RBP1和TOR1缺失的白念珠菌,均表现出对雷帕霉素的抗性[30]。研究表明,雷帕霉素作用于菌体后,会抑制核糖体蛋白基因表达[33],诱导氮抑制代谢基因的转录和翻译[34],以增强菌体适应氮饥饿的能力。由此可见,雷帕霉素作用于白念珠菌后,抑制Tor激酶会影响菌体多方面代谢的调控,包括抑制氮源代谢和增强自噬。因此雷帕霉素诱导白念珠菌过度自噬可能是其抗真菌作用的机制之一。诱导自噬发生的具体机制尚待进一步研究。
另外,自噬引起的ROS增加会造成DNA损伤[2]。已有研究表明,MMS诱导白念珠菌DNA损伤后,特异性磷酸化丝氨酸、色氨酸的PP4磷酸酶CaPph3p和依赖金属离子蛋白磷酸酶家族的CaPtc2p,可以通过DNA复制检查点功能修复DNA损伤。而CaPTC2和CaPPH3缺失菌对雷帕霉素均敏感,且发现CaPTC2对CaPPH3有显性上位作用。推测CaPTC2和CaPPH3缺失后,雷帕霉素诱导自噬所致DNA损伤丧失了CaPph3p和CaPtc2p的修复作用,引起细胞死亡。在白念珠菌中,CaPTC2和CaPPH3是否通过Tor激酶调控自噬,尚待进一步研究。对此相关研究,可能会揭示白念珠菌自噬调控中的一种磷酸化调节机制[35]。
2.3 白介素iL-17A调节真菌TOR通路
白介素IL-17与真菌细胞结合后,能够阻断病原真菌与宿主细胞的交互作用。其与白念珠菌结合后,菌体内有21种基因上调,包括参与液泡蛋白分选的RIC1基因,并且Cvt通路中的一些基因成倍表达。除此之外,发现TOR通路被抑制,抑制TOR的LPF18基因也上调,自噬增加[36]。白介素IL-17是首个被发现对白念珠菌自噬有调控作用的细胞免疫因子,但其具体调控机制尚未清楚,目前推测可能通过LPF18调控TOR通路来调控自噬。
3 在应激条件下的白念珠菌中的自噬
3.1 氧化应激条件
白念珠菌中,阻断自噬通路会影响细胞应激应答的许多方面。CCZ1基因缺失导致液泡碎裂,使得自噬通路被阻断。研究发现,CCZ1在氧化应激中也起重要作用。在H2O2作用下,CCZ1缺失菌中的ROS水平迅速升高。使CCZ1缺失菌体自噬功能缺陷后,氧化应激致使线粒体被破坏,同时胞内ROS升高[9]。由此可见,当CCZ1缺失时自噬缺陷,不能保护氧化应激对线粒体的损伤,自噬可以增强白念珠菌对应激环境的适应性。
3.2 内质网应激条件
衣霉素和二硫苏糖醇 (DTT)这两种内质网应激药物,以及敲除内质网P型Ca2+-ATP酶的编码基因SPF1,均能使菌体内Atg8和Lap41的自噬流增加,这表现为非选择性自噬。然而衣霉素作用于SPF1缺失菌,发现内质网蛋白Sec63自噬流增强,这表现为内质网样自噬。说明大多数内质网应激条件诱导菌体发生的是非选择性自噬,而不是内质网样自噬。SPF1基因和ATG基因的双突变株对这些内质网应激药物很敏感,说明自噬能够减缓内质网应激损伤。另外发现,SPF1缺失菌自噬功能失调,菌体对抗真菌药物敏感,同时毒力和宿主侵袭力下降[8]。可见白念珠菌中的自噬可以减缓内质网应激应答,且自噬缺陷使菌体的耐药性和毒力下降。
4 小 结
自噬在细胞内的功能是把双刃剑,不能片面地理解自噬对菌体的作用。适度自噬有利于菌体的生长,而过度自噬导致细胞死亡则可能是抗菌机制之一。有些萜类化合物中含有有效抗菌成分,其在抗菌药物的领域上有着较好研发前景,但其作用机制不明。近期有研究表明,有些萜类化合物可能通过诱导过度自噬发挥抗菌作用。例如香芹酚对白念珠菌的抗菌作用,可能与其促进白念珠菌自噬相关基因和应激基因表达上调有关[37]。目前对白念珠菌自噬调节机制的研究较少,相关分子机制尚未明确,但借鉴肿瘤细胞和酵母细胞中自噬机制研究方法,开展白念珠菌中自噬发生相关分子机制研究,将是未来真菌适应性研究和抗真菌新药靶研究的热点。
[1] Finkel T.Signal transduction by mitochondrial oxidants[J].J Biol Chem,2011,287(7):4434-4440.
[2] 纪元,龙建纲,刘健康.自噬发生中的ROS调节机制[J].中国生物化学与分子生物学报,2014,30(4):321-327.
[3] Hale AN,Ledbetter DJ,Gawriluk T R,et al.Autophagy:regulation and role in development[J].Autophagy,2013,9(7):951-972.
[4] Codogno P,Meijer AJ.Autophagy and signaling:their role in cell survival and cell death[J].Cell Death Differ,2005,12(Suppl 2):1509-1518.
[5] Pfaller MA,Diekema DJ.Epidemiology of invasive candidiasis:a persistent public health problem[J].Clin Microbiol Rev,2007,20(1):133-163.
[6] Palmer G E.Autophagy in the invading pathogen[J].Autophagy,2007,3(3):251-253.
[7] Bartoszewska M,Kiel JA.The role of macroautophagy in development of filamentous fungi[J].Antioxid Redox Signal,2011,14(11):2271-2287.
[8] Yu Q,Jia C,Dong Y,et al.Candidaalbicansautophagy,no longer a bystander:its role in tolerance to ER stress-related antifungal drugs[J].Fungal Genet Biol,2015,81:238-249.doi:10.1016/j.fgb.2015.02.008.
[9] Dong Y,Yu Q,Chen Y,et al.The Ccz1 mediates the autophagic clearance of damaged mitochondria in response to oxidative stress inCandidaalbicans[J].Int J Biochem Cell Biol,2015,69:41-51.doi:10.1016/j.biocel.2015.10.002.
[10] Wang CW,Klionsky DJ.The molecular mechanism of autophagy.[J].Molecular Medicine,2003,9(3-4):65-76.
[11] Palmer GE.Autophagy inCandidaalbicans[J].Methods Enzymol,2008,451(8):311-322.
[12] Abeliovich H,Klionsky DJ.Autophagy in yeast:mechanistic insights and physiological function[J].Microbiol Mol Biol Rev,2001,65(3):463.
[13] Baba M,Osumi M,Scott SV,et al.Two distinct pathways for targeting proteins from the cytoplasm to the vacuole/lysosome[J].J Cell Biol,1997,139(7):1687-1695.
[14] Scott SV,Baba M,Ohsumi Y,et al.Aminopeptidase I is targeted to the vacuole by a nonclassical vesicular mechanism[J].J Cell Biol,1997,138(1):37-44.
[15] Tuttle DL,Dunn WJ.Divergent modes of autophagy in the methylotrophic yeast Pichia pastoris[J].J Cell Sci,1995,108(Pt1):25-35.
[16] Baba M,Takeshige K,Baba N,et al.Ultrastructural analysis of the autophagic process in yeast:detection of autophagosomes and their characterization[J].J Cell Biol,1994,124(6):903-913.
[17] Darsow T,Rieder SE,Emr SD.A multispecificity syntaxin homologue,Vam3p,essential for autophagic and biosynthetic protein transport to the vacuole[J].J Cell Biol,1997,138(3):517-529.
[18] Sato TK,Darsow T,Emr SD.Vam7p,a SNAP-25-like molecule,and Vam3p,a syntaxin homolog,function together in yeast vacuolar protein trafficking[J].Mol Cell Biol,1998,18(9):5308-5319.
[19] Noda T,Kim J,Huang WP,et al.Apg9p/Cvt7p is an integral membrane protein required for transport vesicle formation in the Cvt and autophagy pathways[J].J Cell Biol,2000,148(3):465-480.
[20] Lang T,Schaeffeler E,Bernreuther D,et al.Aut2p and Aut7p,two novel microtubule-associated proteins are essential for delivery of autophagic vesicles to the vacuole[J].EMBO J,1998,17(13):3597-3607.
[21] Matsuura A,Tsukada M,Wada Y,et al.Apg1p,a novel protein kinase required for the autophagic process inSaccharomycescerevisiae[J].Gene,1997,192(2):245-250.
[22] Rane HS,Bernardo SM,Hayek SR,et al.The contribution ofCandidaalbicansvacuolar ATPase subunit V(1)B,encoded by VMA2,to stress response,autophagy,and virulence is independent of environmental pH[J].Eukaryot Cell,2014,13(9):1207-1221.
[23] Brown EJ,Albers MW,Shin TB,et al.A mammalian protein targeted by G1-arresting rapamycin-receptor complex[J].Nature,1994,369(6483):756-758.
[24] Kunz J,Henriquez R,Schneider U,et al.Target of rapamycin in yeast,TOR2,is an essential phosphatidylinositol kinase homolog required for G1 progression[J].Cell,1993,73(3):585-596.
[25] Uritani M,Hidaka H,Hotta Y,et al.Fission yeast Tor2 links nitrogen signals to cell proliferation and acts downstream of the Rheb GTPase[J].Genes Cells,2006,11(12):1367-1379.
[26] Kamada Y,Sekito T,Ohsumi Y.Autophagy in yeast:a TOR-mediated response to nutrient starvation[J].Curr Top Microbiol Immunol,2004,279:73-84.
[27] Chang HJ,Ro SH,Jing C,et al.mTOR regulation of autophagy[J].Febs Letters,2010,584(7):1287-1295.
[28] Biswas K,Morschhauser J.The Mep2p ammonium permease controls nitrogen starvation-induced filamentous growth inCandidaalbicans[J].Mol Microbiol,2005,56(3):649-669.
[29] Tsao CC,Chen YT,Lan CY.A small G protein Rhb1 and a GTPase-activating protein Tsc2 involved in nitrogen starvation-induced morphogenesis and cell wall integrity ofCandidaalbicans[J].Fungal Genet Biol,2009,46(2):126-136.
[30] Cruz MC,Goldstein AL,Blankenship J,et al.Rapamycin and less immunosuppressive analogs are toxic toCandidaalbicansandCryptococcusneoformansvia FKBP12-dependent inhibition of TOR[J].Antimicrob Agents Chemother,2001,45(11):3162-3170.
[31] Ferrara A,Cafferkey R,Livi GP.Cloning and sequence analysis of a rapamycin-binding protein-encoding gene (RBP1) fromCandidaalbicans[J].Gene,1992,113(1):125-127.
[32] Sabatini D M,Erdjument-Bromage H,Lui M,et al.RAFT1:a mammalian protein that binds to FKBP12 in a rapamycin-dependent fashion and is homologous to yeast TORs[J].Cell,1994,78(1):35-43.
[33] Cardenas ME,Cutler NS,Lorenz MC,et al.The TOR signaling cascade regulates gene expression in response to nutrients[J].Genes Dev,1999,13(24):3271-3279.
[34] Barbet NC,Schneider U,Helliwell SB,et al.TOR controls translation initiation and early G1 progression in yeast[J].Mol Biol Cell,1996,7(1):25-42.
[35] Feng J,Zhao Y,Duan Y,et al.Genetic interactions between protein phosphatases CaPtc2p and CaPph3p in response to genotoxins and rapamycin inCandidaalbicans[J].FEMS Yeast Res,2013,13(1):85-96.
[36] Zelante T,Iannitti R G,De Luca A,et al.Sensing of mammalian IL-17A regulates fungal adaptation and virulence[J].Nat Commun,2012,3:683.
[37] Rao A,Zhang Y,Muend S,et al.Mechanism of antifungal activity of terpenoid phenols resembles calcium stress and inhibition of the TOR pathway[J].Antimicrob Agents Chemother,2010,54(12):5062-5069.
[本文编辑] 施 慧
R 379.4
B
1673-3827(2017)12-0175-05
国家自然科学基金 (81673478)
张金宇,女 (汉族),硕士研究生在读.E-mail:rsuzhang@163.com
曹永兵,E-mail:ybcao@vip.sina.com;韩冰,E-mail:hbshcn@163.com
2017-01-04
自噬在真核细胞中保守存在的,自噬在真核细胞中是通过在溶酶体或液泡内降解细胞自身结构并加以利用的一种非特异性行为,这对维持胞内稳态平衡具有重要作用。已知的自噬可分为以下三种类型:巨自噬、微自噬和分子伴侣介导的自噬。在酵母细胞和大多数哺乳动物细胞中,自噬的发生由自噬相关基因ATG (autophagy-related gene)完成。其表达参与自噬发生的各个过程,目前已知的ATG基因超过了30种[1]。酵母和哺乳动物细胞中,自噬受到mTORC1 (mTOR复合物1)调控,激活mTORC1后自噬则被抑制。哺乳动物细胞中,自噬调节中另一类重要的转录调节因子Foxo,激活态的Foxo,通过干预自噬相关蛋白的方式参与调节自噬[2]。自噬的发生影响着真核细胞的适应性、分化和发育过程[3]。自噬对细胞具有双重作用,适度的自噬能够保护细胞,但自噬过度又可能导致自噬性细胞死亡[4]。
白念珠菌是最主要的机会致病真菌[5],已有研究表明,自噬在白念珠菌中也保守存在[6],而且影响白念珠菌的毒力[7]。应激刺激或者氮饥饿等营养缺陷的环境,诱导白念珠菌自噬增加。处于内质网应激和氧化应激条件下的白念珠菌,通过增强自噬减缓应激反应、增强菌体存活能力[8-9]。由此可见,自噬的研究将是揭示白念珠菌适应性和耐药性
