欧洲七叶树种胚愈伤组织培养与七叶皂苷量的分析
2017-08-16王明梅王晨阳王意敏刘忠华
王明梅, 王晨阳, 张 敏, 王意敏, 刘忠华
(北京林业大学 生物科学与技术学院, 北京 100083)
欧洲七叶树种胚愈伤组织培养与七叶皂苷量的分析
王明梅, 王晨阳, 张 敏, 王意敏, 刘忠华
(北京林业大学 生物科学与技术学院, 北京 100083)
通过改变培养基中植物生长调节剂的配比,筛选出适宜欧洲七叶树种胚愈伤组织增殖及七叶皂苷含量高的培养基,并对愈伤组织细胞生长与次生代谢物积累的规律进行初步分析,为细胞培养生产七叶皂苷提供理论基础。结果表明:欧洲七叶树种胚愈伤组织增殖培养的最佳培养基为MS+8 mg/L 6-BA+1 mg/L NAA;在最佳增殖培养基上,愈伤组织的最佳继代时期为35 d,最佳收获期为42 d;对愈伤组织比生长速率与七叶皂苷比合成速率进行分析,发现随着欧洲七叶树种胚愈伤组织细胞生长速率和比生长速率的降低,七叶皂苷合成速率和比合成速率增加。
欧洲七叶树种胚;愈伤组织;七叶皂苷;植物生长调节剂配比
欧洲七叶树(AesculushippocastanumL.)为七叶树科(Hippocastanaceae)七叶树属(Aesculus)的一种落叶乔木,树体高大雄伟,树冠开阔,叶大而形美,具有良好的遮荫效果,是世界五大观赏树种之一,又是重要的药用树种,在我国仅有少量分布。欧洲七叶树种子中含有三萜皂苷混合物如七叶树苷元、乙酸、惕各酸、葡萄糖醛酸、葡萄糖、木糖等,总称为七叶皂苷,还含有七叶酸、七叶灵酸以及黄酮类及甾醇类化合物、香豆素类(七叶树苷、秦皮苷、秦皮素等)、鞣质、淀粉、镁、钠、锰、钴、碘等[1-3]。七叶皂苷是欧洲七叶树种子中的主要活性成分,主要包括A、B、C和D 4种组分,根据德国DAC的定义七叶皂苷A、B称为β-七叶皂苷(β- aescin),七叶皂苷C、D 称为α-七叶皂苷(α-aescin)[3]。大量研究表明,七叶皂苷具有消炎、抗渗出、抗水肿、抗氧化、恢复毛细血管通透性,提高静脉张力,改善血液循环,促进脑细胞恢复、抗肿瘤等作用[4-9];目前临床主要用于治疗腰椎间盘突出症、急性甲状腺炎、颅脑外伤、脑出血、脑梗死及术后肿胀等疾病[10-15]。
欧洲七叶树原产于希腊北部和阿尔巴尼亚山区,我国的北京、上海、青岛等城市已有引种栽培,但结实率不高,资源有限难以满足其医药和绿化需求[2]。利用植物细胞培养生产次生代谢产物可不受季节、产地等的限制,是解决药用植物资源短缺的有效途径[16]。目前,国内外的大部分研究工作都是从欧洲七叶树的器官中直接提取七叶皂苷,并对其进行成分分析,仅Profumo等[17]利用欧洲七叶树叶外植体进行胚性愈伤的诱导并对胚状体中七叶素的含量进行了初步分析。之后有学者分别以欧洲七叶树的幼嫩叶片、胚芽、茎段、雄蕊花丝等为外植体进行了离体培养及快速繁殖体系的建立[18-21];Zead等对欧洲七叶树种子种皮及胚乳中4种主要皂苷(七叶皂苷Ia、Ib和异七叶皂苷Ia、Ib)的含量进行测定,发现胚乳中七叶皂苷Ia、Ib的含量均高于种皮,七叶皂苷主要贮存于种子的胚乳中[22];而利用欧洲七叶树种胚进行细胞培养生产七叶皂苷类化合物,国内外报道较少;通过改变培养基中植物生长调节剂配比,筛选出适合七叶皂苷生产的植物细胞培养体系,国内外未见报道。因此,笔者探讨了不同激素配比对欧洲七叶树种胚愈伤组织增殖及七叶皂苷量的影响,得到了细胞培养生产七叶皂苷的最佳植物生长调节剂组合,并对愈伤组织生长量及七叶皂苷含量进行初步分析,以便为欧洲七叶树种胚细胞培养生产七叶皂苷的相关研究提供技术原理和工艺基础。
1 材料与方法
1.1 材料
欧洲七叶树种子于2015年9月13日采自北京植物园内,通过MS+2 mg/L 2,4-D+0.5 mg/L 6-BA诱导产生愈伤组织;七叶皂苷标准品(由上海源叶生物科技有限公司提供,批号:6805-41-0),质量分数大于98%;所用化学试剂均为分析纯。
1.2 主要仪器
UV-2102C型紫外可见分光光度计(尤尼柯上海仪器有限公司),KQ5200E型超声波清洗器(江苏昆山),高速冷冻离心机(美国sigma公司),电热恒温水浴锅(北京市永光明医疗仪器厂)等。
1.3 方法
1.3.1 愈伤组织的增殖培养
在超净工作台上称取生长旺盛、色泽淡黄的种胚愈伤组织1.0 g接种于添加2,4-D、6-BA和NAA不同激素配比的MS培养基上(表1),培养基灭菌前pH为5.75~5.78,培养温度(25±2)℃,黑暗培养21 d,测定细胞的鲜质量、干质量以及七叶皂苷含量,筛选出最佳培养基,再用筛选出的培养基进行培养,每隔7 d测定1次细胞的鲜质量、干质量以及七叶皂苷含量。

表1 欧洲七叶树种胚愈伤组织培养的不同激素配比
1.3.2 七叶总皂苷的测定
采用张新等[23]方法。
1.3.3 标准曲线的绘制
精密称取七叶皂苷(Escin)标准品适量,加甲醇溶解配制成浓度为(4.6 mg/mL)的七叶皂苷标准品溶液。精密吸取标准品溶液5、10、20、40、60、80和100 μL,分别置于10 mL刻度试管,挥去溶剂,按文献[23]方法操作,测定吸收值,计算回归方程为:C=0.006A-0.0086,r=0.999,线形范围为0~92 μg。
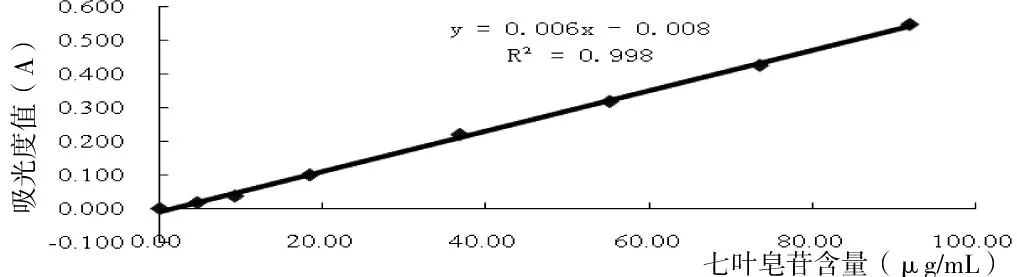
图1 七叶皂苷标准曲线Fig 1 The standard curve of escin
1.3.4 样品中七叶皂苷的提取
准确称取愈伤组织粉末(0.05±0.0005)g,过40目筛,置于10 mL离心管中,精密加入70%乙醇1.75 mL,于超声波清洗仪中20℃超声提取30 min,10 000 r/min离心1 min,取上清液,沉淀中加入1.75 mL的70%乙醇,重复提取1次,离心,合并两次所得的提取液,活性炭脱色,过滤,作为供试液,按文献[23]方法测其七叶皂苷含量。
1.3.5 计算公式
七叶皂苷的含量(mg/g)=C×V1×V2/V3×1000W
式中:C为稀释后提取液中七叶皂苷的浓度(μg/mL);V1为稀释后提取液的体积(mL);V2为未稀释时提取液的总体积(mL);V3为比色时精确吸取的提取液体积(mL);W为精确称取的材料干粉末的质量(g)。
生长速率(g·d-1)=dX/dt(单位时间愈伤组织细胞质量的增加)
比生长速率(d-1)=1/X·dX/dt(单位质量的愈伤组织细胞在单位时间内增加的细胞质量)
七叶皂苷合成速率(mg·d-1)=dp/dt
七叶皂苷比合成速率(d-1)=1/X·dp/dt
式中:X为愈伤组织细胞量;t为时间;p为七叶皂苷含量。
1.3.6 数据分析
采用Excel 2007和SPSS 17.0软件对实验数据进行分析。
2 结果与分析
2.1 植物生长调节剂对欧洲七叶树种胚愈伤组织生长及七叶皂苷合成的影响
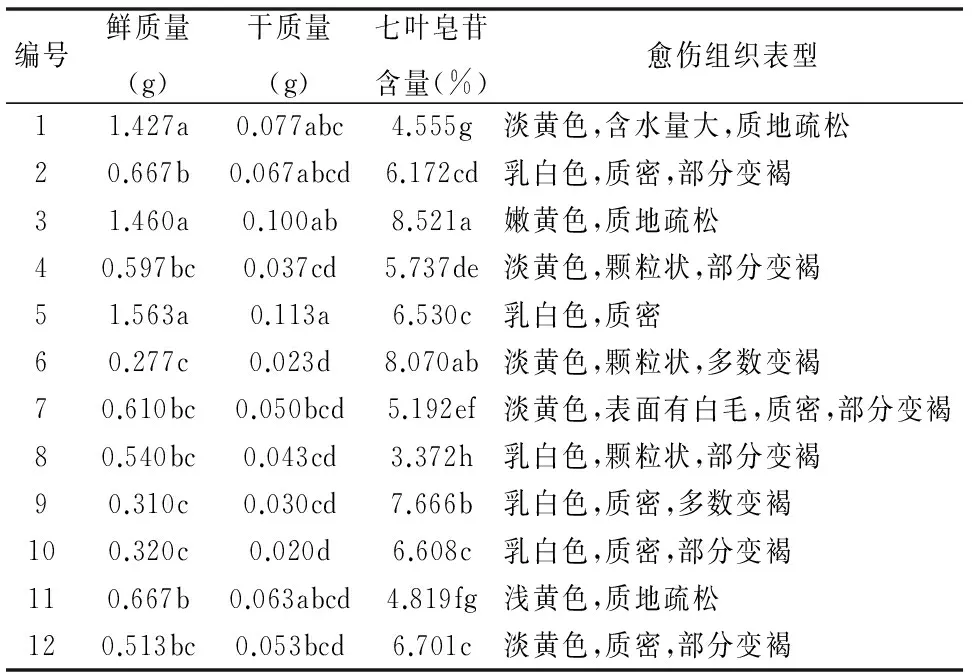
表2 不同激素配比对欧洲七叶树种胚愈伤组织生长量和七叶皂苷量的影响Table 2 Effects of different hormone proportion on callus of embryos in Aesculus hippocastanum L.
不同字母表示在0.05水平差异显著(P<0.05)
将质地疏松、长势良好的愈伤组织接种到不同激素配比的MS培养基中培养21 d,其生长量、七叶皂苷含量及愈伤组织表型均有差异(表2)。结果表明:愈伤组织在添加有0.5 mg/L 2,4-D+6 mg/L 6-BA+1 mg/L NAA的培养基上呈现出乳白色,质密的表型,其鲜质量和干质量的生长量均达到最大值,分别为1.563和0.113 g,七叶皂苷的含量为6.530%(图2);愈伤组织在添加有8 mg/L 6-BA+1 mg/L NAA的培养基上呈现出嫩黄色,质地疏松的表型,其鲜质量和干质量的生长量较大,分别为1.460和0.100 g,并且其七叶皂苷含量最高为8.521%;愈伤组织在添加有0.5 mg/L 2,4-D+8 mg/L 6-BA的培养基上七叶皂苷含量较大为8.070%,但其鲜质量和干质量的生长量较小,仅为0.277和0.023 g,显著低于以上2种处理,并且愈伤组织褐变较严重。通过显著性分析,在添加有0.5 mg/L 2,4-D+6 mg/L 6-BA+1 mg/L NAA的培养基中愈伤组织生长量与添加有8 mg/L 6-BA+1 mg/L NAA的培养基中愈伤组织的生长量没有显著差异,但七叶皂苷含量差异显著。综上所述,将添加有8 mg/L 6-BA+1 mg/L NAA的培养基作为愈伤组织增殖培养的最佳培养基。
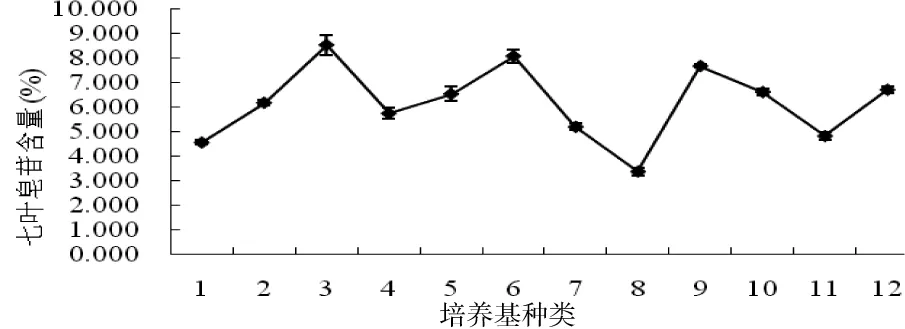
图2 不同激素配比对欧洲七叶树种胚愈伤组织中七叶皂苷量的影响Fig 2 Effects of different hormone proportion on escin content in embryos callus of Aesculus hippocastanum L.
2.2 欧洲七叶树种胚愈伤组织生长与七叶皂苷合成
将质地疏松,长势良好的愈伤组织接种到最佳增殖培养基中培养49 d,其生长曲线与七叶皂苷合成曲线(如图3)显示,愈伤组织转接到最佳增殖培养基后即进入快速生长,刚转接的7 d内未出现明显的生长缓慢的现象,原因可能是新的培养基中营养物质丰富且生长空间充足,所以此时次生代谢物产量也有所增加;0~35 d愈伤组织快速生长,鲜质量从1.023 g生长到6.193 g,干质量从0.076 g生长到0.43 g;35 d之后愈伤组织进入稳定期。七叶皂苷含量在0~7 d内迅速增加,从8.444%增加到最大14.604%,7~14 d迅速下降到最低点为3.901%,之后再增加,含量值维持在7.65%以上,但42 d后七叶皂苷含量呈下降趋势,原因可能是培养基中营养物质缺乏,次生代谢物合成减少。综上所述,愈伤组织培养35 d时达到最大生长量,而七叶皂苷含量处于较低水平,故此时是愈伤组织的最佳继代期;愈伤组织培养42 d时生长量稍有下降,但七叶皂苷含量相对较高,因此此时是愈伤组织的最佳收获期。
2.3 欧洲七叶树愈伤组织比生长速率与七叶皂苷比合成速率
欧洲七叶树种胚愈伤组织生长速率和比生长速率如图4所示。由图4可知,0~7 d内愈伤组织生长速率与比生长速率相对较低,7~35 d内愈伤组织生长速率迅速增加,35 d时达到最大值0.312 g/d,35~42 d生长速率迅速下降;7~21 d内愈伤组织比生长速率迅速增加,21~35 d内比生长速率处于较稳定状态,28 d时达到最大值为0.053/d,35~42 d比生长速率迅速下降,42~49 d生长速率与比生长速率稍有上升。
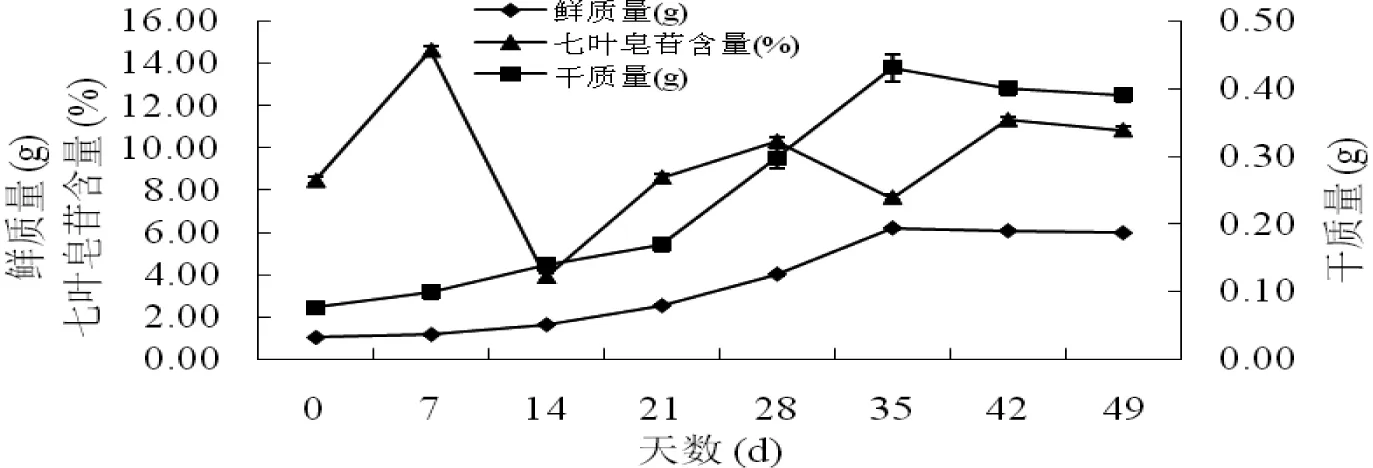
图3 欧洲七叶树种胚愈伤组织生长与七叶皂苷合成曲线Fig 3 The growth curves of Aesculus hippocastanum L. embryos callus and escin production
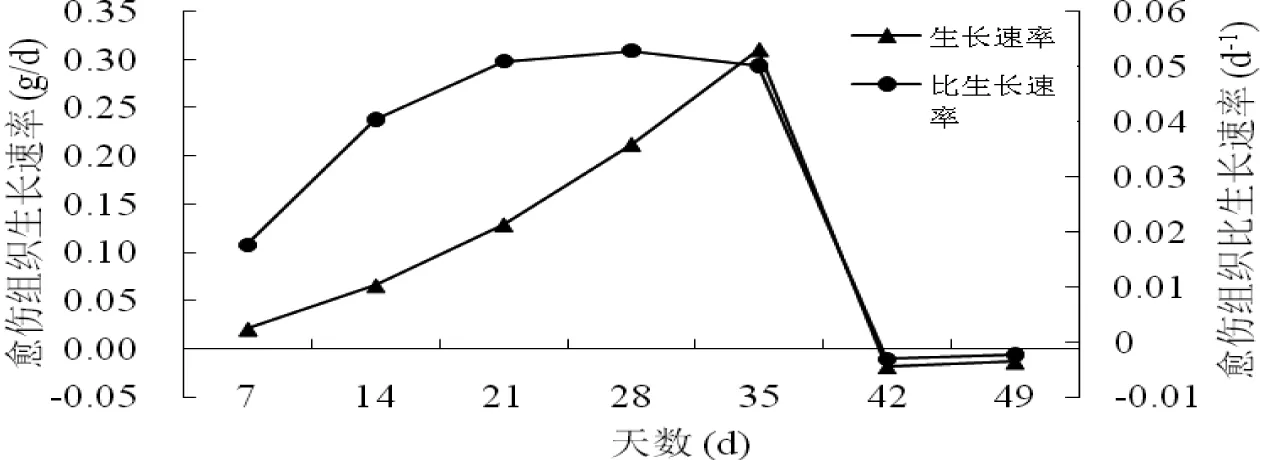
图4 愈伤组织生长速率与比生长速率Fig 4 Dynamic changes of callus growth rate and specific growth rate
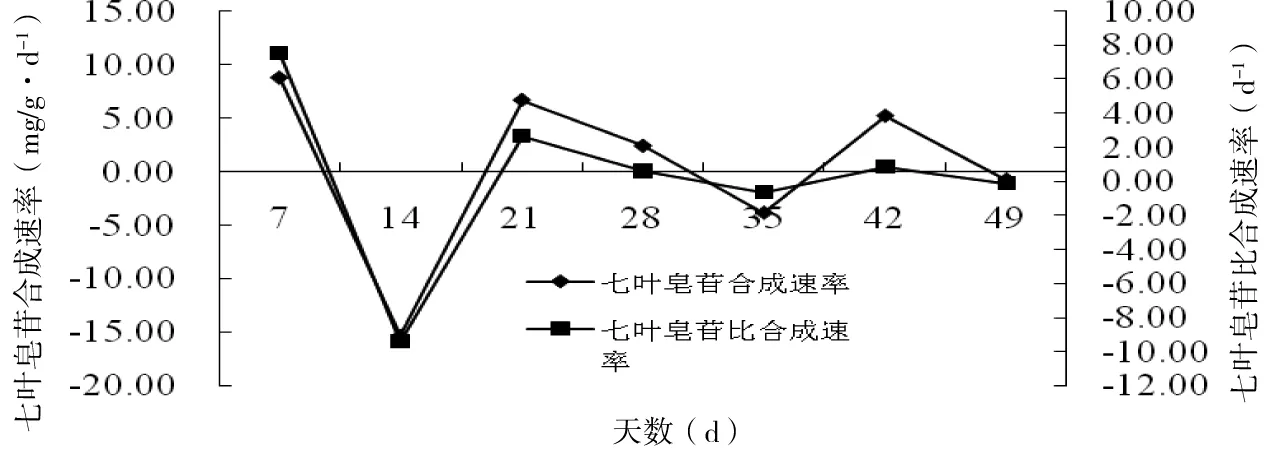
图5 七叶皂苷合成速率与比合成速率Fig 5 Dynamic changes of escin synthesis rate and specific synthesis rate
欧洲七叶树种胚愈伤组织中七叶皂苷的合成速率与比合成速率如图5所示。由图5可知,七叶皂苷的合成速率与比合成速率的变化趋势相同,0~7 d内七叶皂苷合成速率与比合成速率达到最高值为8.80 mg/g/d和7.54/d,可能因为培养基中营养物质充足,促进了次生代谢物的合成;7~14 d在愈伤组织细胞生长迅速时期,七叶皂苷的合成速率与比合成速率迅速下降,呈现负增长,可能是因为愈伤组织比生长速率增加较大,即绝对生长速度较快,减少甚至停止了次生代谢物的合成,14~21 d七叶皂苷合成速率与比合成速率迅速增加,21~35 d七叶皂苷合成速率与比合成速率又处于下降趋势,35~42 d七叶皂苷合成速率与比合成速率处于上升趋势,而此时愈伤组织细胞生长速率降低,可能是因为培养基中营养物质减少,生长空间变小,细胞生长缓慢,促进次生代谢物的合成;42~49 d合成速率与比合成速率处于下降趋势。
综上推测,随着欧洲七叶树种胚愈伤组织细胞生长速率和比生长速率的降低,七叶皂苷合成速率和比合成速率增加;而愈伤组织生长速率和比生长速率增加时,七叶皂苷的合成速率和比合成速率变化无特定的规律。
3 结论
植物生长调节剂的配比是影响愈伤组织细胞生长量和次生代谢物产量的重要因素之一,且不同物种细胞生长量和次生代谢物产量的积累与其所依赖的植物生长调节剂配比紧密相关[24-25]。吕秀立等[26]研究发现高浓度的6-BA与NAA组合利于欧洲七叶树胚性愈伤组织的诱导与增殖;Profumo等[17]研究发现,欧洲七叶树胚性愈伤组织及胚状体中七叶皂苷的含量要比种子中高很多。本实验在12种不同激素配比的培养基中,选用高浓度的6-BA与不同浓度的2,4-D、NAA进行组合。欧洲七叶树种胚愈伤组织在未添加2,4-D的培养基中,随着6-BA、NAA浓度的增加,七叶皂苷含量显著增加,表明6-BA、NAA对欧洲七叶树种胚愈伤组织中七叶皂苷的合成具有促进作用;愈伤组织在未添加NAA的培养基中,随着2,4-D浓度的增加,七叶皂苷含量变化无规律性,但愈伤组织生长量均显著降低,表明2,4-D对七叶皂苷合成的促进作用不明显,且高浓度的2,4-D与高浓度的6-BA组合不利于愈伤组织的增长。由此可见,在欧洲七叶树种胚愈伤组织的增殖培养过程中6-BA和NAA的组合有利于提高愈伤组织生长量和七叶皂苷含量。
在利用植物细胞培养生产次生代谢物中,研究细胞生长规律和次生代谢物的积累规律,对提高次生代谢物产率及植物细胞培养的进一步放大具有重要意义[27]。本研究发现欧洲七叶树种胚愈伤组织固体培养的周期约为35 d,在一个培养周期中愈伤组织细胞没有明显的迟滞期,直接进入快速生长期,之后进入稳定期和衰亡期。0~35 d为快速生长期,35 d后进入稳定期,稳定期时间相对较长,之后进入衰亡期。经过35 d的培养,愈伤组织生物量达到最大,七叶皂苷含量的较大值在42 d,42 d之后七叶皂苷含量下降,原因可能是培养基中营养物质缺乏,次生代谢物合成减少。因此建议选择的最佳继代时间是35 d,最佳收获时间则为42 d。
利用植物细胞培养生产次生代谢物是解决药用植物资源短缺的有效途径,但次生代谢物的生产率低,成为限制该技术商业化和大规模生产的主要障碍[28],而植物细胞培养中提高次生代谢产物的产量主要包括两个方面:一是细胞生物量的提高,二是次生代谢产物积累的提高,而两者并不总是统一的[29],因此探讨两者的关系对细胞培养生产次生代谢物质很有必要。通过分析细胞比生长速率与次生代谢物比合成速率可得出细胞生长与次生代谢物积累的关系[30]。生长速率和比生长速率是用来确定生物或培养物生长速度的量度,比生长速率即愈伤组织细胞的绝对生长速度[30],七叶皂苷比合成速率即绝对合成速度。本研究通过分析欧洲七叶树愈伤组织比生长速率与七叶皂苷比合成速率发现,随着欧洲七叶树种胚愈伤组织细胞生长速率和比生长速率的降低,七叶皂苷合成速率和比合成速率增加;而愈伤组织比生长速率增加时,七叶皂苷的比合成速率变化无特定的规律。
[1]于新蕊,薛玉红. 欧洲七叶树研究概况[J]. 国际中医中药杂志, 2001, 23(4): 207-210.
[2]石召华,张一娟,关小羽,等. 七叶树属植物研究进展[J]. 世界科学技术-中医药现代化, 2013, 15(2): 322-328.
[3]WAGNER J, BOSSES J. On the composition of horse chestnut seeds. Ⅰ.Studies on the pure saponin, escin[J]. Hoppe-Seyler′s Zeitschrift fvr Physiologische Cheme, 1960, 320: 27-34.
[4]骆晓梅,彭 涛,王 林. 七叶皂苷的药学和治疗作用[J]. 国外医学药学分册, 2002, 29(3): 168-171.
[5]HU X M, ZENG F D. Inhibitory effect of beta-aescin on inflammatory process following focal cerebral ischemia-reperfusioninrats[J]. Chinese Journal of Pharmacology and Toxicology, 2005, 19(1): 1-6.
[6]WEI F, MA L Y, JIN W T, et al. Antiinflammatory triterpenoid saponins from the seeds ofAesculuschinensis[J]. Chemical and Pharmaceutical Bulletin, 2004, 52(10): 1246-1248.
[7]SIRTORI C R. Aescin: pharmacology, pharmacokinetics and therapeutic profile[J]. Pharmacological Research, 2001, 44(3): 183-193.
[8]牛泱平,邱燕燕,竺 佳,等. 七叶皂苷钠对小鼠急性淋巴白血病L1210细胞的体内外作用研究[J]. 中草药, 2009, 40(11): 1770-1773.
[9]万贵平,张真真,蔡雪婷,等. 七叶皂苷钠抑制人白血病Jurkat细胞增殖的机制研究[J]. 中草药, 2012, 43(1): 106-110.
[10]张旭桥,王晓晖,姜升平,等. 七叶皂苷纳合脊柱微创镇痛术治疗腰椎间盘突出症[J].中国医学创新, 2015, 12(36): 19-22.
[11]李存杰,孙 宇. 七叶皂苷钠联合小剂量泼尼松治疗亚急性甲状腺炎女性患者的疗效及安全性[J]. 山东大学耳鼻喉眼学报, 2016, 30(2): 75-77.
[12]欧国强,任智文. β-七叶皂苷钠在神经科疾病中的应用[J]. 四川医学, 2002, 23(4): 417-418.
[13]潘生英,臧志忠,欧阳和中. 用七叶皂苷钠治疗脑出血的效果研究[J]. 当代医药论丛, 2015 (22): 143-144.
[14]崔岚嵩. 注射用七叶皂苷钠联合冰敷治疗甲状腺术后颈部肿胀的临床应用[J]. 中国实用医药, 2014 (32): 100-102.
[15]王俊国,徐 慧,王玉静. 七叶皂苷钠不同剂型联合应用对跟骨骨折术后肢体肿胀治疗的临床研究[J]. 中国实用医药, 2015 (17): 12-13.
[16]阮氏钏,杨万霞,方升佐,等. 培养基种类及激素配比对青钱柳悬浮细胞次生代谢物质积累的影响[J]. 南京林业大学学报(自然科学版), 2015, 39(2): 47-51.
[17]PROFUMO P, GASTALDO P, GAVIGLIA A M, et al. Somatic embryogenesis from cotyledonary explants ofAesculushippocastanumL.[J]. Acta Embryologiae et morphologiae experimentalis, 1991,11: 101-106.
[18]PAOLA G, SILVANA C, PAOLA P. Somatic embryogenesis from stem explants ofAesculushippocastanum[J]. Plant Cell, 1994, 39(1): 97-99.
[19]吕秀立,施季森. 欧洲七叶树的离体培养及快速繁殖[J]. 南京林业大学学报(自然科学版), 2004, 28(3): 41-44.
[21]APUANA M. Somatic embryogenesis in horse chestnut(AesculushippocastanumL.)[J]. Methods in Molecular Biology, 2016, 1359: 431-438.
[22]ZEAD H M A, KHALDUN M A A, AHMAD N, et al. Determination of four major saponins in skin and endosperm of seeds of horse chestnut(AesculusHippocastanumL.) using high performance liquid chromatography with positive confirmation by thin layer chromatography[J]. Advanced Pharmaceutical Bulletin, 2015, 5(4): 587-591.
[23]张 新,王志伟,马 琳. 娑罗子中总皂苷的比色测定[J]. 天然产物研究与开发, 2000, 12(5): 28-30.
[24]赵 胡,王玉娇,管恒洁,等. 不同激素配比对半支莲细胞生长与甜菜红素积累及抗氧化酶活性的影响[J]. 天然产物研究与开发, 2015(27): 2014-2019.
[25]房慧勇,朱 虹,丁海麦,等. 影响愈伤组织中次生代谢产物含量的因素研究进展[J]. 中国中药杂志, 2014, 39(15): 2846-2850.
[26]吕秀立. 欧洲七叶树体细胞胚发生和植株再生研究[D]. 南京: 南京林业大学, 2004.
[27]王 莉,史玲玲,刘玉军. 不同光质对长鞭红景天悬浮细胞生长及苯丙氨酸解氨酶活性的影响[J]. 林业科学, 2007, 43(6): 52-56.
[28]YUE W, MING Q L, LIN B, et al. Medicinal plant cell suspension cultures: pharmaceutical applications and high-yielding strategies for the desired secondary metabolites[J]. Critical Reviews in Biotechnology, 2016, 36(2): 1-18.
[29]黄淑燕. 雷公藤组织培养机理及次生代谢产物含量研究[D]. 福建: 福建农林大学, 2012.
[30]陈红贤,于笑笑,王晨阳,等. 国槐槐角种胚细胞悬浮培养的动力学研究[J]. 浙江农林大学学报, 2016, 33(2): 272-279.
Callus culture of embryos inAesculushippocastanumL. and analysis on escin content
WANG Ming-mei, WANG Chen-yang, ZHANG Min, WANG Yi-min, LIU Zhong-hua
(College of Biological Sciences and Technology, Beijing Forestry University, Beijing 100083, China)
Through changing the plant growth regulators proportion of medium, the optimal medium for callus proliferation and high content of escin were obtained; the growth of callus and accumulation of secondary metabolites were preliminarily analyzed which can provide theoretical basis for the production of escin in cell culture. Results revealed that the optimal medium for callus proliferation of embryos inAesculushippocastanumL. was MS+8 mg/L 6-BA+1 mg/L NAA. In the optimal medium, the best subculture period was 35 d and the best harvest time was 42 d. The callus specific growth rate and escin specific synthesis rate were analyzed, which showed that with the decrease of the callus growth rate and specific growth rate, the escin synthesis rate and specific synthesis rate was increased.
AesculushippocastanumL. embryos; callus; escin; the proportion of plant growth regulators
2016-07-25;
2016-08-11
国家自然科学基金(31470668)
王明梅,硕士,从事药用植物及其次生代谢研究工作,E-mail:mingmeiwang@126.com
刘忠华,博士,副教授,主要从事植物生长发育及系统进化研究,E-mail:liuzh6@bjfu.edu.cn
Q943;Q946.83+8.4
A
2095-1736(2017)04-0053-05
doi∶10.3969/j.issn.2095-1736.2017.04.053
