肾缺血再灌注损伤大鼠肺内谷胱甘肽过氧化物酶1的表达变化
2017-08-16于国霞霍宏昌王素玲
于国霞,霍宏昌,王素玲,王 切
(1.河北省石家庄市妇幼保健院药剂科,河北 石家庄 050051;2.河北省血液中心检验科,河北 石家庄 050071;3. 河北医科大学基础医学院人体解剖学教研室,河北 石家庄 050017)
·论 著·
肾缺血再灌注损伤大鼠肺内谷胱甘肽过氧化物酶1的表达变化
于国霞1,霍宏昌1,王素玲2,王 切3*
(1.河北省石家庄市妇幼保健院药剂科,河北 石家庄 050051;2.河北省血液中心检验科,河北 石家庄 050071;3. 河北医科大学基础医学院人体解剖学教研室,河北 石家庄 050017)
目的观察谷胱甘肽过氧化物酶1(glutathione peroxidase 1,GPX-1)在肾缺血再灌注损伤(renal ischemia reperfusion injury,RIRI)大鼠肺内的表达变化,探讨GPX-1清除过氧化物保护肺脏免遭过氧化损伤的作用。方法切除Wistar大鼠右肾,无损伤动脉夹夹闭左肾动脉,建立大鼠RIRI模型。肾脏血液重新灌注24 h后取血、肾脏、肺脏。血清尿素氮(blood urea nitrogen,BUN)、血清肌酐(serum creatinine,SCr)浓度分别采用酶偶联速率法和苦味酸法测定;HE染色法观察大鼠肾形态结构改变;肺组织过氧化氢(hydrogen peroxide,H2O2)和丙二醛(malondialdehyde,MDA)含量分别采用钼酸比色法和硫代巴比妥酸比色法测定,GPX-1的mRNA和蛋白表达水平分别采用RT-PCR和Western blotting法测定,并对GPX-1表达水平与MDA含量、H2O2含量作相关性分析。结果与对照组相比,RIRI组大鼠肾组织形态结构受损明显,BUN和SCr含量、肺组织MDA含量和H2O2含量也明显升高;RIRI组大鼠肺组织GPX-1 mRNA和蛋白表达水平也明显增强,并与MDA含量、H2O2含量均呈正相关。结论RIRI使肺组织也处于氧化应激状态并遭受过氧化损伤;GPX-1可能通过清除过氧化物,保护肺脏免遭过氧化损伤。
肾动脉;再灌注损伤;谷胱甘肽过氧化物酶1;大鼠
肾缺血再灌注损伤(renal ischaemia-reperfusion injury,RIRI)是保留肾单位手术、肾动脉阻断术、肾脏移植等临床治疗过程中不可避免的结果,也是导致术后肾脏功能恢复延迟、甚至引发急性肾衰竭的主要原因[1-3]。已有研究表明,在缺血再灌注发生过程中,会有大量活性氧族(reactive oxygen species,ROS)产生,从而导致肾损伤。因此,氧化应激可能是导致RIRI的主要原因[4-6]。谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)是一类抗氧化酶家族,能将ROS成员还原为水和醇,从而保护生物膜和细胞成分,对抗氧化应激。GPX-1是GPX家族中含量最丰富的家族成员,主要存在于细胞质和线粒体中,且在肺脏广泛表达,在保护肺脏对抗氧化应激中具有重要作用[7-9]。肺脏血供丰富,氧含量高,对缺氧反应极为敏感。本研究制造大鼠RIRI模型,观察肺组织丙二醛(malondialdehyde,MDA)含量、过氧化氢(hydrogen peroxide,H2O2)含量、抗氧化酶GPX-1基因和蛋白表达水平变化,探讨RIRI发生后肺组织内的氧化应激状态及GPX-1的抗氧化作用。
1 材料与方法
1.1 RIRI模型建立以及样品处理 雄性Wistar大鼠12只,购于河北省实验动物中心,体质量190~210 g,随机分为RIRI组6只和对照组6只。6%水合氯醛腹腔注射麻醉大鼠(5 mL/kg),将大鼠固定于手术台,自剑突向下做约4 cm长腹部正中切口,结扎大鼠右侧肾蒂后切除其右侧肾脏。RIRI组大鼠分离左侧肾动脉并采用无创动脉夹于肾门处将其夹闭,阻断其血液供应,肉眼可见左侧肾脏由鲜红色逐渐变为暗红色,提示肾动脉夹闭成功。45 min 后弃去动脉夹, 重新恢复肾脏血液灌注,肉眼可见左侧肾脏又迅速转变为鲜红色,提示重新灌注成功。对照组大鼠只分离左侧肾动脉但并不夹闭阻断血供。术后大鼠均单笼饲养、自由食水。恢复血液供应24 h后重新麻醉大鼠,收集血液,3 000 r/min离心10 min,分离血清,用于血清尿素氮(blood urea nitrogen,BUN)、血清肌酐(serum creatinine,SCr)浓度检测;取部分肾脏组织固定于4%多聚甲醛中,用于苏木精-伊红(Hematoxylin-Eosin,HE)染色法观察肾脏形态学改变;取部分肺脏组织迅速置于液氮中,用于MDA含量、H2O2含量、GPX-1 mRNA及蛋白水平测定。
1.2 主要试剂 Trizol、dNTP、Taq DNA聚合酶为Invitrogen公司产品;反转录试剂盒为Promega公司产品;SCr和BUN检测试剂盒为中生北控生物科技有限公司产品;MDA和H2O2检测试剂盒为南京建成科技有限公司产品。GPX-1一抗(兔抗鼠)为Abcam公司产品,二抗(羊抗兔)为Zymed公司产品。
1.3 BUN、SCr含量检测 大鼠SCr含量采用苦味酸法测定,BUN含量采用酶偶联速率法测定,标本处理及检测过程均按试剂盒操作说明进行。
1.4 肾脏形态学观察 HE染色法观察大鼠肾脏组织形态结构改变。按常规组织切片的操作步骤处理固定后的肾组织修块:脱水、透明、浸蜡、包埋,切片厚约5 μm,HE染色后封片,光学显微镜下观察肾组织形态结构改变并拍照。
1.5 肺组织匀浆内MDA含量测定 将预冷的匀浆缓冲液(1 mmol/L盐酸苯甲脒,50 mmol/L磷酸钾缓冲液,pH 7.4,0.5 mol/L 氯化钠,0.1%吐温20, 1 mmol/L PMSF,5 mmol/Lβ-巯基乙醇,1 mmol/L EDTANa3)加入冰冻肺组织内,冰浴下匀浆,将匀浆液4 000 r/min 4 ℃离心20 min,收集上清即制成10%肺组织匀浆,匀浆内MDA含量按照南京建成MDA测定试剂盒检测步骤进行。
1.6 肺组织匀浆制备及H2O2含量检测 将冰冻肺组织按照10 mg/100 μL比例加入预冷匀浆缓冲液(1 mmol/L盐酸苯甲脒,50 mmol/L磷酸钾缓冲液,pH 7.4,0.5 mol/L氯化钠,0.1%吐温20,1 mmol/L PMSF,5 mmol/Lβ-巯基乙醇,1 mmol/L EDTANa3),冰浴下匀浆,将匀浆液4 000 r/min 4 ℃离心20min,收集上清即为10%肺组织匀浆。大鼠肺组织匀浆内H2O2含量采用钼酸比色法检测,以每克肺组织匀浆样本蛋白所含过氧化氢的量(mmol/g pro)表示,整个检测过程按试剂盒操作说明进行。
1.7 肺组织GPX-1 mRNA水平测定 TRIzol法裂解提取肺组织总RNA并反转录成cDNA,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内对照进行RT-PCR。以GPX-1扩增产物灰度值与GAPDH灰度值之比表示GPX-1 mRNA的相对表达量。
1.8 大鼠肺组织GPX-1蛋白水平检测 Western blot法测定大鼠肺组织GPX-1蛋白相对表达水平。大鼠肺组织匀浆制备匀浆液, 离心取上清,煮沸法使蛋白变性,改良Lowry法进行蛋白总量测定。SDS-PAGE凝胶电泳蛋白上样量为66 μg。半干转膜、5%脱脂奶粉封闭后,在PVDF膜上加入GPX-1一抗,置于摇床振荡过夜。洗膜后加入辣根过氧化物酶标记IgG抗体。显影、定影、晾干后,凝胶成像系统扫描胶片拍照并进行图像分析,以GPX-1光密度值与内对照GAPDH光密度值之比表示GPX-1的蛋白相对表达量。
1.9 相关性分析 大鼠肺组织GPX-1 mRNA和蛋白表达水平与其肺组织MDA含量、H2O2含量的相关性采用Pearson相关分析。
1.10 统计学方法 应用SPSS 13.0统计软件处理数据。计量资料比较采用t检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠肾组织形态结构改变 光学显微镜下可见:RIRI组大鼠肾小管管腔扩张明显;肾小囊囊腔扩张;部分肾小球萎缩,体积变小;肾小管间隙扩大,肾间质水肿;集合管管腔扩张。正常组大鼠肾小囊、肾血管球、集合管、远曲小管及近曲小管形态结构清晰规整。见图1,2。

图1 RIRI组肾小球、肾小管形态改变(HE ×400)
Figure 1 The morphological changes of glomeruli and tubules in RIRI group(HE ×400)

图2 对照组肾小球、肾小管形态结构(HE ×400)
Figure 2 The morphological of glomeruli and tubules in control group(HE ×400)
2.2 2组SCr和BUN含量比较 RIRI组大鼠BUN和SCr含量均明显高于对照组,差异有统计学意义(P<0.05),见表1。


组别BUN(mmol/L)SCr(μmol/L)对照组 4.462±0.541103.444±8.465RIRI组13.685±4.397131.153±17.814t5.0933.459P0.0000.006
2.3 2组肺组织MDA和H2O2含量比较 RIRI组大鼠肺组织MDA 和H2O2含量均明显高于对照组,差异有统计学意义(P<0.05),见表2。


组别MDAH2O2对照组 7.63±1.6824.52±2.96RIRI组10.89±1.7437.36±4.36t3.2925.963P0.0080.000
2.4 2组肺组织GPX-1 mRNA和蛋白表达量比较 RIRI组大鼠肺组织GPX-1 mRNA和蛋白相对表达量明显高于对照组,差异有统计学意义(P<0.01),见图3、4,见表3。
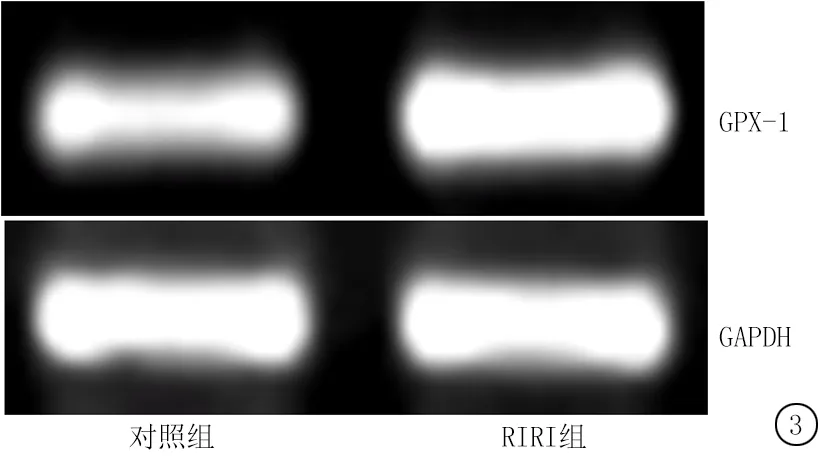
图3 GPX-1的mRNA表达
Figure 3 The mRNA expression of GPX-1

图4 GPX-1的蛋白表达
Figure 4 The protein expression of GPX-1
表3 2组GPX-1 mRNA和GPX-1 蛋白表达比较
Table3 Comparison of expression of GPX-1 mRNA and protein of GPX-1 between two groups

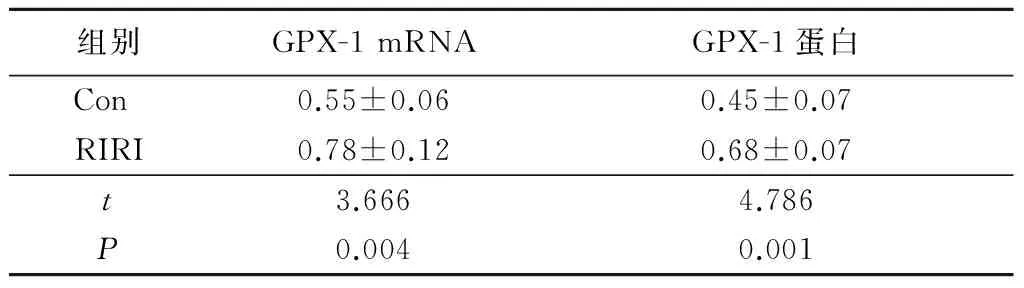
组别GPX-1mRNAGPX-1蛋白Con 0.55±0.060.45±0.07RIRI0.78±0.120.68±0.07t3.6664.786P0.0040.001
2.5 相关性分析 大鼠肺组织GPX-1 mRNA表达水平与MDA含量、H2O2含量呈正相关(P<0.05);GPX-1蛋白表达水平与MDA含量、H2O2含量也呈正相关(P<0.05)。见表4。

表4 肺组织GPX-1 mRNA和蛋白表达水平与MDA、H2O2含量的相关性Table 4 The Correlation between GPX-1 mRNA, protein expression and MDA, H2O2 content in lung
3 讨 论
肾脏是泌尿系统的重要器官,在维持电解质、水平衡,血流动力学以及机体内环境的平衡稳定中发挥着重要作用[10]。RIRI是肾脏手术治疗过程中不可避免的病理生理反应,极大地增加了患者术后并发症的发生率和病死率。因此,对RIRI发生机制和防治途径的探讨已经成为医疗界的一个研究焦点。实验研究表明氧化应激可能是导致RIRI发生的主要机制之一[11]。肺脏富含血液和氧气,对缺血缺氧反应极为敏感。本研究的目的为:观察RIRI发生后肾脏处于高度氧化应激状态时,肺组织是否也同样处于氧化应激状态并遭受过氧化损伤,抗氧化酶GPX-1的表达又如何改变。
对于RIRI的研究是通过动物模型来实现的。无损伤血管夹夹闭大鼠左肾动脉阻断其血液供应,45 min 后弃去血管夹重新恢复血液灌注从而诱导大鼠RIRI模型。BUN和SCr是临床上检验肾脏功能的常用指标。有研究显示RIRI可以导致含氮代谢产物在血浆内的积累,如BUN和SCr。本研究结果与其一致。本研究HE染色结果显示RIRI组大鼠的肾小球和肾小管形态结构均明显受损。表明本研究RIRI模型是成功的,RIRI组大鼠肾脏的形态结构和功能均严重损伤。
ROS是一类高活性分子家族,它们可由肺内的多种细胞类型针对来自于环境内的物理和化学剂刺激因子而产生。ROS在肺脏大量产生或因ROS清除机制受损导致其过度积累时,会引发氧化应激损伤。ROS成员主要包括超氧阴离子、H2O2和羟自由基等。这些代谢活跃分子能与细胞内和细胞膜上的重要结构蛋白、功能蛋白以及核酸DNA等物质发生过氧化反应,导致蛋白质和核酸变性、细胞膜结构损伤、线粒体功能障碍,甚至细胞死亡[12]。其中H2O2是ROS成员中含量最丰富代谢最稳定的形式。因此,H2O2被认为是引发组织细胞氧化应激损伤的一个主要因素,除去多余的H2O2对防止组织损伤至关重要[13-14]。本研究结果显示RIRI组大鼠肺组织内H2O2含量明显高于对照组。说明在RIRI发生时,不仅肾脏会处于氧化应激状态,肺组织内也同时会出现大量ROS,处于高度氧化应激状态。此外,MDA 是细胞膜和细胞内的脂类物质与ROS发生过氧化反应所形成的终末代谢产物之一, 其含量的高低能直接反映脂类物质与ROS发生过氧化反应的速度和强度。因此,MDA常被作为评价组织细胞发生过氧化损伤程度的标志物之一[15-16]。本研究结果显示RIRI组大鼠肺组织内不仅H2O2含量明显升高,MDA含量也明显高于对照组。表明在RIRI发生时,肺组织不仅处于高度氧化应激状态并已遭受严重过氧化损伤。
机体内存在氧化还原反应系统与抗氧化系统。当机体处于正常状态时,氧化还原反应系统与抗氧化系统处于平衡状态。当这种平衡状态被打破时,就会导致ROS在体内的大量积聚,并诱发氧化应激反应的发生。细胞内具有发达的酶防御系统来对抗ROS的过度产生,包括GPX。GPX是一类抗氧化酶家族,能催化具有破坏性的H2O2以及大量氢过氧化物(如DNA过氧化物和脂质过氧化物)还原为水和醇,从而保护生物膜和细胞成分对抗氧化应激反应。通过对GPX硒蛋白组的分析发现,哺乳动物共有6个家族成员。胞内硒依赖性GPX-1是GPX家族的主要成员,且在机体内表达广泛,尤其在肺部的肺泡上皮细胞、肺泡巨噬细胞等广泛表达[7-9]。提示GPX-1可能在肺脏发挥重要的抗氧化作用。本研究结果显示,RIRI发生时大鼠肺组织GPX-1 mRNA和蛋白表达水平与对照组相比均明显升高,并且GPX-1 mRNA和蛋白表达水平与MDA、H2O2含量均呈正相关。推测RIRI发生时,肺组织内由于有大量ROS产生并与脂类物质发生过氧化反应,从而引发过氧化损伤的发生。为清除积累过多的ROS并维持机体处于氧化还原平衡状态,机体反馈性地上调抗氧化酶GPX-1的表达以清除机体内过多的ROS,从而保护肺组织免遭氧化应激损伤。
总之,RIRI可使肺脏组织也处于氧化应激状态,并遭受过氧化损伤;抗氧化酶GPX-1可能在清除ROS保护肺组织免遭进一步过氧化损伤中发挥了重要作用。本研究为寻求RIRI所诱发的肺组织损伤防治途径提供了一条新思路。
[1] Xu YM,Ding GH,Huang J,et al. Tanshinone ⅡA pretreatment attenuates ischemia/reperfusion-induced renal injury[J]. Exp Ther Med,2016,12(4):2741-2746.
[2] Moslemi F,Taheri P,Azimipoor M,et al. Effect of angiotensin Ⅱ type 1 receptor blockade on kidney ischemia/reperfusion:a gender-related difference[J]. J Renal Inj Prev,2016,5(3):140-143.
[3] Wu H,Huang T,Ying L,et al. MiR-155 is involved in renal ischemia-reperfusion injury via direct targeting of foxo3a and regulatingrenal tubular cell pyroptosis[J]. Cell Physiol Biochem,2016,40(6):1692-1705.
[4] Zhao L,Xu L,Tao X,et al. Protective effect of the total flavonoids from rosa laevigata michx fruit on renal ischemia-reperfusion injury through suppression of oxidative stress and inflammation[J]. Molecules,2016,21(7):E952.
[5] Abogresha NM,Greish SM,Abdelaziz EZ,et al. Remote effect of kidney ischemia-reperfusion injury on pancreas:role of oxidative stress and mitochondrial apoptosis[J]. Arch Med Sci,2016,12(2):252-262.
[6] Hardi P,Nagy T,Fazekas G,et al. Sodium pentosan polysulfate reduced renal ischemia-reperfusion-induced oxidative stress and inflammatory responses in an experimental animal model[J]. J Vasc Res,2016,53(3/4):230-242.
[7] Geraghty P,Hardigan AA,Wallace AM,et al. The glutathione peroxidase 1-protein tyrosine phosphatase 1B-protein phosphatase 2A axis. A key determinant of airway inflammation and alveolar destruction[J]. Am J Respir Cell Mol Biol,2013,49(5):721-730.
[8] Vlahos R,Bozinovski S. Glutathione peroxidase-1 as a novel therapeutic target for COPD[J]. Redox Rep,2013,18(4):142-149.
[9] Jin L,Li D,Alesi GN,et al. Glutamate dehydrogenase 1 signals through antioxidant glutathione peroxidase 1 to regulate redoxhomeostasis and tumor growth[J]. Cancer Cell,2015,27(2):257-270.
[10] Duann P,Lianos EA,Ma J,et al. Autophagy,innate immunity and tissue repair in acute kidney injury[J]. Int J Mol Sci,2016,17(5):pii:E662.
[11] Xu Y,Hu N,Jiang W,et al. Curcumin-carrying nanoparticles prevent ischemia-reperfusion injury in human renal cells[J]. Oncotarget,2016,7(52):87390-87401.
[12] Luo D,Xu Z,Hu X,et al. URI prevents potassium dichromate-induced oxidative stress and cell death in gastric cancer cells[J]. Am J Transl Res,2016,8(12):5399-5409.
[13] Harrison-Findik DD,Lu S. The effect of alcohol and hydrogen peroxide on liver hepcidin gene expression in mice lacking antioxidant enzymes,glutathione peroxidase-1 or catalase[J]. Biomolecules,2015,5(2):793-807.
[14] Kim KS,Lee D,Song CG,et al. Reactive oxygen species-activated nanomaterials as theranostic agents[J]. Nanomedicine(Lond),2015,10(17):2709-2723.
[15] Bahinipati J,Mohapatra PC. Ischemia Modified Albumin as a Marker of Oxidative Stress in Normal Pregnancy[J]. J Clin Diagn Res,2016,10(9):BC15-17.
[16] 霍宏昌,王切,王素玲,等.大鼠肾缺血再灌注损伤模型心肌内过氧化酶Ⅲ的表达变化[J].河北医科大学学报,2016,37(10):1165-1169.
(本文编辑:许卓文)
Expression change of GPX-1 in lung of renal ischemia reperfusion injury rats
YU Guo-xia1, HUO Hong-chang1, WANG Su-ling2, WANG Qie3*
(1.DepartmentofPharmacy,MaternalandChildHealthCareHospitalofShijiazhuang050051,China; 2.DepartmentofClinicalLaboratory,HebeiBloodCenter,HebeiProvince,Shijiazhuang050071,China; 3.DepartmentofAnatomy,theSchoolofBasicMedicalSciences,HebeiMedicalUniversity,Shijiazhuang050017,China)
Objective To observe the expression change of glutathione peroxidase1(GPX-1) in lung of renal ischemia reperfusion injury(RIRI) model and to explore the role of GPX-1 in protecting lung against peroxide damage by scavenging peroxide. Methods The left renal artery of Wistar rats was clipped with non-damage vascular clamp after removing the right kidney to create RIRI model. After 24 hours of renal blood perfusion, the blood, kidney and lung were collected. The serum blood urea nitrogen(BUN) and serum creatinine(SCr) were detected with picric acid method and enzyme coupling rate method, respectively. The morphological changes of kidney was observed with HE staining, the malondialdehyde(MDA)and hydrogen peroxide(H2O2) content in lung tissue were determined by thiobarbituric acid colorimetric method and molybdate colorimetric method, respectively. The GPX-1 mRNA and protein expression were evaluated by RT-PCR and Western blotting, respectively. The correlation between MDA content, H2O2content and GPX-1 expression level was analyzed. Results Compared with the control group, the morphological structure of lung tissue of RIRI model was significantly damaged, the BUN and SCr level, the MDA and H2O2content in lung tissue of RIRI were significantly increased, mRNA and protein level of GPX-1 were also significantly enhanced. There were positive correlation between MDA and GPX-1 mRNA, between MDA and GPX-1 pretein, between H2O2and GPX-1 mRNA, between H2O2and GPX-1 pretein. Conclusion The RIRI can make lung tissue to be in oxidative stress and be subjected to peroxidative damage. GPX-1 may protect lung against peroxide damage by scavenging superoxide.
renal artery; reperfusion injury; glutathione peroxidase 1; rats
2017-02-17;
2017-03-01
河北省医学科学研究重点课题(20160088)
于国霞(1977-),女,河北石家庄人,河北省石家庄市妇幼保健院主管中药师,医学学士,从事临床药学研究。
*通讯作者。E-mail:wangqie1012@163.com
R322.121;R619.9
A
1007-3205(2017)08-0873-05
10.3969/j.issn.1007-3205.2017.08.002
