复心汤对心衰大鼠DAG-PKC信号通路的影响*
2017-08-16薛一涛刘鹏焦华琛刘广志陈
薛一涛刘 鹏焦华琛刘广志陈 炜
(1.山东中医药大学附属医院,山东 济南 250000;2.山东中医药大学,山东 济南 250000)
·研究报告·
复心汤对心衰大鼠DAG-PKC信号通路的影响*
薛一涛1刘 鹏2焦华琛1刘广志2陈 炜2
(1.山东中医药大学附属医院,山东 济南 250000;2.山东中医药大学,山东 济南 250000)
目的通过观察复心合剂对阿霉素诱导的心衰大鼠DAG/PKC信号通路表达的影响,探讨DAG/PKC信号通路与心衰的关系。方法采用阿霉素诱导建立心衰大鼠模型,造模成功后给予复心汤、卡托普利药物干预4周,比较不同组别大鼠心肌细胞内DAG、PKC的表达量。结果心衰大鼠心肌细胞中DAG、PKC表达量增高;复心汤能够降低心衰心肌细胞中DAG、PKC表达量。结论复心汤能够改善心衰大鼠一般状态,抑制心衰心肌细胞中DAG/PKC信号通路的过度表达。
复心汤 DAG PKC 心衰
心力衰竭是指各种病理因素导致各种心脏结构改变或功能障碍,出现心脏充盈及(或)射血功能受损而引起的一组临床综合征[1-4]。有研究表明蛋白激酶C(PKC)存在于心脏所有的细胞内[5],当发生心衰时,不同亚型的PKC表达提高,引起心肌细胞的肥大。临床已证明复心汤能够改善患者心衰症状[6]。本文旨在通过探讨复心汤是否通过影响DAG-PKC信号通路来改善心衰,推进心衰功能障碍机理的研究,开辟治疗心衰的一条新路。
1 材料和方法
1.1 实验动物 SPF级健康雄性Wistar大鼠75只,体质量180~220 g。实验动物购于山东大学实验动物中心,实验动物许可证号:Scxk(鲁)20130009。饲养于温度湿度恒定、人工光照明暗各12 h的清洁级动物饲养室内,标准饲料和无菌水自由饮食。
1.2 试药与仪器 1)药物:复心合剂(由山东中医药大学附属医院药剂科提供,配制批号:20130509,规格:250 mL/瓶。组成:制附子30 g,仙灵脾30 g,葶苈子30 g,泽泻20 g,当归15 g,黄柏15 g)、盐酸阿霉素(上海华蓝生物科技有限公司;规格:100mg/瓶;产品批号:25316-40-9)、卡托普利片(中美上海施贵制药有限公司;规格:12.5 mg×20片/盒;批准文号:国药准字H31022986)、0.9%氯化钠注射液(山东洁晶药业有限公司;规格:500mL/瓶;批准文号:国药准字H37021260)。2)试剂:TRIZOL RNA试剂盒(北京康为世纪生物科技有限公司)、大鼠脑钠肽(BNP)ELISA检测试剂盒(上海研吉生物科技有限公司)、2x Taq Master Mix(北京康为世纪生物科技有限公司)、Oligo dT、RNA酶抑制剂、dNTP、M-MLV[均购自普洛麦格(北京)生物技术有限公司],RNA抑制剂、Taq酶、5×RT buffer(均购自上海生工生物有限公司),琼脂糖:美国Promaga公司。其余试剂均由山东省中医院中心实验室提供。3)主要仪器:MP200-I型电子天平(上海第二天平仪器厂),紫外分光光度仪(ND-1000,型号JCS0112,Gene Company,美国),PCR扩增仪 (T-Gradient,Biometra,Germany),凝胶成象分析系统 (Alpha 2200,美国),MICROMAX RF型高速低温离心机(Thermo IEC美国),725型超低温冰箱 (Thermo Forma美国),ULTRA-TURRAX匀浆机T-25 basic型(德国IKA公司)。SW-CJ-1F型超净工作台(苏州安泰技术有限公司)。
1.3 分组与造模 1)实验分组:健康成年Wistar雄性大鼠75只,按随机数字表法分为空白组、卡托普利组、模型组、复心合剂低剂量组、复心合剂高剂量组,其中空白组11只,其余各组各16只。2)模型制备:采用腹腔注射阿霉素诱导大鼠心衰的造模方法复制动物模型。模型制备开始前,配置于实验开始后取Wistar大鼠分别称质量,配制浓度为1 mg/mL的阿霉素溶液备用。实验组按3mg/(kg·d)的剂量腹膜内注射阿霉素溶液,每周1次,共6周,累计总量为18mg/kg。空白组给予腹腔内注射与阿霉素等体积的生理盐水,每周1次,共6周,实验周期及注射次数同各实验组。实验第6周给药后随机选取空白对照组与模型组大鼠各5只,麻醉后取腹主动脉血液,测BNP,进行统计学评价,模型组与空白对照组相比有统计学意义者为造模成功。3)药物干预:将卡托普利100mg粉碎,过200目筛,溶于160mL生理盐水中备用。各组于最后一次阿霉素注射24 g后开始灌胃,空白组和模型组每天上午给予同体积比生理盐水2mL/次灌胃;复心合剂低剂量组每天按4mL/kg剂量给予复心合剂灌胃;复心合剂,高剂量组每天按6mL/kg灌胃给予复心合剂灌胃;卡托普利组给予卡托普利6.25mg/kg的剂量开始灌胃。各组干预4周。
1.4 观察指标及测定方法 1)大鼠行为体征及死亡情况的观察:密切观察大鼠的一般情况,包括进食水量、体质量、呼吸、活动情况、精神状态、大小便、外观毛色、爪甲口唇、有无血性分泌物等,同时统计大鼠的死亡情况。2)血浆BNP的测定:药物干预6周实验结束后,各组实验动物于最后一次给药禁食12 h后,分别于模型组、对照组随机取5只大鼠,腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉,剖开腹腔,于腹主动脉取血,放置离心机(3000 r/min)离心15min,测BNP水平,用SPSS17.0进行t检验,模型组与对照组相比较有统计学意义为造模成功。3)RT-PCR法检测心肌细胞中DAG-βmRNA、PKC-αmRNA、PKC-εmRNA表达量。(1)RNA提取与分析:采用TRizol一步法提取组织总RNA,ND-1000分光光度计检测A260/A280比值,验证RNA纯度和浓度。(2)RTRT反应体系为:采用oligo dT为RT反应引物,总反应体系为60μL,包括4μg的总RNA,5×RT buffer 12μL、RNA酶抑制剂120 U,10mM dNTP 6μL,M-MLV 600U,DEPC水调总体积至60μL,70℃5min,37℃5min,42℃,1 h,70℃,10min。(3)引物均由上海博尚生物技术有限公司设计与合成(详见表1)。(4)PCR扩增:PCR总反应体积25μL,包括2x Taq MasterMix 12.5μL,cDNA 4μL,目的基因上下游引物(10μM)各1μL,补DEPC水至25μL,进行PCR扩增。循环参数:94℃预变性5min,94℃1min,58~60℃1 min,72℃1 min,2630个循环后,72℃延长10min。(5)目的基因表达水平分析:PCR产物经1.5%琼脂糖凝胶电泳,后Alpha凝胶成像分析,计算条带灰度值反应表达情况。系统分析图像:以GAPDH为内参照,计算各基因与同步GAPDH灰度值的比值作为相对表达量,比值越大,表达水平越高,反之则越低。
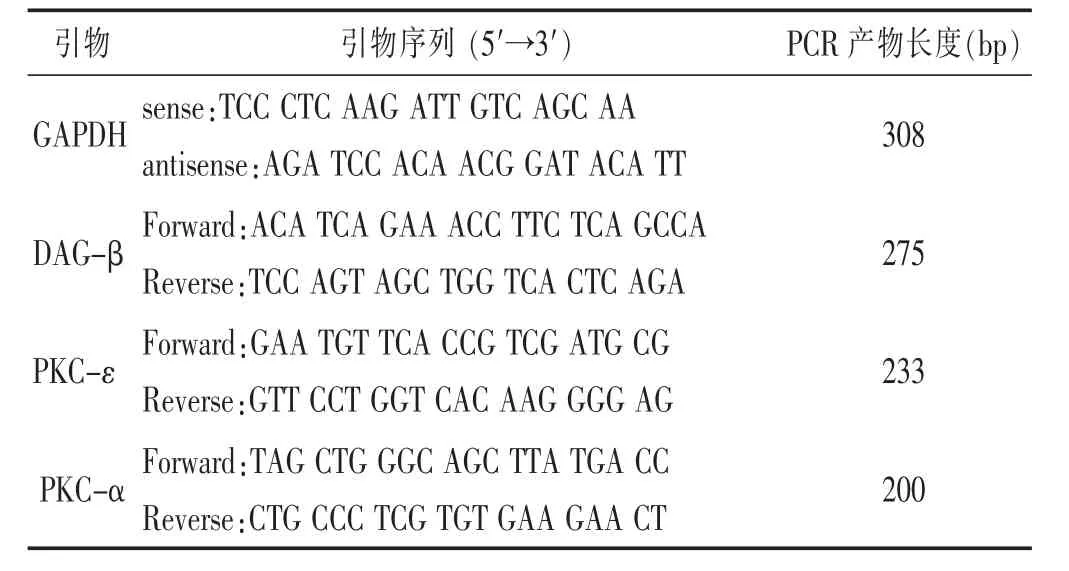
表1 引物序列及PCR产物长度
1.5 统计学处理 应用SPSS17.0统计软件。计量资料以(±s)表示,多组间比较采用完全随机设计的单因素方差分析(One-Way-ANOVA),组间两两比较采用SNK检验。P<0.05为差异有统计学意义。
2 结 果
2.1 实验动物一般状态观察 造模过程中,与空白组比较,实验组大鼠全部出现体质量增长缓慢,一般状态差,精神萎靡,活动量减少,进食进水量减少,蜷卧,呼吸急促,口周及鼻腔可见少量出血,背毛发黄,皮毛稀疏,大便稀薄,造模过程中高剂量组死亡1只。6周后药物干预阶段,模型组大鼠一般状态进行性下降,死亡3只;复心合剂组与卡托普利组大鼠精神状态较模型组改善,低剂量组死亡1只。对死亡大鼠尸体解剖发现死亡大鼠存在胸腔、腹腔积液,肝脾肿大。
2.2 造模BNP评价 见表2。药物干预6周后,测定模型组大鼠血浆BNP水平明显显著高于空白对照组,差异具有统计学意义(P<0.01)。
表2 两组大鼠血浆BNP水平比较(±s)
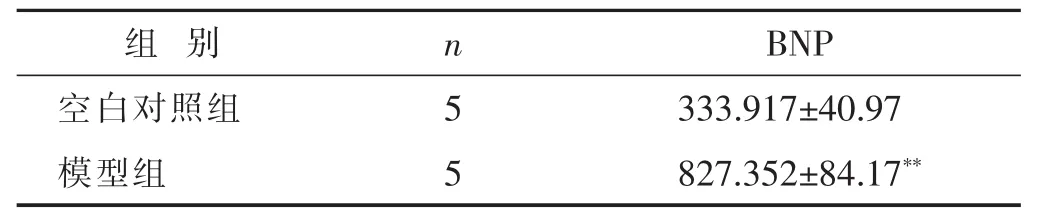
表2 两组大鼠血浆BNP水平比较(±s)
与空白对照组比较,*P<0.05,**P<0.01。
组别 n BNP空白对照组 5333.917±40.97模型组 5827.352±84.17**
2.3 各组大鼠心肌细胞中DAG-β、PKC-α、PKC-εmRNA表达量 见表3和图1。实验中未在心肌组织中未检测到PKC-αmRNA的表达。与空白对照组比较,模型组大鼠心肌细胞中DAG-βmRNA、PKC-ε mRNA表达量明显增高,差异具有统计学意义 (P<0.01)。与模型组比较,复心合剂高剂量组、卡托普利组、复心合剂低剂量组大鼠心肌细胞中DAG-βmRNA、PKC-εmRNA表达量明显降低(均P<0.01)。复心合剂高剂量组与卡托普利组比较,大鼠心肌细胞中DAG-βmRNA、PKC-εmRNA表达量均未见明显变化,差异无统计学意义(P>0.05);复心合剂高剂量组与低剂量组比较,大鼠心肌细胞中DAG-βmRNA、PKC-εmRNA表达量有显著差异(P<0.01)。复心合剂低剂量组大鼠心肌细胞中DAG-βmRNA、PKC-ε mRNA表达量明显高于卡托普利组(P<0.01)。
表3 各组大鼠心肌细胞中DAG-β、PKC-ε相对表达量比较(±s)

表3 各组大鼠心肌细胞中DAG-β、PKC-ε相对表达量比较(±s)
与模型组比较,*P<0.01;与卡托普利组比较,◇P<0.01;与复心合剂低剂量组比较,▽P<0.01。
组 别 n DAG-β相对表达量 PKC-ε相对表达量空白对照组 10 0.357±0.0168*0.549±0.032*模型组 10 0.409±0.035 0.749±0.054复心合剂高剂量组 10 0.358±0.019▽0.535±0.031*▽复心合剂低剂量组 10 0.389±0.015*◇0.614±0.019*◇卡托普利组 10 0.354±0.023*0.520±0.021*
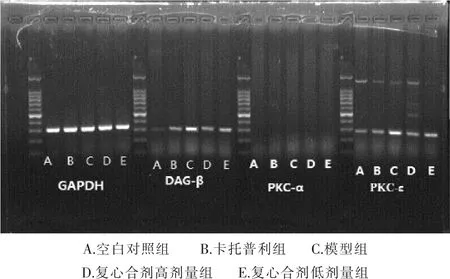
图1 RT-PCR分析DAG-β、PKC-ε在心衰大鼠心肌中的表达
3 讨 论
在心脏所有细胞中都有PKC的存在,在成人心肌中可以检测到9种PKC异构体,在成年大鼠心肌中大约有10种PKC异构体表达,其中75%是cPKC。cPKC主要存在于膜、胞浆和核-细胞骨架3部分。在正常成熟鼠心中证实存在ɑ、δ、ε-PKC,ξPKC只存在于非肌细胞中[7],β-PKC是否存在尚有争论。与新生鼠比较,成年鼠心中α、δ-PKC表达都有所降低,但ε-PKC无明显变化。α-PKC存在于膜、胞浆和核-细胞骨架,δ-PKC只存在于核细胞骨架部分。ε-PKC存在于所有3个部分。与正常心肌细胞比较,心衰肌细胞中PKC的活性明显增加[8]。不同的心衰类型,PKC通路发生不同的作用,研究显示在充血性心力衰竭中,分布在膜、核-细胞骨架部分的主要表现为ε、β1和β2-PKC活性明显增加[9]。在扩张性心肌病和缺血性心肌病引起的导致的心衰中,α、β1和β2-PKC活性提高更明显 ,ε-PKC未见明显改变[10]。过去普遍认为ε-PKC被认为参与在心肌缺血预处理过程中具有心肌保护作用的调节。然而,最近研究表明ε-PKC还参与了心室增厚与心衰的发病过程[11-12]。在本次实验中,空白组及实验各组中都未检测到α-PKCmRNA的表达,可能为成年Wister雄性大鼠心肌组织中无α-PKC。模型组与空白组比较,大鼠心衰症状较重,心肌细胞中DAG-βmRNA、PKC-εmRNA表达量显著增高,表明在心肌细胞衰亡过程DAG/PKC信号通路过度激活,与众多学者研究结果相符。
在心衰与肥大心肌细胞中PKC过度表达,激活转录基因,细胞内蛋白合成量都增加[13],但在肥大心肌细胞中以收缩蛋白为主[14],在发生衰竭的心肌细胞中合成的蛋白以结构蛋白为主[15]。本实验中笔者观察到:模型组大鼠心肌组织中DAG-βmRNA、PKC-εmRNA表达量明显高于其余各组(P<0.01),说明在心肌细胞发生衰亡的过程中DAG/PKC信号通路处于过度激活状态。复心汤高低剂量组与卡托普利组大鼠心肌细胞中DAG-βmRNA、PKC-εmRNA表达量较模型组有明显减低(均P<0.01),表明复心汤及卡托普利能够抑制心衰细胞中DAG/PKC信号通路的表达,来发挥抗心力衰竭的作用,其中高剂量组与低剂量组在抑制该通路表达方面差异存在统计学意义(P<0.01),提示在一定剂量范围内,复心合剂在抑制DAG-PKC信号通路的表达方面呈现剂量依赖性,剂量越高疗效越好。复心合剂高剂量组与卡托普利组在抑制PKC表达方面未见明显差异(P>0.05),前期已有学者研究发现ACEI能够降低PKC-ε表达,提示复心合剂高剂量在改善心衰,抑制心室肥厚,改善心衰心室重构的某些方面与卡托普利具有等同效果。
[1] 周岩,孙兰军,徐强.慢性心力衰竭大鼠模型研究进展[J].辽宁中医杂志,2014,41(8):18.
[2] 林鑫.复心汤对心衰大鼠模型TNF-а及心肌细胞凋亡的影响[D].济南:山东中医药大学,2012.
[3] 张然.PKC调节心肌细胞无负荷收缩功能[D].西安:第四军医大学,2005.
[4] 中华医学会心血管分会,中华心血管病杂志编辑委员会.中国心力衰竭(心衰)诊断和治疗指南[J].中华心血管病杂志,2014,42(2):98-122.
[5] Azzi A,Boscoboinik D,Hensey C.The protein kinase C family[J].Eur JBiochem,1992,208(3):547-557.
[6] 薛一涛,焦华琛,刘鹏.中医药调控心衰细胞PKC信号通路的现状及思考[J].中国中医急症,2016,25(12):2298-2300,2307.
[7] Vitalyi 0,Peter MB,Susan FS.PKC-λis the atypical protein kinase C isoform[J].Expressed by immature ventricle.Am J physiol,1997,4(2):H1636.
[8] 陈文政.蛋白激酶C(PKC)与心衰[J].解剖科学进展,2001,7(2):141.
[9] Gu X,Sanford PB.Increased protein kinase Cand isozyme redistribution in pressure-oberbad cardiac hypertrophy in the rat[J].Circ Res,1994(75):926.
[10]Nancy B,Richard A,Walsh MDD,etal.Increased protein kinase C activity and expression of Ca2+-senditive isoforms in failing human heart[J].Circulation,1999,26(3):384.
[11]Inagaki K,Iwanaga Y,Sarai N,et al.Tissue an giotensin II during progression or ventricular hypertrophy to heart failure in hypertensive rats;differential effects on PKC epsilon and PKCbeta[J].JMelCellCardiol,2002,34(10):1377-1385.
[12]高玖鸣.腺病毒介导的心肌蛋白激酶Cε基因转移导致心肌损害[J].生物医学工程与临床,2006,10(4):249.
[13]Liu Q,Chen X,Macdonnell SM,etal.Protein kinase Cα,but not PKCβor PKCγ,regulates contractility and heart failure susceptibility:implications for ruboxistaurin asa novel therapeutic approach[J].Circ Res,2009,105(2):194-200.
[14]王云英.蛋白激酶C对自发性高血压大鼠肥大心肌细胞无负荷收缩功能的调节[J].生理学报2008,60(2):197-204.
[15]SabriA,Steinberg SF.Protein kinase C isoform-selective signals that lead to cardiac hypertrophy and the progression of heart failure[J].MolCellBiochem,2003,251(1-2):97-101.
E ffect of Fuxin Decoction on DAG-PKC Signaling Pathway in Rats w ith Heart Failure
XUE Yitao,LIUPeng,JIAOHuachen,etal. Affiliated Hospitalof Shandong University of TraditionalChineseMedicine,Shandong,Jinan 250000,China.
Objective:To investigate the relationship between DAG/PKC signaling pathway and heart failure by observing the effectof Fuxin Decoction on the expression ofDAG/PKC signaling pathway in ratswith Adriamycin induced heart failure.M ethods:Themodel of rats with heart failure was induced by Adriamycin.After successful modeling,the ratswere treated with Fuxin Decoction and captopril for4 weeks.The expressions of DAG and PKC in themyocardial cells of differentgroupswere compared.Results:The expression of DAG and PKC in cardiacmyocytes increased in heart failure rats.Fuxin Decoction could reduce the expression of DAG and PKC in heart failure heartmuscle cells.Conclusion:Fuxin Decoction can improve the general state of ratswith heart failure and inhibit the overexpression ofDAG/PKC signaling pathway in heart failure cells.
Fuxin Decoction;DAG;PKC;Heart failure
R285.5
A
1004-745X(2017)07-1141-04
10.3969/j.issn.1004-745X.2017.07.004
2017-04-11)
国家自然科学基金 (81273703)
