昆虫细胞凋亡的线粒体通路研究进展
2017-08-13任小双张兰张燕宁
任小双 张兰 张燕宁
摘要 介绍了哺乳动物和一些代表昆虫的线粒体凋亡途径研究进展,特别是与线粒体途径密切相关的凋亡调控因子,如细胞色素C,caspases家族,Bcl-2家族等的功能作用,阐述了线粒体在昆虫细胞凋亡中的作用,为进一步研究昆虫细胞凋亡机制以及发展以昆虫细胞凋亡因子为靶标的特异性杀虫剂提供理论基础。
关键词 昆虫;细胞凋亡;线粒体;细胞色素C;胱天蛋白酶;Bcl-2家族
中图分类号 Q962 文献标识码 A 文章编号 0517-6611(2017)03-0167-04
Abstract We introduced the research progress of mitochondria apoptosis pathways in some representative insects and mammals, especially apoptosis regulatory factors closely related to mitochondrial pathway, such as cytochrome C, caspases family, Bcl2 family. The role of mitochondria in insects cell apoptosis was elaborated, so as to provide theoretical basis for studing apoptosis mechanism in insect cells and developing the apoptosis factor as the specific target of pesticides.
Key words Insects;Cell apoptosis;Mitochondria;Cytochrome C;Caspases;Bcl2 family
细胞凋亡(apoptosis)是受一系列基因严格调控、按照特定规律和程序进行的一种主动死亡方式,也可称作细胞程序性死亡(programmed cell death,PCD),Kerr等[1]于1972年首次提出这一概念。凋亡与增殖、分化共同调控机体的稳定,除了维持自身代谢需要、主动去除多余的或不需要的细胞外,还在抑制和治疗癌症方面发挥着重要作用。细胞对外界刺激很敏感,如化学药物、紫外线等都可诱导凋亡发生[2-3],而凋亡途径一旦紊乱,则会导致疾病发生,如癌症等[4-5]。
细胞凋亡的信号转导机制十分复杂,研究主要集中在哺乳动物、果蝇(Drosophila melanogaster)和线虫(Caenorhabditis elegans)等中。线虫细胞凋亡通路比较简单,而在哺乳动物中至少存在3条信号转导通路,即线粒体通路,也称为线粒体内途径(mitochondria mediated apoptosis pathway)、死亡受体通路(death receptor pathway,即外途径)和内质网通路(endoplasmic reticulum associated death)[6]。线粒体通路是细胞凋亡最经典的通路。线粒体接收到凋亡信号后,跨膜电位下降,线粒体膜通透化,释放膜间隙蛋白如线粒体促凋亡蛋白(second mitochondria-derived activator of caspases,Smac)、细胞色素C等到胞质中,激活胱天蛋白酶(caspases),或独立破坏染色质,引发细胞凋亡[7]。该通路主要包括线粒体外膜通透性,线粒体膜电位的改变,B细胞淋巴瘤2家族蛋白(Bcell lymphoma 2 family proteins, Bcl2)的参与,ROS(reactive oxygen species)的产生,氧化磷酸化失偶联,ATP合成减少等至关重要凋亡现象。
1 昆虫细胞凋亡概述
昆虫是生物界种类最多、数量最大的类群,但对其凋亡机理的研究还较少。近年来昆虫细胞培养技术不断发展,国内外陆续出现了一些关于昆虫细胞凋亡通路的研究,研究结果表明昆虫细胞凋亡途径有3条:①与哺乳动物细胞凋亡途径类似,即依赖细胞色素C的释放和caspases活化的凋亡途径;②与线虫细胞的凋亡途径类似,即细胞凋亡不依赖于细胞色素C的释放;③不依赖于caspases的凋亡途径[8]。在昆虫中,关于双翅目昆虫果蝇凋亡机制的研究较多,对于细胞色素C是否从线粒体释放到细胞质中这一过程和线粒体外膜通透化与否仍存在争议[9]。其次,昆虫中研究较多的是鳞翅目昆虫,一些研究表明其细胞凋亡过程依赖于细胞色素C,凋亡中出现线粒体膜电位、线粒体结构及线粒体膜通透性的改变,即鳞翅目昆虫细胞凋亡途径更类似于哺乳动物细胞凋亡的線粒体通路[10]。
线粒体在昆虫细胞凋亡中扮演着至关重要的作用[11]。通过比较哺乳动物和昆虫细胞在凋亡过程中的几个重要节点,并总结昆虫线粒体通路的一些研究进展,有助于阐释线粒体在昆虫细胞凋亡中的作用,以期为深入研究一些杀虫药剂的杀虫机理和抗癌药物的开发提供依据。
2 线粒体与昆虫细胞凋亡
线粒体作为细胞的能量工厂,是真核细胞生存所必需的。在凋亡发生过程中,线粒体不仅是促凋亡蛋白和抑凋亡蛋白相互作用决定细胞命运的位点,还是激活caspases的起源[12]。线粒体是一个由双层膜组成的囊状结构,内外膜通透性不同,内膜上存在一些载体蛋白或通道,可以选择性地通过一些物质。细胞接收到凋亡信号后刺激多种促凋亡蛋白转移至线粒体,继而破坏线粒体膜的通透性和完整性,Bcl-2家族蛋白调节此过程[13]。线粒体膜通透化导致多种凋亡诱导因子或蛋白从线粒体释放到胞质,如细胞色素C、内切核酸酶(EndoG),继而引起典型的凋亡变化[14]。同时,线粒体肿胀突起、线粒体脊消失等形态动力学改变是细胞凋亡的重要特征。在哺乳动物、果蠅及一些鳞翅目昆虫细胞凋亡的过程中都可以观察到线粒体形态的动态变化[15,16] 。
2.1 细胞色素C
细胞色素C存在于线粒体内膜上,作为呼吸链的重要一员,影响ATP的产生。在哺乳动物细胞中,细胞色素C从线粒体释放到胞质中是起始凋亡途径的关键一步,被认为是线粒体凋亡途径的重要标志[17]。细胞色素C从线粒体释放到胞质后可以与凋亡蛋白酶激活因子结合,形成凋亡小体,促进caspases-9前体的自身活化,活化的caspases-9前体激活caspases-3效应蛋白,导致细胞凋亡[8]。
早期的研究显示果蝇细胞凋亡途径缺乏线粒体因子的参与,在大多数果蝇细胞系如S2和BG2的凋亡过程中没有检测到细胞色素C的释放[18]。但在果蝇视黄醛细胞和分化的精细胞凋亡过程中有细胞色素C的参与,在果蝇的SL-2细胞凋亡过程中也检测到细胞色素C的释放[18]。在果蝇中目前发现了2个高度同源的细胞色素C基因:Cyt c-p和Cyt c-d,二者均编码产生15 ku左右的水溶性蛋白(DC-4和DC-3),正常状态下位于线粒体内膜上并参与电子传递[19]。因此,在果蝇中,细胞色素C并不参与所有细胞的凋亡过程,具有细胞类型依赖性。一些学者认为果蝇细胞凋亡中caspases 的活化在进化上是一种更为原始的机制[9,20]。
在鳞翅目昆虫中,目前研究表明细胞色素C在线粒体途径中的作用和功能与哺乳动物相似。研究者鉴定了细胞色素C在鳞翅目草地贪夜蛾(Spodoptera frugiperda)Sf9细胞凋亡中的重要作用并证实了细胞色素C释放依赖于线粒体通透性转运孔(mitochondria permeability transition pore,MPTP)[21]。王文祥等[22]研究结果显示喜树碱(CPT)诱导Sf9细胞凋亡后,线粒体膜上的细胞色素C向细胞质中释放,同时胞内Sf-caspase-1被激活。Pan等[23]证实线粒体参与羟基喜树碱诱导的家蚕(Bombyx mori Linnaeus)BmN-SWU1细胞凋亡,线粒体通透性转换孔被开放,释放细胞色素C,继而激活caspase-9和caspase-3,具有时间和浓度依赖性。Zhang等[24]在研究喜树碱的杀虫活性机制中发现其可以诱导甜菜夜蛾(Spodoptera exigua Hiibner)中肠脂肪体细胞凋亡,且凋亡过程中伴随有细胞色素C的释放和caspases的激活,证实了喜树碱诱导的凋亡可能依赖于细胞色素C介导的线粒体内途径。
目前,对细胞色素C的释放机制还不清楚。在哺乳动物中,细胞色素C 被释放的途径可能有3 种:①借助线粒体膜通透性转运孔释放到胞浆,并受Ca2+浓度的调节[25];②线粒体外膜存在细胞色素C 的特定通道,待信号刺激时会开放;③K+的堆积可能引起线粒体的肿胀甚至外膜破裂,最终导致细胞色素C的释放[26]。家蚕细胞色素C依赖的凋亡途径中,Bmp53的表达升高可能有助于细胞色素C的释放,但家蚕细胞色素C是如何释放的还不清楚[27]。
2.2 胱天蛋白酶(caspases)家族
胱天蛋白酶是细胞凋亡的中枢效应器,在细胞凋亡的启动及进程中发挥着关键的作用。胱天蛋白酶家族成员通过对凋亡信号的募集、传递和执行,完成胱天蛋白酶成员之间的级联反应,推动细胞凋亡进程[28]。胱天蛋白酶酶原由1个大亚基(p20),小亚基(p10)和N端前域组成。通常,胱天蛋白酶以无活性的酶原形式存在,在凋亡过程中通过大、小亚基和N端前域的断裂,形成具有2个大亚基和2个小亚基的四聚体——具有2个活性中心的成熟的胱天蛋白酶。 胱天蛋白酶活性中心由1个保守的组氨酸-半胱氨酸组件和1个大的能够容纳底物P4-P1残基的具有延展性构象的口袋组成。胱天蛋白酶酶原的激活是凋亡过程的关键步骤,无论何种凋亡途径,最后都有caspases 的激活,但在没有caspases的情况下凋亡仍可以发生[29]。
在哺乳动物中,目前已鉴定出18种caspases 家族成员[30],参与凋亡的有caspase-2、caspase-3、caspase-4、caspase-6、caspase-7、caspase-8、caspase-9和caspase-10。其中可以分为上游的启动caspases,包括caspase-8、9和10,以及下游的执行caspases,包括caspase-3 和7,除此之外,caspase-6具有起始胱天蛋白酶的长N端前域,而在序列和功能上更接近于执行胱天蛋白酶[31]。caspases 家族作为线粒体内途径的核心组分,凋亡发生时,细胞色素C一旦释放到胞质,与Apaf-1结合形成复合体,随后诱导构象变化,促进这个复合体与caspase-9 前体procaspases-9和dATP的结合,继而导致一系列的胱天蛋白酶激活[32],caspases 被激活以后可以降解細胞骨架蛋白actin等,最终导致细胞死亡。
目前在果蝇中已经鉴定出7 种caspases成员[33],包括含长结构域的Dronc,Dredd,strica和短结构域的Decay,Damm,Drice 和Dcp-1。Drice,Dcp-1 和 Decay 与哺乳动物的caspases-3有高度的同源性[34]。而Dronc是一个与线虫CED-3或人类caspases-9类似的caspases,Dronc结合 Apaf-1/CED-4类似蛋白Dark,Dark被激活后反过来激活效应caspases[27]。果蝇细胞凋亡过程中存在依赖胱天蛋白酶活化(内途径)或不依赖胱天蛋白酶活化(外途径)2种凋亡形式。2006年研究人员发现Dronc和Drice是果蝇细胞凋亡所必需的胱天蛋白酶[35-36]。果蝇细胞接收到凋亡刺激信号后,起始胱天蛋白酶Dronc酶原可以自身活化,接着激活效应胱天蛋白酶Drice,这个过程没有细胞色素C的释放。活化的Dronc和Drice 形成类似于凋亡小体的聚合物[19]。但在某些细胞类型中,缺乏Dronc和Drice時,细胞凋亡也可发生,表明在昆虫细胞死亡系统中已建立多条凋亡通路[37]。
家蚕作为研究细胞凋亡机制的模式昆虫,与棉铃虫(Helicoverpa armigera)、草地贪夜蛾等鳞翅目昆虫的caspases家族序列之间具有高度的保守性。2011年,研究人员克隆出家蚕的起始caspases(BmDronc)序列,它具有募集结构域(CARD),其功能与哺乳动物的caspases-9类似,具有促凋亡作用[38]。家蚕的caspases家族成员BmlCE,BmlCE-2和BmlCE-5陆续被鉴定出来,但功能尚不清楚[39]。2014年,Yi 等[11]报道BmICE-2可能具有caspases-9的活性并可以促进家蚕BmN-SWU1细胞凋亡。
2.3 Bcl-2家族
B细胞淋巴瘤2蛋白(B-cell lymphoma 2 family proteins,Bcl-2)家族是细胞凋亡过程中一类关键的蛋白,调控线粒体膜通透性和细胞色素C释放等。Bcl-2家族蛋白可以分为促凋亡蛋白和抑凋亡蛋白,大多数细胞同时表达多种Bcl-2家族蛋白[40]。促凋亡蛋白可分为效应蛋白(effector protein)和BH3 蛋白-only(BH3-only protein)。效应蛋白包括BAX 和BAK,一旦被激活,二者就在线粒体外膜(mitochondrial outer membrane,MOM)内寡聚体化形成蛋白脂小孔,从而促进线粒体外膜小孔(mitochondrial outer membrane pore,MOMP)的形成。BH3-only 蛋白(BID 和BIM)可促进BAK 和BAX 寡聚体化及细胞色素C 的释放[41]。抑凋亡BcL-2 蛋白含有4 个同源结构域(BH1、BH2、BH3、BH4),主要成员包括A1、Bcl-2、Bcl-w、Bcl-xL、MCL-1,它们主要通过直接抑制促凋亡Bcl-2 蛋白(Bak和Bax)来保持线粒体外膜的完整性。
在哺乳动物中,Bcl-2家族蛋白调控线粒体的动态变化和凋亡的起始过程[42]。许多研究表明,细胞接收到凋亡信号后,Bcl-2蛋白家族的某些蛋白从胞质转移到线粒体外膜,进而产生线粒体跨膜电位。Bcl-2 家族蛋白能与其他孔蛋白相互作用,在线粒体膜上形成一个高运输无选择性的、跨线粒体外膜和内膜的通道-线粒体通透性转换孔(permeability transition pore,PTP)[21]。PTP 形成以后,大量Ca2+涌入到胞质中,胞质和线粒体基质间的化学平衡被打破,引发线粒体内膜膨胀,反过来引起更多PTP 的開放,最终导致线粒体内膜的破裂,凋亡诱导因子(AIF)、细胞色素C和胱冬肽酶原等释放到胞液中。
目前在果蝇体内鉴定出2个Bcl-2 家族蛋白,分别是促凋亡蛋白Debcl和抑凋亡蛋白Buffy,其中Debcl与哺乳动物促凋亡蛋白Bok/Mtd同源性最高。 Buffy和Debcl都包含BH1、BH2、BH3结构域和Bcl-2家族蛋白的碳端跨膜结构域,Debcl 定位于线粒体,而Buffy定位于内质网[43]。在外部环境的刺激下,Debcl和Buffy的突变体都参与调控细胞凋亡,Debcl具有促凋亡作用,而Buffy是表现促凋亡还是抑凋亡活性视具体情况而定[15]。Richardson等[34]证实Buffy在体内是1个抗凋亡Bcl-2家族成员,且与哺乳动物Bcl-2在抑制细胞周期上高度保守。之后报道表明Buffy可以启动Grim依赖的细胞死亡,首次证实Buffy参与调控发育性PCD过程,且起促凋亡作用。因此Bcl-2家族中的促凋亡或抑凋亡成员是否具有双重作用,还需要进一步确定[44]。
在家蚕中,目前只有2个Bcl-2家族基因被克隆和鉴定,即Bm109和BmBuffy。 BmBuffy全长1 632 bp,编码292个氨基酸,含有BH1、BH2、BH3结构域。系统进化树分析结果显示,BmBuffy与昆虫中意蜂(Apis mellifera)和果蝇的Buffy亲缘关系最近,与哺乳动物Bok基因聚为一类,并证实了Bmbuffy是Bcl-2家族蛋白Bak的同系物,且其可抑制羟基喜树碱诱导的家蚕细胞凋亡[45]。BmBuffy的过表达抑制了细胞色素C的释放和caspases-3的活化,从而抑制凋亡,沉默BmBuffy的RNA反而促进凋亡[46]。
2.4 凋亡抑制因子(inhibitor of apoptosis proteins,IAPs)
凋亡抑制因子广泛存在于线虫、昆虫及哺乳动物中,在进化上具有保守性。目前,在哺乳动物中已发现8个IAPs家族成员,包括细胞凋亡抑制因子1和2(cellular IAP1 和cellular IAP2,cIAP1和cIAP2),神经元凋亡抑制因子(neuronal apoptosis inhibitor protein,NAIP),Survivin,黑色素瘤凋亡抑制蛋白(melanoma-IAP,ML-IAP/Livin)、睾丸特异凋亡抑制蛋白(hILP)、X染色体连锁凋亡抑制因子(X-linked IAP,XIAP)以及含泛素连接酶的杆状病毒IAP重复序列(分别由BIRC1-8基因编码),每个IAPs家族成员在结构上至少含有1个杆状病毒IAP重复(baculovirus IAP repeat,BIR)结构域,一些家族成员含有多个BIR结构域[47]。目前对细胞凋亡因子cIAP1、cIAP2以及X染色体连锁凋亡抑制因子XIAP研究比较多,其在结构上除了每个IAP都含有3个BIR结构域外,还包括RING结构域,具有E3泛素连接酶活性。XIAP是典型的IAP蛋白,通过直接与caspases结合从而抑制其活性,比如caspase-3,-7和-9,因此,IAP蛋白也被认为是细胞凋亡的直接抑制剂。事实上,IAP蛋白主要通過阻止胱天蛋白酶活化或者与促凋亡信号中间产物相互作用而对凋亡过程进行调控[48]。
在果蝇中,其凋亡抑制蛋白(drosophila apoptosis inhibiting Protein,DIAP1)包含2个BIR结构域,用以结合caspase或促凋亡因子,结构域RING能够对DIAP1本身或者通过BIR结构域结合的caspase或促凋亡因子进行泛素化修饰[49]。如Steller[50]研究证实果蝇DIAP1对胱天蛋白酶Dronc进行泛素化修饰,阻止Dronc激活下游的效应胱天蛋白酶,阻止细胞凋亡的发生。
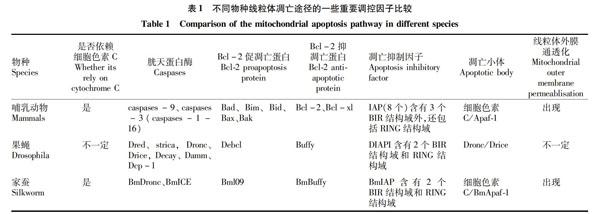
在其他昆虫中,Huang等[51]从家蚕BmN细胞中克隆了IAP的同源物BmIAP,其在结构上包括2个BIR结构域和1个RING结构域,并证实草地贪夜蛾Sf-21细胞的凋亡同时需要BIR和RING结构域,BmIAP能够抑制Bax诱导的哺乳动物HEK293细胞凋亡,但对Fas诱导的凋亡没有作用。表1为不同物种线粒体凋亡途径的一些重要调控因子的比较[50,52]。
3 展望
关于细胞凋亡机制的研究大多是以哺乳动物为载体,而对昆虫凋亡的研究较少。通过对哺乳动物、果蝇和家蚕等鳞翅目昆虫凋亡途径的比较,可以发现凋亡机制在不同的生物种类中具有一定的保守性。线粒体凋亡途径存在于哺乳动物和大部分昆虫中,在哺乳动物和昆虫等细胞凋亡的过程中都发挥着重要作用。大量研究表明,线粒体途径是细胞凋亡信号转导的核心途径。但其调控机制在昆虫与哺乳动物之间,甚至在不同类属昆虫之间都存在差异。目前昆虫细胞凋亡的信号传导通路研究还不是很深入,尤其是在分子水平层面的研究匮乏,为了更好地阐释这一复杂的凋亡机制以及线粒体途径对昆虫细胞的调控机理,还需要进行更多生物化学和基因水平的研究分析,进而明确线粒体在昆虫细胞凋亡中的作用,了解线粒体的昆虫毒理学意义,也为进一步进行杀虫剂诱导昆虫死亡的机理研究,开发新的有活性的药剂提供理论指导。
参考文献
[1] KERR J F,WYLLIE A H,CURRIE A R.Apoptosis:A basic biological phenomenon with wideranging implications in tissue kinetics[J].Br J Canc,1972,26(4):239-257.
[2] ZHANG B Y,XU Z P,ZHANG Y X,et al.Fipronil induces apoptosis through caspasedependent mitochondrial pathways in Drosophila S2 cells[J].Pesticide biochemistry and physiology,2015,119(1):81-89.
[3] CHANDNA S,SUMAN S,CHANDNA M,et al.Radioresistant Sf9 insect cells undergo an atypical form of Baxdependent apoptosis at very high doses of γradiation[J].International journal of radiation biology,2013,89(12):1017-1027.
[4] 鐘國华,水克娟,吕朝军,等.印楝素对SL-1的细胞凋亡诱导作用[J].昆虫学报,2008,51(6):618-627.
[5] SYNOWIEC E,HOSER G,BIALKOWSKAWARZECHA J,et al.Doxorubicin differentially induces apoptosis,expression of mitochondrial apoptosisrelated genes,and mitochondrial potential in BCRABL1expressing cells sensitive and resistant to imatinib[J].Biomed research internationa,2015(1):1-9.
[6] WANG H,LIU H,ZHENG Z M,et al.Role of death receptor,mitochondrial and endoplasmic reticulum pathways in different stages of degenerative human lumbar disc[J].Apoptos,2011,16(10):990-1003.
[7] SHAN M,FAN T J.Cytotoxicity of carteolol to human corneal epithelial cells by inducing apoptosis via triggering the Bcl2 family proteinmediated mitochondrial proapoptotic pathway[J].Toxicology in vitro,2016,35:36-42.
[8] 刘凯于,邓玉杰,张许平,等.昆虫细胞程序性死亡的研究进展[J].昆虫学报,2008,51(6):652-658.
[9] KIESSLING S,GREEN D R.Cell survival and proliferation in Drosophila S2 cells following apoptotic stress in the absence of the APAF1 homolog,ARK,or downstream caspases[J].Apoptosis,2006,11(4):497-507.
[10] HUANG J F,LV C J, HU M Y, et al.The mitochondriamediate apoptosis of Lepidopteran cells induced by azadirachtin[J].PLoS One,2013,8(3):58499.
[11] YI H S,PAN C X,PAN C,et al.BmICE2 is a novel proapoptotic caspases involved in apoptosis in the silkworm,Bombyx mori[J].Biochemical and biophysical research communications,2014,445(1):100-106.
[12] 赵丹,贺莉芳,刘晖,等.线粒体、细胞色素C、Caspase与细胞凋亡[J].医学动物防制,2012,28(12):1337-1340.
[13] BRUNELLE J K,LETAI A.Control of mitochondrial apoptosis by the Bcl2 family[J].J Cell Sci,2009,122:437-441.
[14] WANG C X,YOULE R J.The role of mitochondria in apoptosis[J].Annu Rev Genet,2009,43(1):95-118.
[15] GALINDO K A,LU W J,PARK J H,et al.The Bax/Bak ortholog in Drosophila,Debcl,exerts limited control over programmed cell death[J].Development,2009,136(2):275-283.
[16] GOYAL G,FELL B,SARIN A,et al.Role of mitochondrial remodeling in programmed cell death in Drosophila melanogaster[J].Dev Cell,2007,12(5):807-816.
[17] LIU L J,PENG J X,LIU K Y,et al.Influence of cytochrome c on apoptosis induced by Anagrapha(Syngrapha)falcifera multiple nuclear polyhedrosis virus(AfMNPV)in insect Spodoptera litura cells[J].Cell Biol Int,2007,31(9):996-1001.
[18] DORSTYN L,MILLS K,LAZEBNIK Y,et al.The two cytochrome c species,DC3 and DC4,are not required for caspases activation and apoptosis in.Drosophila cells[J].J Cell Biol,2004,167(3):405-410.
[19] MEANS J C,MURO I,CLEM R J.Lack of involvement of mitochondrial factors in caspase activation in a Drosophila cellfree system[J].Cell Death Differ,2006,13(7):1222-1234.
[20] DORSTYN L,READ S,CAKOUROS D,et al.The role of cytochrome c in caspase activation in Drosophila melanogaster cells[J].Journal of cell biology,2002,156(6):1089-1098.
[21] KUMARSWAMY R,SETH R K,DWARAKANATH B S,et al.Mitochondrial regulation of insect cell apoptosis:Evidence for permeability transition poreindependent cytochromec release in the Lepidopteran Sf9 cells[J].The international journal of biochemistry & cell biology,2009,41(6):1430-1440.
[22] 王文祥,鐘國华,胡美英,等.喜树碱诱导的草地贪夜蛾Sf9 细胞凋亡[J].昆虫学报,2011,54(8):894-901.
[23] PAN C,HU Y F,SONG J,et al.Effects of 10hydroxycamptothecin on intrinsic mitochondrial pathway in silkworm BmNSWU1 cells[J].Pesticide biochemistry and physiology,2016,127:15-20.
[24] ZHANG L,ZHANG Y N,HE W Z,et al.Effects of camptothecin and hydroxycamptothecin on insect cell lines Sf21 and IOZCASSpexII[J].Pest Manag Sci,2012,68(4):652-657.
[25] WU C C,BRATTON S B.Regulation of the intrinsic apoptosis pathway by reactive oxygen species[J].Antioxid Redox Signal,2013,19(6):546-558.
[26] SAITO M,KORSMEYER S J,SCHLESINGER P H.BAXdependent transport of cytochrome C reconstituted in pure liposomes[J].Nat Cell Biol,2000,2(8):553-555.
[27] SUGANUMA I,USHIYAMA T,YAMADA H,et al.Cloning and characterization of a dronc homologue in the silkworm,Bombyx mori[J].Insect Biochem Mol Biol,2011,41(11):909-921.
[28] CHEN P,HU Y F,WANG L,et al.Mitochondrial apoptotic pathway is activated by H2O2mediated oxidative stress in BmNSWU1 cells from Bombyx mori ovary[J].PLoS One,2015,10(7):134694.
[29] LIU P L,CHEN Y L,CHEN Y H,et al.Wood smoke extract induces oxidative stressmediated caspaseindependent apoptosis in human lung endothelial cells:Role of ALF and EndoG[J].Am J Physiol Lung Cell Mol Physiol,2005,289(5):739-749.
[30] CONNOLLY P F,JGER R,FEARNHEAD H O.New roles for old enzymes:Killer caspases as the engine of cell behavior changes[J].Front Physiol,2014,5:149.
[31] 胡硕,胡成平.线粒体与细胞凋亡的研究進展[J].国际呼吸杂志,2006,26(6):463-466.
[32] BOATRIGHT K M,SALVESEN G S.Mechanisms of caspase activation[J].Curr Opin Cell Biol,2003,15(6):725-731.
[33] COOPER D M,GRANVILLE D J,LOWENBERGER C.The insect caspases[J].Apoptosis,2009,14(3):247-256.
[34] RICHARDSON H,KUMAR S.Death to flies:Drosophila as a model system to study programmed cell death[J].J Immunol Methods,2002,265(1/2):21-38.
[35] ARAMA E,BADER M,SRIVASTAVA M,et al.The two Drosophila cytochrome C proteins can function in both respiration and caspases activation[J].EMBO J,2006,25(1):232-243.
[36] 戶艳芬.活性氧诱导家蚕细胞凋亡的内源性线粒体途径的研究[D].重庆:西南大学,2014.
[37] SNIPAS S J,DRAG M,STENNICKE H R,et al.Activation mechanism and substrate specificity of the Drosophila initiator caspase DRONC[J].Cell Death Differ,2008,15(5):938-945.
[38] ZHANG J Y,PAN M H,SUN Z Y,et al.The genomic underpinnings of apoptosis in the silkworm,Bombyx mori[J].BMC Genomics,2010,11:611.
[39] BRYANT B,ZHANG Y P,ZHANG C,et al.A lepidopteran ortholog of reaper reveals functional conservation and evolution of IAP antagonists[J].Insect Mol Biol,2009,18(3):341-351.
[40] MARTINOU J C,YOULE R J.Mitochondria in apoptosis:Bcl2 family members and mitochondrial dynamics[J].Dev Cell,2011,21(1):92-101.
[41] ZONG W X,LINDSTEN T,ROSS A J,et al.BH3only proteins that bind prosurvival Bcl2 family members fail to induce apoptosis in the absence of Bax and Bak[J].Genes Dev,2001,15:1481-1486.
[42] 邓亮,吴娣,洪一江,等.BCL-2 家族的研究新进展[J].安徽农业科学,2012,40(4):1936-1938.
[43] ABDELWAHID E,ROLLAND S,TENG X,et al.Mitochondrial involvement in cell death of nonmammalian eukaryotes[J].Biochim Biophys Act,2011,1813(4):597-607.
[44] WU J N,NGUYEN N,AGHAZARIAN M,et al.grim promotes programmed cell death of Drosophila microchaete glial cells[J].Mech Ev,2010,127(9/10/11/12):407-417.
[45] ZHANG J Y,PAN M H,SUN Z Y,et al.The genomic underpinnings of apoptosis in the silkworm,Bombyx mori[J].BMC Genomics,2010,11(1):611-619.
[46] PAN C,HU Y F,YI H S,et al.Role of Bmbuffy in hydroxycamptothecineinduced apoptosis in BmNSWU1 cells of the silkworm,Bombyx mori[J].Biochem Biophys Res Commun,2014,447(2):237-243.
[47] FALKENHORST J,GRUNEWALD S,MHLENBERG T,et al.Inhibitor of Apoptosis Proteins(IAPs)are commonly dysregulated in GIST and can be pharmacologically targeted to enhance the proapoptotic activity of imatinib[J].Oncotarget,2016,7(27):41390-41403.
[48] KOCAB A J,DUCKETT C S.Inhibitor of apoptosis proteins as intracellular signaling intermediates[J].FEBS Journal,2016,283(2):221-231.
[49] CHRISTIANSEN A E,DING T,FAN Y,et al.Noncell autonomous control of apoptosis by ligandindependent Hedgehog signaling in Drosophila[J].Cell Death Differ,2013,20(2):302-311.
[50] STELLER H.Regulation of apoptosis in Drosophila[J].Cell death and differentiation,2008,15(7):1132-1138.
[51] HUANG Q H,DEVERAUX Q L,MAEDA S,et al.Cloning and characterization of an inhibitor of apoptosis protein(IAP)from Bombyx mori[J].Biochim Biophys Acta,2001,1499(3):191-198.
[52] XU D B,WOODFIELD S E,LEE T V,et al.Genetic control of programmed cell death(apoptosis)in Drosophila[J].Fly(Austin),2009,3(1):78-90.
