紫外线C诱导的人晶状体上皮细胞中CRYAA表达的上升△
2017-08-11李丹罗怡卢奕
李丹 罗怡 卢奕
·基础研究·
紫外线C诱导的人晶状体上皮细胞中CRYAA表达的上升△
李丹 罗怡*卢奕*
目的 研究在紫外线照射下人晶状体上皮细胞(LEC)中晶状体蛋白的表达变化。方法 用波长为254 nm的紫外线C(UVC)照射LEC(包括原代细胞和细胞系),一定时间后收集照射后的细胞进行如下实验:①碘化丙啶(PI)染色和线粒体膜电位流式检测对细胞进行凋亡评估;②实时荧光定量聚合酶链反应(PCR)检测CYRAA,CRYAB,CRYBB2基因的mRNA表达量;③免疫荧光染色检测CRYAA的蛋白表达;④焦磷酸测序检测CRYAA基因的启动子区域甲基化。结果 LEC在强度为25 μW/cm2的UVC照射0、10、20、30 min后立即做PI染色,结果显示:随着照射时间的增加,细胞凋亡率递增,分别为0、7%、33%和100%。LEC在UVC照射10 s并培养24 h后100%死亡;照射5 s并培养24 h后,部分凋亡,CRYAA基因表达量显著上调(>4倍),但是细胞传代后CRYAA基因表达量恢复正常水平。焦磷酸测序结果显示,CRYAA基因的启动子区甲基化水平无明显变化。结论 LEC在受到强度为25 μW/cm2的UVC照射10 s并继续培养24 h后死亡,照射5 s并继续培养24 h后,CRYAA基因表达上调,提示其抗氧化作用,但该上调不是通过CRYAA基因启动子甲基化改变来调控的。(中国眼耳鼻喉科杂志,2017,17:239-244)
白内障;紫外线;CRYAA;细胞凋亡
白内障被定义为晶状体浑浊,在全球范围内约有1 600万患者,是主要的致盲眼病[1]。现在普遍认为白内障是随着年龄老化自然发生的,平均在50岁开始发病。同时,若干其他因素也会影响、加速白内障的发生、发展,包括家族遗传、眼外伤、糖尿病、眼部炎症、长时间暴露在紫外线(ultraviolet,UV)下等因素。已经被普遍认同的是:长期在可接触UV环境下工作的人(不论UV是来自于太阳光,还是消毒灯),患白内障的年龄会比平均年龄提前。这个现象说明UV照射和白内障发生间有直接联系。
人眼的晶状体是一个由紧密、整齐排列的无核纤维细胞组成的透明椭圆球体和覆盖在上面的一层囊膜构成。在前囊膜上生长有单层晶状体上皮细胞(lens epithelial cells, LEC)。在人的一生中,LEC能够不断分化成纤维细胞,达到晶状体纤维细胞的新老更替。许多研究[2]结果表明白内障的发生始于LEC的病变,因此我们选择人LEC作为实验材料来研究UV对晶状体的影响。以往研究表明UV会对猪LEC[3]和人LEC造成损伤[4-6]。其中在对猪LEC的研究中发现,UV在波长250~280 nm区对细胞的伤害最大[3]。基于这个结论,在本项研究中,我们选择用波长254 nm UV(UV-254)对人LEC照射并在基因和细胞水平做相关检测。
1 资料与方法
1.1 资料 来自于人的材料已通过复旦大学附属眼耳鼻喉科医院伦理委员会审核。人的材料是来自本院白内障手术中撕囊的囊膜片段,已经得到患者的同意。实验所用细胞系人LEC系 SRA01/04[7]购自中国医学科学院肿瘤医院肿瘤研究所。在后文中,如未作特殊说明,LEC均指人LEC。
1.2 方法
1.2.1 细胞培养 来自于人晶状体囊膜的原代细胞培养方法如下。先将前囊膜用微型剪剪成小片段(直径约2 mm),并转移到直径35 mm的细胞培养皿。加入DMEM(Gibco 11995, Life Technologies, NY, USA)加20% 胎牛血清(fetal bovine serum, FBS)(Gibco 10099141)的培养液至刚好盖住培养皿底部(这样可以帮助囊膜贴壁),37℃ 5% CO2培养24 h后,加入1 mL 培养液继续培养3 d。之后每天换液。培养1周后,原代细胞从囊膜中爬出并增殖。用刮刀刮下细胞用来做分子实验。来自于细胞系的SRA01/04细胞用DMEM加10% FBS进行常规培养备用。1.2.2 细胞死亡实验 细胞死亡实验用细胞凋亡和坏死试剂盒(C1056,碧云天,中国)检测。按照说明书孵育后,对细胞进行Hoechst 33342和碘化丙啶(propidium iodide,PI)染色,然后在荧光显微镜下观察。每个培养皿中至少计数了1 300个细胞(并被判定为活细胞或死细胞)。
1.2.3 线粒体膜电位检测实验 细胞早期凋亡用线粒体膜电位检测试剂盒(C2006,碧云天,中国)检测。在该方法中,JC-1是一种通常用于检测线粒体膜电位(Δψm)的荧光素,Δψm的降低是细胞早期凋亡的标志之一。当Δψm高时,JC-1聚集在线粒体基质呈红色荧光;当Δψm低时,JC-1无法聚集而形成单体,呈绿色荧光。在细胞用JC-1处理20 min后,用流式细胞仪对细胞进行流式检测。
1.2.4 实时荧光定量PCR 将细胞用刮刀从培养皿中刮下后收集在1.5 mL的EP管中。用TRIzol(15596; Invitrogen, Carlsbad, CA, USA)提取RNA并测定其浓度。将等量的RNA(2 μg)用PrimeScript RT Master Mix试剂盒(RR036, Takara,中国大连)反转录成cDNA,并将此作为模板用SYBR Premix Ex Taq试剂盒(RR420, Takara)行荧光定量PCR(qPCR)检测。使用仪器为ABI 7500 (Life Technologies, 美国)。基因β-actin为内参基因。所测基因引物为CRYAA: Forward 5′- GAC GAC CAC GGC TAC ATT TC-3′, Reverse 5′- GGC AGA CAG GGA GCA AGA-3′; for CRYAB: Forward 5′- GTT GGG AGA TGT GAT TGA G-3′, Reverse 5′- GAT GAC AGG GAT GAA GTA ATG-3′; for CRYBB2: Forward 5′- GGA CAG CCA AGA GCA CAA GA-3′, Reverse 5′- ACC CGC ACA GAT GAC ACC T-3′; for DNMT1 Forward 5′-GTG GGG GAC TGT GTC TCT GT-3′,Reverse 5′-TGA AAG CTG CAT GTC CTC AC-3′; for β-actin: Forward 5′- AAG GTG ACA GCA GTC GGT T-3′, Reverse 5′- TGT GTG GAC TTG GGA GAG G-3′。1.2.5 焦磷酸测序 DNA抽提使用DNA-easy blood and tissue kit试剂盒(天根,中国)。对2 μg基因组DNA用EpiTect Bisulfite kit试剂盒(Qiagen,加拿大)进行二硫酸盐处理,随后在选定的CRYAA基因的启动子CpG岛区域(-757~-706)进行焦磷酸测序(pyrosequencing)。所用引物是:Forward 5′-biotin-GTG ATA GGG AAG TGG GGA TAT GT-3′, Reverse 5′- CCT AAA CCC CCA ACC CCA TAA CCA T-3′, 测序引物为 5′- CAA CCC CAT AAC CAT C-3′。
1.2.6 免疫荧光染色 LEC用4%多聚甲醛固定15 min,0.1% Triton破膜10 min,10%羊血清封闭30 min,随后加一抗孵育2 h。用磷酸盐缓冲液(phosphate-buffered saline, PBS)洗3次后加二抗Alexa-Fluor 488(Jackson Immuno Research, 美国)1∶400孵育1 h。用PBS洗3次后加Hoechst 33342 1∶2 000孵育1 min,用PBS洗3次后在荧光显微镜下观察拍照。
2 结果
2.1 LEC在UVC照射30 min后立即死亡 首先对254 nm UVC(功率为25 μW/cm2)持续照射后的细胞进行即时观察,对LEC(文中如未做特别说明,则LEC指的是细胞系SRA01/04培养而来的细胞)死亡检测。经过Hoechst和PI染色后,死细胞因为细胞膜破裂会吸收PI而在荧光显微镜下发出红色荧光。在分别照射0、10、20和30 min后,细胞死亡率分别为0、7%、33%和100%(图1)。

图1. UVC照射后细胞死亡实验 LEC在UVC照射0 min (A), 10 min (B), 20 min (C)和30 min (D)后进行PI和Hoechst染色。死细胞在PI通道会发出红色。细胞死亡率显示在最右栏
2.2 LEC在UVC照射数秒后即会引起早期凋亡 在发现30 min的UVC持续照射会导致LEC 100%立即死亡后,对细胞进行UVC照射数秒,随后培养24 h后做早期凋亡检测。选择的照射时间为2 s、5 s、10 s和30 s。结果发现在LEC经过10 s UVC照射,培养24 h后全部从培养皿底部漂起死亡;而经过5 s UVC照射,培养24 h后在显微镜下观察大约有25%的细胞漂起;经过2 s UVC照射,培养24 h后在显微镜下观察未见明显的细胞漂起现象。进而使用JC-1试剂盒检测线粒体膜电位(Δψm)来提示细胞早期凋亡程度。实验结果如图2所示,经过5 s UVC照射并培养24 h后,早期凋亡率与未处理细胞相比提高了2倍(从1.8%到5.4%)。2.3 UVC照射后CRYAA基因表达量升高 基于以上结果,选择对LEC进行5 s UVC照射并继续培养,因为在这个剂量的刺激下,既能引起细胞部分损伤又不至于全部死亡。在照射后不同时间点用qPCR检测了3个编码晶状体蛋白基因的mRNA水平:CRYAA,CRYAB和CRYBB2代表α和 β 晶状体蛋白的表达水平。选择UVC照射5 s后培养0 h,6 h,24 h,传第二代后(P2)以及传第三代后(P3)共5个时间点来做基因表达检测,结果如图3所示。相较于0 h,CRYAA和CRYAB的表达量在24 h分别升高到4.6和2.6倍,并在P2,P3回归到0 h水平。这一结果说明UVC短时照射会刺激细胞启动保护机制。而α晶状体蛋白已知具有细胞抗氧化损伤、热损伤的作用[8-10],因此CRYAA,CRYAB表达水平升高。而在传代后期表达水平的回落提示在传代过程中死细胞的去除以及新增殖细胞抵消了受损细胞的影响。
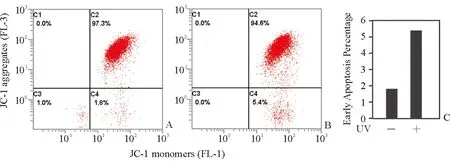
图2. UVC引起的线粒体膜电位改变 未接受(A)和接受UVC照射(B)的LEC线粒体膜电位检测结果显示(C4象限代表JC-1单体形式,即细胞早期凋亡标志),UVC照射5 s并培养24 h后会引起早期凋亡的升高
我们之前的研究结果证实在年龄相关性白内障中,CRYAA基因的表达量降低与其启动子区域内高甲基化水平相关[11]。因此猜测UVC引起了CRYAA基因的启动子甲基化降低,从而调控了其表达量的升高。于是检测了一个主要的DNA甲基化转移酶基因DNMT1的表达量,同样使用qPCR检测。但是检测结果显示DNMT1在24 h同样也是升高的,提示CRYAA基因表达量的升高应该不是受甲基化调控来实现的。此外,我们还在原代培养的LEC(即从白内障手术中的囊膜片段进行原代培养的细胞)上验证了这种基因表达的变化(图3B)。由于原代细胞的材料不易取得且较难培养,选择了2个时间点进行验证。结果显示在UVC 5 s并培养24 h后,CRYAA基因的表达升高1.3倍,而CRYAB和CRYBB2基因则无明显变化。这种与用细胞系做基因检测所得到结果的不一致应该是细胞系(图3C)和原代细胞(图3D)本身的性质(即其内源晶状体基因的起始转录本量)不一样所导致的。有证据[12-14]表明来自于细胞系培养的LEC中,晶状体蛋白相较于原代人LEC有极大的降低。但DNMT1的表达无论在细胞系还是原代LEC中,UVC照射均可引起其基因表达升高大约2倍。对DNMT1这种升高的机制和影响的解读是一个未来可以深入研究的方向。
除此之外,我们还用人αA和αB晶状体蛋白的抗体(CRYAA和CRYAB)对UVC照射5 s并培养24 h前后的LEC做了荧光染色。结果如图4所示,用绿色荧光信号表征的CRYAA和CRYAB蛋白表达量在UVC照射5 s并培养24 h后有明显升高。

图3. 晶状体基因和DNMT1基因在UVC照射前后的表达变化 A.在细胞系SRA01/04中各基因的qPCR检测结果;B.在原代培养LEC中各基因的qPCR检测结果;C.细胞系SRA01/04;D.原代培养LEC显微镜下观察图片,标尺200 μm
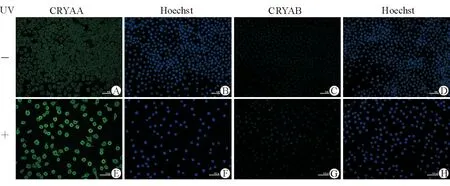
图4. 免疫荧光染色显示CRYAA和CRYAB的表达量升高 在LEC细胞未经过处理(A,C)和经过UVC照射5 s并培养24 h后(E,G)用CRYAA和CRYAB抗体做免疫荧光染色;细胞核DNA用Hoechst染色(B,D,F,H)
2.4 焦磷酸测序结果显示CRYAA甲基化水平正常 为了进一步探究CRYAA被UVC照射后产生的表达上调的机制,我们利用焦磷酸测序技术对CRYAA基因启动子区域(-757~-706)的CpG岛序列(图5A)的甲基化水平做了检测。选择如前文所述的5个时间点,测序结果如图5B所示,显示并无明显差异。这个结果提示,CRYAA表达量的增加不是由于其启动子区的低甲基化来实现的。

图5. UVC照射后CRYAA启动子CpG岛甲基化水平检测 A.CRYAA基因启动子-757~-706序列。B.在UVC照射5 s后5个时间点做焦磷酸测序检测,其平均水平于最后一栏所示
3 讨论
世界卫生组织(World Health Organization,WHO)已经明确白内障在过度太阳光照的国家相比其他国家会早发、高发。并且,在这些国家里,由白内障手术取出的白内障晶状体颜色更深[15-16]。这些数据表明了直接的UV照射和晶状体浑浊之间的相关性。在分子机制层面,在一定的时间和强度UV照射后,凋亡基因Bax表达升高,抗凋亡基因Bcl-2表达降低,并且Bax/Bcl-2比值和LEC凋亡水平呈正相关[17]。在更系统的基因组表达研究中,Osada等[6]用基因芯片比较了UVB照射前后LEC全基因组表达的变化,并重点分析了细胞外蛋白,筛选出了18个编码分泌蛋白的基因有2倍以上上调。这些研究都表明外部UV照射能在分子水平上对细胞功能进行调节。对于白内障患者,UV照射是如何加重晶状体浑浊程度的,其分子机制是我们试图探究的谜题。
在本实验中,我们研究了UV对LEC更直接的影响,即重点分析LEC组成晶状体的最重要成分:晶状体蛋白编码基因的表达量变化。在人晶状体中,水溶性的晶状体蛋白约占90%,并根据其性状主要分为3类:α, β和 γ[18-19]。其中α晶状体蛋白又由αA和αB的多肽链组成复合物,并具有分子伴侣(chaperone)调控蛋白折叠的功能,以帮助蛋白在晶状体及其他组织里规则有序地排列[20-22],提供有序的梯度折光率以确保其组织透明性。特别是编码αA晶状体蛋白的CRYAA基因,其启动子区是首个被鉴定出在哺乳动物中具有组织特异性/偏向性的启动子[23],因此,被当作晶状体中的明星分子得到广泛研究[24]。而β和γ晶状体蛋白则会形成β/γ超级家族,β晶状体蛋白也是晶状体中含量最丰富的水溶性蛋白。在本研究中,我们选择了CRYAA,CRYAB和CRYBB2(分别编码αA, αB 和βB2晶状体蛋白)这3个基因作为代表来表征整体的晶状体蛋白水平。经过一系列测试发现,功率25 μW/cm2紫外灯在254 nm波长照射5 s是合适的照射强度,在这个强度下,培养皿中的细胞既受到了UVC的影响,又能存活。根据图3的qPCR和图4的荧光染色结果,我们观察到CRYAA和CRYAB在UVC照射5 s并培养6 h及24 h后有不同程度的上调,而CRYBB2的表达量则比较稳定。这也和以往的研究[8-10]结果相吻合,即α晶状体蛋白在受到氧化应激、高温及亚硝酸盐处理时会启动对细胞的保护作用。因此推测α 和 β晶状体蛋白在UVC刺激下的不同表现可能是由于α晶状体蛋白特殊的抗凋亡能力。
根据qPCR结果(图3A),甲基化转移酶基因DNMT1的表达无论在细胞系还是原代LEC中,UVC照射均可引起其基因表达升高大约2倍。这与我们设想的CRYAA升高可能是其启动子区去甲基化的结果相违背(如果CRYAA的升高是其启动子区去甲基化的结果,那么最直接的解释是甲基化转移酶如DNMT1表达降低或者去甲基化酶如TET2升高)。于是对CRYAA的启动子区进行了甲基化焦磷酸测序,结果证实UVC引起的CRYAA,CRYAB表达升高并不是通过甲基化水平来调节的。我们推测,像老年性白内障发生过程一样,甲基化水平的改变需要更长时间的慢性影响;而对由UVC照射引起DNMT1表达升高机制和影响的解读是未来一个可以深入研究的方向。
志谢 感谢为本实验提供手术材料的白内障患者。感谢复旦大学附属眼耳鼻喉科医院吴继红教授为本研究提供的宝贵建议。
[ 1 ] Asbell PA, Dualan I, Mindel J, et al. Age-related cataract [J]. Lancet, 2005,365(9459):599-609.
[ 2 ] Ong MD, Payne DM, Garner MH. Differential protein expression in lens epithelial whole-mounts and lens epithelial cell cultures [J]. Exp Eye Res, 2003,77(1):35-49.
[ 3 ] Okuno T, Nakanishi-Ueda T, Ueda T, et al. Ultraviolet action spectrum for cell killing of primary porcine lens epithelial cells [J]. J Occup Health, 2012,54(3):181-186.
[ 4 ] Kim ST, Koh JW. Mechanisms of apoptosis on human lens epithelium after ultraviolet light exposure [J]. Korean J Ophthalmol, 2011,25(3):196-201.
[ 5 ] Youn HY, McCanna DJ, Sivak JG, et al. In vitro ultraviolet-induced damage in human corneal, lens, and retinal pigment epithelial cells [J]. Mol Vis, 2011,17:237-246.
[ 6 ] Osada H, Yoshitake Y, Ikeda T, et al. Ultraviolet B-induced expression of amphiregulin and growth differentiation factor 15 in human lens epithelial cells [J]. Mol Vis, 2011,17:159-169.
[ 7 ] Ibaraki N. Human lens epithelial cell culture [J]. Methods Mol Biol, 2002,188:1-6.
[ 8 ] Hamann S, Metrailler S, Schorderet DF, et al. Analysis of the cytoprotective role of alpha-crystallins in cell survival and implication of the alphaA-crystallin C-terminal extension domain in preventing Bax-induced apoptosis [J]. PLoS One, 2013,8(2):e55372.
[ 9 ] Nahomi RB, Wang B, Raghavan CT, et al. Chaperone peptides of alpha-crystallin inhibit epithelial cell apoptosis, protein insolubilization, and opacification in experimental cataracts [J]. J Biol Chem, 2013,288(18):13022-13035.
[10] Christopher KL, Pedler MG, Shieh B, et al. Alpha-crystallin-mediated protection of lens cells against heat and oxidative stress-induced cell death [J]. Biochim Biophys Acta, 2014,1843(2):309-315.
[11] Zhou P, Luo Y, Liu X, et al. Down-regulation and CpG island hypermethylation of CRYAA in age-related nuclear cataract [J]. FASEB J, 2012,26(12):4897-4902.
[12] Ibaraki N, Chen SC, Lin LR, et al. Human lens epithelial cell line [J]. Exp Eye Res, 1998,67(5):577-585.
[13] McDevitt DS, Yamada T. Crystallin expression in the TVI cell line [J]. Differentiation, 1980,16(2):125-128.
[14] Fleming TP, Song Z, Andley UP. Expression of growth control and differentiation genes in human lens epithelial cells with extended life span [J]. Invest Ophthalmol Vis Sci, 1998,39(8):1387-1398.
[15] Resnikoff S, Pascolini D, Etya'ale D, et al. Global data on visual impairment in the year 2002 [J]. Bull World Health Organ, 2004,82(11):844-851.
[16] Varma SD, Kovtun S, Hegde KR. Role of ultraviolet irradiation and oxidative stress in cataract formation-medical prevention by nutritional antioxidants and metabolic agonists [J]. Eye Contact Lens, 2011,37(4):233-245.[17] Ji Y, Cai L, Zheng T, et al. The mechanism of UVB irradiation induced-apoptosis in cataract [J]. Mol Cell Biochem, 2015,401(1-2):87-95.[18] Reddy MA, Francis PJ, Berry V, et al. Molecular genetic basis of inherited cataract and associated phenotypes [J]. Surv Ophthalmol, 2004,49(3):300-315.
[19] Graw J. Genetics of crystallins: cataract and beyond [J]. Exp Eye Res, 2009,88(2):173-189.
[20] Augusteyn RC. alpha-crystallin: a review of its structure and function [J]. Clin Exp Optom, 2004,87(6):356-366.
[21] Reddy GB, Kumar PA, Kumar MS. Chaperone-like activity and hydrophobicity of alpha-crystallin [J]. IUBMB Life, 2006,58(11):632-641.
[22] Basha E, O'Neill H, Vierling E. Small heat shock proteins and alpha-crystallins: dynamic proteins with flexible functions [J]. Trends Biochem Sci, 2012,37(3):106-117.
[23] Overbeek PA, Chepelinsky AB, Khillan JS, et al. Lens-specific expression and developmental regulation of the bacterial chloramphenicol acetyltransferase gene driven by the murine alpha A-crystallin promoter in transgenic mice [J]. Proc Natl Acad Sci U S A, 1985,82(23):7815-7819.
[24] Yang Y, Stopka T, Golestaneh N, et al. Regulation of alphaA-crystallin via Pax6, c-Maf, CREB and a broad domain of lens-specific chromatin [J]. EMBO J, 2006,25(10):2107-2118.
(本文编辑 诸静英)
Ultraviolet C induced up-regulation expression ofCRYAAin human lens epithelial cells
LI Dan, LUO Yi*, LU Yi*.
Research Center, Eye Ear Nose and Throat Hospital of Fudan University, Shanghai 200031, China
LU Yi, Email: luyieent@126.com
Objective To investigate the crystalline expression change induced by ultraviolet (UV) exposure in human lens epithelial cells (LECs). Methods LECs (including cells from primary culture and cell line) were exposed to UVC at the wavelength of 254 nm for certain time and were collected for the following assays: ①apoptosis detection by propidium iodide (PI) staining and mitochondrial membrane potential evaluation; ②quantitative PCR (qPCR) for measuring the expression of crystallin coding genesCYRAA,CRYABandCRYBB2; ③Immunofluorescence staining ofCRYAA; ④pyrosequencing analysis of the promoter region ofCRYAAto evaluated the methylation status. Results LECs exposed to UVC at the intensity of 25 μW/cm2for 0, 10, 20 and 30 min showed an increasing apoptosis rate by immediate propidium iodide (PI) staining at 0, 7%, 33% and 100%. LECs exposed to UVC for 10 seconds or longer died at 100% after 24 hours, whereas LECs exposed to UVC for 5 seconds died partially after 24 hours; theCRYAAgene expression showed a significant increase after 24 hours. The pyrosequencing ofCRYAApromoter showed that the methylation status did not change in the UVC-treated cells. Conclusions The exposure to UVC for longer than 10 seconds would 100% kill the cultured LECs. A 5 seconds-exposure to UVC would induce an increase inCRYAAexpression, and the up-regulation is not the result from demethylation. (Chin J Ophthalmol and Otorhinolaryngol,2017,17:239-244)
Cataract; Ultraviolet;CRYAA; Cell apoptosis
国家自然科学基金(81200668)
复旦大学附属眼耳鼻喉科医院实验中心*眼科 卫生部近视眼及相关疾病重点实验室 上海 200031
卢奕(Email:luyieent@126.com)
10.14166/j.issn.1671-2420.2017.04.003
2016-08-22)
