双酶法制备富含多酚的荞麦浓缩蛋白及体外消化研究
2017-08-07陈雅君陈小威杨晓泉王金梅
陈雅君 陈小威 杨晓泉 郭 健 王金梅
(华南理工大学食品科学与工程学院;广东省天然产物绿色加工与产品安全重点实验室,广州 510640)
双酶法制备富含多酚的荞麦浓缩蛋白及体外消化研究
陈雅君 陈小威 杨晓泉 郭 健 王金梅
(华南理工大学食品科学与工程学院;广东省天然产物绿色加工与产品安全重点实验室,广州 510640)
开发一种双酶结合膜分离的方法制备富含多酚的荞麦浓缩蛋白,系统比较了双酶法与传统碱溶酸沉法、盐提法在蛋白质及多酚的含量和回收率、溶解性等方面的差异;并结合SDS-PAGE、氮释放量、胶束多酚释放量等,考察了荞麦浓缩蛋白的模拟体外消化。结果表明:相对于碱溶酸沉法和盐提法,双酶法制备荞麦蛋白不仅具有较高的蛋白质质量分数(49.07%)和最高的蛋白回收率(57.93%),而且多酚质量分数(11.35%)显著高于碱溶酸沉法(3.65%)和盐提法(2.67%),回收率更高达70.89%,多酚多以结合态与蛋白共存;体外消化试验后,3种残渣蛋白SDS-PAGE分析结果相似,分子质量大于14.4 ku的组分全部裂解;此外,双酶法制备的荞麦蛋白氮释放量相对较低(43.30%),而胶束的多酚释放量高达2.05%,是良好的抗消化蛋白。
荞麦浓缩蛋白 多酚 双酶法 碱溶酸沉法 盐提法 体外消化
荞麦(buckwheat, BW)在分类上属于Polygonaceae属禾谷类谷物,在全世界广泛种植,尤其是北半球(如中国、俄罗斯)。由于荞麦,尤其是苦荞麦,富含高生物营养价值的蛋白质(8.51%~18.87%)、可食纤维(3%~15%)、丰富的多酚(1.97%~3.03%)以及优质的多聚不饱和脂肪酸等,近年来作为独特的食药两用粮食在美国、加拿大、日本和欧洲备受欢迎[1-3]。荞麦蛋白生理价值高,具有良好的氨基酸组成,尤其是富含其他植物蛋白缺乏的赖氨酸,生理作用甚至优于大豆蛋白[4]。长期食用荞麦蛋白可抑制体脂肪蓄积、降血压、改善便秘、抗衰老、抑制结石形成,降低乳腺癌和结肠癌的发病率,并能降低慢性疾病的风险,这归因于它高含量的多酚化合物(如芦丁、槲皮素、阿魏酸等)与之结合存在[5-7]。且由于其本身对蛋白酶降解作用的敏感性,荞麦蛋白还是天然的抗消化蛋白,类似于膳食纤维[8]。可应用于功能性食品配料,可降低胆固醇,抑制脂肪蓄积,改善便秘,预防肿瘤发生以及改善肠道内短链脂肪酸的发酵过程等[9-10]。
近年来,对荞麦的研究一直是热点问题,主要集中在蛋白或多酚成分的提取和理化性质研究等方面。其中,国外对荞麦蛋白的利用主要针对产品配料方面,改善食品的组织结构,增加营养保健价值。而荞麦蛋白的制备方法有多种,常用的有碱溶酸沉法[8]、盐提法[11]、蛋白酶酶解法[12]等,其中碱溶酸沉法因其操作简单、成本低廉等优点在工业生产中应用最多[13]。然而,传统的制备方法存在制得的荞麦蛋白色泽深、纯度低、回收率低以及多酚含量低等缺点[8],未能使荞麦的功能性成分得以充分保留,这大大阻碍了荞麦蛋白产业的发展。
本研究开发一种双酶结合膜分离的方法制备荞麦浓缩蛋白,对比传统碱溶酸沉法、盐提法,探讨其对多酚、蛋白含量及回收率的影响,并对蛋白质的溶解性和体外消化性进行了考察,旨在寻找高效制备富含多酚荞麦浓缩蛋白的方法,以此推进荞麦生产和深加工,开发新型功能性食品配料,形成新的经济增长点。
1 材料与方法
1.1 材料与仪器
苦荞皮层粉、苦荞芯层粉、苦荞籽:四川大凉山甘洛县;480L α-淀粉酶(480 KNU/g):丹麦诺维信公司;糖化酶(≥2 100 U/g):上海阿拉丁生化科技股份有限公司;标准分子量蛋白:上海升正生物技术有限公司。
UV-2450分光光度计:日本Shimadzu公司;Rapid N Cube杜马斯定氮仪:法国Elementar公司;CR22G高速冷冻离心机:日立Hitachi公司;Mini-Sub Cell电泳槽、电泳仪:美国Bio-Rad公司。
1.2 试验方法
1.2.1 荞麦浓缩蛋白(BPC)的制备
1.2.1.1 双酶法
取一定量苦荞皮层粉与蒸馏水以料液比1∶15(m/V)混合,分散机6 000 r/min处理10 min后调节pH至6.0,添加5% 480L α-淀粉酶,并放置于70 ℃水浴搅拌(300 r/min)酶解3 h;随后样液冷却至室温并调节pH至4.0,添加5%糖化酶,于60 ℃水浴并搅拌(300 r/min)酶解1 h,并于100 ℃保温5 min灭酶处理;冷却至室温后采用80 ku的聚砜膜进行超滤渗滤,流速为1 500 mL/min,渗滤体积为上样体积4倍,截留液经冷冻干燥得双酶法苦荞麦浓缩蛋白,简称双酶法蛋白。
1.2.1.2 碱溶酸沉法
取一定量苦荞皮层粉1∶20充分分散于蒸馏水中,调节pH值至8.0,磁力搅拌90 min,8 500 r/min离心20 min,取上清液,调节pH至4.6,随后8 500r/min离心20 min,得到蛋白沉淀物;二次水洗沉淀物,调节pH至7.0复溶,经透析、冷冻干燥后得到碱溶酸沉法苦荞麦浓缩蛋白,简称碱溶酸沉法蛋白[8]。
中国国际商会副秘书长张屹在致辞中表示,中国国际商会负责与澜湄对口机构开展机制性的务实合作。作为2018澜湄合作博览会的主办单位,中国国际商会积极发挥对外交流的渠道和专业服务的优势,为云南的对外开放和经济社会发展作出一份贡献。他强调,中国国际商会愿与澜湄国家贸易投资促进机构和商协会组织共同努力,为澜湄国家企业提供更好的专业化贸易信息以及投资、促进、综合一体化服务,为澜湄国家综合服务作出努力。
1.2.1.3 盐提法
一定量苦荞皮层粉与含0.033 mol/L NaHCO3的0.086 mol/L NaCl盐溶液以料液比1∶10(m/V)混合,室温搅拌过夜,之后胶体磨4 000 r/min均质分散处理15 min,液料10 000 r/min离心30 min,取上清液经透析、冷冻干燥,即得盐提法苦荞麦浓缩蛋白,简称盐提法蛋白[11]。
1.2.2 蛋白含量及回收率测定
采用杜马斯定氮法测定样品中蛋白含量(×5.83)。根据所得蛋白提取物的质量及蛋白质纯度、原料的质量及蛋白质纯度,可得蛋白提取物的蛋白质回收率:
蛋白回收率=[蛋白提取物质量×蛋白提取物蛋白质含量/(原料质量×原料蛋白质含量)]×100%
1.2.3 不同形态多酚及多酚回收率测定
多酚含量测定方法参考Carbonaro等[14]的方法。0.02~0.15 g样品溶于1 mL 0.1 mol/L NaOH碱液中,10 000 r/min离心15 min,取2份上清液:一份上清液于紫外波长328 nm处检测,测定总酚吸光度A1;另一份加入等体积10%质量分数的三氯乙酸(TCA),沉淀蛋白质,10 000 r/min离心15 min,上清液于328 nm处测定游离多酚吸光度A2;并以芦丁标品为参照品做标准曲线。结合酚含量=总酚含量-游离酚含量。
多酚回收率=[蛋白提取物质量×蛋白提取物多酚含量/(原料质量×原料多酚含量)]×100%
1.2.4 SDS-PAGE分析
凝胶电泳采用Laemmli[15]系统,在不连续缓冲系统上进行SDS-PAGE电泳分析,分离胶浓度为12%,浓缩胶浓度为5%。取适量样品,添加电泳缓冲液配制成4 mg/mL溶液,沸水煮3 min,上样量为2.5 μL;凝胶电泳在恒流下进行,样品在浓缩胶中时电流为15 mA,进入分离胶后电流调整为25 mA;凝胶用0.25%考马斯亮蓝R-250染色1 h,脱色采用甲醇乙酸脱色液(甲醇∶乙酸∶水=1∶1∶8)进行12 h脱色。
1.2.5 蛋白溶解性的测定
将蛋白样品配制成为1%(m/V)溶液,磁力搅拌30 min后用0.5 mol/L HCl或NaOH调节pH值至2.0~9.0,离心(10 000 r/min,20 min),上清液稀释50倍后Lowry法测定蛋白含量,以BSA为标样。
1.2.6 体外消化
参考White等[16]和Wu等[17]的方法进行体外模拟消化试验,略作改动。碱溶酸沉法蛋白、盐提法蛋白和双酶法蛋白分散液各1份,用6 mol/L HCl调pH至2.0,于37 ℃条件下保温10 min,加入100mg/mL胃蛋白酶0.2 mL并于37 ℃恒温摇床酶解1 h。分别在不同消化时间(0、30、60 min)取样待测,并调节pH至7.0终止反应。胃蛋白酶消化结束后,用 2 mol/L氢氧化钠溶液调节体系的pH值为7.0,加入100 mg/mL胰蛋白酶0.12 mL和脱氧胆酸钠(体系最终浓度为8.6 mmol/L),于37 ℃条件下恒温摇床酶解2 h。期间在不同消化时间(30、60、120 min)取样待测。消化后的样品经165 000 g离心95 min制备胶束,测定总酚含量。同时对体外消化过程中的亚基降解情况进行SDS-PAGE的分析以及蛋白可溶性氮释放量测定,并计算生物可接受率:生物可接受率=(胶束中总酚质量/蛋白总酚质量)×100%。
蛋白消化过程中释放的可溶性氮释放量的测定采用TCA-NSI法。取3 mL不同消化时间的样品溶液加入3 mL 10%TCA,静置30 min后离心(5 000 g,20 min),弃去上清液,沉淀部分再次用10%TCA洗涤、离心,弃去上清液即得TCA不溶组分,然后测定其中的氮含量。样品蛋白质总氮和TCA不溶性氮含量均采用杜马斯定氮仪进行测定。消化过程中氮释放量(%)按下式计算:氮释放量=[(N0-Nt)/Ntot]×100%,式中:Nt为消化tmin时的TCA不溶性氮/mg,N0为消化0 min蛋白样品中的TCA不溶性氮/mg,Ntot为蛋白样品中的总氮量/mg。
1.3 数据统计与分析
应用SPSS 17.0软件中的One-Way ANOVA对所有数据进行方差分析,利用Duncan′s多重比较对差异显著性进行分析;数据以平均值±标准偏差(Means±SD)表示,P<0.05表示显著。
2 结果分析与讨论
2.1 苦荞麦基本成分分析
荞麦中的蛋白和多酚含量因品种的差异有很大不同,而其中多酚在苦荞籽中的含量较为丰富[1,8]。所选苦荞籽不仅含有优良丰富的全价蛋白质[(12.28±0.24)%,湿基],而且还含有丰富的多酚(2.41±0.03)%,远高于其他谷物,如小麦、大米、高粱等[7,18]。荞麦不同部位的蛋白、多酚含量相差较大(表1)。大量的蛋白和多酚富集在苦荞的皮层部位,蛋白质和多酚质量分数分别为(15.66±1.03)%和(2.96±0.05)%,而在芯层中的含量显著(P<0.05)低于皮层中,这是因为在芯层中淀粉含量较高[19]。多酚与蛋白质具有较强的相互作用(疏水相互作用和氢键结合)[20],使得大部分多酚同蛋白一起存在于苦荞皮层中,其中以结合态存在的多酚约占总酚的41.5%。综上可得,苦荞皮层粉为制备富含多酚荞麦蛋白的优选原料。
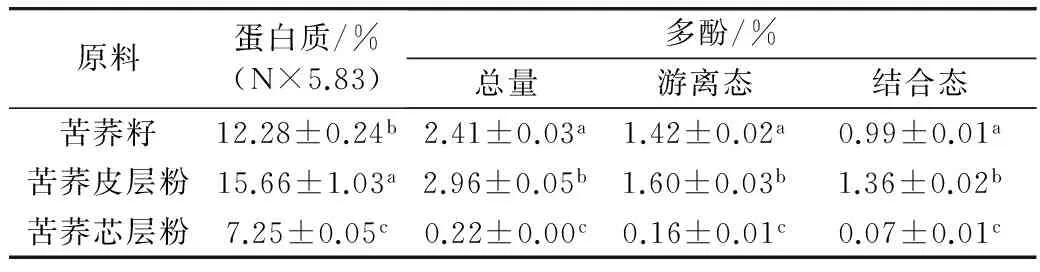
表1 苦荞麦基本组成分析(n=3)
注:不同小写字母表示同一列数值间有显著性差异(P<0.05),余同。
2.2 不同制备方法对BPC纯度、得率及多酚回收率的影响
以苦荞皮层粉为原料对比了不同制备方法对荞麦浓缩蛋白回收率、纯度以及多酚回收率的影响。由表2可知,双酶法的蛋白回收率(57.93%)显著(P<0.05)高于碱溶酸沉法(33.35%)与盐提法(38.40%),这是因为在淀粉酶-糖化酶的双酶解作用下使大量存在的淀粉颗粒酶解成分子量较小的寡糖及单糖并在超滤过程中脱除,而全蛋白组分被截留下来,提高回收率;碱溶酸沉法与盐提法是通过改变蛋白分子周围电荷,沉淀或提高蛋白分子与水分子间的相互作用而分离得到蛋白,主要获得为水溶性清蛋白与盐溶性球蛋白[13],回收率相对较低,分别为(33.35±1.5)%和(38.40±4.29)%。双酶法获得的蛋白纯度相对较低(49.07%),这是由于淀粉酶和糖化酶仅仅除去淀粉,而保留了活性多酚、膳食纤维和维生素等。还值得一提的是,前期的试验仅仅使用480Lα-淀粉酶对苦荞皮层粉进行酶解提取蛋白,获得的蛋白纯度仅有28.91%;而添加糖化酶的双酶法处理后,蛋白纯度提高了近一倍,这是因为淀粉酶酶解长链淀粉、结合糖化酶酶解成寡糖,更有利于超滤膜脱除淀粉,提高了蛋白含量。此外,双酶法显著(P<0.05)保留了多酚成分(70.89±1.15)%,这可能是因为双酶法高效地保留了蛋白,而多酚多与蛋白多以结合方式存在(表1),促进多酚随同蛋白一起被保留下来。而碱溶酸沉法与盐提法则由于蛋白回收率不高,可推测在离心过程中部分多酚伴随蛋白被除去,因而多酚回收率也相对偏低。
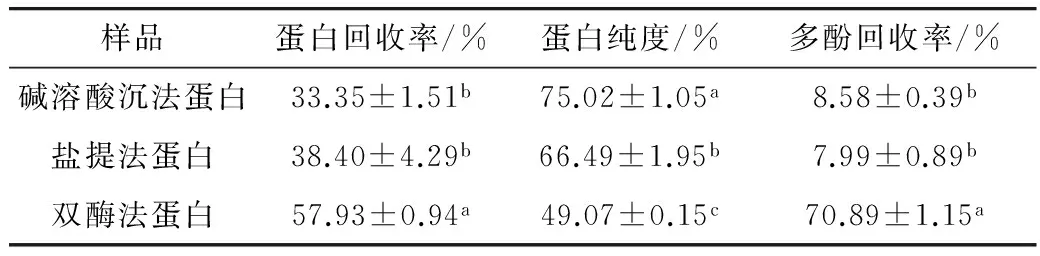
表2 不同方法制备的荞麦蛋白纯度、回收率及多酚回收率(n=3)
2.3 不同方法制备的BPC凝胶色谱电泳分析
荞麦中蛋白质的主要成分是盐溶性球蛋白,主要由分子质量280 ku的13S球蛋白组成,约占总蛋白的43%,由43~68、57~58、26~36 ku的亚基多肽链构成,链与链之间由二硫键连接;8S球蛋白的亚基分子分子量约为60 ku,相对含量较低[13];2S清蛋白主要分子带则集中在8~16 ku的范围内[13]。苦荞皮层粉和3种方法制备的荞麦蛋白在还原状态下的电泳图谱,如图1。双酶法制备的蛋白与苦荞皮层粉原料的分子量分布基本一致,其蛋白质分子质量主要集中在36 ku以及26 ku附近,而碱溶酸沉法和盐提法制备的蛋白缺少60 ku以上的条带。碱溶酸沉法蛋白和盐提法蛋白与原料间的差异可能是在离心操作过程中,分子质量大的蛋白聚集体随沉淀物被分离除去。说明双酶法制备的蛋白能有效保留原料蛋白质的全组分。

图1 苦荞皮层粉及3种荞麦浓缩蛋白的SDS-PAGE图谱(M道电泳带为标准蛋白,1~4道电泳带分别为:苦荞皮层粉、碱溶酸沉法蛋白、盐提法蛋白、双酶法蛋白)。
2.4 不同制备方法对BPC多酚存在方式的影响
植物多酚是人类膳食中的一类重要活性成分,其与蛋白质的络合反应是其最重要的特性之一[20]。图2比较了苦荞皮层粉原料以及3种方法提取蛋白的总酚含量、共价结合酚以及以弱电作用结合的游离酚的含量[21]。碱溶酸沉法蛋白、盐提法蛋白、双酶法蛋白的总酚质量分数分别为3.65%、2.67%和11.35%,双酶法制备的荞麦蛋白中总酚含量是碱溶酸沉法的3.1倍,是盐提法的4.3倍。碱溶酸沉法和盐提法蛋白中结合酚含量显著(P<0.05)高于游离酚,而双酶法蛋白的多酚含量相对较高。这可能是不同处理方法对多酚-蛋白质相互作用影响的结果[22-23]。

图2 苦荞麦皮层粉及不同方法制备的荞麦浓缩蛋白的多酚存在方式
2.5 不同制备方法对BPC溶解度的影响
溶解性直接影响蛋白质的功能性质。3种方法制备的荞麦蛋白的溶解度-pH曲线(图3)显示,在pH 2.0~9.0的环境下,荞麦蛋白溶解性:盐提法蛋白>碱溶酸沉法蛋白>双酶法蛋白。蛋白质的溶解性差异与制备方法相关,盐提法蛋白之所以具有良好的溶解性,是由于盐提法制备的蛋白以可溶性清蛋白和球蛋白为主(图 1),此外,有研究表明添加NaCl(1.0 mol/L)能明显提高BPC的溶解性[24];双酶法制备的蛋白多酚含量相对高,疏水多酚与蛋白的结合会导致其低溶解性[21]。此外,索氏提取法测得双酶法蛋白的粗脂肪质量分数(13.30%)高于碱溶酸沉法(8.39%)和盐提法蛋白(4.19%),为高油脂蛋白。当pH远离等电点时,净电荷增加并分裂蛋白聚合体而起到增溶作用,脂肪的存在会减弱蛋白聚合体的这种分裂[25]。
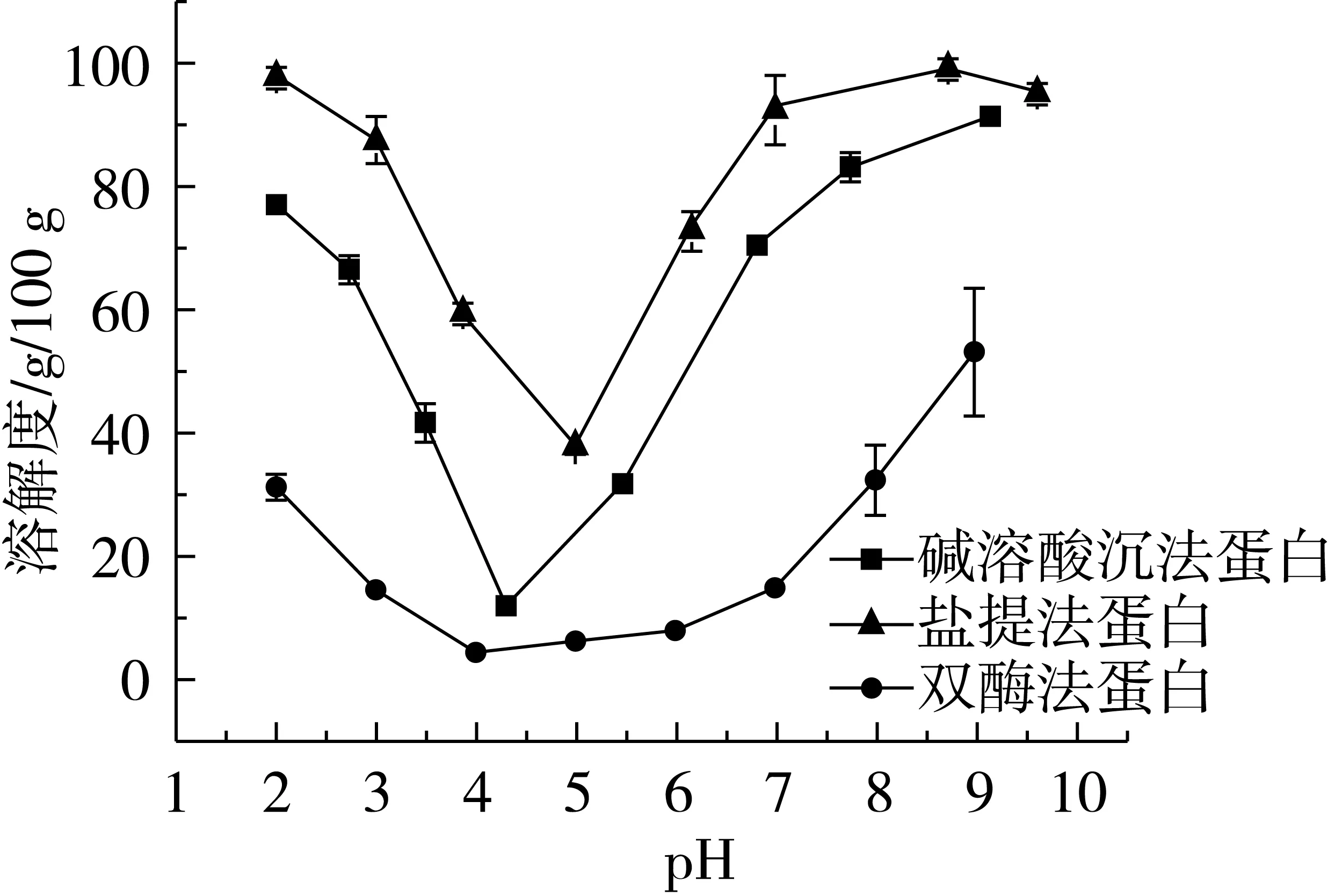
图3 不同方法制备的荞麦浓缩蛋白的溶解度-pH曲线
2.6 体外消化
研究了胃蛋白酶-胰蛋白酶体外模拟人体胃肠消化过程以考察荞麦浓缩蛋白的体外消化性,如图4所示。胃蛋白酶消化结束后,碱溶酸沉法和盐提法蛋白中分子质量大于36 ku的组分被裂解形成分子质量较低的寡肽,而小于14.4 ku的组分仍然存在,这与Ikeda等[26]的报道相似,而D-BPC的亚基降解要更慢于前2种蛋白。胰蛋白酶消化结束后,3种蛋白中分子质量大于14.4 ku的组分几乎都裂解,说明大部分小分子质量的寡肽被继续裂解成分子质量更小的肽(已经难以染色或跑出分离胶),这与随后的可溶性氮释放情况是一致的。

图4 不同方法制备的荞麦浓缩蛋白体外消化过程的SDS-PAGE图谱(从左到右泳道1为标准分子质量蛋白,2、3、4依次为碱溶酸沉法蛋白消化0、60、180 min,5、6、7依次为盐提法蛋白消化0、60、180 min,8、9、10依次为双酶法蛋白消化0、60、180 min)。
蛋白体外消化过程中的可溶性氮释放变化可以补充说明SDS-PAGE结果。如图5a所示,在胃蛋白酶消化阶段,3种蛋白质的可溶性氮释放量增加趋势相似,都是在0~30 min内急剧增加,然后增加缓慢,直到胃蛋白酶消化结束而到达最大值;在进一步的胰蛋白酶消化阶段,盐提法与双酶法蛋白的变化趋势较碱溶酸沉法蛋白缓慢,消化结束时3种蛋白的可溶性氮释放量依次是碱溶酸沉法蛋白(61.22%)>盐提法蛋白(49.52%)>双酶法蛋白(43.30%)。该结果说明荞麦蛋白是抗消化蛋白,其中富含多酚的双酶法蛋白体现了良好的抗消化性,这与Tang等[8]的报道一致。这是因为在消化过程中,多酚一方面可与消化酶结合导致消化率降低,另一方面,其与蛋白质结合形成的复合物也在一定程度上阻碍了人体对蛋白质的吸收和利用[27]。

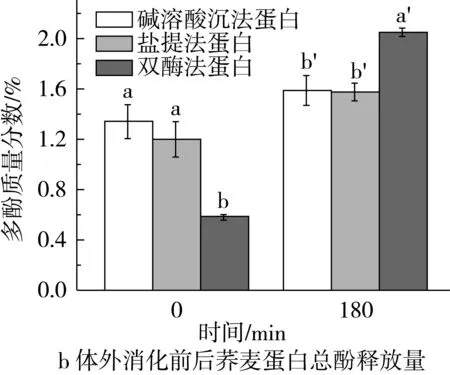
图5 不同方法制备的荞麦浓缩蛋白体外消化过程中氮释放量的变化以及消化前后的总酚释放量
生物可接受率被定义为胃肠道内从食物基质释放或者萃取并可用于肠吸收的复合物。本研究模拟消化阶段可释放到胶束相并可用于通过绒毛上皮细胞吸收的多酚含量。结果表明,体外消化前碱溶酸沉法蛋白超速离心后的上清液中的总酚含量最高(图5b)。经过体外消化后双酶法蛋白胶束中的总酚量大大提高(2.05%),显著高于碱溶酸沉法和盐提法蛋白,通过计算,生物可接受率由0.96%增加至5.22%,生物可接受率的增加可归因于胶束的形成使得消化过程中多酚的溶解性提高。
3 结论
以苦荞皮层粉作为原料,双酶法制备的荞麦浓缩蛋白富含多酚特点突出,蛋白回收率57.93%,总酚质量分数11.35%,显著高于碱溶酸沉法(3.1倍)和盐提法(4.3倍)。此外,该蛋白组分完整,虽然溶解性较低,但体外消化试验表明该蛋白的胶束总酚释放量高达2.05%,显著(P<0.05)高于碱溶酸沉法和盐提法得到的蛋白,而氮释放量较低43.30%,是良好的抗消化蛋白。双酶法能高效、环保地提高荞麦蛋白的回收率、较大程度地保留活性多酚,是未来制备高活性成分蛋白产品的一种趋势。
[1]Zielinski H, Gimenez-Bastida J A. Buckwheat as a functional food and its effects on health[J]. Journal of Agricultural and Food Chemistry, 2015, 63(36): 7896-7913
[2]Krkoskova B, Mrazova Z. Prophylactic components of buckwheat[J]. Food Research International, 2005, 38(5):561-568[3]Wang M, Liu J, Gao J, et al. Antioxidant activity of tartary buckwheat bran extract and its effect on the lipid profile of hyperlipidemic rats[J]. Journal of Agricultural and Food Chemistry, 2009, 57(11):5106-5112
[4]Steadman K J, Burgoon M S, Lewis B A, et al. Buckwheat seed milling fractions: Description, macronutrient composition and dietary fibre[J]. Journal of Cereal Science, 2001, 33(3):271-278
[5]Tomotake H, Kayashita J, Kato N. Hypolipidemic activity of common (FagopyrumesculentumMoench) and tartary (FagopyrumtataricumGaertn.) buckwheat[J]. Journal of the Science of Food and Agriculture, 2015, 95(10):1963-1967
[6]Kayashita J, Shimaoka I, Nakajoh M, et al. Feeding of buckwheat protein extract reduces hepatic triglyceride concentration, adipose tissue weight, and hepatic lipogenesis in rats[J]. The Journal of Nutritional Biochemistry, 1996, 7(10):555-559
[7]Guo X, Ma Y, Parry J, et al. Phenolics content and antioxidant activity of tartary buckwheat from different locations[J]. Molecules, 2011, 16(12):9850-9867
[8]Tang C. Functional properties and in vitro digestibility of buckwheat protein products: Influence of processing[J]. Journal of Food Engineering, 2007, 82(4):568-576
[9]Zhang Z, Zhou M, Tang Y, et al. Bioactive compounds in functional buckwheat food[J]. Food Research International, 2012, 49(1):389-395
[10]Ishii S, Katsumura T, Shiozuka C, et al. Anti-inflammatory effect of buckwheat sprouts in lipopolysaccharide-activated human colon cancer cells and mice[J]. Bioscience Biotechnology and Biochemistry, 2008, 72(12):3148-3157
[11]Lee S, Han Y, Do J, et al. Allergenic potential and enzymatic resistance of buckwheat[J]. Nutrition Research and Practice, 2013, 7(1):3-8
[12]朱慧,涂世,刘蓉蓉,等. 酶法提取苦荞麦蛋白的理化性质和加工性质[J]. 食品科学,2010,31(19):197-203 Zhu Hui, Tu Shi, Liu rongrong, et al. Physico-chemical and functional properties of enzymatically prepared tatary buckwheat protein[J]. Food Science, 2010,31(19):197-203
[13]王晓燕. 多酚对荞麦蛋白物化、营养及结构性质的影响[D]. 广州:华南理工大学,2010 Wang Xiaoyan. The effect of polyphenols on physicochemical, nutritional and structural properties of buckwheat proteins[D]. Guangzhou: South China University of Technology, 2010
[14]Carbonaro M, Grant G, Cappelloni M, et al. Perspectives into factors limiting in vivo digestion of legume proteins: Antinutritional compounds or storage proteins[J]. Journal of Agricultural and Food Chemistry, 2000, 48(3):742-749[15]Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227(5259):680-685
[16]White D A, Fisk I D, Makkhun S, et al. In vitro assessment of the bioaccessibility of tocopherol and fatty acids from sunflower seed oil bodies[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13):5720-5726
[17]Wu N, Huang X, Yang X, et al. In vitro assessment of the bioaccessibility of fatty acids and tocopherol from soybean oil body emulsions stabilized with iota-carrageenan[J]. Journal of Agricultural and Food Chemistry, 2012, 60(6):1567-1575
[18]Taylor J R N, Belton P S, Beta T, et al. Increasing the utilisation of sorghum, millets and pseudocereals: Developments in the science of their phenolic phytochemicals, biofortification and protein functionality[J]. Journal of Cereal Science, 2014,59(3):257-275
[19]魏益民,王立宏,张国权. 荞麦籽粒结构的观察与分析[J]. 西北植物学报,1997,17(4):474-477 Wei Yimin, Wang Lihong, Zhang Guoquan. Observation and analysis of the structure of buckwheat (Fagopyrum) kernel[J]. Acta Botanica Boreali-Occidentalia Sinica,1997,17(4):474-477
[20]Rohn S. Possibilities and limitations in the analysis of covalent interactions between phenolic compounds and proteins[J]. Food Research International, 2014,65, Part A:13-19
[21]Tang C, Wang X. Physicochemical and structural characterisation of globulin and albumin from common buckwheat (FagopyrumesculentumMoench) seeds[J]. Food Chemistry, 2010, 121(1):119-126
[22]Kawamoto H, Nakatsubo F. Effects of environmental factors on two-stage tannin-protein co-precipitation[J]. Phytochemistry, 1997, 46(3):479-483
[23]Haslam E. Natural polyphenols (vegetable tannins) as drugs: possible modes of action[J]. Journal of Natural Products, 1996, 59(2):205-215
[24]Metzger B T, Barnes D M, Reed J D. Insoluble fraction of buckwheat (Fagopyrumesculentummoench) protein possessing cholesterol-binding properties that reduce micelle cholesterol solubility and uptake by caco-2 cells[J]. Journal of Agricultural and Food Chemistry, 2007, 55(15):6032-6038
[25]米宏伟,唐传核,杨晓泉. 加工工艺对荞麦蛋白功能特性的影响[J]. 食品与发酵工业,2006,32(2):128-131 Mi Hongwei, Tang Chuanhe, Yang Xiaoquan. Functional properties of buckwheat protein: influence of processing[J]. Food and Fermentation Industries,2006,32(2):128-131
[26]Ikeda K,Kishida M. Digestibility of proteins in buckwheat seed [J]. Fagopyrum, 1993,13:21-24
[27]Donnelly E D, Anthony W B. Relationship of tannin, dry matter digestibility and crude protein in Sericea lespedeza[J]. Crop Science, 1969, 9(3):361-362.
Evaluation of Double-Enzyme Extraction andinvitroDigestion of Buckwheat Protein Concentrate Rich in Polyphenols
Chen Yajun Chen Xiaowei Yang Xiaoquan Guo Jian Wang Jinmei
(School of Food Science and Engineering; Guangdong Province Key Laboratory for Green Processing of Natural Products and Product Safety, South China University of Technology, Guangzhou 510640)
The aim of this work was to develop a new method, double-enzyme extraction in combination with membrane separation, to prepare buckwheat protein concentrate (BPC) rich in polyphenols. Double-enzyme extraction method and traditional protein preparation method, the alkaline extraction-acid precipitation method and the salt extraction method, were compared in regard to the protein content and recovery, polyphenols contents and recovery and the solubility of BPC. In addition, the in vitro digestion of protein was also evaluated combined with SDS-PAGE, nitrogen release and polyphenols micelle release analysis. Compared to alkaline extraction-acid precipitation and salt extraction, double-enzyme extraction showed the highest protein recovery (57.93%), with a protein content of 49.07%. Furthermore, double-enzyme extraction method displayed the highest polyphenols contents(11.35%) and recovery (70.89%), compared to those of the alkaline extraction-acid precipitation method(3.65% and 8.58%, respectively) and the salt extraction method (2.67% and 7.99%, respectively). Similar results from the SDS-PAGE analysis of BPC prepared by these three methods were observed after theinvitrodigestion. Additionally, the nitrogen release of BPC from double-enzyme extraction method was only 43.30%, whereas the micellar polyphenol released was up to 2.05%, suggesting that the buckwheat protein concentrate prepared from double-enzyme extraction possessed a high resistibility to digestion.
buckwheat protein concentrate, polyphenols, double-enzyme extraction, alkaline extraction-acid precipitation, salt extraction method,invitrodigestion
国家自然科学基金(31130042、31371744)
2015-10-03
陈雅君,女,1991年出生,硕士,植物蛋白加工与利用
杨晓泉,男,1965年出生,教授,博士生导师,植物蛋白加工与利用
TS201.1
A
1003-0174(2017)02-0067-07
