环氧合酶-2、前列腺素E2在百草枯诱导肺纤维化大鼠中的表达
2017-08-03潘东峰梁沛枫肖红燕梁诗颂
潘东峰,梁沛枫,肖红燕,梁诗颂
·论 著·
环氧合酶-2、前列腺素E2在百草枯诱导肺纤维化大鼠中的表达
潘东峰1,2,梁沛枫2,3,肖红燕2,4,梁诗颂1,2
目的 观察百草枯诱导的肺纤维化大鼠中环氧合酶-2(COX-2)、前列腺素E2(PGE2)的表达水平。方法 24只SD大鼠随机分为实验组和对照组各12只,实验组给予百草枯(50 mg/kg)一次性腹腔注射。HE染色观察染毒后28 d肺组织病理改变,双抗体夹心法测定大鼠血清、肺泡灌洗液(BALF)中COX-2、PGE2水平,免疫组化检测肺组织中COX-2、PGE2表达。结果 与对照组相比,实验组染毒28 d后可见肺纤维改变,血清和BALF中COX-2表达水平均显著增高[(371.02±23.19)比(958.24±35.29),(351.09±22.54)比(943.68±33.17)pg/mL,P均<0.05);血清和BALF中PGE2表达水平均显著增高[(110.56±12.30)比(366.23±17.54),(113.58±11.40)比(367.17±19.05)ng/L,P均<0.05)];肺组织COX-2和PGE2阳性细胞数分级、阳性细胞显色强度分级和IHS评分均显著增高(COX-2:9.00±2.09比36.67±3.07,1.00±0.00比2.83±0.40,1.33±0.52比5.67±0.81;PGE2:9.83±1.72比38.83±2.56,1.17±0.41比2.67±0.52,1.33±0.52比3.67±1.96,P均<0.05)。结论 COX-2、PGE2在百草枯诱导的肺纤维化大鼠中高表达,参与了肺纤维的病理过程。
百草枯;环氧合酶-2;前列腺素E2;肺纤维化
百草枯(Paraquat,PQ)中毒诱发的肺间质纤维化作为一种不可逆的病理损伤,是导致患者死亡的重要原因[1],但至今其病理机制还未阐明[2]。近年来研究发现,百草枯中毒后的炎症反应参与了组织器官的损害和最终的纤维化[3-6]。前列腺素E(PGE2)是炎症反应的主要炎性介质之一,而环氧合酶-2(COX-2)则是促进前列腺素类物质表达的诱导型酶,PGE2、COX-2是否参与百草枯中毒后肺纤维化过程尚不清楚。本研究通过百草枯诱导肺纤维化大鼠的实验性研究,旨在阐明COX-2-PGE2通路在百草枯肺纤维化中的作用,为进一步认识百草枯肺纤维化的发病机制、防治中毒后肺纤维化的发展提供新的思路和依据。
1 材料与方法
1.1 主要试剂与仪器:市售百草枯(20%有效成分,江金帆达生化股份公司),COX-2一抗,PGE2一抗,第二抗体试剂SP-9001 试剂盒,DAB显色试剂试剂盒(上海碧云天生物技术有限公司)。BX51T-PHD-J11显微镜(日本,奥林巴斯),多功能真彩色细胞图象分析管理系统CMOS(日本,奥林巴斯),Image-Pro Plus(美国,Media Cybernetics 公司)。
1.2 动物模型制备:清洁级Sprague-Dawley(SD) 大鼠24 只,雌雄各半,鼠龄8~10周,体重180~220 g,购自西安交通大学动物实验中心,动物批号:201401224。SD大鼠室温下适应性喂养1周后进行实验。实验组大鼠均给予PQ(50 mg/kg)一次性腹腔注射,后进行标准喂养直至处死;对照组大鼠常规喂养。
1.3 标本采集:实验大鼠在染毒后0 d、28 d分别取6只,10%水合氯醛(0.3 mL/kg)腹腔注射麻醉后开腹,取腹主动脉血3 mL;尖端磨平的14号针头插入气管中,结扎后经气管分3次向右肺内注入生理盐水3 mL,缓慢回抽收集肺泡灌洗液(BALF),回收率>70%。动脉血、BALF 1 200 r/min离心10 min后取上清液,分装于-70 ℃冻存待测;结扎左肺门,于结扎线外侧切除左肺,置于10%甲醛溶液固定24 h,常规石蜡包埋,切片,行HE染色观察肺组织病理改变。
1.4 HE和Masson染色
1.5 血清、BALF中COX-2、PGE2水平测定:双抗体夹心法测定大鼠血清、BALF中COX-2、PGE2水平。纯化的抗COX-2、抗PGE2抗体制成固相抗体,COX-2、PGE2分别与 HRP 标记的羊抗大鼠抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物 TMB 显色。用酶标仪在 450 nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中大鼠血清、BALF中COX-2、PGE2浓度。
1.6 免疫组化:肺组织少许于磷酸盐缓冲液冲洗,4%多聚甲醛(0.1 MPBS,pH 7.0~7.6,含0.1%DEPC)固定,乙醇脱水后石蜡包埋、切片。切片依次经脱蜡、入水0.1 MPBS冲洗,0.01 M柠檬酸盐缓冲液(pH 6.0)修复;5%正常山羊血清封闭一抗4 ℃孵育24 h,二抗37 ℃孵育20 min,0.1MPBS洗3次×5 min;滴加辣根酶标记链霉卵白素工作液(S-A/HRP),37 ℃ 20 min,0.1 MPBS冲洗;DAB显色6 min,充分水洗;苏木素复染细胞核1 min,充分水洗、1%盐酸酒精分化、1%胺水反蓝、充分水洗,经70%乙醇5 min、梯度乙醇脱水、二甲苯透明、中性树脂封片。选择实验组和对照组免疫组化染色切片的阳性和阴性组织相,进行100×显微照相,随机选取5个视野进行免疫组化评分,采用 IHS 评分标准[7],A为阳性细胞数分级:0~1%=0,1%~10%=1,10%~50%=2,50%~80%=3,80%~100%=4;B为阳性细胞显色强度分级:0(阴性),1(弱阳性),2(阳性),3(强阳性);IHS=A×B:“-”为0分,“+”为1~4分,“++”为5~8分,“+++”为9~12分。

2 结果
2.1 HE和Masson染色:对照组HE染色见肺泡结构完整,肺泡壁无增厚,肺泡腔大小均匀,腔内未见中性粒细胞浸润;实验组HE染色可见肺泡轻度融合扩张,肺间隔轻度增生; Masson染色肺泡腔腔内可见大量纤维素样渗出物,肺间隔增宽,纤维组织增生(图1-图3,目录后)。
2.2 血清和BALF中COX-2表达水平:实验组与对照组血清和BALF中COX-2表达水平在0 d差异无统计学意义(P>0.05),实验组染毒28 d后,血清和BALF中COX-2表达水平均显著高于对照组(P<0.05),见表1。
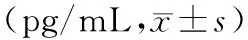
表1 百草枯诱导肺纤维化大鼠血清和BALF中COX-2表达水平
2.3 血清和BALF中PGE2表达水平:实验组与对照组血清和BALF中PGE2表达水平在0 d差异无统计学意义(P>0.05),实验组染毒28 d后,血清和BALF中PGE2表达水平均显著高于对照组(P<0.05),见表2。
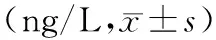
表2 百草枯诱导肺纤维化大鼠血清和BALF中PGE2表达水平
2.4 肺组织中COX-2、PGE2免疫组化:免疫组化结果显示,实验组肺组织中COX-2和PGE2较对照组显著高表达(图4-图7,目录后),定量结果显示见表3;实验组COX-2和PGE2阳性细胞数分级、阳性细胞显色强度分级和IHS评分均显著高于对照组(P<0.05)。
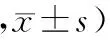
表3 百草枯诱导肺纤维化大鼠肺组织中COX-2、PGE2免疫组化评分比较(分
3 讨论
百草枯中毒后的肺纤维化的发生机制非常复杂,近年来随着对百草枯中毒分子生物学机制研究的深入,人们发现百草枯中毒后除了百草枯本身理化作用外,还有大量的炎性因子和细胞因子,如肿瘤坏死因子-α(TNF-α)、白介素-10(IL-10)、核转录因子(NF-КB)等都有被报道参与了组织器官的损害和最终的纤维化[3-6],因而百草枯中毒后的炎症反应受到越来越多的重视。
花生四烯酸-诱导型酶COX-2-PGE2这一通路是炎症反应的中心环节,而肺为这一途径中的终极代谢产物PGE2灭活的主要器官(其首次经过肺循环后,可有95%被代谢)。既往研究中[8-11],COX-2-PGE2通路被证实在博来霉素诱导的肺纤维化过程中扮演重要作用,由此推论COX-2-PGE2通路是博来霉素诱导的肺纤维化的主要机制。但此推论仅仅是基于博来霉素诱导的肺纤维化模型研究所得,在百草枯所致的肺纤维化模型中是否具有相同的机制还有待进一步明确。前期已有学者证实[12],PQ中毒后大鼠肺内脂肪酸及羟脯氨酸含量均明显上升,而羟脯氨酸含量则是衡量肺间质纤维化的一个指标,这似乎是PQ中毒患者出现肺间质纤维化的一个因素。但在研究中并未涉及花生四烯酸(AA)的代谢终产物PGE2及代谢途径中重要的限速酶COX-2的表达情况。基于上述理论基础,我们假设,COX-2-PGE2通路参与了百草枯诱导的肺纤维化过程。
研究结果显示,在百草枯诱导的肺纤维化过程中,COX-2和PGE2均出现高表达,证实COX-2和PGE2在参与了百草枯诱导的肺纤维化病理过程。追溯其理论基础,在炎症刺激如物理、化学等因素的作用下,细胞的磷脂酶被激活,从磷脂酶中释放出AA,AA在环氧合酶(COX)等一系列酶的催化作用下最终会生成主要代谢产物-前列腺素类(PGs)。COX有两种同工酶,即组成性酶COX-1和诱导型酶COX-2,其中诱导型酶COX-2在正常情况下并不存在,仅在各种化学、物理性损伤和生物因子(细胞因子、生长因子、内毒素等)刺激下,经过信号转导作用于COX-2的5’端转录起始点上游区的转录调控序列,促进COX-2转录,从而诱导COX-2高表达,继而促进PGs的合成,介导疼痛、炎症和发热等反应。
本实验证实了COX-2和PGE2在百草枯诱导的肺纤维化病理过程中的表达情况,但研究仅局限于COX-2和PGE2与肺纤维化的关系,至于这一通路上的其他因子是否也具有相同的效果,以及肺纤维化过程与其他细胞因子、炎性介质是否存在复杂的关系,尚需要进一步验证。
[1] 卢中秋.急性百草枯中毒的救治:任重道远[J].中华危重病急救医学,2015,4:241.
[2] 史晓峰,张玥,王勇强.百草枯中毒的毒理机制及治疗进展[J].山东医药,2015,2:99-101.
[3] 杨书明.急性百草枯中毒血清炎性细胞因子的临床意义[J].中华劳动卫生职业病杂志,2015,33(9):695-697.
[4] 吴伟,刘莹,胡明,等.百草枯中毒大鼠肺TGF-β1,和c-Jun的表达及姜黄素的干预作用[J].中国医科大学学报,2011,40(1):12-16.
[5] 谢宗贤,徐兵,王繁麟,等.百草枯大鼠肺组织炎症因子TNF-α和IL-6的表达和水杨酸钠的干预作用[J].中华急诊医学杂志,2015,24(7):768-771.
[6] 王煜,孔冰冰,杨文萍.急性百草枯中毒患者血清细胞因子的变化与预后的相关性研究[J].中国急救医学,2016,36(10):897-900.
[7] Soslow RA,Dannenberg AJ,Rush D,et al.COX-2 is expressed in human pulmonary,colonic,and mammary tumors[J].Cancer,2000,89(12):2637-2645.
[8] Young LR,Pasula R,Gulleman PM,et al.Susceptibility of Hermansky-Pudlak mice to bleomycin-induced type II cell apoptosis and fibrosis[J].American Journal of Respiratory Cell and Molecular Biology,2007,37(1):67-74.
[9] 李志军,刘红栓,王今达.血必净联合前列腺素E1防治急性肺纤维化的实验研究[J].中华急诊医学杂志,2007,16(3):255-259.
[10] Phan SH.Fibroblast phenotypes in pulmonary fibrosis[J].American Journal of Respiratory Cell and Molecular Biology,2003,29(3 Suppl):S87-S92.
[11] Lovgren AK,Jania LA,Hartney JM,et al.COX-2-derived prostacyclin protects against bleomycin-induced pulmonary fibrosis[J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2006,291(2):L144-L156.
[12] Fukushima T,Tanaka K,Lim H,et al.Changes in the fatty acid composition and hydroxyproline content in rat lung in relation to collagen synthesis after paraquat administration[J].Fukushima Journal of Medical Science,2003,49(1):33-43.
Expression of cyclooxygenase 2 and prostaglandin E2in rats with paraquat induced pulmonary fibrosis
PAN Dongfeng1,2,LIANG Peifeng2,3,XIAO Hongyan2,4,LIANG Shisun1,2.
1.Department of Emergency,Ningxia People’s Hospital,Yinchuan 750002,China;2.The First Affiliated Hospital of Northwest University for Nationalities, Yinchuan 750002, China;3.Analysis department,Ningxia People’s Hospital,Yinchuan 750002,China;4.Pathology Department,Ningxia People’s Hospital,Yinchuan 750002,China
Objective To observe the expression of cyclooxygenase 2 (COX-2) and prostaglandin E2(PGE2) in rats with paraquat-induced pulmonary fibrosis.Methods 24 SD rats were randomly divided into the experimental group and control group (n=12),and the rats in the experimental group were given paraquat (50 mg/kg) by intraperitoneal injection for once.The pathology changes of lung tissue were evaluated by HE staining,the expression of COX-2 and PGE2in serum and alveolar lavage fluid (BALF) were detected by the double antibody clamp method,the expression of COX-2 and PGE2in lung tissue were detected by using the immunohistochemical method.Results Compared with the control group,pulmonary fibrosis changes were found in the experimental group after 28 days,the COX-2 expression in serum and BALF were significantly increased (371.02±23.19 vs.958.24 ± 35.29,351.09 ± 22.54 vs.943.68 ± 33.17) pg/ml (P<0.05);and PGE2in serum and BALF expression levels were significantly higher (110.56 ± 12.30 vs.366.23 ± 17.54,113.58 ± 11.40 vs.367.17±19.05 ng/L) (P<0.05);COX-2 of lung tissue and PGE2positive cells number classification,positive color intensity scale and IHS scores were significantly higher (COX-2:9.00±2.09 vs.36.67± 3.07,1.00±0.00 vs.2.83± 0.40,1.33±0.52 vs.5.67 ± 0.81 mm;PGE 2:9.83±1.72 vs.38.83±2.56,1.17± 0.41 vs.2.67±0.52,1.33± 0.52 vs.3.67 ±1.96) (P<0.05).Conclusion COX-2 and PGE2are higher expression in rats with pulmonary fibrosis induced by paraquat,they are participating in the pathological process of pulmonary fibrosis.
Paraquat;Cyclooxygenase2;ProstaglandinE2;Pulmonaryfibrosis
10.13621/j.1001-5949.2017.07.0588
宁夏自然科学基金项目(NZ14161)
1.宁夏人民医院急诊科,宁夏 银川 750002 2.西北民族大学第一附属医院,宁夏 银川 750002 3.宁夏人民医院统计室,宁夏 银川 750002 4.宁夏人民医院病理科,宁夏 银川 750002
潘东峰(1977-),男,副教授,副主任医师,主要从事急危重症、中毒等相关研究。
http://kns.cnki.net/kcms/detail/64.1008.R.20170713.0845.010.html
R735
A
2016-11-14 [责任编辑]王凯荣
