表现为环形强化的单发脑转移瘤和胶质母细胞瘤高场强MRI强化特征分析
2017-07-24张晓瑞王华锋杨素君王玉芳河北省邯郸市中心医院CT室河北邯郸05600河北省邯郸市中心医院核医学科河北邯郸05600
张晓瑞,申 静,侯 博,王华锋,杨素君,王玉芳(.河北省邯郸市中心医院CT室,河北 邯郸 05600;.河北省邯郸市中心医院核医学科,河北 邯郸 05600)
·论 著·
表现为环形强化的单发脑转移瘤和胶质母细胞瘤高场强MRI强化特征分析
张晓瑞1,申 静2,侯 博1,王华锋1,杨素君1,王玉芳1
(1.河北省邯郸市中心医院CT室,河北 邯郸 056001;2.河北省邯郸市中心医院核医学科,河北 邯郸 056001)
目的探讨环形强化的单发脑转移瘤和胶质母细胞瘤高场强MRI强化特征对二者的鉴别诊断价值。方法回顾性分析经手术病理证实为单发脑转移瘤和胶质母细胞瘤且术前行MRI增强检查表现为环形强化的病例,包括25例胶质母细胞瘤,9例单发脑转移瘤。结果单发脑转移瘤与胶质母细胞瘤在是否囊实性、囊变数目、 部分均匀囊壁占周长的比率、囊壁均匀性、囊壁厚薄、有无分隔方面差异均无统计学意义(P>0.05);胶质母细胞瘤内壁不光滑、外壁不光滑、轮廓不平滑、无张力的比例高于单发脑转移瘤,差异均有统计学意义(P<0.05)。结论与胶质母细胞瘤相比,内壁光滑、外壁光滑、轮廓平滑、有张力这些征象更多见于单发脑转移瘤,从而有助于二者鉴别。
胶质母细胞瘤;脑肿瘤;磁共振成像
胶质母细胞瘤和转移瘤是成人脑肿瘤最常见的恶性肿瘤,二者的鉴别对于制定合适的诊疗方案至关重要。当患者有明确的原发肿瘤病史同时颅内多发占位时,诊断颅内转移比较容易。但是当颅内仅仅表现为单发肿块时,鉴别诊断就比较困难。随着高场强MRI的广泛应用和MRI技术的发展,灌注、扩散张量成像DTI、弥散加权像等新技术被用来试图解决胶质母细胞瘤和单发脑转移瘤的鉴别问题[1-4]。尽管随着这些新技术的出现,二者的鉴别诊断仍然是一个难题。基于肿瘤的形态和信号特点,仍然是鉴别胶质母细胞瘤和单发脑转移瘤的可靠的检查方法[5]。大多数的胶质母细胞瘤和单发脑转移瘤伴有囊变,增强后呈明显环形强化,本研究探讨二者的MRI环形强化特征对鉴别单发脑转移瘤和胶质母细胞瘤的诊断价值。
1 资料与方法
1.1 一般资料 选择2013年1月—2016年12月我院手术或病理证实为胶质母细胞瘤或单发脑转移瘤且术前行MRI增强检查的患者44例(复发及术前经放化疗的患者、肿瘤伴出血者除外)。转移瘤12例中呈环形强化9例(脑转移瘤组),男性7例,女性2例,年龄56~75岁,平均(62.9±6.4)岁。胶质母细胞瘤32例中环形强化25例(胶质母细胞瘤组),男性16例,女性9例,年龄28~73岁,平均(52.4±12.0)岁。2组性别差异无统计学意义(P>0.05),脑转移瘤组年龄大于胶质母细胞瘤患者(P<0.05)。
1.2 扫描方法 应用GE DISCOVERY MR 750 超导磁共振扫描仪,标准8通道头线圈。对每位患者行横断面T1WI、T2WI、FLAIR序列扫描后,静脉注射钆喷替酸普甲胺(Gd-DTPA)行PWI扫描及增强T1WI扫描。
常规MRI扫描参数中轴位T1WI(T1-FLAIR序列):TR 460 s,TE 12 s,翻转角72 °。轴位T2WI(FSE 序列):TR 4 300 ms,TE 120 ms,翻转角90 °。轴位T2-FLAIR:TR 8 300 s,TE 150 ms,TI 2 100 ms,层厚5.0 mm,层间隔1.0 mm,视野范围(field of vision,FOV)22 cm×22 cm,矩阵256×256。矢状位T2WI(FRFSE序列):TR 3 300 ms,TE 95 ms,层厚5.0 mm,层间隔1.0 mm,FOV 22 cm×22 cm,矩阵384×384。经肘静脉快速注射钆喷酸葡胺造影剂(剂量0.1 mmol/kg)后行横断面、冠状面、矢状面增强扫描。
1.3 图像分析 2名高年资神经系统影像医师在不知道病理的条件下,对所采集的图像进行观察,记录肿瘤的发病部位、瘤体囊实性、环形强化是否均匀、是否存在部分均匀一致的囊壁以及占瘤体周长的比率、单囊还是多囊、囊壁厚薄(以3 mm为界)、囊壁是否均匀、内壁是否光滑、外壁是否光滑、病变是否存在分隔、病变是否存在张力、病变轮廓是否光整。
1.4 统计学方法 应用SPSS 17.0软件进行数据分析。计数资料比较分别采用χ2检验和构成比χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 单发脑转移瘤和胶质母细胞瘤的发病部位 单发脑转移瘤9例,病变部位位于额叶4例,颞叶1例,顶叶2例,小脑半球2例;胶质母细胞瘤25例,病变位于额叶13例,颞叶4例,顶叶5例,枕叶3例。脑转移瘤可以发生在幕上、幕下,胶质母细胞瘤发生在幕上。
2.2 单发脑转移瘤和胶质母细胞瘤的强化特征 单发脑转移瘤与胶质母细胞瘤在是否囊实性、囊变数目、均匀囊壁占周长的比率、囊壁均匀性、囊壁厚薄、有无分隔方面差异均无统计学意义(P>0.05);而胶质母细胞瘤内壁不光滑、外壁不光滑、轮廓不平滑、无张力的比例高于单发脑转移瘤,差异均有统计学意义(P<0.05)。见表1。
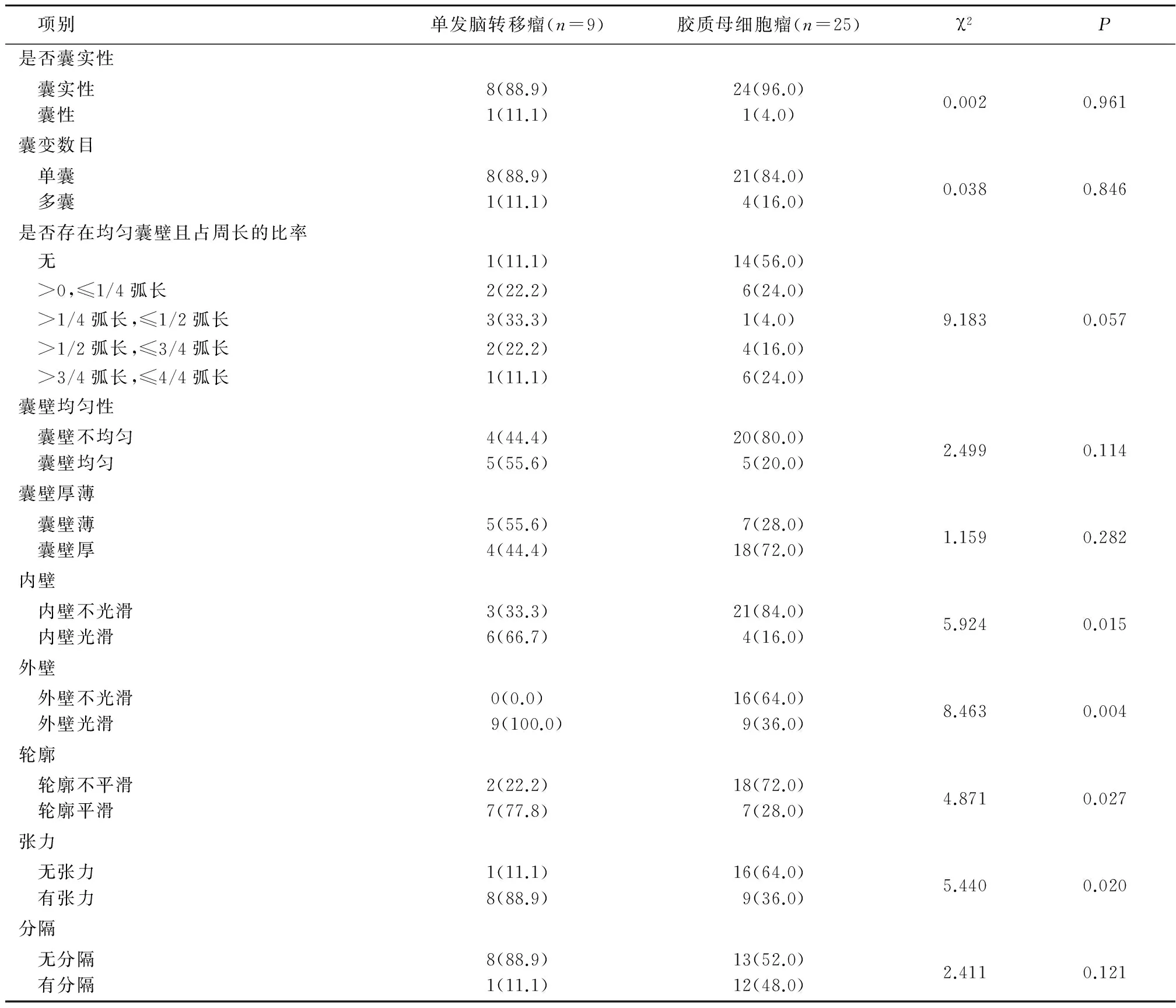
表1 单发脑转移瘤和胶质母细胞瘤的强化特征比较 (例数,%)
3 讨 论
颅内表现为环形强化的肿瘤和肿瘤样病变主要包括胶质母细胞瘤、脑转移瘤、脑脓肿、听神经瘤、颅咽管瘤、毛细胞星形细胞瘤、节细胞胶质瘤、多形性黄色星形细胞瘤、囊肿等[6-7]。脑脓肿一般发病比较急,症状比较重,MR弥散加权成像病变内呈明显高信号是其特征性表现,因此容易诊断。听神经瘤和颅咽管瘤为脑外肿瘤,前者位于桥小脑角区,往往伴有内听道扩大,后者位于鞍区,可以看到正常垂体,发病部位具有特征性,术前不难作出正确诊断。毛细胞星形细胞瘤多见于儿童,幕下多见。节细胞胶质瘤和多形性黄色星形细胞瘤多见于青少年。各种类型的囊肿影像表现比较典型,结合发病部位,也很容易确诊。囊性脑膜瘤比较少见,根据其实性成分的等T1等T2及明显均匀强化,也能够诊断。脑转移瘤多发并且伴明确原发肿瘤病史时,往往能够明确诊断。当转移瘤仅表现为孤立肿块时,其与胶质母细胞瘤往往很难鉴别。
脑转移瘤是成年人颅内最常见的肿瘤,占颅内肿瘤的20%~40%[8],其中单发脑转移瘤占所有颅内转移瘤的25%~30%[9],而其中大部分又表现为囊实性、囊性[10],增强后呈不同程度的环形强化。囊实性病变伴有壁结节,囊性病灶则为单纯环形强化。转移瘤可发生于任何年龄,但以40~70岁最为常见。临床主要以头痛、恶心呕吐等颅高压症状为主,也可以表现为相应部位的神经损害症状,极少数因脑卒中急性发病。原发肿瘤绝大部分为肺癌,还有就是消化系统恶性肿瘤、乳腺癌、甲状腺癌等,部分脑转移瘤原发灶不容易发现。转移瘤好发于大脑半球的皮髓质交界区,主要是因为供血动脉在皮髓质角交界处突然变细,瘤栓容易停留于此增殖。
胶质母细胞也是成年人常见的颅内肿瘤,发病高峰年龄为45~75岁,占颅内肿瘤的12%~15%,占所有星形细胞瘤的2/3。起源于髓质,位置往往较深。临床主要表现为头痛、恶心、呕吐等症状。胶质母细胞瘤高度恶性,血管丰富、生长较快,呈浸润性、膨胀性生长,一般呈团块状,肿瘤较大时病变中心因缺氧缺血坏死呈无强化或轻度强化,病变周围因血脑屏障破坏,增强后呈花环状、环状强化[11-13]。
胶质母细胞瘤和单发脑转移瘤的发病机制、临床进程、治疗计划和预后不同[14-15]。胶质母细胞瘤首选治疗方案是手术切除,脑转移瘤发现时,一般已无手术机会,只能保守治疗,因此术前鉴别二者对于采取何种治疗手段意义重大。基于肿瘤形态和MRI信号特点尤其是增强特征仍然是鉴别二者的可靠的影像方法。
脑转移瘤幕上多见,也可见于幕下,胶质母细胞瘤幕下罕见。本研究有2例幕下转移瘤,未见幕下胶质母细胞瘤。因此,发病部位对于二者的鉴别有一定的帮助。
绝大多数的单发脑转移瘤和胶质母细胞瘤伴有明显的囊变、出血、坏死,增强后病变中心为囊变、坏死的组织不强化,病变周围有血脑屏障的破坏呈环形、花环样强化。转移瘤早期时体积较小,多表现为圆形或类圆形结节样强化,后期肿瘤体积较大,病变中心容易发生囊变、坏死。胶质母细胞瘤早期一般不引起症状,不容易发现,当出现临床症状时肿瘤体积一般已经较大,中心也出现了囊变坏死。本研究单发脑转移瘤和胶质母细胞瘤呈环形强化的比例为75.0%(9/12)和78.1%(25/32)。脑转移瘤一般为血行转移,肿瘤来源于同一个细胞增殖,各个方向分化程度、生长速度一致,多为圆形或类圆形,肿瘤周围为血管源性水肿,无肿瘤细胞浸润,因此内外壁较光滑;胶质母细胞瘤因为肿瘤细胞各个方向分化程度、生长速度不同,并且为浸润性生长,所以一般呈厚薄不一的不规则环状、花环状强化,环壁内缘凸凹不平,外缘不光整,外缘可见星芒状突起。本研究胶质母细胞瘤的囊壁内、外壁大部分不光滑及轮廓不规整(84.0%、64.0%、72.0%),明显多于单发脑转移瘤(33.3%、0.0%、22.2%)。有学者研究认为转移瘤内侧壁不光整的比率为75%,外侧壁不光整的比率为18.3%[16]。本研究二者比例低可能与评估囊壁光滑与否将肿瘤的实性部分排除在外有关。除此之外,转移瘤瘤体高张力明显多于胶质母细胞瘤(88.9%vs36.0%),印证了转移瘤的各个方向的分化、生长速度一致性要高于胶质母细胞瘤。单发脑转移瘤和胶质母细胞在囊实性与否、囊变数目、均匀囊壁占周长的比率、囊壁均匀性、囊壁厚薄、是否存在分隔方面差异均无统计学意义。分房指病灶内有间隔形成,各房的大小形态及间隔厚度各异,病理基础是因为转移瘤来源于同一个肿瘤细胞增殖,各个方向生长速度一致,坏死一般发生在病变中心,较少见分房,而胶质母细胞瘤是多中心的,各个方向分化、生长不均,所以可形成分房。贾守强等[16]研究发现38.3%的胶质母细胞瘤,8.3%的转移瘤有分房征,分房征高度提示胶质瘤。分房征类似于本研究的分隔。本研究胶质母细胞瘤和脑转移瘤有分隔的比例分别为12/25、1/9,但差异无统计学意义。可能与本研究样本量太小有关。
本研究尚存在一些不足之处:样本量较小;各观察项目不可避免地受到观测者主观因素的影响;对于同样呈环形强化的其他高级别胶质瘤未纳入研究等。因此,本研究有待补充样本量,尽可能标准化各项观测项目,进一步探讨。
总之,与胶质母细胞瘤相比,内壁光滑、外壁光滑、轮廓平滑、有张力等征象更多见于单发脑转移瘤,这有助于术前鉴别单发脑转移瘤和胶质母细胞瘤,从而指导临床采取合适的诊疗方案。
[1] Halshtok Neiman O,Sadetzki S,Chetrit A,et al. Perfusion-weighted imaging of peritumoral edema can aid in the differential diagnosis of glioblastoma mulltiforme versus brain metastasis[J]. Isr Med Assoc J,2013,15(2):103-105.
[2] Bette S,Huber T,Wiestler B,et al. Analysis of fractional anisotropy facilitates differentiation of glioblastoma and brain metastases in a clinical setting[J]. Eur J Radiol,2016,85(12):2182-2187.
[3] Miquelini LA,Pérez Akly MS,Funes JA,et al. Usefulness of the apparent diffusion coefficient for the evaluation of the white matter to differentiate between glioblastoma and brain metastases[J]. Radiologia,2016,58(3):207-213.
[4] Jung BC,Arevalo-Perez J,Lyo JK,et al. Comparison of glioblastomas and brain metastases using dynamic contrast-enhanced perfusion MRI[J]. J Neuroimaging,2016,26(2):240-246.
[5] Maurer MH,Synowitz M,Badakshi H,et al. Glioblastoma multiforme versus solitary supratentorial brain metastasis:differentiation based on morphology and magnetic resonance signal characteristics[J]. Rofo,2013,185(3):235-240.
[6] 陶晓娟,孙波,戴建平.颅内磁共振成像环形强化病变[J].国外医学临床放射学分册,2003,26(2):67-70.
[7] 秦健,朱建忠,何艳丽,等.脑内环形强化病变的MRI诊断[J].实用放射学杂志,2013,29(1):11-14.
[8] Soffietti R,Rudā R,Mutani R. Management of brain metastases[J]. J Neurol,2002,249(10):1357-1369.
[9] 张晓东,许乙凯.脑单发转移瘤和星形细胞瘤的MRI鉴别诊断评价[J].临床放射学杂志,2007,26(2):109-112.
[10] 刘勇,罗丽,傅家庆.单发脑转移瘤MRI诊断与误诊分析[J].实用放射学杂志,2011,27(6):849-851,865.
[11] 李青,周晓军,苏敏.临床病理学[M].北京:人民卫生出版社,2009:713-718.
[12] Louis DN,Ohgaki H,Wiestler OD,et al. WHO classsification of tumorours of the central nervous system[M]. Lyon:International Agency for Reseach on Cancer,2007:33-49.
[13] 任建政,陈毓秀,徐杰,等.脑胶质母细胞瘤的MRI表现[J].实用放射学杂志,2012,28(6):843-845.
[14] Petchell RA. The mamagement of brain metastases[J]. Cancer Treat Rev,2003,29(6):533-540.
[15] Schiff D. Single brain metastasis[J]. Curr Treat Options Neurol,2001,3(1):89-99.
[16] 贾守强,李娜,李庆国.脑内环形强化病灶的MBI研究[J]. 实用诊断与治疗杂志,2007,21(7):525-526,529.
(本文编辑:许卓文)
2017-04-11;
2017-05-10
河北省医学科学研究重点课题(20171133)
张晓瑞(1982-),男,河北涉县人,河北邯郸市中心医院主治医师,医学硕士,从事医学影像学诊断研究。
R730.264;R739.41
B
1007-3205(2017)07-0841-04
10.3969/j.issn.1007-3205.2017.07.025
