应用RNA干扰技术沉默人恶性黑素瘤细胞株A375中PPO基因的实验研究
2017-07-24王正想张国强高顺强赵桂松刘思源河北省沧州市中心医院皮肤科河北沧州0600河北医科大学第四医院皮肤科河北石家庄0500河北医科大学第三医院骨与软组织肿瘤科河北石家庄05005
王正想,张国强,高顺强,赵桂松,刘思源*(.河北省沧州市中心医院皮肤科,河北 沧州 0600;.河北医科大学第四医院皮肤科,河北 石家庄 0500;.河北医科大学第三医院骨与软组织肿瘤科,河北 石家庄 05005)
·论 著·
应用RNA干扰技术沉默人恶性黑素瘤细胞株A375中PPO基因的实验研究
王正想1,张国强2,高顺强2,赵桂松3,刘思源3*
(1.河北省沧州市中心医院皮肤科,河北 沧州 061001;2.河北医科大学第四医院皮肤科,河北 石家庄 050011;3.河北医科大学第三医院骨与软组织肿瘤科,河北 石家庄 050051)
目的探讨RNA干扰技术沉默PPO基因对人恶性黑素瘤细胞株A375细胞生长的影响。方法用PPO腺病毒载体转染A375细胞,采用RT-PCR方法检测A375细胞PPO的表达变化,采用MTT比色分析法检测对A375细胞增殖的影响,采用流式细胞术,Annexin Ⅴ-FITC/PI双染色检测A375细胞早期凋亡的变化。结果实验组人黑色素瘤A375细胞PPO基因 mRNA校正值低于空载体组和阴性对照组(P<0.05)。转染PPO基因后3组第7天时细胞增殖OD值高于第1、3、5天,第5天时细胞增殖OD值高于第1、3天,第3天时细胞增殖OD值高于第1天(P<0.05);转染PPO基因后第1、3、5、7天时实验组细胞增殖OD值低于空载体组和阴性对照组(P<0.05)。转染PPO基因后3组第7天凋亡率高于第1、3、5天,第5天凋亡率高于第1、3天,第3天凋亡率高于第1天(P<0.05);第1、3、5、7天时实验组凋亡率高于空载体组和阴性对照组(P<0.05)。结论沉默PPO基因能诱导A375细胞早期凋亡,从而抑制A375细胞生长增殖。
黑色素瘤;基因沉默;RNA干扰
恶性黑色素瘤是一类起源于神经嵴的黑素细胞恶性肿瘤,发病率占皮肤恶性肿瘤的第3位(6.8%~20.0%)[1],是皮肤科领域最常引起死亡的恶性肿瘤。恶性黑色素瘤恶性程度高、发生转移早,目前的治疗方法不理想[2]。PPO(proliferation and phosphorylation oncogene)基因是利用克隆筛选技术找到的一个新的癌基因[3],该基因位于1p36区,编号为KIAA0090, DNA长度约36 000 bp,cDNA长度6 022 bp,共有25个外显子,编码993个氨基酸。RNA干扰技术是近年来发现的从基因水平治疗肿瘤的新方法。RNA干扰是一种由双链RNA诱发的基因沉默。RNA干扰技术是近年来发现的从基因水平治疗肿瘤的新方法,为治疗对化疗耐药的恶性黑色素瘤开辟了新的途径。本研究通过RNA干扰技术沉默PPO基因,抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路中PPO基因相关蛋白的表达,从而在细胞水平抑制恶性黑色素瘤的生长增殖。报告如下。
1 资料与方法
1.1 材料 人黑色素瘤细胞株A375由河北医科大学第四医院科研中心提供,EB腺病毒载体由武汉晶赛生物公司合成,四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)染色剂、DMEM(高糖型)培养基、 RT-PCR酶混合物试剂盒由美国 Fermentas公司提供,Trizol Reagent由美国Invitrogen公司提供。
1.2 方法
1.2.1 细胞培养 将人黑色素瘤A375细胞培养于含10%胎牛血清的DMEM培养液中(含浓度为100 U/mL青霉素、链霉素,pH 7.2~7.4),置于37 ℃、5% CO2饱和湿度的培养箱中常规传代培养。
1.2.2 细胞转染方法 4~6 h待细胞完全贴壁,小心吸出各孔培养液。设空白对照组(内无细胞只加培养基)﹑阴性对照组(单细胞悬液不加任何药物干预)﹑空转录病毒组(加入空载体)和实验组(加入PPO腺病毒载体),各组均加入不含牛血清的培养基100 μL,空转录病毒组加入HK 0.5 μL,实验组加入PPO 0.5 μL,感染时间为90 min,每15 min轻轻晃动培养液1次混匀。90 min后移除含病毒的无血清培养液,加入含血清的常规培养液,放入37 ℃、5% CO2饱和湿度的培养箱中继续培养。转染24 h后感染复数(multiplicity of infection,MOI)=5、10、20、50、100时转染效率分别为50%、67%、69%、70%、70%。MOI=50时转染效率达到最大且增大MOI值转染效率不再变化,故以下转染实验选取MOI=50时转染后不同时间对细胞的影响。
1.2.3 RT-PCR检测PPO基因mRNA的表达 转染A375细胞48 h后,用RT-PCR方法检测PPO基因mRNA表达,证明腺病毒已经成功转染A375细胞并部分沉默PPO基因。
细胞RNA的定量测定: 吸取2 μL RNA样品,经焦碳酸二乙酯水稀释,用紫外分光光度计分别测定260 nm和280 nm光密度值(OD260和OD280);RNA浓度以OD260×核酸稀释倍数×40/1 000的计算值表示;以OD260和OD280的比值(OD260/OD280)表示RNA的纯度,该比值为1.8~2.0说明RNA纯度较高,若该比值<1.8说明有酚、异硫氰酸胍、蛋白或DNA等物质污染。
RT-PCR引物设计:引物由上海捷瑞生物技术服务有限公司负责合成和PAGE纯化,用无菌去离子水稀释,PPO正义引物为5′-GCTTTCGGAG-AAGTCTAGTTCAAAG-3′,反义引物为5′-TCTCCACGAGGTATAGGTTAATGGT-3′;β-actin作为参照基因,正义引物为5′-GTGACTTT-GTCACAGCCCAAGA-3′,反义引物为5′-AACCTCCATGCTGCTGCTTACA-3′。琼脂糖凝胶电泳:分别取5 μL RT-PCR产物、Marker,在1.5%的琼脂糖凝胶中,恒压80 V电泳30 min后,用凝胶成像系统观察电泳结果,进行分析。
1.2.4 MTT比色法检测沉默PPO基因后A375细胞的增殖影响情况 ①实验分组:以A375细胞为研究对象,分为对照组(加入PBS),空载体组(加入Adrs-5),实验组(加入等量PPO)。②取对数生长期的A375细胞,制备单细胞悬液,进行细胞计数调整至1×104个细胞/200 μL,分别接种到5个不同的96孔板中,每组接种6个复孔细胞培养过夜,按上述转染步骤进行转染。转染后盖好盖子,周边贴胶布,在其上标明日期。放入37 ℃、5%CO2饱和湿度的培养箱中培养。分别在转染后第1、3、5、7天相同时间点前4 h,每孔加入20 μL MTT(5 g/L),37 ℃﹑5%CO2饱和湿度条件下继续培养4 h,4 h后弃上清液,每孔加入DMSO 150 μL,避光条件下振荡10~15 min,用全自动酶标仪于波长492 nm处测定各孔光吸收值,所有试验重复3次,记录结果。
1.2.5 流式细胞术检测转染后凋亡情况 ①常规于培养瓶内培养细胞,取生长状态良好的瓶装细胞,用0.25%胰蛋白酶消化细胞制备单细胞悬液,用血球计数板计数,调整细胞密度为1×106/瓶,将细胞悬液分到7个培养瓶中进行培养。待细胞培养过夜后,随机分为实验组、空载体组、阴性对照组。实验组又随机分为第1天组、第3天组、第5天组、第7天组,并做标记,分组后按上述转染步骤进行转染,继续放入37 ℃、5% CO2饱和湿度的培养箱中培养。②培养1 d后,取第1天组培养瓶,向内加入2 mL 0.25%胰蛋白酶消化,置于倒置显微镜下观察,见细胞间连接消失,细胞胞质回缩,倒掉胰酶,再加入刚才收集的旧培养基终止消化。用吸管反复吹打瓶壁细胞,以确保所有贴壁细胞都能被吹打下来,但吹打时动作要轻柔,同时尽可能不出现泡沫,细胞脱壁后形成细胞悬液。将细胞悬液吸入相应离心管中,1 000 r/min离心5 min。离心完毕后去上清液,缓慢加入1 mL冷PBS溶液,轻轻振荡使细胞悬浮,1 000 r/min离心5 min,再用PBS洗涤细胞2次。③用250 μL结合缓冲液重新悬浮细胞,调节其浓度为1×106个/mL。④取100 μL细胞悬液于5 mL流式管中,加入5 μL AnnexinⅤ,于室温下避光孵育15 min,加入10 μL PI溶液。⑤混匀后于室温下避光孵育15 min。⑥在反应管中加400 μL PBS,流式细胞仪分析。
1.2.6 结果分析 以细胞凋亡指数表示细胞凋亡情况,细胞凋亡指数=(凋亡细胞数/细胞计数总数)×100%。
1.3 统计学方法 应用SPSS 20.0统计学软件分析数据,所有实验数据至少重复3次取平均值,计量资料比较分别采用单因素方差分析和q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 RT-PCR方法检测PPO基因mRNA的表达情况 经转染处理后48 h,实验组、阴性对照组和空载体组均在80 bp处出现电泳条带,实验组PPO基因转录水平明显下降。RT-PCR半定量分析结果显示,实验组人黑色素瘤A375细胞PPO基因 mRNA校正值为0.14±0.06,低于空载体组的0.25±0.02和阴性对照组的0.23±0.08,差异有统计学意义(P<0.05)。见图1。
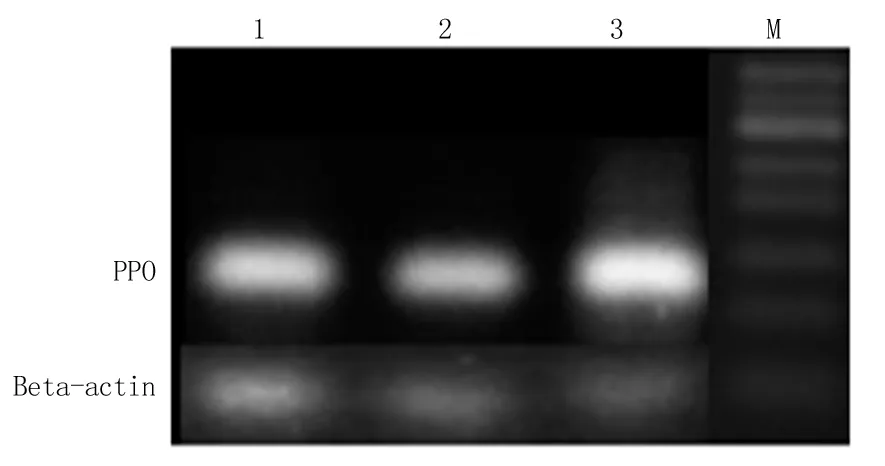
图1 mRNA表达
1.空载体组;2.阴性对照组;3.实验组;M.Mark
Figure 1 Expression of mRNA
2.2 转染PPO基因后对人恶性黑色素瘤细胞A375增殖抑制的影响 转染PPO基因后3组第7天时细胞增殖OD值高于第1、3、5天,第5天时细胞增殖OD值高于第1、3天,第3天时细胞增殖OD值高于第1天,差异均有统计学意义(P<0.05);转染PPO基因后第1、3、5、7天时实验组细胞增殖OD值低于空载体组和阴性对照组,差异均有统计学意义(P<0.05),而空载体组与阴性对照组差异无统计学意义(P>0.05)。见表1。
2.3 转染PPO基因后对人恶性黑色素瘤细胞A375早期凋亡的影响 AnnexinⅤ-FITC/PI双染色流式细胞仪分析结果显示,转染PPO基因后3组第7天凋亡率高于第1、3、5天,第5天凋亡率高于第1、3天,第3天凋亡率高于第1天,差异均有统计学意义(P<0.05);第1、3、5、7天时实验组凋亡率高于空载体组和阴性对照组,差异均有统计学意义(P<0.05),而空载体组与阴性对照组凋亡率差异无统计学意义(P>0.05)。见表2,图2。

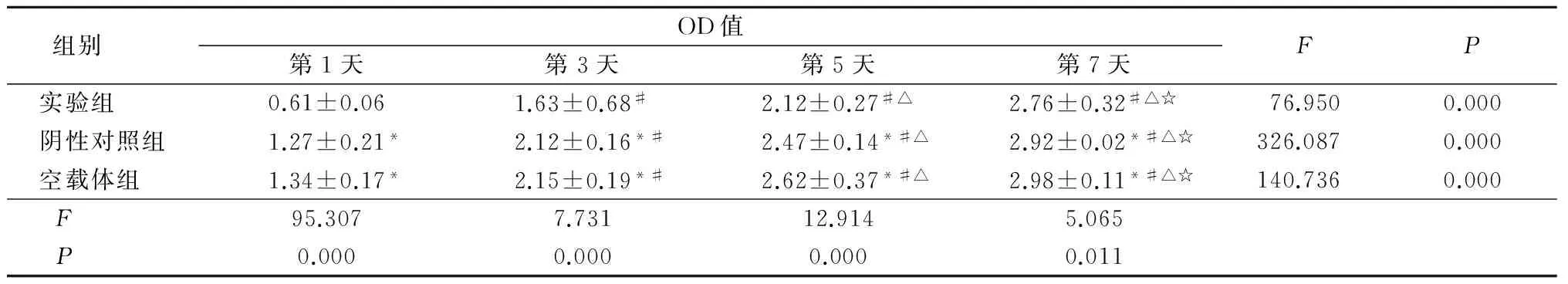
组别 OD值第1天第3天第5天第7天FP实验组 0.61±0.061.63±0.68#2.12±0.27#△2.76±0.32#△☆76.9500.000阴性对照组1.27±0.21*2.12±0.16*#2.47±0.14*#△2.92±0.02*#△☆326.0870.000空载体组 1.34±0.17*2.15±0.19*#2.62±0.37*#△2.98±0.11*#△☆140.7360.000F 95.3077.73112.9145.065P 0.0000.0000.0000.011
*P<0.05与实验组比较 #P<0.05与第1天比较 △P<0.05与第3天比较 ☆P<0.05与第5天比较(q检验)
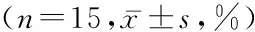
组别 凋亡率第1天第3天第5天第7天FP实验组 30.10±2.0232.70±1.95#60.50±1.60#△63.40±5.10#△☆516.2210.000阴性对照组7.25±0.73*9.75±0.61*#15.53±0.76*#△25.35±0.46*#△☆2289.0430.000空载体组 7.40±0.58*10.30±1.21*#16.65±0.72*#△23.89±2.30*#△☆422.7420.000F 1571.9661368.3548095.687716.635P 0.0000.0000.0000.000
*P<0.05与实验组比较 #P<0.05与第1天比较 △P<0.05与第3天比较 ☆P<0.05与第5天比较(q检验)
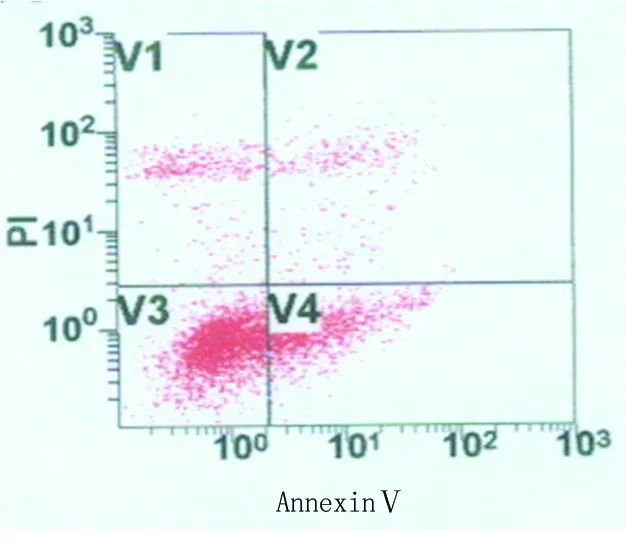
图2 细胞凋亡情况
Figure 2 The apoptosis of cells
3 讨 论
恶性黑色素瘤治疗的关键是早期诊断、正确分期,一经确诊首选完整切除原发灶,对于早期非侵袭性的病变,手术彻底清除病变为最佳治疗选择。对于晚期患者,主要为化疗及免疫治疗等。对于Ⅳ期有远处转移的患者,手术治疗不能明显提高生存率,干扰素可应用于恶性黑素瘤的辅助治疗[4],但结果证明低剂量干扰素对恶性黑色素瘤的5年总生存率和无病生存率未见明显改善[5]。虽然大剂量干扰素能在一定程度上提高5年生存率,但大剂量干扰素对患者的不良反应目前尚难以解决。
随着人们对恶性黑色素瘤分子生物学异常的逐步认识,分子靶向治疗成为恶性黑色素瘤治疗的热点,一些分子靶向治疗药物也相继进入临床试验阶段。虽然单独应用分子靶向治疗药物效果仍然不是很理想,但分子靶向药物和化疗药物的联合应用,弥补了化疗药物疗效的不足,从一定程度上提高了治疗效果,开辟了恶性黑色素瘤新的治疗途径,是该病治疗的新的发展方向。
目前研究报道中与恶性黑色素瘤分子靶向治疗有关的基因有Ras基因、Raf基因、c-Kit基因等[6-8]。PPO基因作为恶性黑色素瘤的一个关键基因,能使ERK2和MEK1/2磷酸化,从而调控细胞增殖。PPO基因在卵巢癌、子宫癌、乳腺癌、胰腺癌、结肠癌、胃癌、肝癌、前列腺癌、脑胶质瘤、恶性黑色素瘤等多种癌组织和细胞株中都有高表达,并与多种癌症的发生发展密切相关。MAPK通路是一个与多个癌基因密切相关的通路,PPO基因作为这一通路中的重要基因,通过磷酸化MEK1/2,促进肿瘤的发生发展[9-10]。刘亚玲等[11]制备了PPO抗体,并用免疫印迹法检测PPO基因在恶性黑色素瘤组织中表达,结果显示PPO蛋白位于相对分子质量110 000附近,膜上无其他蛋白印迹,蛋白印迹清晰,表明PPO抗体具有很强的特异性,可以作为检测恶性肿瘤的一种特异性抗体。本课题组前期研究发现PPO基因在A375细胞中存在高表达[12],然而能否通过RNA干扰方法沉默PPO基因,抑制MAPK通路中PPO基因相关蛋白的表达,从而在细胞水平抑制恶性黑色素瘤的生长增殖,有待进一步研究。本研究以腺病毒作为载体,利用RNA干扰方法沉默PPO基因,观察对A375细胞增殖和凋亡的影响。
RNA干扰技术是研究基因调控的一种新手段,RNA干扰可用于治疗多种单基因疾病以及与蛋白表达有关的疾病[13]。通过RNA干扰 技术沉默特殊基因的表达,在抑制肿瘤细胞生长及肿瘤的转移和增加化疗药物敏感性等方面取得了很大进展,许多临床前研究已经取得了丰硕成果[14-15]。RNA干扰所采用的载体主要有多聚复合物、纳米颗粒载体、病毒和细菌载体[16-17]等,病毒载体又可分为逆转录病毒、腺病毒、腺相关病毒、慢病毒等。本研究所采用的载体为腺病毒载体,通过腺病毒载体干扰PPO基因,抑制PPO基因的转录,从而沉默PPO基因,通过观察细胞增殖与凋亡情况,探讨该基因与细胞增殖、凋亡之间的关系。
本研究结果显示,阴性对照组细胞数目多,增殖旺盛,贴壁良好,细胞形态呈梭形或多角形,可见伪足,胞浆均匀、饱满,胞膜光滑完整有光泽,折光性良好,可与周围细胞融合成片状,形成单细胞层;空载体组细胞增殖良好,贴壁能力、大小及细胞形态与阴性对照组无明显差别;实验组细胞生长缓慢,贴壁能力差,呈散在分布,出现少数圆形细胞,部分细胞皱缩甚至破裂,失去原有的折光性,随着时间延长,悬浮细胞增多,贴壁细胞数量较阴性对照组和空载体组减少,且随时间延长差别越明显。从大体形态学上可以证实,沉默PPO基因后可以抑制恶性黑色素瘤细胞A375的分裂增殖,促进其凋亡。因此,PPO基因有望成为恶性黑素瘤治疗的新靶点。
本研究为进一步证实细胞水平是否真正的转染成功,并使PPO基因沉默,通过RT-PCR方法,在分子生物学水平观察PPO基因mRNA的表达情况,结果显示经转染处理48 h实验组、阴性对照组和空载体组均在80 bp处出现电泳条带,但实验组PPO基因转录水平明显下降。由于在腺病毒干扰PPO基因中,并不是该基因的转录过程完全阻断,故在RT-PCR结果中,实验组仍然在80 bp处出现电泳条带,而不是完全消失。随着科学技术的发展和人们对分子生物学的深入研究,如果能达到对某个基因的完全沉默,就会对某种细胞的影响作用更加明显,在应用到临床工作中的疗效会更加理想,从而增加该种方法治疗恶性肿瘤乃至其他基因病的临床应用价值。
[1] 刘彤云,何黎.皮肤黑素瘤的诊断和治疗[J].皮肤病与性病,2015,37(3):145-147.
[2] 马文宇,吴邓婷.中药植物多糖对恶性黑素瘤作用的实验研究进展[J].皮肤病与性病,2016,38(1):33-35.
[3] 张国强,刘思源,耿春杰,等.三氧化二砷对人恶性黑色素瘤A375细胞增殖及新癌基因PPO表达的影响[J].中国老年学杂志,2011,31(3):423-425.
[4] 王恩文,马惠文,李代蓉,等.皮肤恶性黑素瘤广泛转移存活14年1例[J].检验医学与临床,2015,12(8):1175-1176.
[5] 吴荻,崔久嵬,于鸿.黑素瘤的免疫治疗研究进展[J].细胞与分子免疫学杂志,2016,32(2):272-279.
[6] Zhang C,Spevak W,Zhang Y,et al. RAF inhibitors that evade paradoxical MAPK pathway activation[J].Nature,2015,526(7574):583-586.
[7] Ho AW,Tsao H. Targeted Therapies in melanoma: translational research at its finest[J]. J Invest Dermatol,2015,135(8):1929-1933.
[8] Ponti G,Pellacani G,Tomasi A,et al. Molecular targeted approaches for advanced BRAF V600,N-RAS,c-KIT,and GNAQ melanomas[J]. Dise Markers,2014,2014:671283.
[9] Fernandes JD,Hsieh R,de Freitas LA,et al. MAPK inase pathways: molecular roads to primary acral lentiginous melanoma[J]. Am J Dermatopathol,2015,37(12):892-897.
[10] Nani A,Belarbi M,Ksouri-Megdiche W,et al. Effects of polyphenols and lipids from Pennisetum glaucum grains on T-cell activation: modulation of Ca(2+) and ERK1/ERK2 signaling[J]. BMC Complement Altern Med,2015,15:426.
[11] 刘亚玲,刘思源,杨劲松,等.PPO基因单克隆抗体的制备以及在恶性黑色素瘤中表达的研究[J].中华肿瘤防治杂志,2007,14(6):422-424.
[12] 刘思源,张玉想.PPO在MAPK通路中的一个新癌基因[J].中国肿瘤临床,2006,33(23):1342-1345.
[13] Wittrup A,Lieberman J. Knocking down disease:a progress report on siRNA therapeutics[J]. Nat Rev Genet,2015,16(9):543-552.
[14] Ambesajir A,Kaushik A,Kaushik JJ,et al. RNA interference:a futuristic tool and its therapeutic applications[J]. Saudi J Biol Sci,2012,19(4):395-403.
[15] Rothdiener M,Müller D,Castro PG,et al. Targeted delivery of siRNA to CD33-positive tumor cells with liposomal carrier systems[J]. J Control Release,2010,144(2):251-258.
[16] Veesler D,Cupelli K,Burger M,et al. Single-particle EM reveals plasticity of interactions between the adenovirus penton base and integrin αVβ3[J]. Proc Natl Acad Sci U S A,2014,111(24):8815-8819.
[17] Hu P,Li Y,Sands MS,et al. Generation of a stable packaging cell line producing high-titer-PPT-deleted integration-deficient lentiviral vectors[J]. Mol Ther Methods Clin Dev,2015,2:15025.
(本文编辑:赵丽洁)
Experimental study on PPO gene silencing in human malignant melanoma cell line A375 by RNA interference
WANG Zheng-xiang1, ZHANG Guo-qiang2, GAO Shun-qiang2, ZHAO Gui-song3, LIU Si-yuan3*
(1.DepartmentofDermatology,CangzhouCenterHospital,HebeiProvince,Cangzhou061000,China; 2.DepartmentofDermatology,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China; 3.DepartmentofBoneOncology,theThirdHospitalofHebeiMedicalUniversity,Shijiazhuang050051,China)
Objective To investigate the effect of silencing PPO gene on the growth of human malignant melanoma cell line A375 by RNA interference. Methods A375 cells were transfected with PPO adenovirus vector, expression of PPO was detectded by RT-PCR in the A375 cell, MTT colorimetric analysis method was used to detect the effects on the proliferation of A375 cells, by flow cytometry and Annexin Ⅴ-FITC/PI double staining, changes of early apoptosis were detected. Results The expression of PPO mRNA was decreased in the transfection group than in the non-transfection group and negative virus group(P<0.05). After transfected with PPO, the OD values of the three groups at 7 d were higher than that at 1 d, 3 d and 5 d, the OD values of cells at 5 d were higher than at 1 d and 3 d, the OD values of cells at 3 d were higher than at 1 d(P<0.05). The OD value of transfection group was higher than the non-transfection group and negative virus group(P<0.05). After transfected, the apoptosis rate of the three groups at 7 d was higher than that at 1 d, 3 d and 5 d, the apoptosis rate of cells at 5 d was higher than that at 1 d and 3 d, the apoptosis rate of cells at 3 d was higher than that at 1 d(P<0.05). The apoptosis rate of transfection group was higher than the non-transfection group and negative virus group(P<0.05).Conclusion PPO gene silence can inhibit the proliferation and induce early apoptosis in A375 cells.
melanoma; gene silencing; RNA interference
2016-10-09;
2017-03-17
国家自然科学基金资助项目(30440086)
王正想(1982-),男,河北沧州人,河北省沧州市中心医院主治医师,医学硕士,从事皮肤疾病诊治研究。
*通讯作者。E-mail:18533112831@163.com
R739.5
A
1007-3205(2017)07-0805-05
10.3969/j.issn.1007-3205.2017.07.015
