舟山带鱼线粒体COI基因SNP位点分析
2017-07-18卞光明王娜泠胡则辉王跃斌胡成硕柴学军
卞光明,王娜泠,胡则辉,王跃斌,胡成硕,柴学军
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
舟山带鱼线粒体COI基因SNP位点分析
卞光明,王娜泠,胡则辉,王跃斌,胡成硕,柴学军
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
为探讨舟山带鱼种质状况,本研究利用直接测序法对舟山带鱼线粒体COI基因进行SNP挖掘分析,获得长度一致的985 bp基因片段,检测到22个SNP位点,对SNP位点在样品中分布情况分析,发现部分SNP位点分布情况类似甚至完全相同,推测基于线粒体COI基因片段不同位点突变可能存在关联性。
带鱼;线粒体COI基因;SNP;关联性
舟山带鱼Trichiurus lepturus是舟山渔场最重要的海洋捕捞经济鱼类,是全国首批海鲜类地理标志证明商标海鲜,其眼睛呈黑色、骨小体肥、背脊无凸骨、鳞片易脱落、肉质鲜而不腥,与其他带鱼相比,具有DHA成分、无大骨粒异物感,被称为“世界上最好吃的带鱼”[1]。由于舟山带鱼捕捞强度过度、人工繁育技术难度较大以及生存环境变化,舟山渔场甚至出现无带鱼可捞现象,随着休渔、种质资源保护区、产出控制等措施实施,带鱼资源状况虽有所好转,但群体小型化、年龄结构失衡、产卵期延长以及单位渔获量下降等现象仍较为严峻[2]。
线粒体DNA(mitochondrial DNA,mtDNA)严格遵守母系遗传、分子结构简单稳定,具有可溯源性等,常应用于进化生物学及群体遗传学研究。细胞色素C氧化酶I亚基(cytochrome c oxidase subunit I,COI)携带的遗传信息量大、进化速率适中、中间解析能力强,已普遍应用于银鲳Pampus argenteus[3]、黄姑鱼属Nibea[4]、四指马鲅属 Eleutheronoma[5]、太湖新银鱼 Neosalanx taihuensis[6]、脊尾白虾 Exopalaemon carinicauda[7]、中华绒螯蟹Eriocheir sinensis[8]、大眼蟹属Macrophthalmus[9]、紫贻贝Mytilus galloprovincialis[10]以及厚壳贻贝Mytilus coruscus[11]等水生动物种群遗传结构分析、分子进化及系统发育。SNP分布广、覆盖率高、遗传稳定、多态性丰富,直接测序法操作简单、技术成熟、无需通过多个位点构建遗传图谱,特别适合鱼类等较小目的基因片段研究[12]。目前所报道的研究主要采用 16S rRNA[13]、18S rDNA[14]、D-loop[15-16]、COI[17]、SSR[18]分析不同海域带鱼群体,未见具体分析舟山带鱼线粒体COI基因SNP位点特性研究。本研究利用直接测序法对舟山带鱼的线粒体COI基因区域进行SNP位点挖掘和分析,以期为舟山带鱼遗传学研究、种质资源的研究提供基础资料。
1 材料与方法
1.1 实验材料
实验所用60个带鱼样品由双拖船取自舟山朱家尖附近海域(122°47′E,29°97′N),取样时间为2016年4月中旬,现场取样并剪下背部肌肉于95%酒精中保存,带回实验室置于-20℃保存待用。
1.2 实验方法
1.2.1 DNA提取
按照天根海洋动物基因组提取试剂盒操作说明提取总基因组DNA,经0.8%琼脂糖凝胶电泳检测DNA完整性后,用Nanodrop 2000紫外分光光度计检测其质量与浓度,稀释为50 ng/μL,-20℃保存待用。
1.2.2 引物设计
从GenBank中下载带鱼线粒体全基因组序列[19],用Oligo7软件[20]设计引物扩增目的片段,目的片段大小在1 200 bp左右,引物序列为COI-F:CTTATCCGAGCAGAACTAAG,COI-R:ACGGCTCCTATTGATAGAAC,退火温度55℃左右,由上海生工生物工程股份有限公司合成。
1.2.3 PCR扩增及测序
PCR 反应总体系为 50 μL,模板 DNA 100 ng,0.5 μL 上、下游引物(10 μmol/L),1 μL dNTP(10 mmol/μL),5 μL 10×Buffer(含Mg2+),0.5 μL Taq DNA聚合酶(5 U/μL),去离子水补充至50 μL。PCR反应条件:95℃预变性3 min,然后进行35个循环,每个循环包括94℃ 30 s,55℃ 1 min,72℃ 1 min,最后72℃延伸7 min。PCR产物经1.4%琼脂糖凝胶电泳检测后,委托上海生工生物工程股份有限公司进行双向测序。
1.3 数据分析
运用ContigExpress Project[21]对测序结果进行拼接,再使用BioEdit[22]对所得序列进行比对筛选,利用Chromas 2.4.1分析序列峰图,以测序波峰整齐,没有杂峰,突变碱基位点样品数不少于2个的位点记作有效突变位点,以排除测序机器误读或错读产生的变异位点。
2 结果与分析
2.1 PCR琼脂糖凝胶电泳图
PCR扩增产物凝胶电泳图如图1所示,Marker为2 000 bp,从下至上依次为(100 bp、250 bp、500 bp、750 bp、1 000 bp、2 000 bp),从电泳图上可观察到,产物片段的大小与设计的目的片段的长度一致(1 200 bp),且条带明亮、清晰,没有杂带,满足直接测序的要求。
2.2 SNP位点峰图

图1 部分PCR产物电泳图谱Fig.1 Electrophoresis results of part PCR product
本文对三个突变频率大于25%的SNP位点进行峰图分析(23位点、500位点、773位点),位点具体突变形式如图2~4所示,三个SNP位点波峰整齐、无杂峰。
SNP23突变形式:C/T转换
SNP500突变形式:T/C转换
SNP 773突变形式:G/A转换
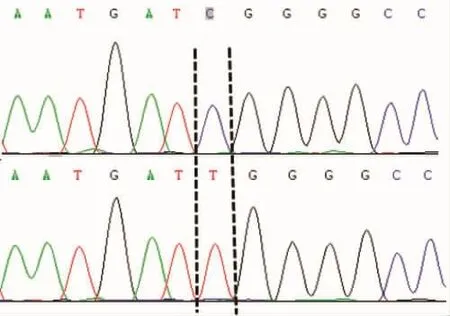
图2 COI基因23位点突变形式Fig.2 Mutation forms of COI gene at 23rdlocus
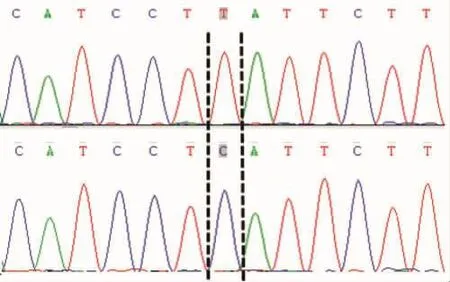
图3 COI基因500位点突变形式Fig.3 Mutation forms of COI gene at 500thlocus
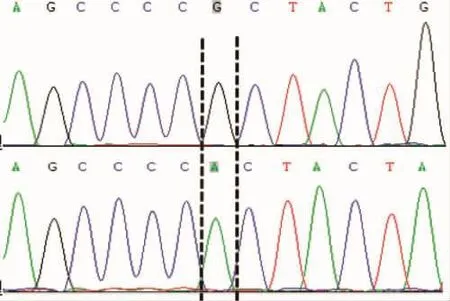
图4 COI基因733位点突变形式Fig.4 Mutation forms of COI gene at 733rdlocus
2.3 SNP位点统计分析
使用BioEdit软件对测序序列比对分析,删除两端不稳定序列,获得985 bp基因片段,共检测到22个变异位点,检测到SNP位点具体情况见表1,773位点、23位点、500位点以及953位点突变率较高,分别为43.67%、25.00%、25.00% 以及23.33%。
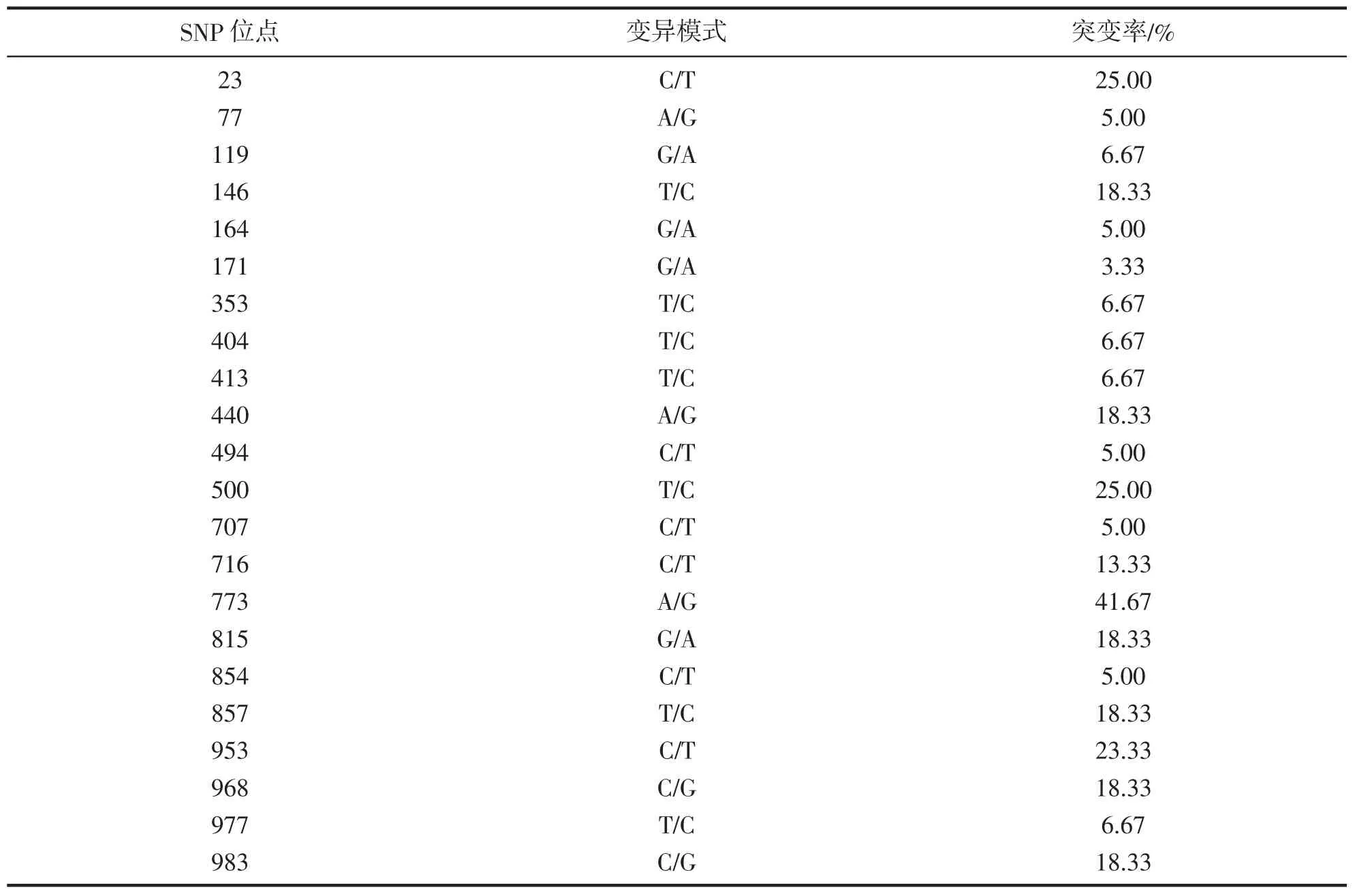
表1 COI基因序列部分区域SNP位点Tab.1 SNPs identified in COI gene subregio
表2为SNP位点在60个带鱼样品中的具体分布情况,从表中可以发现,815位点、857位点、968位点以及983位点发生突变可能具有一定的关联性,位点突变率均为18.33%,在11个样品中均检测到且分布情况完全一致;位点119、位点404以及位点977的位点突变率为6.67%;位点353与位点413的位点突变率为6.67%,在样品中的分布情况也呈现一致,虽然突变数量较少(位点突变率仅为6.67%),但不排除相关位点之间的突变存在关联性。除此以外,440位点、500位点以及953位点在样品中的分布情况相似度也较高。

表2 SNP位点在样品中的分布情况Tab.2 The distribution of SNP locus in samples
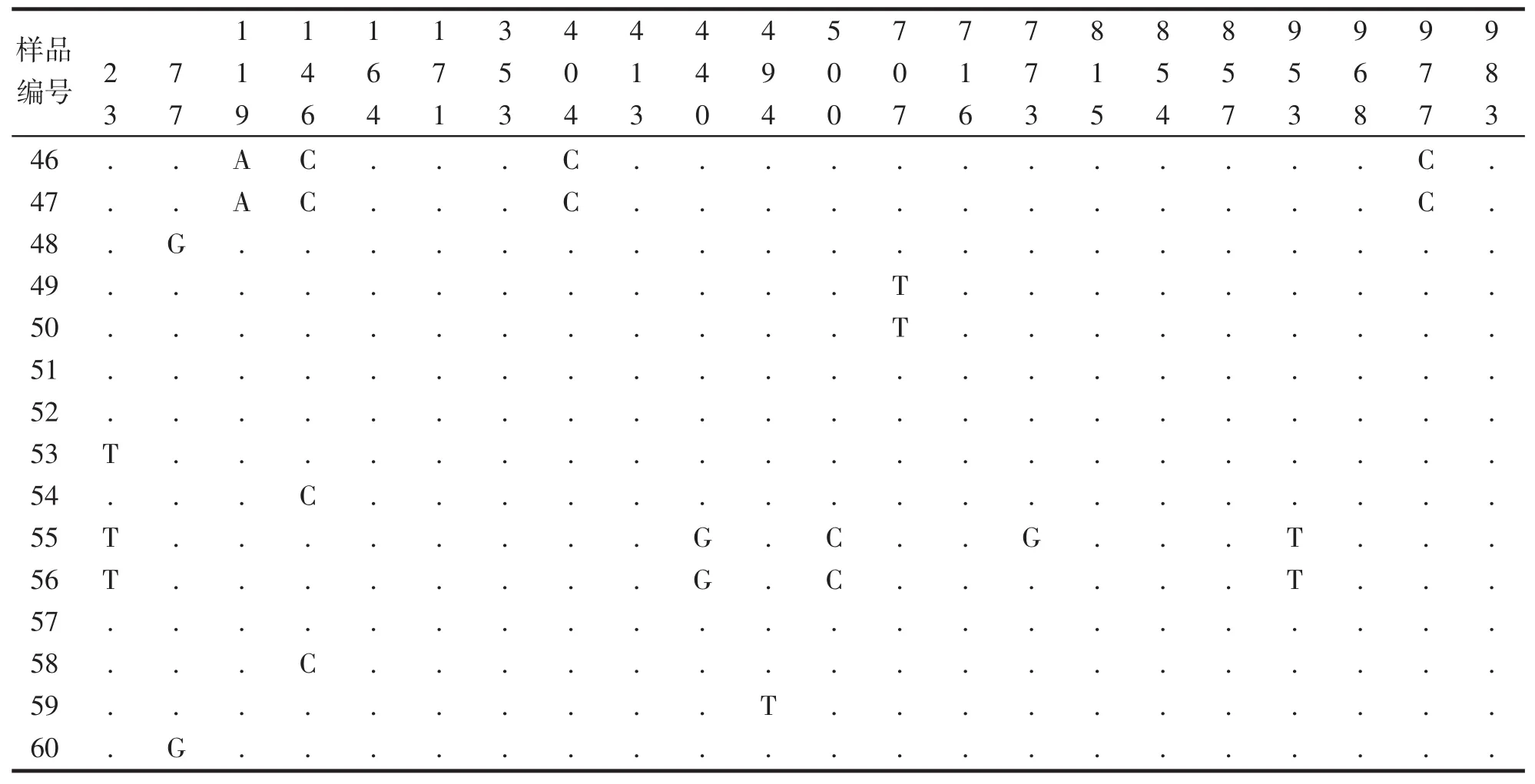
续表
3 讨论
本文采用直接测序法对带鱼COI基因进行测序,有效避免传统基因克隆方法对变异位点分型产生误读、错读等影响。在获得的985 bp片段中检测到22个变异位点,变异率为0.021 3,与带鱼其他相关研究结果相近[17]。根据Chromas 2.4.1分析序列峰图所示,变异位点峰图清晰、无杂带,能够对SNP位点进行精准的统计。对线粒体COI基因片段SNP位点在60个舟山带鱼样品中的分布情况统计的过程中,发现一些SNP位点变异频率以及分布情况存在相似性甚至完全相同,关于不同位点变异是否存在关联性,还有待于进一步研究。
[1]舟山带鱼[DB/OL].(2012-12-27)[2016-08-15].http://www.wangdanian.cn/wenda/5324.html.
[2]浙江省海洋水产研究所资源室.2015年上半年浙江海洋渔业资源动态评析[DB/OL].(2015-09-11)[2016-08-15].http://www.zjhys.cn/news/hydt/20159/1111331020951901.html.
[3]彭士明,施兆鸿,侯俊利.基于线粒体D-loop区与COI基因序列比较分析养殖与野生银鲳群体遗传多样性[J].水产学报,2010,34(1):19-25.
[4]CHAI X J,HU Z H,WANG Y B,et al.Genetic diversity and the relationship of Nibea japonica and Nibea miichthiodies using mitochondrial DNA gene[J].Biochemical Systematics and Ecology,2013,48(2):274-280.
[5]邓春兴.基于COI基因序列的中国东南沿海四指马鲅属鱼类的遗传多样性分析[D].广州:暨南大学,2014:23-45.
[6]张 迪,雷光春,龚 成,等.基于COI基因序列的太湖新银鱼遗传多样性[J].湖泊科学,2012,24(2):299-306.
[7]马 朋,刘 萍,李 健,等.脊尾白虾3个野生群体线粒体COI基因的遗传多样性及其系统发育分析[J].渔业科学进展,2011,32(6):50-56.
[8]葛家春,许志强,李晓晖,等.利用线粒体COI序列分析4水系中华绒螯蟹群体遗传学特征[J].中国水产科学,2011,18(1):16-22.
[9]徐敬明.2种大眼蟹线粒体COI基因序列的比较研究[J].水生态学杂志,2010,3(2):42-47.
[10]沈玉帮,张俊彬,冯冰冰,等.基于线粒体COI序列分析对紫贻贝群体遗传多样性的研究分析[J].海洋通报,2011,30(4):435-440.
[11]杨振雄,毛阳丽,宋 娜,等.浙江和福建沿海厚壳贻贝Mytilus coruscus群体的COI序列比较分析[J].海洋湖沼通报,2014(2):82-87.
[12]柏盈盈,贾智英,葛会争,等.TLR9基因SNP位点检测及其在7种鲤中的遗传多样性研究[J].淡水渔业,2013,43(6):19-28.
[13]蒙子宁.中国近海小黄鱼、带鱼和小带鱼的遗传多样性以及八种石首鱼类的分子系统进化[D].厦门:厦门大学,2003:91-108.
[14]张继民,刘 霜,赵建民,等.带鱼(Trichiurus haumela)鱼卵DNA的提取及其18S rDNA初步分析[J].海洋通报,2009,28(6):62-65.
[15]肖永双.西北太平洋五种海洋鱼类的分子系统地理学研究[D].青岛:中国海洋大学,2011:101-116.
[16]郑文娟,杜一超,林 洁,等.基于线粒体DNA D-loop区部分序列分析舟山海域带鱼种群遗传结构[J].水生生物学报,2015,39(2):408-423.
[17]李鹏飞,朱文斌,贺舟挺,等.东海带鱼DNA条形码的建立及COI序列变异分析[J].浙江海洋学院学报:自然科学版,2013,32(1):6-9.
[18]毕金贞.带鱼微卫星标记的开发和微卫星标记在牙鲆选择育种中的应用[D].青岛:中国海洋大学,2010:6-40.
[19]LIU Y,CUI Z.The complete mitochondrial genome sequence of the cutlassfish Trichiurus japonicus(Perciformes:Trichiuridae):Genome characterization and phylogenetic considerations[J].Marine Genomics,2009,2(2):133-142.
[20]RYCHLIK W.OLIGO 7 primer analysis software[J].Methods in Molecular Biology,2007,402:35-60.
[21]CLARK M J,CHEN R,LAM H Y,et al.Performance comparison of exome DNA sequencing technologies[J].Nature Biotechnol,2011,29(10):908-914.
[22]HALL T A.BioEdit:a user-friendly biological sequence alignment editor and analysis program for windows 95/98/NT[J].Nucleic Acids Symposium Series,1999,41:95-98.
Analysis on Mitochondrial COI Gene SNP Loci of Trichiurus lepturus from Zhoushan Sea Area
BIAN Guang-ming,WANG Na-ling,HU Ze-hui,et al
(Marine and Fisheries Institute of Zhejiang Ocean University,Zhejiang Marine Fisheries Institute,Zhoushan 316021,China)
To investigate the germplasm resources of Trichiurus lepturus collected from Zhoushan coastal sea area,SNP loci and analysis based on mtDNA COI gene were carried out using direct sequencing technique.The fragments with the length of 985 bp were obtained,detecting 22 SNP locus.According to the similar or even identical distribution of SNP locus in samples,there may be a correlation between mutations of mtDNA COI gene fragments at different sites.
Trichiurus lepturus;mitochondrial COI gene;SNP;correlation
Q953+.3
:A
2016-11-10
浙江省科技厅合作与转化项目(2013F50003);舟山市公益项目(2015C31013)
卞光明(1992-),男,江苏连云港人,硕士研究生,研究方向:种质与种苗工程.E-mail:mingbg@163.com
柴学军(1972-),男,教授级高工,研究方向:鱼类繁育与海洋生物技术.E-mail:chaixj6530@sohu.com
1008-830X(2017)01-0019-06
