盐胁迫对航天诱变向日葵生理生化指标的影响
2017-07-13胡晓炜姜玉莹杨军
胡晓炜 姜玉莹 杨军
摘要 [目的]探究盐胁迫下航天诱变向日葵生理生化指标的变化。[方法]选用航天诱变向日葵作为试验材料,用不同浓度(0、0.3%、0.6%、0.9%、1.2%)NaCl进行处理,分别测定其SOD活性、POD活性、MDA含量、可溶性蛋白含量、脯氨酸含量,分析盐胁迫对航天诱变向日葵生理生化指标的影响。[结果]随着盐浓度的增加,SOD活性随之上升,当盐浓度为0.6%时,SOD活性下降;POD活性随盐浓度的升高而上升;MDA、可溶性蛋白、Pro的含量随盐浓度的上升而下降,当盐浓度为0.9%时其含量呈增加趋势。[结论]航天诱变向日葵能在0.9%的鹽浓度下正常生长。该研究结果可为筛选抗盐的向日葵新材料提供理论支持。
关键词 航天诱变;向日葵;盐胁迫;生理生化指标
中图分类号 S501;Q945.78 文献标识码 A 文章编号 0517-6611(2017)13-0024-03
Effects of Salt Stress on Physiological and Biological Indices of Sunflower Induced by Space Flight
HU Xiao-wei, JIANG Yu-ying,YANG Jun*
(College of Life Science, China West Normal University, Nanchong, Sichuan 637009)
Abstract [Objective] To study the changes of physiological and biochemical indices of sunflower induced by space flight under salt stress. [Method] Taking sunflower induced by space flight as test materials, they were treated with different concentrations of NaCl (0, 0.3%, 06%, 0.9% and 1.2%). SOD activity, POD activity,MDA content, soluble protein content and proline content were determined. The effects of salt stress on physiological and biochemical indices of sunflower induced by space flight were analyzed. [Result] SOD activity increased with the increase of salt concentration. When salt concentration was 0.6%, SOD activity declined. POD activity increased with the increase of salt concentration. The contents of MDA, soluble protein and proline decreased with the rise of salt concentration. When salt concentration was 0.9%, they increased. [Conclusion] Sunflower induced by space flight can grow normally at salt concentration of 0.9%. These results can provide theoretical support for screening out new sunflower material against salt stress.
Key words Space flight induction;Sunflower;Salt stress;Physiological and biochemical indices
向日葵(Helianthus annuus L.)是菊科向日葵属的植物,为一年生草本植物,是当今世界上重要的油料作物之一。向日葵种子含人体所必需的亚油酸、油酸以及少量的甾醇(固醇)、维生素E、磷脂、植物蜡及类胡萝卜素等非皂化物。向日葵属于生物治盐碱作物之一[1],能产果实葵花籽。由于我国西北地区的土地存在盐碱化较严重的问题,如何开发利用这些盐碱地和有效种植粮食作物和经济作物,一直以来都是人们关注的问题。若要解决该问题,就要培育具有高抗能力的作物新品种。
向日葵是当今世界第二大油料作物,西华师范大学细胞生物学实验室于2003年将向日葵种子经过卫星搭载后,经过长达十余年的研究,在观赏向日葵等方面选育了大量的新材料,并且在遗传背景分析[2]和生理生化[3]等方面做了大量的基础研究工作。然而,关于诱导向日葵的抗性研究方面则鲜见报道。 笔者研究了盐胁迫对航天诱变向日葵生理生化指标的影响,旨在为筛选抗盐的向日葵新材料提供理论支持。
1 材料与方法
1.1 材料
1.1.1
航天诱变种子。选取向日葵种子(去壳)若干,要求大小基本一致。
1.1.2 试剂。NaCl、蒸馏水等。
1.1.3 耗材与仪器。耗材有烧杯、玻璃棒、滤纸、1 000 mL容量瓶、直径10 cm培养皿4个、10 mL量筒;仪器有分析天平、光照培养箱、恒温培养箱、分光光度计等。
1.2 方法
1.2.1 培养皿的处理。
选用直径为10 cm的玻璃培养皿,洗净并置于烘箱中110 ℃杀菌后,内放1层滤纸,用蒸馏水浸润。
1.2.2 种子的处理。
用75%的乙醇消毒若干种子后立即用蒸馏水漂洗3次;在25 ℃无光照条件下,用蒸馏水浸泡向日葵种子8 h,再将种子放在培养皿中28 ℃下催芽48 h,选取发芽正常种子播种在泥土中,每天浇250 mL蒸馏水,每周浇50 mL Hoagland营养液1次。待2片真叶完全展开后进行试验。
1.2.3 盐溶液的配制。
分别配制0、0.3%、0.6%、0.9%、12%NaCl溶液。
1.2.4 幼苗的处理。
对照组处理3株幼苗,无重复;0.3%~1.2% NaCl,每個浓度处理3株,每株重复3次。前3 d用0.3%250 mL NaCl浇泥土盆,此后NaCl盐浓度每3 d递增0.3%,达到试验设计的浓度后,每天定时、定量按预定盐浓度浇灌。整个试验在夏日光照下进行,其中有几天下雨,所以试验结果存在一定的误差。
1.2.5 生理生化指标的测定。
选用生长点下第2或3叶位的叶片进行测定。超氧化物歧化酶(SOD)采用NBT光化学还原法[4]测定;过氧化物酶(POD)活性采用愈创木酚比色法[5]测定;丙二醛(MDA)含量采用硫代巴比妥法[6]测定;可溶性蛋白质含量采用考马斯亮蓝G-250染色法[7-8]测定;平均脯氨酸(Pro)含量采用酸性茚三酮比色法[9]测定。
1.3 数据处理
采用 Excel 2010软件进行数据统计与分析。
2 结果与分析
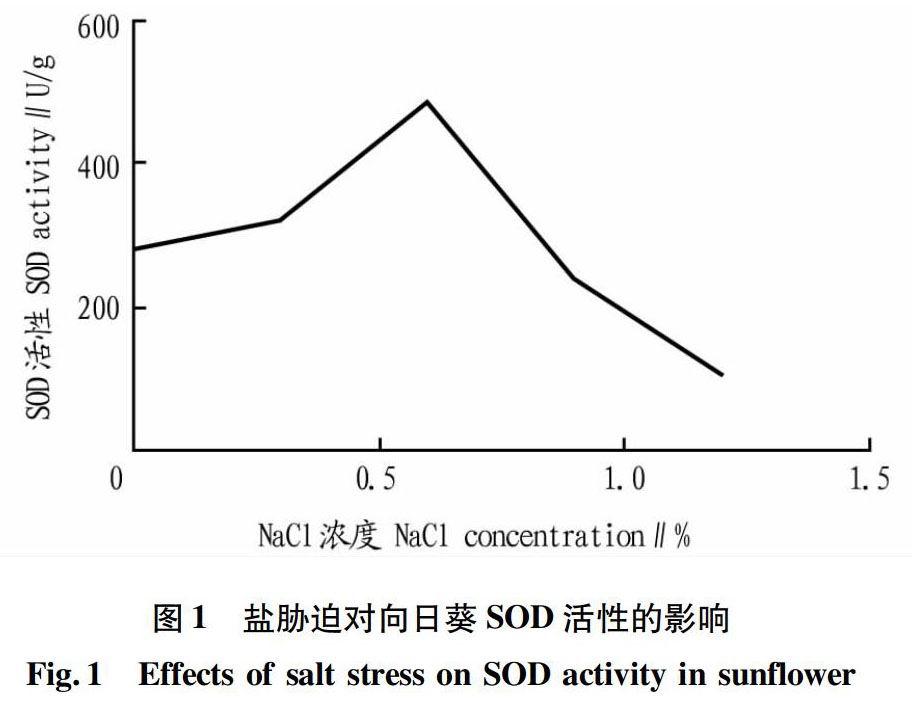
2.1 SOD活性
从图1可以看出,在盐浓度为0~06%时SOD活性达到最大值(486.35 U/g),而当盐浓度为0.6%~1.2%时,SOD活性急剧下降,当盐浓度为1.2%时,其活性降至最低值(104.9 U/g),SOD活性明显低于对照组。总体来看,SOD活性呈现先上升后下降的趋势。
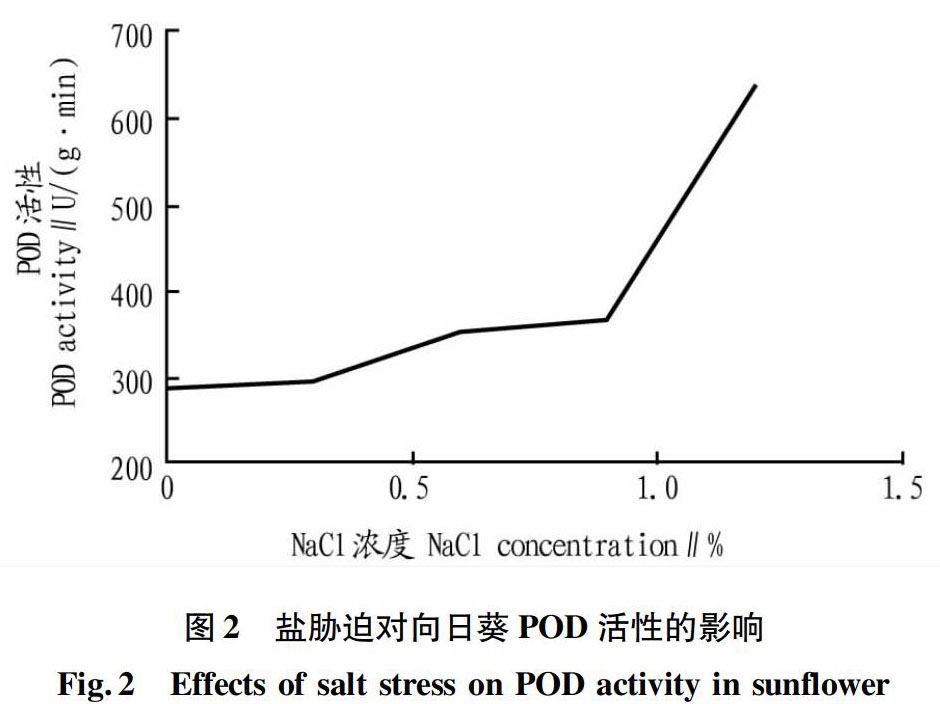
2.2 POD活性
从图2可以看出,当盐浓度为0~0.9%时POD活性缓慢上升,当NaCl浓度为0.9%~1.2%时POD活性急剧上升。总体来看,POD活性呈现上升趋势。
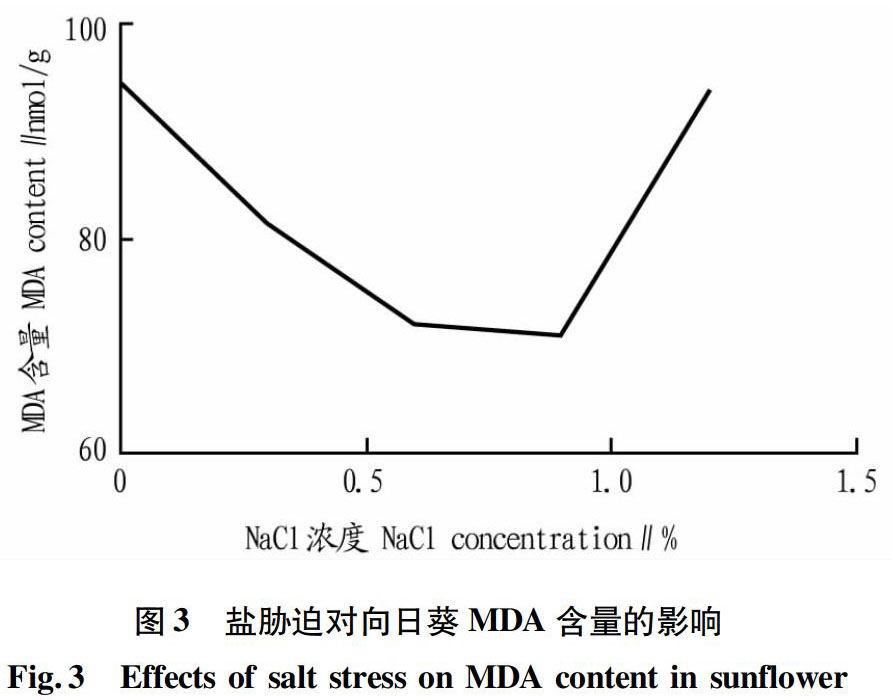
2.3 MDA含量
从图3可以看出,当NaCl浓度为0~09%时MDA含量随盐浓度的增加而降低,当NaCl浓度为0.9%时,MDA含量达到最低值(71.19 nmol/g)。当NaCl浓度为0.9%~1.2%时MDA含量随盐浓度的增加而上升。总体来看,MDA含量呈先稳定后上升的趋势。
2.4 可溶性蛋白含量
从图4可以看出,当NaCl浓度为0~0.9%时可溶性蛋白含量呈下降趋势,当NaCl浓度为09%时可溶性蛋白含量降至最低值(1.118 mg/g),当NaCl浓度为0.9%~1.2%时呈上升趋势。可溶性蛋白含量总体上呈现先下降再上升的趋势。
2.5 Pro含量
从图5可以看出,当盐浓度0~0.9%时Pro含量随盐浓度的增加而逐渐降低,当NaCl浓度为0.9%时Pro含量降至最低值(225.3 μg/g)。当NaCl浓度为0.9%~1.2%时,Pro含量随NaCl浓度的增加而逐渐上升。总体来看,Pro含量呈现先下降后上升的趋势。
3 讨论与结论
SOD和POD对植物盐胁迫有着重要的保护作用,主要表现在防止、中断膜脂过氧化、保护细胞膜系统不受损伤等方面[10-11]。植物体内的活性氧(ROS)在盐胁迫环境下会被诱导产生,比如羟自由基(OH-)、过氧化氢(H2O2)和超氧阴离子(O2- )等[12-13]。大部分植物SOD、POD活性的变化趋势总体呈现为在低盐浓度下上升,高盐浓度下下降。
SOD有利于清除植物在盐胁迫下产生的自由基,防止膜脂过氧化,所以SOD活性在一定程度上反映向日葵在该条件下的适应能力。盐胁迫对植物叶片中SOD活性的影响已在沙枣[14]、葡萄[15]、阿月浑子[16]等植物上进行了研究。研究发现,水稻叶片中的SOD活性随着盐胁迫强度的增加呈现先上升后下降的变化,在一定的范围内呈正相关[17]。Horemans等[18]研究表明,在盐胁迫下水稻叶绿体内总SOD活性下降,APX活性呈先升后降的趋势,其研究结果大都与该试验的结果一致。该试验中,SOD活性在盐浓度0~0.6%的范围内上升到最大值后,再在0.6%~1.2%的盐浓度范围内,SOD活性急剧下降。SOD活性下降的原因可能是高浓度的盐浓度下SOD受到伤害,导致其活性下降,保护细胞膜不受到过氧化作用的能力降低[19]。POD可使体内某些氧化酶的毒性产物H2O2分解并阻止其对膜脂的攻击而发生过氧化作用。研究表明,水稻叶片中的POD活性随着盐胁迫强度的增加呈现先上升后下降的变化,在一定的范围内表现出正相关[17],这与该试验结果类似,该试验中POD的活性在0~0.9%的NaCl浓度下缓慢上升,0.9%~1.2% NaCl浓度下急剧上升,可能是在高浓度盐溶液的胁迫下为防止膜脂过氧化程度而导致POD活性急剧上升。这说明低盐浓度对航天诱变向日葵的影响不大,在高盐胁迫下航天诱变向日葵会做出明显的应激反应。
过氧化物丙二醛(MDA)作为膜脂过氧化的主要产物之一,膜损伤程度的大小与其含量有关[6]。在盐胁迫下,随着盐胁迫强度增加MDA含量在一定范围内也呈现上升趋势,这种现象已在苹果,板栗等植物中观察到[20],但对其他植物(如黄瓜)的研究认为盐胁迫引起膜通透性增加的同时,MDA的含量却减少[21]。该试验结果表明,在不同的盐胁迫下,向日葵的MDA含量总体变化趋势呈现为先稳定后上升,并未出现直线增加或减少的单一变化趋势。龚明等[22]研究表明,在不存在盐胁迫和盐胁迫初期,耐盐的大麦比不耐盐的小麦具有更高的MDA含量,因此典型的耐盐植物以及可以遗传的抗盐性植物可能受制于各自遗传特性的控制,从而维持高盐环境下长期胁迫下和盐诱导下所形成的独特的生理代谢机制,甚至在较平稳的低盐胁迫下或没盐胁迫下也表现出来,即保持较高的MDA、SOD、Pro水平,而膜脂透性却处于较低水平[23]。该试验中,在0~0.9%的NaCl浓度下,植物叶片细胞内的各种保护机制可使MDA含量维持在一定的水平波动,但胁迫强度超过特定的阈值(0.9%~1.2%)时,细胞内代谢失调,自由基积累,膜质过氧化作用加大,造成MDA的积累,呈上升趋势,因此向日葵的MDA含量总体变化趋势呈现为先稳定后上升。
可溶性蛋白是盐胁迫条件下植物细胞内重要的渗透调节剂之一,平衡原生质体内外的渗透压、降低细胞内溶质的渗透势等大部分依赖于可溶性蛋白在植物细胞内的积累[24-25]。目前,有关可溶性蛋白作为抗盐指标的研究比较少。赵曼利等[26]研究表明焦健在不同品种油橄榄抗盐性生理指标中证明随着NaCl胁迫的加剧可溶性蛋白质含量呈现先升后降的趋势,但在该试验中可溶性蛋白含量的变化趋势是先下降后上升,在0~0.9%的盐浓度范围内其含量呈下降趋势,可能是因为盐胁迫条件下,可溶性蛋白的分解加速,分解成各种氨基酸,以降低叶片的渗透势,促进植物对水分的吸收,降低盐害程度;在0.9%~1.2%的盐浓度范围内呈上升趋势,可能是在高浓度盐胁迫下,细胞膜受损,膜蛋白转化为可溶性蛋白,从而导致可溶性蛋白含量增加[27]。二者的抗盐机制的不同,前者主要积累蛋白质抵抗盐胁迫,后者主要积累氨基酸抵御盐胁迫。
脯氨酸(Pro)是盐胁迫下向日葵的主要渗透调节物质之一[28]。大量研究表明,当向日葵幼苗处于盐胁迫下时,其体内的脯氨酸含量会明显增高[29-30]。在0.9%~1.2%NaCl胁迫下,脯氨酸含量是随盐浓度增加而增加,但在0~0.9%NaCl胁迫下脯氨酸的含量随胁迫的增加却减少,可能是向日葵适应盐渍环境的结果。因为脯氨酸积累与耐盐程度呈负相关[31-32],因此认为盐胁迫对向日葵造成的伤害是导致脯氨酸积累的原因[33-34],脯氨酸的积累是植物受到逆境伤害的征兆。Rye等[35]认为脯氨酸的积累是耐盐的原因,而不是盐胁迫下的偶然结果。向日葵在盐胁迫下,体内的生理生化活动受到干扰,同时它本身也通过调节自身代谢来做出反应,脯氨酸的积累正是这一种响应,它既可能是向日葵的适应性,也可能是向日葵叶片细胞结构和功能受损的表现[36]。该试验中,在0~0.9%NaCl胁迫下脯氨酸的减少可能是向日葵适应盐渍环境的结果,随着盐浓度的增高(0.9%~12%NaCl),高浓度的盐下向日葵叶片细胞的结构和功能受到损伤,蛋白质合成受阻而蛋白质分解加强,导致向日葵叶片内脯氨酸增加。
综上所述,NaCl胁迫对航天诱变向日葵植株的生长及其体内生理活动过程产生了一系列影响,包括SOD、POD活性的升高,MDA含量先稳定后上升,可溶性蛋白的分解与生成,脯氨酸的含量先下降后上升,引起的一系列反应主要是由于航天诱变向日葵适应盐渍环境的表现,所以试验结果表明航天诱变向日葵可以在较高浓度的盐地里能正常生长,从而推进我国西北盐碱地区的开发和利用。但由于航天诱变向日葵耐盐性的机制十分复杂,仅从某一侧面或某些层次去研究航天诱变向日葵的耐盐能力是远远不够的,航天诱变向日葵的耐盐表现也是多方面的。添加一些外源物质可能对某一些航天诱变向日葵的抗盐性有一定的作用,有可能对一些航天诱变向日葵没有作用;而航天诱变技术也存在品质、产量和抗性间不协调现象以及诱变基因能否遗传表达的问题等。因此,需要对航天诱变向日葵的耐盐机制进行进一步深入研究。
参考文献
[1] 李庆文.向日葵及其栽培[M].北京:中国农业出版社,1991:236-242.
[2] 陈卫英,陈真勇,杨军.航天诱变向日葵突变株系盛花期的光合特性[J].西北农业学报,2012,21(8):139-145.
[3] 陈卫英,陈真勇,杨军,等.航天诱变向日葵花部形态特征及传粉生态学研究[J].绵阳师范学院学报,2009,28(2):56-60.
[4] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003:167-170.
[5] 张兆英.不同贮藏条件下四种药用植物种子活力的研究[D].保定:河北农业大学,2003:13-17.
[6] 王爱国,邵从本,罗广华.丙二醛作为植物脂质过氧化指标的探讨[J].植物生理学通讯,1986(2):55-57.
[7] DA SILVA M A O,ARRUDA M A Z.Mechanization of the Bradford reaction for the spectrophotometric determination of total proteins[J].Analytical biochemistry,2006,351(1):155-157.
[8] PALEG L G,ASPINALL D.The physiology and biochemistry of drought resistance in plants[M].Sydney:Academic Press,1981:145-168.
[9] BATES L S,WALDREN R P,TEARE I D.Rapid determination of free proline for water-stress studies[J].Plant and soil,1973,39(1):205-207.
[10] AUBERT S,HENNION F,BOUCHEREAU A,et al.Subcellular compartmentation of proline in the leaves of the subantarctic Kerguelen cabbage Pringlea antiscorbutica R.Br.in vivo 13C-NMR study[J].Plant cell and environment,1999,22(3):255-259.
[11] GREENWAY H,MUNNSR R.Mechanism of salt tolerance in non-halophytes[J].Ann Rev Plant Physiol,1980,31:149-190.
[12] 趙范明,葛成,翟志忠.干旱地区次生盐碱地主要造林树种抗盐指标的确定及耐盐能力的排序[J].林业科学研究,1997,10(2):194-198.
[13] 王树凤,陈益泰,潘红伟,等.土壤盐胁迫下桤木8个无性系生理特性的变化[J].浙江林学院学报,2006,23(1):19-23.
[14] HTTERMANN A,ZOMMORODI M,REISE K.Addition of hydrogels to soil for prolonging the survival of Pinus halepensis seedling subjected to drought[J].Soil and tillage research,1999,50(3/4):295-304.
[15] HERNNDEZ J A,DEL RO L A,SEVILLA F.Salt stress-induced changes in superoxide dismutase isozymes in leaves and mesophyll protoplasts from Vigna unguiculata(L.)Walp.[J].New phytologist,1994,126(1):37-44.
[16] 克热木·伊力,袁琳,齐曼·尤努斯,等.盐胁迫对阿月浑子SOD、CAT、POD活性的影响[J].新疆农业科学,2004,41(3):129-134.
[17] HOAI N T T,SHIM I S,KOBAYASHI K,et al.Accumulation of some nitrogen compounds in response to salt stress and their relationships with salt tolerance in rice(Oryza sativa L.)seedling[J].Plant growth regulation,2003,41(2):159-164.
[18] HOREMANS N,FOYER C H,ASARD H.Transport and action of ascorbate at the plant plasma membrane[J].Trends in plant science,2000,5(6):263-267.
[19] 刘训财,陈华锋,井立文,等.盐胁迫对中国春-百萨燕麦草双二倍体SOD、CAT活性和MDA含量的影响[J].安徽农学通报,2009,15(8):43-46.
[20] 姚允聪,王有年,周向东.土壤干旱与艳红苹果叶片几个生理指标的变化[M]//张上隆,陈昆松.园艺学进展.北京:中国农业出版社,1994:417-421.
[21] 王邦锡,孙莉,黄久常.渗透胁迫引起的膜损伤与膜脂过氧化和某些自由基的关系[J].中国科学(B辑),1992(4):364-368.
[22] 龚明,丁念诚,贺子义,等.盐胁迫下大麦和小麦叶片脂质过氧化伤害与超微结构变化的关系[J].植物学报,1989,31(11):841-846.
[23] 张明艳.杜仲对盐胁迫反应的研究[D].兰州:甘肃农业大学,2000:18-26.
[24] 张川红,尹伟伦,沈漫.盐胁迫对国槐和中林46杨幼苗膜类脂的影响[J].北京林业大学学报,2002,24(5/6):89-95.
[25] 马焕成,蒋东明.木本植物抗盐性研究进展[J].西南林学院学报,1998,18(1):52-59.
[26] 赵曼利,杜启兰,焦健,等.盐胁迫对不同品种油橄榄抗盐性生理指标的影响[J].福建农林大学学报(自然科学版),2016,45(1):19-25.
[27] 马万侠.臭椿等4个树种在盐胁迫下反应特性的研究[D].泰安:山东农业大学,2010.
[28] 杨晓慧,蒋卫杰,魏珉,等.植物对盐胁迫的反应及其抗盐机理研究进展[J].山东农业大学学报(自然科学版),2006,37(2):302-305.
[29] 唐奇志,刘兆普,陈铭达,等.海水处理对向日葵幼苗生长及叶片一些生理特性的影响[J].植物学通报,2004,21(6):667-672.
[30] 刘鹏,何瑞霞,孙海燕.NaCl胁迫对不同品种向日葵幼苗生理特性的影响[J].内蒙古民族大学学报(自然科学版),2006,21(5):525-527.
[31] HARO R,BAUELOS M A,QUINTERO F J,et al.Genetic basis of sodium exclusion and sodium tolerance in yeast.A model for plants[J].Physiol Plant,1993,89(4):868-874.
[32] PETRUSA L M,WINICOV I.Proline status in salt tolerant and salt sensitive alfalfa cell lines and plants in response to NaCl[J].Plant Physiol Biochem,1997,35(4):303-310.
[33] GARCIA A B,DE ALMEIDA ENGLER J,IYER S,et al.Effects of osmoprotectants upon NaCl stress in rice[J].Plant Physiol,1997,115(1):159-169.
[34] LUTTS S,KINET J M,BOUHARMONT J.NaCl-induced senescence in leaves of rice(Oryza sativa L.)cultivars differing in salinity resistance[J].Ann Bot,1996,78(3):339-398.
[35] RYE H S,YUE S,WEMMER D E,et al.Stable fluorescent complexes of double-stranded DNA with bis-intercalating asymmetric cyanine dyes:Properties and applications[J].Nucleic Acids Res,1992,20(11):2803-2812.
[36] 李國雷.盐胁迫下13个树种反应特性的研究[D].泰安:山东农业大学,2004:47-60.
